四川省小麦条锈菌耐高温性鉴定及其cDNA文库构建
王金鑫, 吴艳琴, 王凤涛, 冯 晶, 蔺瑞明, 徐世昌
(中国农业科学院植物保护研究所,植物病虫害生物学国家重点实验室, 北京 100193)
四川省小麦条锈菌耐高温性鉴定及其cDNA文库构建
王金鑫,吴艳琴,王凤涛,冯晶,蔺瑞明*,徐世昌
(中国农业科学院植物保护研究所,植物病虫害生物学国家重点实验室, 北京100193)
近年条锈菌越夏调查发现,小麦条锈菌耐高温性增强,越夏海拔下限有所降低。本研究通过在高温(21±0.2)℃条件下接种,评价了119个来自四川省的条锈菌菌株耐高温性,并构建了耐高温菌株SC-PX143萌发夏孢子的cDNA文库。结果发现来自四川的条锈菌群体中耐高温菌株占35.3%,主要分布在成都市、凉山市、简阳市和广元市。夏孢子萌发率统计分析表明,耐高温菌株在高温条件下比温度敏感菌株具有更高的萌发率。采用SMART技术构建了耐高温菌株萌发夏孢子cDNA文库,库容为2.1×106cfu,插入片段平均多大于1.0 kb。本研究结果初步明确了四川省小麦条锈菌群体中耐高温菌株组成和分布区域,不同菌株在夏孢子萌发阶段对高温的耐受性存在显著差异,为进一步研究条锈菌耐高温机制奠定基础。
小麦条锈菌;耐高温性;夏孢子萌发率;cDNA文库
小麦条锈病是由条形柄锈菌小麦专化型(Pucciniastriiformisf.sp.tritici)引起的真菌病害,在流行暴发年份能造成严重的产量损失[1]。在大规模种植感病品种的地区,如遇到低温、潮湿的气候条件以及充足的初侵染菌源,极易引起条锈病大规模暴发流行。小麦条锈病是典型的低温病害,但近年来在条锈菌越夏区调查中发现,条锈菌越夏海拔下限逐年下降[2]。甘肃省平凉市夏季最热旬平均温度超过23℃的年份也存在越夏菌源[3]。Milus等发现美国2000年之后的菌株比2000年之前的菌株具有更强的高温适应性,具体表现在潜伏期更短,产孢量更大[4]。另外,张静秋等对我国不同地区条锈菌温度敏感性分析发现存在耐高温菌株[5]。耐高温条锈菌菌株的出现可能对我国未来小麦条锈病的发生、流行危害以及制定相应的防治策略产生深远影响,并带来新的挑战。然而,有关耐高温小麦条锈菌在我国各主要流行区域的分布范围、耐高温性,及其与毒性变异关系和调控机制等尚不清楚。
构建病原菌cDNA文库是克隆关键基因的基础性工作,已有学者构建了小麦条锈菌吸器、萌发10 h的夏孢子cDNA文库[67],而且目前已完成了小麦条锈菌基因组和转录组测序分析[89],这些基础性工作为研究条锈菌侵染过程中基因克隆、表达及功能验证奠定了基础。本研究分析了来自四川省条锈菌群体中耐高温菌株分布情况,筛选获得了具有耐高温特性的条锈菌菌株,构建了在高温胁迫条件下耐高温菌株萌发的夏孢子cDNA文库并对其质量进行了评价,为克隆与条锈菌耐高温性状相关的基因,揭示其在条锈菌耐高温机制调控中的功能奠定了基础。
1 材料与方法
1.1材料
供试菌株:2012-2014年分离的来自四川省的119个条锈菌菌株。
供试试剂:SMARTTMcDNA文库构建试剂盒,Advantage 2 Polymerase Mix试剂盒,日本Clontech公司;SfiⅠ酶,NEB有限公司(北京);pUC19载体,蛋白酶K,T4 DNA连接酶,日本TaKaRa公司;琼脂粉,琼脂糖,Amp,IPTG,x-gal,北京科昊达生物技术公司。
培养基:水琼脂培养基(琼脂粉10 g,加水定容到400 mL,121℃高压蒸汽灭菌20 min),Luria-Bertani(LB)固体培养基(胰蛋白胨10 g,酵母提取物5 g,NaCl 10 g,水溶解后,用NaOH调pH至7.0,琼脂15 g,加水定容到1 L, 121℃高压蒸汽灭菌20 min),使用前加入抗生素(100 mg/L Amp)和GUS基因表达选择底物和诱导剂(50 mg/mL IPTG,20 mg/mL x-gal)。
供试仪器:研究级生物显微镜(BX63),日本奥林巴斯公司;紫外分光光度计(ND-2000),美国Thermo公司;光照培养箱(MLR-352H),购自日本三洋公司;PCR仪(MyCycle),美国Bio-Rad公司。
1.2方法
耐高温菌株筛选:感病品种‘铭贤169’播种于直径10 cm花盆中,每盆30株,基质为草炭土与麦田土按1∶1混合,适量补充有机肥,待出苗1周后,利用扫抹法,即用‘铭贤169’扩繁的菌株夏孢子直接扫抹于第1叶充分展开的‘铭贤169’幼苗上,在(21±0.2)℃接种桶中黑暗保湿24 h,相对湿度100%,然后转移至18/25℃(夜/昼)温室中继续潜育培养,光照强度8 000~12 000 lx,光周期L∥D=8 h∥16 h。接种15 d后调查发病严重程度。严重度划分标准参考商鸿生等的方法[10],依据严重度确定测试菌株的耐高温性。在本研究中发病严重度达到40%以上的菌株即为耐高温菌株,发病严重度在0~5%的菌株即为温度敏感菌株。
耐高温菌株夏孢子扩繁和样品制备:将耐高温菌株SC-PX143在‘铭贤169’幼苗上经过连续5次以上高温条件下继代培养,确认该菌株具有良好并稳定的耐高温特性。利用‘铭贤169’幼苗在常温条件下扩繁夏孢子,具体方法是:菌种直接扫抹于第1片叶完全展开的‘铭贤169’幼苗上,接种后于(10±0.2)℃黑暗保湿24 h,然后转移到13~16℃(夜/昼)温室中潜育培养,相对湿度80%,光照强度8 000~12 000 lx,光周期L∥D=16 h∥8 h。接种后约14 d收集成熟的夏孢子。准备2.5%水琼脂培养基平板(13 cm×13 cm),每皿培养基约50 mL。用无菌水配制浓度为2.5 mg/mL新鲜夏孢子悬浮液,每皿内均匀涂抹2 mL孢子悬浮液。在室温条件下放置约5~10 min,转移至(21±0.2)℃培养箱中培养8 h后,迅速用载玻片刮取收集萌发的夏孢子及其芽管,在液氮中保存备用。
孢子萌发:以SC-PX143为供试菌,以温度敏感菌株ZBTX14011为对照菌株,新鲜夏孢子分别在最适萌发温度即常温(10±0.2)℃和高温(21±0.2)℃条件下保湿萌发8 h后,显微镜下检测并统计常温及高温条件下孢子萌发情况,3次重复。
耐高温菌株SC-PX143萌发夏孢子总RNA提取与cDNA合成:采用SDS法(抽提缓冲液组成:0.02 mol/L Tris-HCl pH=8.0;0.2 mol/L NaCl;0.005 mol/L EDTA;1% SDS)提取条锈菌萌发夏孢子总RNA,用1.2% 变性琼脂糖凝胶电泳检测其完整性,紫外分光光度法测定其浓度和A260/A280。按照SMARTTMcDNA文库构建试剂盒说明书反转录合成cDNA第一条链,再根据Advantage 2 Polymerase Mix试剂盒说明书PCR合成cDNA第二条链。
cDNA片段与文库载体连接及转化:将cDNA电泳分级后,只保留500 bp以上的片段。用蛋白酶K消化稀释后的双链cDNA,再以SfiⅠ酶切,通过酚-氯仿(1∶1,V∶V)抽提并用70%乙醇沉淀后,获得纯化的cDNA片段。取5 μL cDNA片段、1 μL pUC19载体和1 μL T4 DNA连接酶混合后,于14℃连接过夜。取1 μL连接产物与大肠杆菌(E.coli)DH-5α菌株感受态细胞轻轻混匀,冰浴20 min后42℃热激转化,37℃振荡培养45 min,转速200 r/min,取200 μL菌液均匀涂布于直径15 cm LB固体培养基平板上,在37℃培养箱中培养过夜。
文库质量鉴定:统计转化的单菌落数量,测定文库的库容量和滴度,并用GUS基因表达筛选结果(即产生蓝斑或白斑筛选法)统计平板上长出白斑及蓝斑的数量及其比值,测定文库的重组率。随机挑取单克隆菌落,以M13F(5′-TGTAAAACGACGGCCAGT-3′)和M13R(5′-CAGGAAACAGCTATGACC-3′)引物组合做菌落PCR扩增,检测插入cDNA片段大小。
1.3数据分析
用SAS软件对(10±0.2)℃及(21±0.2)℃条件下孢子萌发率3次重复试验t检验分析,确定差异是否显著。
2 结果与分析
2.1四川省小麦条锈菌耐高温性分析
在高温条件下(21±0.2)接种保湿后继续在18~25℃温室中潜育培养,对采自四川省的119份小麦条锈菌标样进行了接种时期耐高温性鉴定(表1),依据发病严重度,发现来自四川省菌株在高温接种(21±0.2)℃条件下发病严重度达到40%以上的菌株有42株,占总菌株数35.3%,划分为耐高温菌株,主要集中分布在成都市、凉山市、简阳市和广元市;来自绵阳市的耐高温菌株所占比例为22.9%,低于上述4个地方的耐高温菌株的占比例;而来自川西北阿坝州耐高温菌株所占比例最低。其中20.2%的菌株在高温条件下接种不能成功侵染、产孢。17.6%的菌株发病严重度为1%~5%;26.9%菌株发病严重度为10%~20%。在筛选到的耐高温菌株中,分离自四川郫县的菌株SC-PX143在高温下发病严重度达80%以上且耐高温性状稳定,因此本研究选用该菌株为后续试验研究对象,构建了该菌株萌发夏孢子的cDNA文库,为后续菌株耐高温性研究奠定基础。
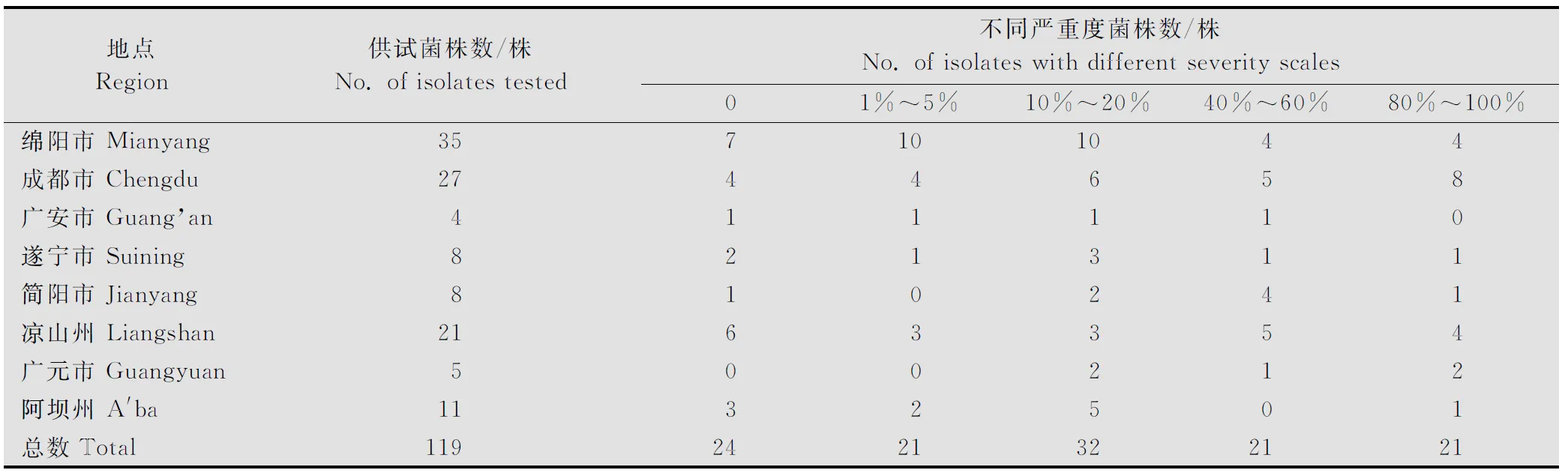
表1 四川省小麦条锈菌耐高温性筛选
2.2小麦条锈菌夏孢子高温胁迫萌发
由于接种温度显著影响了菌株的侵染,因此我们在水琼脂培养基上观察不同温度下孢子的萌发率。统计分析发现,耐高温菌株SC-PX143和温度敏感菌株ZBTX14011在常温(10±0.2)℃保湿培养8 h后平均萌发率分别达到92.2%和88.9%,两者差异不显著;而在高温(21±0.2)℃保湿培养8 h后平均萌发率分别为75.5%和36.5%。高温条件下2个菌株孢子萌发率差异极显著(P<0.01),SC-PX143菌株夏孢子萌发具有较强的耐受高温胁迫能力(图1a~c)。

图1 温度敏感型不同的小麦条锈菌夏孢子萌发Fig.1 Germination of the urediospores of Puccinia striiformis f.sp. tritici with different temperature sensitivities
2.3总RNA完整性检测及双链cDNA合成
利用CTAB法提取小麦条锈菌萌发夏孢子总RNA,经测定A260/A280值为2.28。经变性琼脂糖凝胶电泳检测,其28S rRNA和18S rRNA条带清晰,其亮度比接近2∶1,说明提取的RNA比较完整,其浓度及纯度均满足构建cDNA文库的要求(图2a)。将提取的小麦条锈菌萌发夏孢子总RNA作为反转录模板,获得双链cDNA。经1%琼脂糖凝胶电泳检测,双链cDNA片段长度主要集中分布在500~2 000 bp范围内(图2b),分离并保留500 bp以上的cDNA片段用于文库构建。

图2 萌发夏孢子总RNA及合成双链cDNA琼脂糖凝胶电泳检测Fig.2 The agarose gel electrophoresis of the total RNA and its double-strand cDNA of germinated urediospores
2.4文库质量鉴定
重组文库经蓝白斑筛选,每皿菌落数平均为750个,其中蓝斑49个,得到文库的库容量为2.1×106cfu/mL,重组率为93.5%。随机挑取文库中48个单克隆,根据载体克隆位点两端的测序引物进行PCR扩增鉴定,结果显示扩增条带主要集中分布在750~2 000 bp范围内,其中4个克隆插入片段大小在500~750 bp,15个克隆插入片段大小在750~1 000 bp,29个克隆插入片段大小在1 000~2 000 bp,平均长度1 000 bp左右(图3)。
3 讨论
小麦条锈病属于典型的低温冷凉病害,环境温度是决定病原菌能否成功侵染寄主的关键因素之一。但随着全球气候变暖,小麦条锈菌毒性频繁变异以适应抗病性不同的小麦品种更替,同时还要适应高温等环境胁迫因子的变化。
四川省是小麦条锈菌重要越夏区和冬繁区。近年来,暖冬现象的出现使冬季气温偏高,造成冬前小麦条锈菌不断侵染、繁殖,导致菌源基数扩大。张静秋等[5]发现2010-2011年四川省小麦条锈菌平均ET50为24.53℃,而同时期来自宁夏的菌株ET50仅为19.79℃。四川省4月中、下旬及5月上旬为当地条锈病春季流行期,高温环境会对条锈菌产生选择压力,长期选择积累,使条锈菌增强了对高温胁迫的耐受能力,导致耐高温菌株出现频率增加;8-9月条锈菌越夏期间高温环境会对耐高温菌株进一步筛选,从而使当地小麦条锈菌群体耐受高温胁迫的能力增强。本研究通过对四川省小麦条锈菌耐高温性鉴定,在高温条件下接种和潜育培养,发现发病严重度达到40%以上的菌株占35.3%,且在省内不同地区均有分布,主要集中在成都、凉山、广元和简阳,耐高温菌株出现频率较高,而在海拔相对较高的阿坝州耐高温菌株出现的频率较低,这说明小麦条锈菌耐高温菌株的出现是长期高温环境选择的结果,在四川省东部海拔相对较低、且常年气温较高的地区出现的频率高,但在高海拔、气候冷凉川西北地区则分布较少。

图3 cDNA文库中插入片段琼脂糖凝胶电泳检测Fig.3 The agarose gel electrophoresis of the cDNA fragments of the cDNA library
高温对小麦条锈菌夏孢子萌发的影响研究中发现,随着温度增高,条锈菌夏孢子萌发率逐渐降低。例如CY32号小种在20℃下萌发率高达69.02%,26℃萌发率低于10%[11]。本研究中,耐高温菌株SC-PX143和温度敏感菌株ZBTX14011在高温条件下(21±0.2)℃保湿8 h后夏孢子萌发率差异极显著,而且耐高温菌株在高温条件下接种感病品种‘铭贤169’幼苗发病严重度达到80%以上,说明耐高温菌株夏孢子在萌发过程就具有较高的耐受高温胁迫能力。
研究小麦条锈菌夏孢子萌发这一重要侵染过程中的基因表达情况,对于从分子水平揭示条锈菌的致病机理具有重要价值,但有关温度对小麦条锈菌侵染过程影响的研究目前还没有取得任何进展。条锈菌基因组大小约64.8 Mb(美国Pst-130菌株)至110 Mb(中国CY32号小种)[89],预测其编码25 288个基因。转录组测序是分析基因表达调控途径非常有效的技术,可以揭示病原菌-寄主植物互作过程中特殊表达的基因。Garnica等对小麦条锈菌吸器及萌发的夏孢子转录组进行测序,通过比较两者基因表达差异情况,明确在条锈菌成功侵入小麦过程中发挥作用的基因功能[12]。本研究组已利用转录组测序技术分析耐高温菌株和温度敏感菌株在夏孢子萌发及侵染过程中的基因表达差异,获得参与条锈菌高温胁迫的相关基因。因此,本研究中构建了耐高温菌株在高温胁迫条件下萌发夏孢子的cDNA文库,便于克隆和研究调控条锈菌在萌发和侵染过程中适应高温胁迫的相关基因,为进一步研究小麦条锈菌耐高温机制奠定基础。
[1]李振岐,曾士迈. 中国小麦锈病[M]. 北京:中国农业出版社,2002.
[2]陈万权, 康振生, 马占鸿, 等. 中国小麦条锈病综合治理理论与实践[J]. 中国农业科学, 2013, 46(20):42544262.
[3]王新俊. 平凉市小麦条锈病越夏菌源分布区域精准勘测及主要影响因子研究[J]. 植物保护, 2009, 35(6):130134.
[4]Eugene A M,Kristian Kristensen, Mogens S H. Evidence for increased aggressiveness in a recent widespread strain ofPucciniastriiformisf.sp.triticicausing stripe rust of wheat [J]. Phytopathology, 2009, 99(1):8994.
[5]张静秋, 刘博, 陈万权, 等. 小麦条锈菌群体温度敏感性测定[J]. 植物病理学报, 2013, 43(1):8890.
[6]Zhang Yonghong, Qu Zhipeng, Zheng Wenming, et al. Stage-specific gene expression during urediniospore germination inPucciniastriiformisf.sp.tritici[J]. BMC Genomics, 2008, 9(3):203.
[7]Yin Chuntao, Chen Xianming, Wang Xiaojie, et al. Generation and analysis of expression sequence tags from haustoria of the wheat stripe rust fungusPucciniastriiformisf.sp.tritici[J]. BMC Genomics, 2009, 10:626.
[8]Cantu D, Govindarajulu M, Kozik A, et al. Next generation sequencing provides rapid access to the genome ofPucciniastriiformisf.sp.tritici, the causal agent of wheat stripe rust[J]. PLoS ONE, 2011, 8(8):e24230.
[9]ZhengWenming,HuangLili,HuangJinqun,etal.Highgenomeheterozygosityandendemicgeneticrecombinationinthewheatstriperustfungus[J].NatureCommunications, 2013, 4:2673.
[10]商鸿生,任文礼,王素梅. 小麦条锈病严重度分级标准图的探讨[J]. 植物保护, 1990,16(1):31.
[11]王晓晶, 王海光, 马占鸿. 高温对小麦条锈病菌夏孢子萌发的影响[C]∥中国植物病理学会学术年会论文集. 北京:中国农业科学技术出版社, 2012.
[12]GarnicaDP,UpadhyayaNM,DoddsPN,etal.Strategiesforwheatstriperustpathogenicityidentifiedbytranscriptomesequencing[J].PLoSONE, 2013, 8(6):e67150.
(责任编辑:田喆)
Identification of high-temperature tolerance ofPucciniastriiformisf.sp.triticiin Sichuan Province and the cDNA library construction
Wang Jinxin,Wu Yanqin,Wang Fengtao,Feng Jing,Lin Ruiming,Xu Shichang
(State Key Laboratory for Biology of Plant Diseases and Insect Pests, Institute of Plant Protection, Chinese Academy of Agricultural Sciences, Beijing100193, China)
In the oversummering surveys of stripe rust pathogen in recent years, it was found that high-temperature tolerance of the pathogen has been enhanced and the lowest elevation of the oversummering areas declined. In this study, we inoculated stripe rust isolates at high temperature (21±0.2)℃ to assay the high-temperature tolerance of 119 stripe rust isolates from Sichuan Province, and constructed a cDNA library of the germinated urediospores of a high-temperature tolerant strain SC-PX143. The results showed that 35.3% of the 119 isolates were high-temperature tolerant, mainly distributed in Chengdu, Liangshan, Jianyang and Guangyuan. In addition, high-temperature tolerant isolates had a higher germination rate under high temperature (21±0.2)℃ than the temperature sensitive ones. SMART technology was used to construct a cDNA library with the germinated urediospores of a high-temperature tolerant isolates. The total capacity of the cDNA library was 2.1×106cfu, and most insert cDNA fragments were more than 1.0 kb in length. We preliminarily made clear the composition and distribution areas of high-temperature tolerant wheat stripe rust strains from Sichuan, and there was significant difference in high-temperature tolerance of stripe rust strains during urediniospore germination stage. These results will promote the further studies of high-temperature tolerance mechanism of wheat stripe rust pathogen.
wheat stripe rust;high temperature tolerance;urediniospore germination rate;cDNA library
20150430
20150530
国家重点基础研究发展计划(2013CB127700); 公益性行业(农业)科研专项(201303016);农业部作物种质资源保护与利用专项(2014NWB030-14)
E-mail:linruiming@caas.cn
S 435.121.42, Q 933
A
10.3969/j.issn.05291542.2016.03.011

