溶菌酶表面印迹磁性纳米颗粒的制备与吸附性能表征
杨戍,张鑫,姜锐,孙立权,罗爱芹(北京理工大学生命学院, 北京 100081)
溶菌酶表面印迹磁性纳米颗粒的制备与吸附性能表征
杨戍,张鑫,姜锐,孙立权,罗爱芹*
(北京理工大学生命学院, 北京 100081)
摘要:由于蛋白质分子本身的大分子体积和易变性空间结构,导致蛋白质印迹研究目前仍然面临重大挑战。本文提出一种制备磁性蛋白质表面印迹新方法。首先以溶剂热法一步合成羧基修饰的磁性内核,然后一步实现表面双键修饰,最后以改进的丙烯酰胺印迹体系实现印迹包裹。这种制备方法避免了多步修饰带来的纳米颗粒交联和包裹层过厚等问题。高的饱和磁感应强度表明磁性纳米颗粒具有非常快速的磁响应。吸附实验结果表明I表面印迹聚合物能在10min达到吸附平衡,具有非常快的吸附动力学性能,且符合准二级吸附动力学模型。进一步吸附选择性实验结果显示印迹聚合物具有选择性吸附目标蛋白。
关键词:溶菌酶;表面印迹;磁性纳米颗粒;吸附性能
1 引言
分子印迹应用于蛋白选择性识别常见的印迹体系丙烯酰胺自由基聚合印迹体系,sol-gel印迹体系,苯硼酸印迹聚合体系,多巴胺自聚合体系,壳聚糖印迹聚合体系等。这其中基于丙烯酰胺的印迹聚合体系以其功能多样、适应性强,是蛋白印迹中最常用的[1]。基于丙烯酰胺印迹体系制备的蛋白分子印迹聚合物在多个方面得到应用,如作为毛细管电泳基质[2],制备整体柱[3],实现目标蛋白的识别与释放控制[4],硅胶微球表面的蛋白质印迹[5],磁性纳米颗粒表面的蛋白质印迹[6,7],作为选择性识别单元应用于传感器中[8],作为重结晶晶核[9]等。这其中基于磁性内核表面印迹的研究备受关注。主要是因为磁性分离便于操作。而具有选择性吸附能力的磁性表面印迹复合物颗粒在生物样品处理中具有实际应用价值。本文提出一种新颖的制备磁性表面印迹复合物颗粒的方法,可用于实现蛋白分子选择性、快速分离。
2 实验部分
2.1试剂与仪器
三氯化铁(分析纯)购于天津福成化学试剂公司,乙二醇(EG,分析纯),硅烷偶联剂KH570(MPS,分析纯)购于西陇化工股份有限公司,N,N‘-亚甲基双丙烯酰胺(MBA,分析纯),甲基丙烯酸(MAA,分析纯),无水乙酸钠(NaAc,分析纯),过硫酸铵 (APS,分析纯)购于北京化工厂;溶菌酶(Lyz, Ultra-pure),卵清白蛋白(OVA, Ultra-pure),牛血清白蛋白(BSA, Ultrapure)购于北京莱伯盒斯生物技术有限公司;丙烯酰胺(AAm,分析纯)购于天津化学试剂研究所;N-异丙基丙烯酰胺(NIPAAm,分析纯)购于上海国药化学试剂公司;四甲基乙二胺(TEMED,>99%)购于北京梦怡美生物科技有限公司。
紫外分光光度计(Ultraviolet Spectrophotometer, UV)为Shimadzu UV-1800;透射电子显微镜(Transmission electronic microscopy TEM)为Hitachi H-800。 样品振动磁强计(Vibrating sample magnetometer,VSM)采用Lakeshore Model 7307。
2.2磁性纳米颗粒的制备
溶剂热法制备Fe3O4磁性纳米微球是近年来发展起来的一种制备方法,简单、高效得到广泛关注。本文采用文献的制备方法[10],并稍做调整。具体方法如下:称取0.65 g三氯化铁溶于20 mL乙二醇中,加入0.20 g柠檬酸钠,然后加入1.2 g乙酸钠并剧烈搅拌至全部溶解,将反应液转移到50 mL高压反应釜的聚四氟乙烯内衬中盖紧,然后200°C恒温反应12 h。反应结束后,冷却到室温,将反应釜中的产物倒入烧杯中,利用强磁铁分离出制备得到的褐色磁性粒子。用水和乙醇反复清洗直至上层液体至无色透明呈中性。最后,磁分离,真空干燥后,4°C冰箱密封保存。
2.3磁性纳米颗粒的表面功能化
磁性Fe3O4纳米颗粒表面乙烯基化主要参考文献并进行小的调整[11],具体步骤如下:在250 mL烧杯中加入40 mL无水乙醇、10 mL水和1.5 mL浓氨水,称取200 mg Fe3O4磁性纳米颗粒,利用超声分散于上述混合液中。混合液至于60°C水浴中,在氮气保护和机械搅拌下,加入MPS 400 μL,反应24 h。利用磁分离,乙醇多次洗涤,然后40°C真空干燥。
2.4磁性纳米颗粒表面印迹复合物的制备
称取100 mg乙烯基化的Fe3O4磁性纳米颗粒分散在20 mL PB缓冲液(0.02M, pH 6.0)中备用。另取20 mL PB缓冲液(0.02M, pH 6.0),在其中分别加入30 mg AAm,100 mg NIPAAm,30uL MAA,25 mg MBA和30 mg Lyz,混匀后置于摇床上常温孵育1h。然后加入配置好的磁性颗粒分散液混匀。吹氮气20 min,在室温机械搅拌下,加入APS溶液(10%,w/v)100uL,加入TEMED溶液(30%,v/v)100 μL,氮气保护下反应24 h,得到具有磁性的印迹聚合物(molecularly imprinted polymer,MIP)颗粒。
作为对照制备的非印迹聚合物(non imprinted polymer,NIP)颗粒,只是不加入模板蛋白Lyz,采用以上相同步骤制得。
将制备得到的MIP颗粒浸入10vol%的乙酸-10wt%的 SDS混合洗脱液中振荡6 h,然后磁分离更换洗脱液,此步骤重复5次;再用纯水振荡洗涤多次,直至中性。
2.5磁性纳米颗粒表面印迹聚合物的吸附性能表征
将10 mg溶菌酶表面印迹磁性复合物MIP和NIP分别置于离心管中,加入2.0 mL不同Lyz浓度的PBS溶液,在15°C下以120 rpm的转速振荡。然后磁分离,取上清液通过紫外可见分光光度计进行测定其紫外吸光度,并根据标准曲线测算吸附前后目标蛋白分子的浓度变化,进而测定蛋白质在相应磁性粒子上的吸附量。可通过以下公式计算蛋白质吸附量:
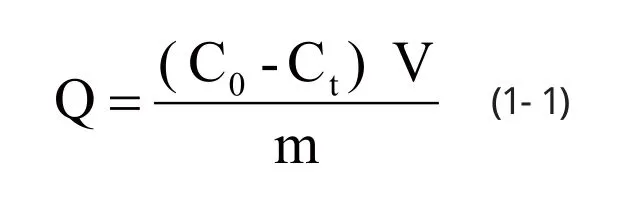
式1-1中,Q是每单位质量的聚合物吸附目标分子的量,mg/g;C0是吸附之前目标分子浓度,mg/mL;Ct是吸附之后目标分子浓度,mg/mL;V是初始溶液的体积,mL;m是加入的聚合物的质量,g。
吸附动力学又称动态吸附实验,主要是为了考察MIP/ NIP的吸附量随时间的变化规律。分别准确称量10mg MIP/ NIP于7支离心管,同时加入2 mL Lyz蛋白吸附液(0.2 mg/ mL)并开始计时,然后分别在5、10、20、30、40 min时利用紫外分光光度计测定磁分离后吸附上清液中模板蛋白的浓度,并依据公式计算得到不同时刻下的吸附量大小。
为了进一步表述MIP颗粒的选择性吸附能力,选取对照NIP作为参考,分别测算其吸附量,并引入印迹因子(imprinting factor, IF)作为判断吸附性能的一个重要指标:
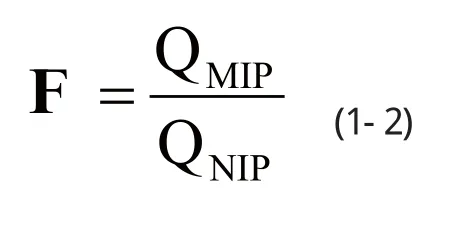
式1-2中,IF为印迹因子;QMIP为印迹聚合物MIP颗粒的吸附量,mg/g;QNIP为非印迹聚合物颗粒NIP的吸附量,mg/g。
选择性吸附实验主要考察的是MIP/NIP对模板蛋白溶菌酶(Lyz)的选择性识别能力。本实验选用了牛血清白蛋白(BSA)和卵清蛋白(OVA)二种蛋白作为参比蛋白来研究磁性聚合物颗粒对模板蛋白的选择吸附性能。准确称取10 mg的MIP/NIP置于2 mL的离心管中,分别加入2 mL浓度均为0.2 mg/ mL的BSA、Lyz和OVA溶液,摇晃均匀后放入摇床振荡吸附0.5 h,磁分离后取上清液,用紫外可见分光光度计测定其浓度。然后根据吸附容量计算公式计算得到相应的吸附量。
引入选择性因子(Selective Coeffi ciency,SC)来表征选择性大小。选择性因子定义如式1-3所示:
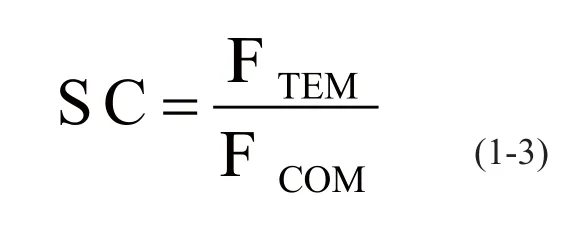
式1-3中,IFTEM是模板分子的印迹因子;IFCOM是对照分子的印迹因子。
3 结果与讨论
3.1磁性纳米颗粒表面印迹聚合物的制备
本文采用柠檬酸作为分散剂包裹磁性纳米颗粒[10],该方法制备得到的Fe3O4磁性纳米颗粒具有非常好的水相分散性,静置2 h也不会产生沉淀;且磁响应快,达到磁分离只需要30 s左右,从而满足实际作为磁分离材料的实际应用需要。从下面的TEM分析(图1)中也可以看出,颗粒呈单分散状态,分散较好;粒径大小约200 nm。

图1 Fe3O4磁性纳米颗粒TEM图Fig. 1 TEM image of the Fe3O4 magnetic nanoparticles
3.2磁性纳米颗粒的表面功能化
常规的磁性颗粒表面功能化这一过程往往需要复杂的多步反应来实现。如果能够引入比较简单的步骤,有望提高整个分子印迹聚合物制备的效率和印迹性能。
Fe3O4磁性纳米颗粒的功能化不仅是应用目的的驱动,也是Fe3O4磁性纳米颗粒本身的特性决定的。磁性Fe3O4纳米颗粒容易团聚,难以体现纳米颗粒的优越特性,也在一定程度上阻碍了之后的应用研究。此外,纯Fe3O4颗粒暴露在空气中极易发生氧化,在pH低于4的酸性介质中易溶解。因而,从不同需求出发,需要对纳米Fe3O4颗粒进行有目的的、有效的表面修饰。
常见的用于实现印迹包裹前的表面功能化修饰中表面硅胶包裹是常采用的一步[12]。虽然表面包裹硅胶层有利于后续的进一步包裹和硅烷化接枝其它功能基团[18],但反应过程中各种条件需要精细控制,还容易使磁性纳米颗粒间形成交联,且增加的反应步骤必然导致磁性纳米颗粒的产率降低,从而给有效制备得到单分散磁性纳米颗粒带来很多麻烦。
本文采用精简的合成步骤[11],采用一步聚合双键功能化,省掉不必要的硅胶包裹步骤,同时避免纳米颗粒的交联,为进一步的表面印迹提供更有效的平台。
图2 聚合双键功能化包裹的磁性纳米颗粒FT-IR图Fig. 2 FT-IR of magnetic nanoparticles coated with double bond functionalization
从图中可以看出,不饱和双键特征峰出现在1610 cm-1处,表明完成了聚合双键功能化表面修饰。
3.3磁性纳米颗粒表面印迹复合物的制备
将表面功能化的磁性纳米颗粒制备加入印迹预聚合体系中作为载体,自由基引发印迹包裹,得到溶菌酶磁性纳米颗粒表面印迹复合物。整个制备过程如下图3所示:
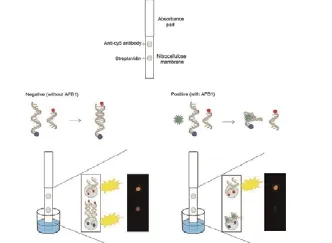
图3 磁性纳米颗粒表面印迹复合物的制备示意图Fig. 3 Schematic illustration of the preparation of surface imprinted magnetic nano particles composites
已有的蛋白印迹研究发现,加入甲基丙烯酸(MAA)能够在丙烯酰胺/N, N‘-亚甲基双丙烯酰胺双丙烯酰胺(MBA)印迹体系中引入额外的静电相互作用,弥补丙烯酰胺印迹体系弱相互作用的不足,从而提高印迹识别效果[13]。另一方面,对于水相中的蛋白印迹过程,除了常规的静电相互作用和氢键等相互作用形式外,N-异丙基丙烯酰胺(NIPAAM)等疏水型辅助功能单体的疏水作用能起到明显的加强作用[14]。因而,本文在制备印迹聚合物包裹时,采用了丙烯酰胺(AM)作为功能单体,并加入甲基丙烯酸(MAA)和N-异丙基丙烯酰胺(NIPAAM)作为辅助功能单体,N, N‘-亚甲基双丙烯酰胺(MBA)作为交联剂,选取蛋白溶菌酶(Lyz)作为模板蛋白,APS引发自由基聚合得到表面印迹复合物颗粒。
3.4磁性纳米颗粒表面印迹复合物的磁响应性能表征
实际应用中磁响应快慢直接影响使用效率,因而需要对制备磁性纳米表面印迹复合物颗粒的磁响应性能进行表征。采用振动样品磁强计(Vibrating Sample Magnetometry,VSM)分别测定室温条件下磁性纳米颗粒(magnetic nanoparticle,MNP)本身以及制备得到的MIP和NIP颗粒的磁滞回线(MH)。如下图所示:
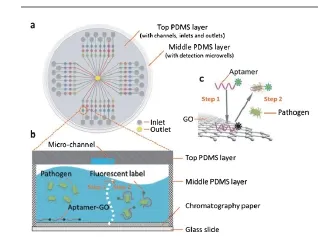
图4 磁性纳米颗粒的VSM测试结果图Fig. 4 the VSM image of the prepared magnetic nano particles
从图中可以看到,制得得到的羧基修饰的磁性纳米颗粒(MNP)的饱和磁化强度接近70 emu/g,表明磁性内核具有非常强的磁响应特性。经过印迹层包裹后,印迹聚合物和非印迹聚合物表面包覆的MIP/NIP颗粒的饱和磁化强度接近40 emu/g,饱和磁化强度的降低是由于印迹层的包裹导致的屏蔽效应。虽然如此,饱和磁化强度也是比较高的数值,因而也能够快速的从溶液中轻易分离出来。对比文献中得到印迹聚合物颗粒的磁饱和磁化强度数值只有约20 emu/g[7],本文得到的包裹后的饱和磁化强度很高,这也说明减少硅胶层包裹,可以有效提高印迹磁性纳米颗粒的磁响应性能。从实际分离效果来看,在外加磁场的作用下,实现磁分离仅用不到30 s的时间就可以完成,非常迅速,从而保证了实际应用的需要。
3.5 溶菌酶磁性纳米颗粒表面印迹复合物的吸附动力学性能测试
溶菌酶磁性纳米颗粒表面印迹复合物的吸附动力学行为直接决定着使用时的操作方式,并且还能揭示出内在的吸附行为规律。
通过测试不同时间点上溶液中自由溶菌酶的浓度,根据公式可以计算在该时间点上的吸附量,进而绘制磁性纳米颗粒表面印迹复合物的吸附动力学曲线。溶菌酶磁性纳米颗粒表面印迹复合物MIP和对照复合物颗粒NIP的动力学吸附曲线如图所示。

图5 磁性纳米颗粒表面印迹复合物和非印迹复合物的吸附动力学图Fig. 5 Binding kinetics of MIP and NIP
从图中可以看出,MIP对模板蛋白溶菌酶分子的吸附能力要高于NIP,且吸附量都随着时间的增加而迅速增加, 在短短的10 min达到吸附平衡状态,吸附容量接近30 mg/g;这种现象的出现主要是由于减少了硅胶层的包覆,从磁响应性能上反应出这种表面印迹聚合物具有更好的磁性能;从吸附动力学性能上看,磁性纳米颗粒表面的羧基也参与到印迹吸附的过程中,与溶菌酶蛋白分子之间具有较强的静电相互作用,将溶菌酶分子迅速拉近磁性复合物颗粒表面;而溶菌酶磁性纳米颗粒表面印迹复合物MIP的表面存在大量未被占据的对溶菌酶分子有很高亲和性的印迹作用空穴,这些印迹空穴可以快速吸附模板分子溶菌酶,使其在较短时间内快速占据印迹空穴,因而此阶段内MIP的吸附速率增长较快,表现在吸附曲线上就是曲线斜率较大,表现出非常快的吸附过程。当表面的印迹空穴被占据后则阻碍溶菌酶分子向内部传质,从而使吸附速度迅速趋于稳定,达到吸附平衡状态。大多数印迹空穴位于载体表面,从而提高了吸附动力学性能,这也体现出表面印迹的优势。对比于大多数已经报道的文章中达到吸附平衡所需时间大约在20 min或者更长[1, 2, 7],本文测得的吸附动力学性能表现要更好;另一方面,在MIP上形成了很多与模板蛋白溶菌酶的形状、大小和功能基团相匹配的印迹立体空穴,这些印迹空穴可以专一的识别和吸附目标蛋白分子,而在NIP上没有形成跟和溶菌酶蛋白分子相匹配的印迹空穴,只存在一些非印迹孔穴,从而使得MIP的吸附量要大于NIP。通过计算可以发现,印迹因子达到1.87。此处非常快的吸附动力学性能得益于新设计的磁性表面印迹复合物制备方法。
3.6磁性纳米颗粒表面印迹复合物的吸附动力学模型分析
进一步通过准二阶动力学方程来描述固体吸附剂对溶液中溶质的吸附动力学行为。
准二级动力学方程表达式如式1-4所示:
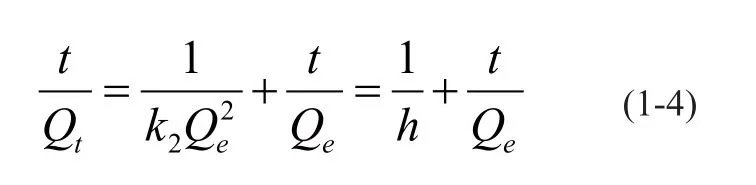
式1-4中,h为初始吸附速率常数,h=k2Qe2,mg/(g min);Qe和Qt分别是平衡时刻和对应的t时刻的吸附容量,mg/g;k2是准二阶动力学常数,mg/(g min);h代表准二阶动力学模型的起始吸附速率,mg/(g min)。通过线性拟合并根据t/Qt与t之间的线性相关系数r2来判断是否合适。
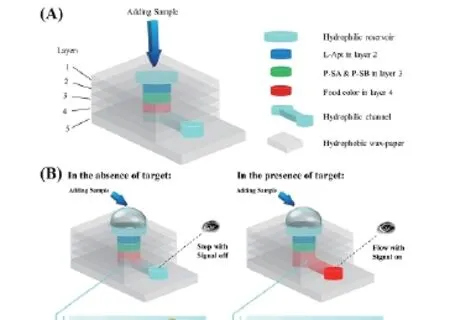
图6 磁性印迹复合物颗粒和非印迹复合物颗粒的吸附动力学数据的准二级动力学方程拟和结果Fig. 6 Pesudo-second-order fit results of binding kinetics for MIP and NIP
从图5中可以看到,相关系数r2都大于0.999,说明本章实验的吸附行为都满足准二级动力学模型。该吸附过程中的限速环节受到化学吸附过程的控制,吸附容量大小与固体颗粒表面作用位点数量成正比。经过计算得到相应的计算平衡吸附容量分别为15.576和29.070 mg/g,与实际测量值很接近。
3.7溶菌酶磁性纳米颗粒表面印迹复合物的吸附选择性测试
为进一步检验溶菌酶磁性纳米颗粒表面印迹复合物对目标蛋白溶菌酶(Lyz,Mw 14.4kDa,pI 11)的吸附选择性,选取牛血清白蛋白(BSA, Mw 64.5kDa,pI 4.7),卵清白蛋白(OVA, Mw 45 kDa,pI 4.6)作为对照蛋白,测试磁性聚合物颗粒对这几种蛋白的吸附行为。测试结果作图如下:
图7 表面印迹磁性复合物颗粒和非印迹复合物颗粒的吸附选择性实验结果Fig. 7 Binding selectivity of MIP and NIP
从图6可以看出,磁性纳米颗粒表面印迹复合物MIP对目标蛋白溶菌酶的吸附量最大,而MIP对对照蛋白的吸附量与非印迹聚合物NIP颗粒的吸附量区别不大,说明表现出非特异性吸附行为。这主要是由于模板蛋白溶菌酶分子比对照蛋白分子的体积要小,所以制备的印迹聚合物MIP表面的印迹空穴相对较小,空间位阻比较大,对照蛋白很难进入空穴,因而造成吸附主要是非特异性吸附;另一方面,在pH 6.5条件下,对照蛋白也是带有负电荷,由于静电排斥作用的存在,导致对照蛋白的吸附量比NIP的非特异性吸附还要小。
通过计算得到不同对照蛋白的选择因子结果列于下表1中。

表1 表面印迹磁性复合物颗粒和非印迹复合物颗粒的吸附选择性因子计算结果Table 1 Selectivity coefficiency (SC) of MIP and NIP
从表1中结果可以看出,溶菌酶磁性纳米颗粒表面印迹复合物MIP于对照蛋白BSA和OVA的选择性因子都超过1.5,表现出较好的吸附选择性。
综上所述,溶菌酶磁性纳米颗粒表面印迹复合物MIP表面存在能与模板蛋白溶菌酶在空间结构上互补且具有印迹吸附作用位点的印迹空穴,能够对目标蛋白产生更强的亲和吸附作用,因而表现出吸附选择性;而非印迹聚合物NIP颗粒主要是依靠非特异性相互作用吸附各种蛋白分子。
4 结论
磁性纳米颗粒表面印迹复合物能提供选择性吸附能力和磁性分离特性,在生命科学领域具有重大应用前景。本文采用新设计的方法,简化合成过程,提高了磁响应特性和快速分离的能力;同时,产生的更强的静电相互作用有助于实现非常快速达到吸附平衡。吸附选择性实验表明制备得到的印迹聚合物具有选择性识别能力。这些性能的改善和提升对磁性表面印迹复合物的实际应用非常重要。
参考文献
[1]Kubo T, Arimura S, Naito T, Otsuka K. Selective adsorption of trypsin using molecularly imprinted polymers prepared with PEG-based hydrogels containing anionic functional monomers[J]. Molecular Imprinting. 2015, 2(1):46-53.
[2]Musile G, Cenci L, Andreetto E, et al. Screening of the binding properties of molecularly imprinted nanoparticles via capillary electrophoresis[J]. Analytical and Bioanalytical Chemistry. 2016, 408 (13):3435-3443.
[3]Lin Z, Yang F, He X, et al. Preparation and evaluation of a macroporous molecularly imprinted hybrid silica monolithic column for recognition of proteins by high performance liquid chromatography[J]. Journal of Chromatography A. 2009,1216(49):8612-8622.
[4]Ji S, Li N, Shen Y,et al. Poly(amino acid)-based thermoresponsive molecularly imprinted magnetic nanoparticles for specific recognition and release of lysozyme[J]. Analytica Chimica Acta. 2016, 909:60-69.
[5]Yang C, Yan X, Guo H, et al. Synthesis of surface proteinimprinted nanoparticles endowed with reversible physical crosslinks[J]. Biosensors and Bioelectronics. 2016, 75:129-135.
[6]Wang H, Li L, Zhao Y. Preparation of Molecularly Imprinted Polymers Functionalized with Core--shell Magnetic Nanoparticles for the Recognition of Glycoprotein[C]. International Conference on Material Science and Application (ICMSA 2015). Atlantis Press, 2015:668-672.
[7]Zhang M, Wang Y, Jia X, et al. The Preparation of Magnetic Molecularly Imprinted Nanoparticles for the Recognition of Bovine Hemoglobin[J]. Talanta. 2014, 120:376-385.
[8]Hirayama K, Kameoka K. Synthesis of polymer particles with specifi c binding sites for lysozyme by a molecular imprinting technique and its application to a quartz crystal microbalance sensor[J]. Bunseki Kagaku. 2000, 49(1):29-34.
[9]Saridakis E, Khurshid S, Govada L, et al. Protein crystallization facilitated by molecularly imprinted polymers[J]. Proceedings of the National Academy of Sciences. 2011,108(27):11081-11086.
[10]Liu J, Sun Z, Deng Y, et al. Highly water-dispersible biocompatible magnetite particles with low cytotoxicity stabilized by citrate groups[J]. Angewandte Chemie International Edition. 2009, 121(32):5989-5993.
[11]Cao J, Zhang X, He X, et al. Facile synthesis of Ni (II)-immobilized core-shell magnetic nanocomposite as an effi cient affi nity adsorbent for the depletion of abundant proteins from bovine blood[J]. Journal Materials Chemistry B. 2013,1(30):3625-3632.
[12]Zeng H, Wang Y, Nie C, et al. Preparation of magnetic molecularly imprinted polymers for separating rutin from Chinese medicinal plants[J]. Analyst. 2012, 137(10):2503-2512.
[13]Ou S, Wu M, Chou T, et al. Polyacrylamide gels with electrostatic functional groups for the molecular imprinting of lysozyme[J]. Analytica Chimica Acta. 2004, 504(1):163-166.
[14]Sankarakumar N, Tong Y W. Preventing viral infections with polymeric Virus Catchers: A novel nanotechnological approach to antiviral therapy[J]. Journal Materials Chemistry B. 2013, 1 (15):1987-2108.
罗爱芹(通讯作者),教授,博士生导师,研究方向为生物分离、分析技术及其应用,电子邮箱:aqluobit@163.com。
中图分类号:TQ028.1
文献标识码:A
DOI:[CLC Number] TQ028.1[Document Code] A10.11967/2016140307 10.11967/2016140307
作者简介:⋆杨戍,男,博士研究生,研究方向为分子印迹技术与相关应用,电子邮箱:1295698925@qq.com;
Preparation and Binding Property Characterization of Lysozyme Surface Imprinted Magnetic Nanoparticles
Shu Yang,Xin Zhang, Rui Jiang, Liquan Sun, Aiqin Luo*
( School of Life, Beijing Institute of Technology, Beijing 100081 )
Abstract:Due to protein' s large molecule size and flexible conformation, protein imprinting is still facing big challenge. In this paper, a novel preparation method for the preparation of protein surface imprinting is presented. A carboxyl functionalized magnetic core was firstly prepared by one-step solvo-thermal method, then magnetic core surface was functionalized with vinyl group with simple one step, followed by enhanced acrylamide imprinting process. This process avoids multi-steps functionalization, possible aggregation and too thick surface coating. High saturation magnetization enables fast magnetic separation of the magnetic nanoparticles. Binding experimental results demonstrated that the imprinted magnetic nanoparticles could reach binding equilibrium within 10min, which shows a very fast binding kinetics. And analysis showed that they agreed with pseudo-second-order binding kinetics model. Further binding selectivity experiments demonstrated lyz-surface imprinted magnetic nanoparticles could selectively absorb target protein.
Key Words:Lysozyme; Surface imprinting; Magnetic nanoparitcles; Binding property

