肥胖对行全胃切除术的胃癌患者围手术期的影响
闫世贤佟伟华陈羽佳刘恒昌徐越超*
山东省潍坊市中医院肿瘤外科1 (261041) 吉林大学白求恩第一医院胃结直肠外科2
肥胖对行全胃切除术的胃癌患者围手术期的影响
闫世贤1佟伟华2陈羽佳2刘恒昌2徐越超2*
山东省潍坊市中医院肿瘤外科1(261041)吉林大学白求恩第一医院胃结直肠外科2
背景:目前主要采用体质指数(BMI)评估肥胖。但有研究发现,BMI相同者的脂肪分布不尽相同,内脏脂肪与皮下脂肪对疾病的影响也存在差异。目的:观察肥胖对行全胃切除术的胃癌患者围手术期的影响。方法:将294例行全胃切除术的胃癌患者根据BMI分为偏瘦组、正常组、偏胖组和肥胖组,根据内脏脂肪面积与总脂肪面积百分比(V/T)将患者分为内脏肥胖(VFv)组和皮下肥胖(VFs)组。分析各组患者的基本资料、手术与术后恢复情况以及BMI、V/T与总体生存率的关系。结果:偏瘦组和肥胖组术后并发症发生率显著高于正常组和偏胖组(P<0.05),偏瘦组以吻合口瘘和营养不良为主,肥胖组以切口脂肪液化和切口感染裂开为主。VFv组术后并发症发生率显著低于VFs组(P<0.05),两组术后并发症均以切口脂肪液化和吻合口瘘为主。正常组(60.8%)和偏胖组(57.4%)生存率显著高于肥胖组(39.2%)和偏瘦组(21.4%)(P<0.05),VFs组生存率显著高于VFv组(61.3%对48.8%,P<0.05)。多因素生存分析结果显示,城乡构成比、TNM分期、肿瘤分化程度、BMI值和V/T值是影响胃癌患者预后的因素(P<0.05)。结论:肥胖可能是行全胃切除术胃癌患者预后较差的标志。
胃肿瘤;肥胖症;全胃切除术;围手术期;预后
肥胖会严重影响身体健康,脂肪蓄积过多可能增加心脑血管疾病、2型糖尿病和骨关节炎等疾病的发病风险[1]。而新近研究表明,肥胖可能是诱发癌症(如乳腺癌、子宫内膜癌、结肠癌等)的危险因素之一[2]。目前国际上关于肥胖对癌症预后影响的观点不一。Payton[3]的队列研究发现,肥胖的前列腺癌患者死亡率显著高于非肥胖患者。但Sugimoto等[4]的研究结果认为肥胖与胃癌患者的预后无明显相关性。本研究通过分析胃癌患者的临床资料,旨在观察肥胖对行全胃切除术胃癌患者围手术期的影响。
对象与方法
一、一般资料
选取2012年1月—2013年12月吉林大学白求恩第一医院胃结直肠外科收治的拟行全胃切除的胃癌患者294例,诊断经胃镜病理检查确诊。其中男198例,女96例,年龄38~82岁。入选标准[5-7]:纳入标准:①临床资料完整,包括年龄、身高、体重、基础疾病、各项生化指标、全腹多排CT检查、肿瘤直径、手术时间、术中出血量;②原发性胃癌,且未发生远处转移;③均由同一主刀医师和一助完成手术。排除标准:①行部分胃切除(近端胃、远端胃切除)或姑息性全胃切除的患者;②因胃癌并发症(出血、穿孔)行全胃切除术者;③病理诊断为除腺癌外的其他类型肿瘤;④联合其他脏器切除者;⑤运动员(包括近1年内进行过规律重量训练者)、哺乳期妇女、卧床或久坐1年以上者。胃癌TNM分期采用国际抗癌联盟/美国癌症联合委员会(UICC/AJCC)2010年制定的第7版胃癌分期。本研究方案经吉林大学白求恩第一医院伦理委员会审核通过,所有患者均签署知情同意书。
二、研究方法
根据患者入院时的身高和体重,计算体质指数(body mass index,BMI),并根据BMI值将患者分为四组,偏瘦组:BMI<18.5 kg/m2;正常组:BMI 18.5~23.9 kg/m2;偏胖组:BMI 24~27.9 kg/m2;肥胖组:BMI≥28 kg/m2。
入院后患者行全腹多排螺旋CT(飞利浦 Brilliance CT 64)检查,调整衰减水平为-250~-50 HU,选取脐水平图像,图像采用GE影像工作站(Authorware 7.0)处理,并用Histogram软件根据设定阈值计算皮下脂肪面积(subcutaneous fat area,SFA)、内脏脂肪面积(visceral fat area,VFA)和总脂肪面积(total fat area,TFA)。SFA定义为腹部皮肤下至腹壁肌肉外缘的脂肪面积,VFA定义为前部腹肌、腰肌和脊椎围成的范围内脂肪面积,TFA定义为SFA+VFA。计算内脏脂肪占总脂肪的百分比(V/T),V/T=VFA/TFA×100%,V/T>29%定义为内脏肥胖(visceral obesity,VFv),V/T≤29%为皮下肥胖(subcutaneous obesity,VFs)。
观察指标:①手术操作时间:从侵入性操作开始至缝合结束的时间;②术中出血量:吸引器中液体量+纱布中液体量-冲洗液液体量;③肿瘤病理学指标:肿瘤的直径、位置、TNM分期、分化程度、淋巴结转移情况。
所有患者术后3个月、6个月、12个月各随访一次,此后每年随访一次,随访截止至2015年6月30日,随访终点设定为患者死亡或最后一次随访。
三、统计学分析
结 果
一、各组患者的基本资料
1.根据BMI分组:不同BMI组患者的城乡构成、高血压、糖尿病患病率和TNM分期差异有统计学意义(P<0.05)。肥胖组城市人口比例高于其他组别(P<0.000 1);肥胖组和偏瘦组高血压患病率显著高于其余两组(P<0.05),肥胖组糖尿病患病率显著高于其余三组(P<0.05);肥胖组患者TNM Ⅰ~Ⅱ期比例显著高于其余三组(P<0.05),正常组和偏胖组患者TNM Ⅰ~Ⅱ期比例显著高于偏瘦组(P<0.05)。而其他组间各指标两两相比差异无统计学意义(P>0.05)(表1)。
2.根据V/T分组:VFs组农村人口比例显著高于VFv组(P<0.05),高血压、糖尿病、冠心病、TNM Ⅰ~Ⅱ期比例、中低分化比例显著降低(P<0.05),而两组性别构成、平均年龄、肿瘤位置、肿瘤直径无明显差异(P>0.05)(表2)。
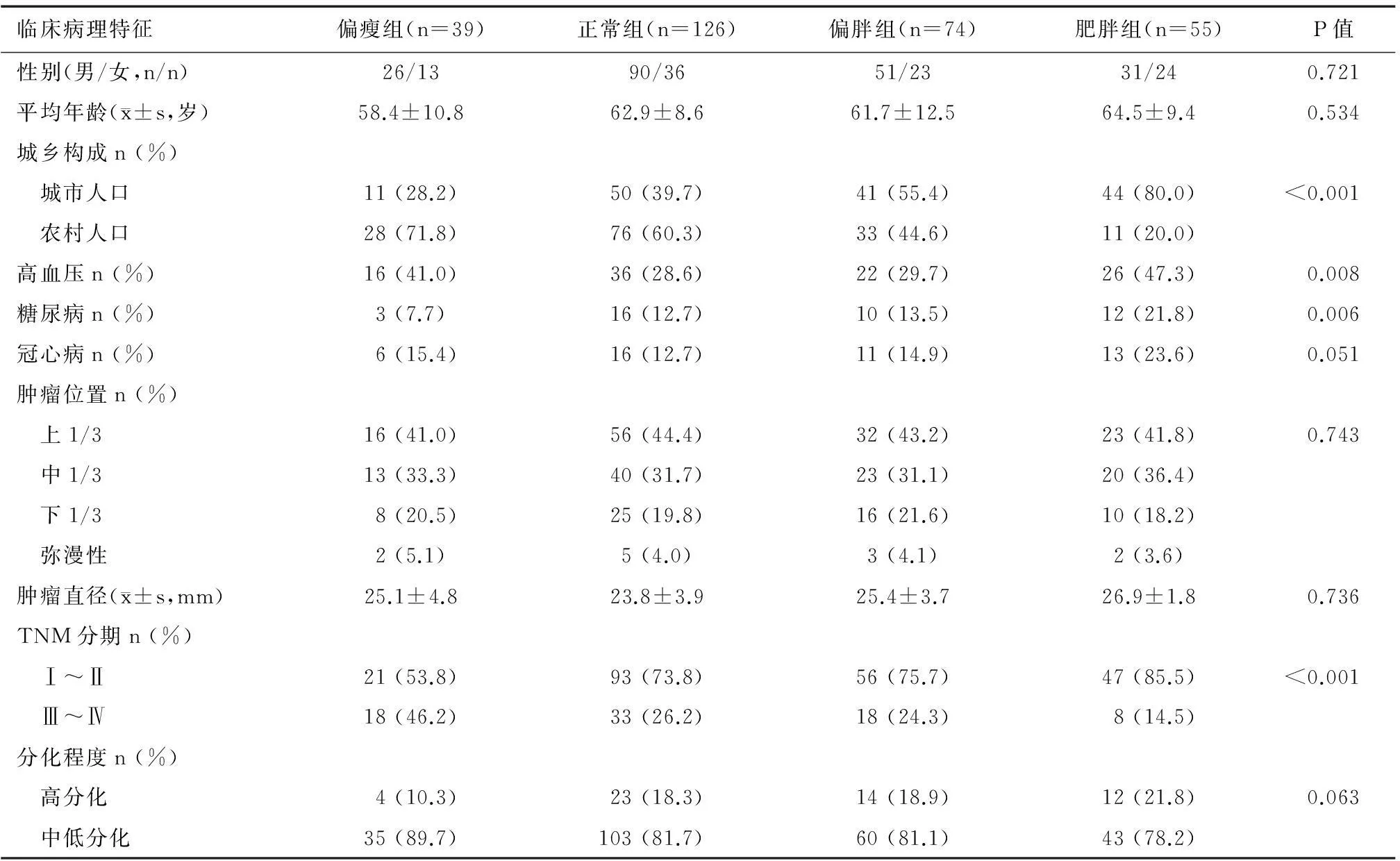
表1 根据BMI分组的患者基本资料
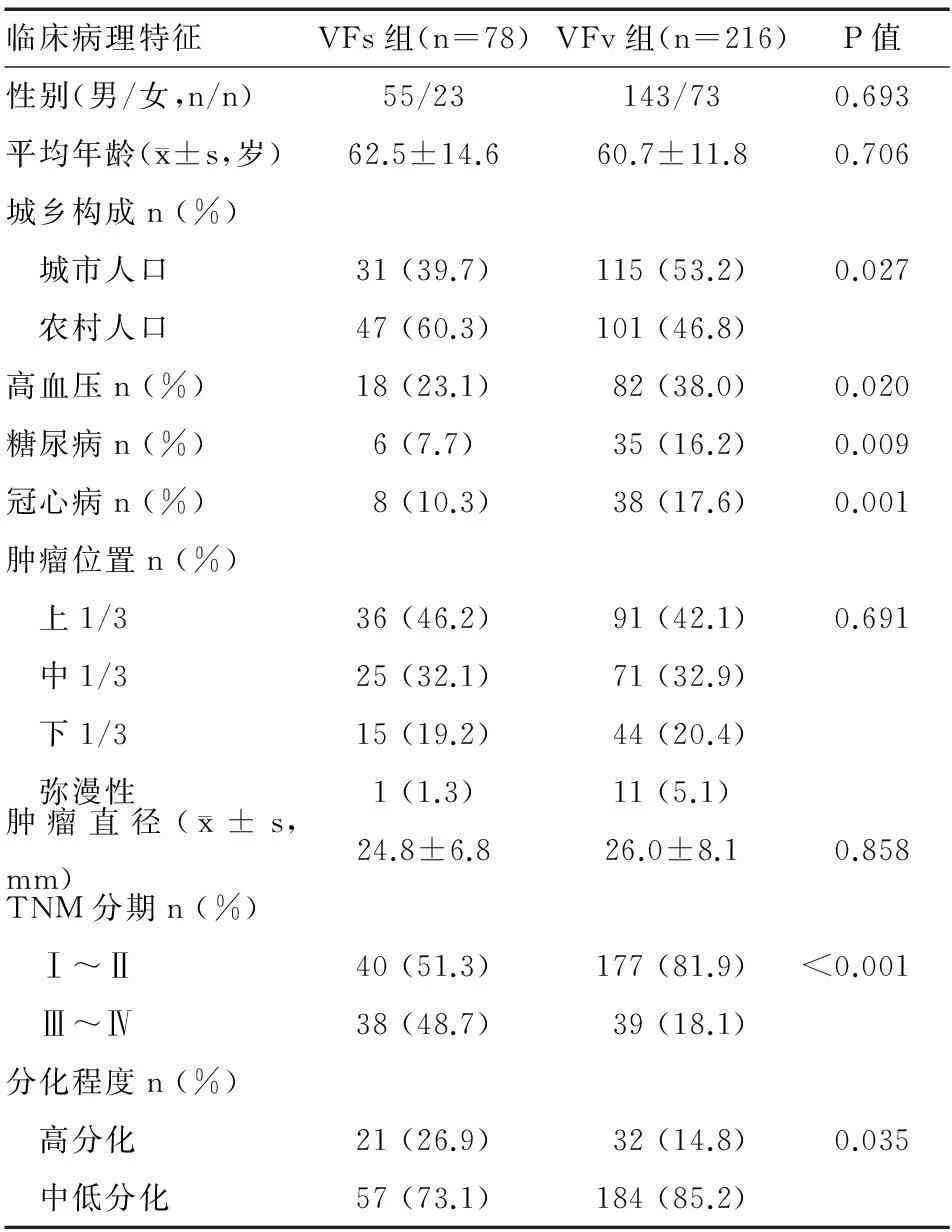
表2 根据V/T分组的患者基本资料
二、手术与术后恢复情况
1.根据BMI分组:不同BMI组手术时长、术中出血量和住院天数之间差异无统计学意义(P>0.05);而术后并发症发生率相比差异有统计学意义(P<0.001),其中偏瘦组术后并发症发生率显著高于其余三组(P<0.000 1),肥胖组显著高于正常组和偏胖组(P=0.001 8,P<0.000 1)(表3)。偏瘦组术后并发症主要为吻合口瘘和营养不良,肥胖组主要为切口脂肪液化和切口感染裂开。
2.根据V/T分组:不同V/T组手术时长、术中出血量和住院天数无明显差异(P>0.05),而VFs组术后并发症发生率显著高于VFv组(P<0.05)(表4)。VFs组和VFv组术后并发症主要为切口脂肪液化和吻合口瘘。
三、随访情况
共267例胃癌患者完成随访,随访完成率为 90.8%。失访27例中,偏瘦组11例,正常组6例,偏胖组6例,肥胖组4例;VFs组16例,VFv组11例。随访时间1~42个月,平均31.8个月。Kaplan-Meier法发现,正常组(60.8%,73/120)和偏胖组生存率(57.4%,39/68)显著高于肥胖组(39.2%,20/51)和偏瘦组(21.4%,6/28)(P<0.05),而正常组与偏胖组以及肥胖组与偏瘦组之间均无明显差异(P>0.05)。VFv组生存率(48.8%,100/205)显著低于VFs组(61.3%,38/62)(P<0.05)(图1)。

表3 不同BMI患者手术与术后恢复情况

表4 不同V/T患者手术与术后恢复情况

A:基于BMI分组的生存曲线;B:基于V/T分组的生存曲线
四、多因素生存分析
多因素生存分析结果显示,城乡构成比、TNM分期、肿瘤分化程度、BMI值和V/T值是影响胃癌患者预后的因素,即城乡构成比越低、TNM分期越高、分化程度越低、BMI值越高和V/T值越高,患者生存率越低(表5)。

表5 胃癌患者预后的多因素COX分析
进一步分析发现,肿瘤TNM分期和分化程度是影响各亚组患者预后的因素,TNM分期越高、分化程度越低,预后越差。此外,VFv组患者BMI值越高,其预后越差;糖尿病是影响偏瘦组和肥胖组患者预后的因素;V/T值是影响偏胖组和肥胖组患者预后的因素。
讨 论
本研究发现,肥胖组手术时长略高于其余三组,VFv组手术时长亦略高于VFs组。与Makino等[8]的研究结果基本一致。在实际操作中,肥胖患者内脏脂肪组织较多,会增加大网膜等组织分离的难度和工作量,故造成手术时长略延长。本研究还发现,偏瘦组和肥胖组术后并发症发生率均高于正常组和偏胖组,与Yanagawa等[9]的研究结果相似。而Tegels等[10]的研究发现,造成这种结果的原因可能是偏瘦组患者入院前多存在营养不良,身体素质较差,造成自主恢复能力较其他患者弱,进而导致术后并发症的发生风险较高。而肥胖患者由于皮下脂肪组织较多,容易发生脂肪液化,继而切口感染的发生风险升高。
本研究生存率分析发现,正常组和偏胖组生存率显著高于肥胖组和偏瘦组,VFs组生存率显著高于VFv组。目前对于BMI与肿瘤患者术后生存率关系的结论并不一致。本研究偏瘦组生存率较低的原因可能为营养状态较差,且偏瘦组中农村人口所占比例较高(71.8%),可能会导致患者术后无法拥有良好的康复环境,因经济问题引起的巨大心理压力可能亦是造成农村肿瘤患者预后较差的原因之一。肥胖组生存率较低的原因之一可能为肥胖患者基础疾病较多,高血压和糖尿病所占比例高于其余三组。Isakson等[11]的研究发现,肥胖可影响肿瘤细胞的分化。有研究指出,肥胖与癌症的发生、发展有共同的转导通路,脂肪细胞产生的多种激素可促进细胞增殖,进而诱导癌细胞的产生和繁殖[12]。本研究中VFv组生存率显著低于VFs组,且肿瘤低分化率较高,这可能是由于大量内脏脂肪包绕在肿瘤组织周围,使炎症反应更剧烈,肿瘤分化程度较低,导致生存率较低。进一步COX分析发现,肿瘤分化程度是影响患者预后的因素之一。
本研究发现城乡构成比、TNM分期、分化程度、BMI值和V/T值为影响胃癌患者预后的因素,即城乡构成比越低、TNM分期越高、分化程度越低、BMI值越高和V/T值越高,患者的生存率越低。这与Abnet等[13]、House等[14]的研究结果一致。其中城乡构成比越低,患者生存率越低,间接证实了偏瘦组生存率较低可能是由于农村人口比例高所造成。TNM分期、分化程度、BMI值和V/T值则可作为初步评估患者预后的指标,并根据不同患者制定个体化治疗方案,提高生存率。
综上所述,肥胖可能是行全胃切除术的胃癌患者预后较差的标志,但结论有待进一步大规模研究证实。
1丁炜光.2型糖尿病合并高甘油三酯血症-腰围表型与非酒精性脂肪性肝病的相关性研究[J].天津医药,2014,42 (12):1219-1222.
2Arem H,Mayne ST,Sampson J,et al.Dietary fat intake and risk of pancreatic cancer in the Prostate,Lung,Colorectal and Ovarian Cancer Screening Trial[J].Ann Epidemiol,2013,23 (9):571-575.
3Payton S.Prostate cancer:periprostatic fat is a risk factor for prostate cancer detection[J].Nat Rev Urol,2012,9 (4):180.
4Sugimoto M,Kinoshita T,Shibasaki H,et al.Short-term outcome of total laparoscopic distal gastrectomy for overweight and obese patients with gastric cancer[J].Surg Endosc,2013,27 (11):4291-4296.
5张广钰,田小林,钟漓,等.microRNA-93在胃癌中的表达及其临床意义[J].肿瘤防治研究,2013,40 (5):447-450.
6Song M,Choi JY,Yang JJ,et al.Obesity at adolescence and gastric cancer risk[J].Cancer Causes Control,2015,26 (2):247-256.
7Yang P,Zhou Y,Chen B,et al.Overweight,obesity and gastric cancer risk:results from a meta-analysis of cohort studies[J].Eur J Cancer,2009,45 (16):2867-2873.
8Makino H,Kunisaki C,Izumisawa Y,et al.Effect of obesity on laparoscopy-assisted distal gastrectomy compared with open distal gastrectomy for gastric cancer[J].J Surg Oncol,2010,102 (2):141-147.
9Yanagawa T,Iwazawa T,Fujita J,et al.Preoperative nutritional status and postoperative infectious complications in gastric cancer patients with pyloric stenosis[J].Jpn J Surg Metab Nutr,2013,47 (5):139-145.
10Tegels JJ,de Maat MF,Hulsewé KW,et al.Value of geriatric frailty and nutritional status assessment in predicting postoperative mortality in gastric cancer surgery[J].J Gastrointest Surg,2014,18 (3):439-445.
11Isakson P,Hammarstedt A,Gustafson B,et al.Impaired preadipocyte differentiation in human abdominal obesity:role of Wnt,tumor necrosis factor-alpha,and inflammation[J].Diabetes,2009,58 (7):1550-1557.
12张楠楠,高超,邱渝杰,等.肥胖与癌症关系的临床研究最新进展[J].医学综述,2014,20 (8):1401-1403.
13Abnet CC,Freedman ND,Hollenbeck AR,et al.A prospective study of BMI and risk of oesophageal and gastric adenocarcinoma[J].Eur J Cancer,2008,44 (3):465-471.
14House MG,Fong Y,Arnaoutakis DJ,et al.Preoperative predictors for complications after pancreaticoduodenectomy:impact of BMI and body fat distribution[J].J Gastrointest Surg,2008,12 (2):270-278.
(2015-10-20收稿;2015-11-14修回)
Effect of Obesity on Perioperative Status in Patients with Total Gastrectomy for Gastric Cancer
YAN Shixian1,TONG Weihua2,CHEN Yujia2,LIU Hengchang2,XU Yuechao2.
1Department of Surgical Oncology,Weifang Traditional Chinese Medicine Hospital,Weifang,Shandong Province (261041);2Department of Gastrointestinal Surgery,the First Hospital of Jilin University,Changchun
Correspondence to:XU Yuechao,Email:383612776@qq.com
Background:Body mass index (BMI) is commonly used for the evaluation of obesity.Studies have shown that the distribution of fat may be different in people with same BMI,and effects of visceral fat and subcutaneous fat on the disease are also different.Aims:To study the effect of obesity on perioperative status in patients with total gastrectomy for gastric cancer.Methods:A total of 294 gastric cancer patients undertaking total gastrectomy were divided into slim group,normal group,overweight group and obese group according to BMI; and visceral obesity (VFv) group and subcutaneous obesity (VFs) group were categorized according to the percentage of visceral fat area to total fat area (V/T).Basic data,surgery,postoperative recovery,and relationships between BMI,V/T and overall survival rate were analyzed.Results:The incidence of postoperative complication in slim group and obese group was significantly higher than that in normal group and overweight group (P<0.05).Main postoperative complications were anastomotic fistula and malnutrition in slim group,and incision fat liquefaction and infection in obese group.The incidence of postoperative complication in VFv group was significantly lower than that in VFs group (P<0.05).Main postoperative complications in VFv group and VFs group were incision fat liquefaction and anastomotic fistula.Overall survival rates in normal group (60.8%) and overweight group (57.4%) were significantly higher than those in obese group (39.2%) and slim group (21.4%) (P<0.05); survival rate in VFs group was significantly higher than that in VFv group (61.3% vs.48.8%,P<0.05).Multivariate survival analysis showed that the urban/rural ratio,TNM staging,tumor differentiation,BMI value and V/T value were the prognostic factors of gastric cancer patients.Conclusions:Obesity may be a marker for poor prognosis of gastric cancer patients after total gastrectomy.
Stomach Neoplasms;Obesity;Gastrectomy;Perioperative Period;Prognosis
DOI:10.3969/j.issn.1008-7125.2016.07.005
*本文通信作者,Email:383612776@qq.com

