ID1对非小细胞肺癌EGFR-TKI耐药的影响
鲍昱辰 赵印敏 陈斌 罗洁 邓沁芳 孙辉 谢博雄 周崧雯
肺癌的发病率和死亡率很高,严重威胁人类健康[1,2]。在我国城市中肺癌死亡率已上升为第一位[3]。随着分子生物学的研究进展,靶向药已成为治疗非小细胞肺癌的重要手段[4]。然而,即使对于敏感人群,第一代表皮生长因子受体-酪氨酸激酶抑制剂(epidermal growth factor receptor-tyrosine kinase inhibitors, EGFR-TKI)(包括易瑞沙、特罗凯、凯美纳)或早或晚仍会出现获得性耐药,导致疾病进展[5,6],因此,如何克服耐药提高疗效已成为靶向药治疗的重要瓶颈[7,8]。分化抑制因子(differentiation inhibitory factor, ID)是一种负性调节因子[9,10]。近年的研究表明,ID蛋白在肿瘤发生及发展过程中发挥了重要作用[11]。ID1作为ID蛋白家族成员,在多种肿瘤中呈高表达,是一种潜在的癌基因[12,13]。有研究[14,15]认为ID1与肺癌靶向药耐药相关,但相关报道甚少,具体分子机制未明。
1 材料与方法
1.1 主要试剂与仪器 肺腺癌细胞株H522、H1975、A549、PC-9、PC-9R由上海市肺科医院中心试验室提供。其中PC-9为EGFR-TKI敏感株,PC-9R为EGFR-TKI获得性耐药株,H1975为T790M突变EGFR-TKI耐药株,A549、H522为EGFR-TKI原发耐药株,获取我院肺癌手术患者癌组织及癌旁组织。青霉素、链霉素购自上海先锋药业公司;Trizol试剂购自Invitrogen公司;SYBR Green PCR试剂盒购自TAKARA公司;RNaseI购自Fermentas公司;兔抗人单克隆抗体购自Abcam公司;BSA购自北京索莱宝生物科技有限公司;吉非替尼购自大连美仑;Realtime检测仪购自ABI公司;流式细胞仪购自Backman Coulter公司。
1.2 细胞培养 H522、H1975、A549、PC-9、PC-9R细胞用10%DMEM含双抗培养液在细胞恒温培养箱(温度为37 ℃且含5%CO2)中培养,次日换液。培养基为90%EMEM,10%胎牛血清。0.25%胰酶-EDTA消化传代,所有试验均采用对数生长期细胞。
1.3 ID1 siRNA慢病毒载体及ID1过表达慢病毒载体的构建ID1 siRNA慢病毒载体构建:shRNA序列:5’-CATGAACGGCTGTTACTCA-3’;病毒滴度:8×108U/mL,同时构建阴性对照慢病毒,ID1过表达慢病毒载体的构建:ID1基因片段引物:上游5’-GAGGATCCCCGGGTACCGGTCGCCACCATGAAAGTCGCCAGTGGCAG-3’;下游5’-TCCTTGTAGTCCATACCGCGACACAAGATGCGATC-3’。病毒滴度:2×108U/mL,同时构建阴性对照慢病毒。胰酶消化各组肺腺癌细胞,制成细胞悬液;显微镜下数出细胞总数,荧光显微镜观察荧光表达情况。
1.4 MTT法检测细胞增殖 细胞计数,调整细胞浓度,每孔悬液约100 μL,以5,000个/孔接种到96孔细胞培养板中,37 ℃、CO2培养24 h;弃培养基,加入含不同浓度吉非替尼(0 μmol/L、0.01 μmol/L、0.05 μmol/L、0.1 μmol/L、0.5 μmol/L、1 μmol/L、5 μmol/L、10 μmol/L、20 μmol/L、30 μmol/L、40 μmol/L、50 μmol/L)的培养基继续培养72 h;每孔加入5 mg/mL MTT溶液20 μL,37 ℃培养4 h;吸去上清液,加入200 μL二甲基亚砜(DMSO),使结晶物充分溶解;采用酶标仪检测570 nm的吸光度(A)值,每组设4个复孔;按以下公式计算细胞增殖率:[(空白组吸光度平均值-DMSO空白组平均值)-(各组平均值-DMSO空白组平均值)]/(空白组平均值-DMSO空白组平均值) ×100%=抑制率;采用直线回归方法计算药物的半抑制浓度(half maximal inhibitory concentration, IC50)值,实验重复3次。
1.5 Real-Time PCR检测各组肿瘤细胞ID1 mRNA的表达情况 去对数生长的各组肺腺癌细胞,Trizol法提取RNA,逆转录制备cDNA。将制备好的cDNA进行PCR扩增,ID1上游引物序列:5’-AAACGTGCTGCTCTACGACA-3’,ID1下游引物序列:5’-GGAACGCATGCCGCCT-3’,GAPDH上游引物序列:5’-CACCCACTCCTCCACCTTTG-3’,GAPDH下游引物序列:5’-CCACCACCCTGTTGCTGTAG-3’;95 ℃变性10 min后,按下述条件扩增40个循环,95 ℃,15 s;60 ℃,45 s;60 ℃延伸1 min。
1.6 免疫组化检测ID1蛋白的表达 选取标本经10%甲醛固定后,常规石蜡包埋、切片,厚度4 μm。采用免疫组化SP法,用PBS液代替一抗作为阴性对照,按照试剂说明书进行操作。结果判断:所有切片均采用双盲法由两位病理科医师独立阅片。ID1阳性表达均定位于细胞浆和细胞膜,呈浅黄色、黄色或棕黄色。随机选择10个高倍镜视野(400倍),每个视野连续计数100个细胞,共计数1,000个细胞。最后表达以染色强度和阳性细胞率的得分之和进行判断:无染色记0分,弱染色记1分,中等染色记2分,强染色记3分;阳性细胞率<5%记0分,5%-25%记1分,26%-50%记2分,>50%记3分。上述两项评分相加,<3分为阴性,≥3分为阳性。
1.7 Western blot检测相关蛋白的表达 取对数生长期的经siRNA慢病毒载体及ID1过表达慢病毒载体转染的H522、H1975、A549、PC-9、PC-9R细胞,收集细胞裂解提取蛋白。BCA法测定细胞裂解物的蛋白含量,取等量蛋白质以12% SDS-PAGE法分离并转移至PVDF膜上,以单克隆抗体4 ℃过夜孵育以检测目标蛋白(p-ERK、ERK、p-AKT、AKT、p-STAT3、STAT3、p-EGFR、EGFR),GAPDH作为内参。洗去一抗,以HRP连接的二抗于室温孵育2 h,洗涤后以ECL试剂盒显示免疫印迹条带。
1.8 动物实验 将肺腺癌细胞PC-9、PC-9/ID1-OE、PC-9/R、PC-9/R/ID1-KD细胞接种至75 cm2细胞培养瓶中,待细胞扩增至90%,胰酶消化,接种至BALB/c-nu裸鼠腋下;每只接种1×108个细胞。每株肺腺癌实验动物各设空白对照和吉非替尼两组。待肿瘤直径生长至3 mm左右时,空白对照组使用生理盐水灌胃治疗,吉非替尼组使用吉非替尼灌胃治疗(剂量为2 mg/kg/d),每天灌胃一次,持续4周;4周后,颈椎脱臼法处死,剥离肿瘤组织,测量肿瘤大小。
1.9 统计学方法 采用SPSS 20.0统计学软件进行统计分析,所有数据均以Meab±SD表示,单变量两组间资料比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 ID1在肺癌细胞株中高表达 肺癌细胞株H522、H1975、A549、PC-9、PC-9R中的ID1 mRNA均有表达(图1)。肺癌组织ID1 mRNA的表达比癌旁组织中高,有统计学差异(P<0.05)(图2A)。肺癌组织ID1蛋白的表达比癌旁组织中表达高,有统计学差异(P<0.05)(图2B)。
2.2 ID1与肺癌耐靶向药的关系 PC-9R细胞中ID1 mRNA表达量高于PC-9细胞,且具有统计学意义(P<0.05)(图1,图3)。根据荧光定量PCR的实验结果,选择PC-9细胞株感染ID1过表达慢病毒载体(ID1-OE),H522、H1975、A549、PC-9R细胞株感染ID1干扰慢病毒载体。72 h后用荧光显微镜观察,各组病毒感染率均大于90%,符合后续实验要求。MTT法检测吉非替尼对各组细胞增殖抑制作用。实验结果显示PC-9细胞感染ID1过表达慢病毒后,对吉非替尼的IC50值为0.64 μmol/L,较对照组(0.05 μmol/L)有一定程度的上升。PC-9R细胞感染ID1干扰慢病毒后,对吉非替尼的IC50值为1.14 μmol/L,较对照组(5.05 μmol/L)有一定程度的下降(表1)。而A549、H522、H1975细胞在感染ID1干扰慢病毒后,对吉非替尼的IC50值无明显改变。
2.3 各组细胞株在感染ID1干扰慢病毒后,ID1的表达情况 慢病毒感染后,H522、H1975、PC-9R、A549细胞中ID1表达下降,PC-9细胞中ID1表达上升(图4)。ID1-siRNA慢病毒感染PC-9R后,p-ERK、p-AKT、p-STAT3、p-EGFR有不同程度下降,ERK、AKT、STAT3、EGFR无明显改变;吉非替尼处理后,ID1-siRNA组ERK、AKT、EGFR磷酸化程度较对照组明显降低。ID1-OE慢病毒感染PC-9后,磷酸及非磷酸ERK、AKT、STAT3、EGFR均无明显改变;吉非替尼处理后,PC-9-ID1-OE组AKT、STAT3磷酸化程度较对照组有一定程度升高(图5)。
2.4 动物实验结果 PC-9实验组肿瘤平均体积为50.8 mm3,对照组肿瘤平均体积3,283.6 mm3,肿瘤抑制率为98.5%;PC-9(ID1 OE)实验组肿瘤平均体积为465.5 mm3,对照组肿瘤平均体积为1,084.7 mm3,肿瘤抑制率为57.1%,组间存在统计学差异(表2)。PC-9/R实验组肿瘤平均体积为81.2 mm3,PC-9/R对照组肿瘤平均体积为371.8 mm3(图5A),肿瘤抑制率为78.2%;PC-9/R(ID1 siRNA)实验组肿瘤平均体积为0,对照组肿瘤平均体积为85.3 mm3(图5B),肿瘤抑制率为100%,组间存在统计学差异(表2),值得注意的是,ID1基因沉默后,PC-9/R肿瘤生长极为缓慢,28 d仅增长0.9倍。
3 讨论
本研究证实了ID1参与非小细胞肺癌对EGFR-TKI耐药,且与手术患者预后相关。在探讨ID1是否参与肺癌靶向药耐药的相关研究中,我们检测了PC9及PC-9/R、H1975、A549、H522多组肺癌细胞株中ID1 mRNA。发现PC-9细胞中ID1 mRNA相对表达量较低,而PC-9/R细胞则明显升高,说明ID1与肺癌EGFR-TKI耐药相关。同时,发现H1975、A549、H522多组肺癌细胞株中ID1高表达,故对非小细胞肺癌手术标本免疫组化及RT-PCR检测,提示ID1在肺癌组织中较正常组织明显升高(P<0.05);分层分析显示,病理类型对ID1表达有意义,在鳞癌患者中呈高表达;分期及性别与ID1表达无相关性;1年OS与ID1表达分析提示,ID1与肺癌预后相关。进一步探讨ID1与非小细胞肺癌对EGFR-TKI耐药的相关性:使用慢病毒干扰技术,过表达及沉默肺癌细胞株ID基因的表达,再检测ID1蛋白的表达变化。结果显示:PC-9细胞感染ID1过表达慢病毒后,对吉非替尼的IC50值为0.64 μmol/L,较对照组(0.05 μmol/L)有一定程度的上升,说明PC-9敏感性降低;PC-9/R细胞感染ID1干扰慢病毒后,对吉非替尼的IC50值为1.14 μmol/L,较对照组(5.05 μmol/L)有一定程度的下降,说明PC-9/R耐药性降低(表1)。荷瘤裸鼠实验结果:PC-9 ID1-OE吉非替尼用药组肿瘤体积大于PC-9吉非替尼用药组。同时发现,吉非替尼处理后,ID1-siRNA组ERK、AKT、EGFR磷酸化程度较对照组明显降低,ID1-OE组AKT、STAT3磷酸化程度较对照组有一定程度升高。这说明:ID1表达量与肺癌EGFR-TKI耐药性呈正相关;STAT3可能通过磷酸化机制参与EGFR-TKI耐药。有研究[16]发现,STAT3的siRNA或抑制剂通过抑制STAT3激活,增强了肺癌细胞对吉非替尼的敏感性。但目前STAT3介导吉非替尼耐药的机制还不是很明确,需要进一步研究。
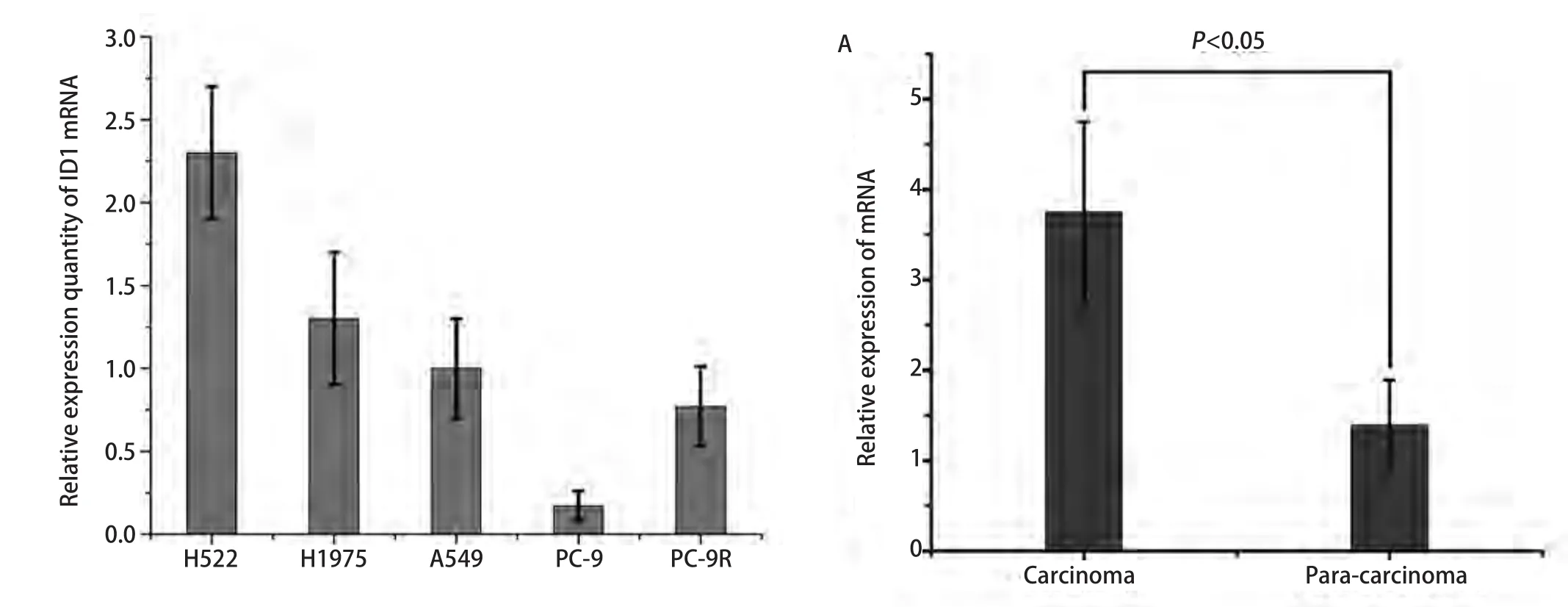
图1 肺癌细胞株H522、H1975、A549、PC-9、PC-9R中的ID1 mRNA相对表达量(P<0.05)Fig 1 Relative expression of ID1 mRNA in H522, H1975, A549, PC-9 and PC-9R lung cancer cell lines (P<0.05)
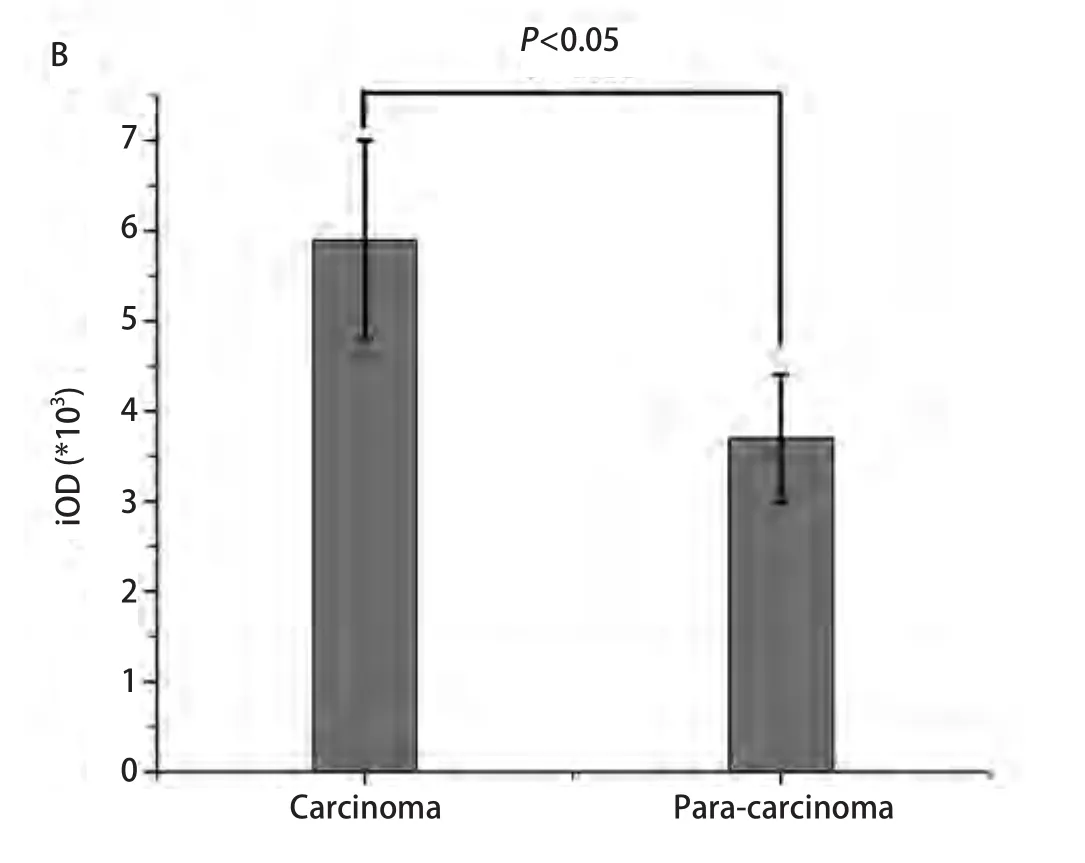
图2 ID1在肺癌组织与癌旁组织的相对表达量(P<0.05)。A:肺癌组织ID1 mRNA的表达量比癌旁组织中ID1 mRNA的表达量高(P<0.05);B:肺癌组织ID1蛋白的表达比癌旁组织中ID1蛋白的表达高(P<0.05)。Fig 2 Relative expression of ID1 in lung cancer tissues and adjacent tissues.A: The expression of ID1 mRNA in lung cancer tissues is relatively higher than that in adjacent tissues (P<0.05); B, C: The expression of ID1 protein in lung cancer tissues is higher than that in adjacent tissues(P<0.05).iOD: integral optical density.
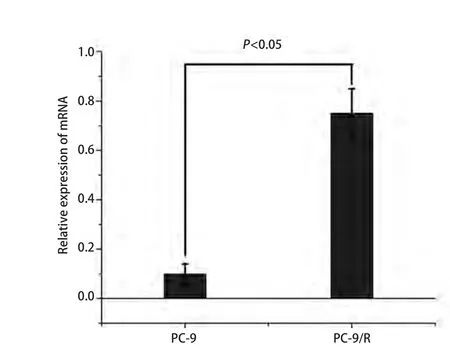
图3 PC-9R细胞中ID1 mRNA表达量高于PC-9细胞(P<0.05)。Fig 3 The expression of ID1 mRNA in PC-9/R cell lines is higher than that in PC-9 cell lines (P<0.05).
本研究通过体内外实验从细胞、动物到临床标本深入探讨了ID1与肺癌之间的关系,证实ID1在肺癌组织中高表达,其中以腺癌尤为明显,且ID1参与非小细胞肺癌对EGFR-TKI的获得性耐药。ID1或可成为非小细胞肺癌有价值的检测项目[17];ID1参与肺癌对EGFR-TKI的耐药,可能与STAT3的磷酸化有关,具体机制还有待我们接下来更深入地研究[17]。
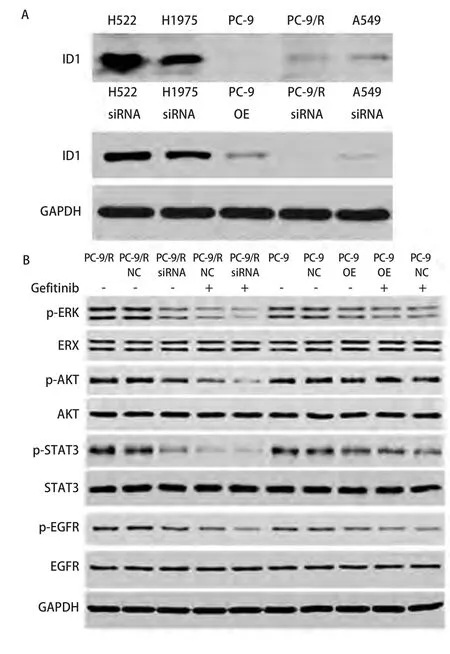
图4 慢病毒感染后,各组细胞ID1的表达情况以及PC-9R中不同信号通路的酶表达情况。A:慢病毒感染后,H522、H1975、PC-9R、A549细胞中ID1表达下降,PC-9细胞中ID1表达上升;B:ID1-siRNA慢病毒感染PC-9R后,p-ERK、p-AKT、p-STAT3、p-EGFR有不同程度下降,ERK、AKT、STAT3、EGFR无明显改变;吉非替尼处理后,ID1-siRNA组ERK、AKT、EGFR磷酸化程度较对照组明显降低。ID1-OE慢病毒感染PC-9后,磷酸及非磷酸ERK、AKT、STAT3、EGFR均无明显改变;吉非替尼处理后,PC-9-ID1-OE组AKT、STAT3磷酸化程度较对照组有一定程度升高。Fig 4 After slow viral infection, groups of cells expressed the ID1 enzyme in different signaling pathways of PC-9R.A: After infection of ID1-siRNA; ID1 expression decreases in H522, H1975, PC-9R, and A549 while increasing in PC-9;B: After infection of ID1-siRNA in PC-9R, p-ERK, p-AKT, p-STAT3 and p-EGFR decreased, whereas ERK, AKT, STAT3 and EGFR showed no change.Following gefitinib treatment, the extent of phosphorylation of ERK, AKT and EGFR in ID1-siRNA is lower than that in the control group.After infection of ID1-OE in PC-9, the extent of phosphorylation or non-phosphorylation of ERK, AKT and EGFR showed no change.After gefitinib treatment, the extent of phosphorylation of AKT and STAT3 in PC-9-ID1-OE is higher than that in the control group.
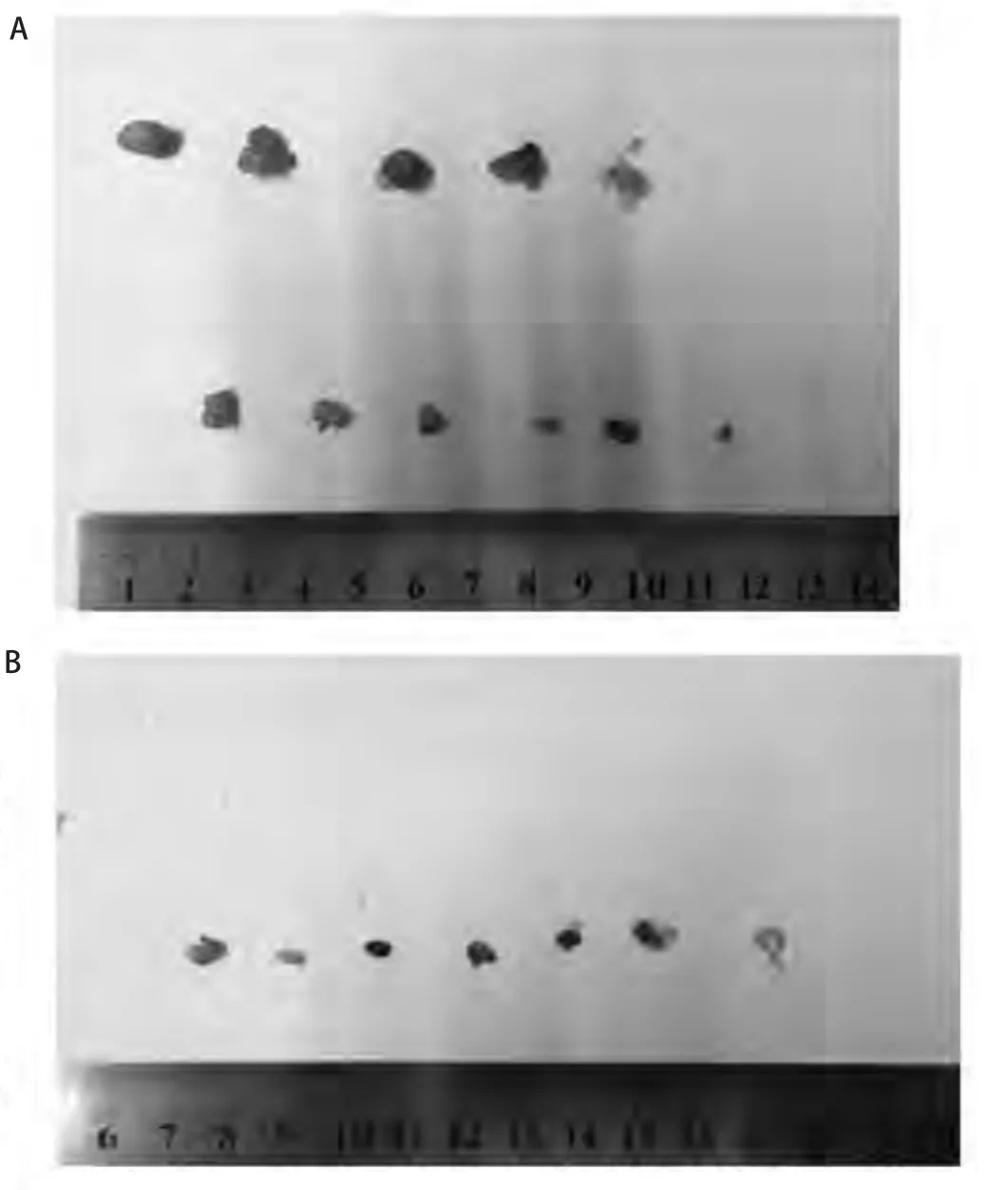
图5 动物实验结果。A:PC-9/R(ID1-OE)实验结果(标尺上方,第一行:对照组剥离肿瘤;第二行:灌胃组剥离肿瘤);B:PC-9R(ID1-siRNA)实验结果(标尺上方,第一行:对照组剥离肿瘤,第二行:灌胃组因肿瘤消失,故空行),值得注意的是,ID1基因沉默后,PC-9R(ID1 siRNA)肿瘤生长极为缓慢,28天仅增长0.9倍。Fig 5 Animal experiment.A: Experimental result of PC-9/R (ID1-OE)(Above scale, first line: control group stripping tumor, second line:lavage group stripping tumor); B: Experimental result of PC-9/R(ID1-siRNA) (Above scale, first line: control group stripping tumor,second line: when the tumor disappears, the lavage group is zero).Notably, with silence of the ID1 gene, tumor growth is very slow in PC-9R (ID1 siRNA), which grew only 0.9 times after 28 days.
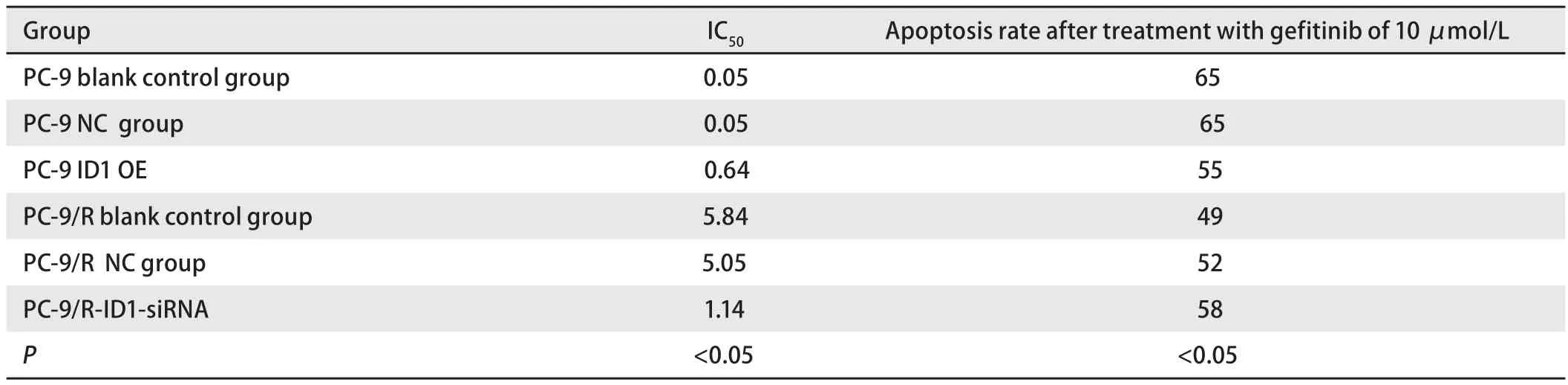
表1 各组肿瘤细胞IC50值和吉非替尼处理后凋亡率Tab 1 IC50 value in groups of tumor cells and apoptosis rate after treatment with gefitinib
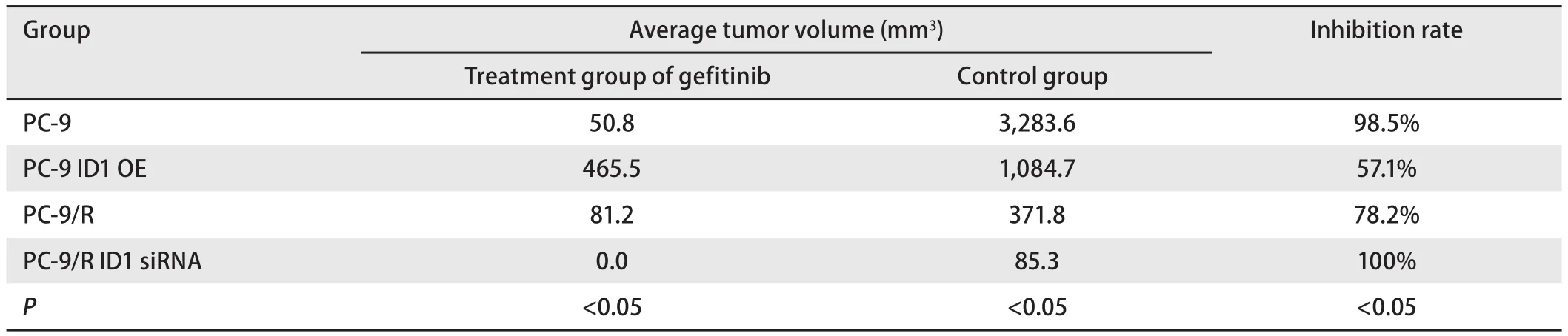
表2 吉非替尼治疗组与对照组的瘤体体积与抑瘤率Tab 2 Gefitinib treatment group and control group in the volume of tumors and inhibitory rate

