重度腺病毒肺炎患儿预后不良相关危险因素
郑申健,胡俊,汪珍珍,付文龙,刘贺临
(1 武汉科技大学附属孝感医院 孝感市中心医院,湖北 孝感 432000; 2 重庆医科大学附属儿童医院,重庆 401122)
·论著·
重度腺病毒肺炎患儿预后不良相关危险因素
郑申健1,胡俊1,汪珍珍1,付文龙2,刘贺临1
(1 武汉科技大学附属孝感医院 孝感市中心医院,湖北 孝感432000; 2 重庆医科大学附属儿童医院,重庆401122)
目的了解重度腺病毒肺炎(SAP)患儿预后不良的相关危险因素,为临床诊疗及预后判断提供指导。方法采用回顾性分析方法,对2012年1月—2014年1月重庆医科大学附属儿童医院儿科病房确诊的91例SAP住院患儿的临床资料进行统计分析。结果91例SAP住院患儿,预后不良23例(25.27%)。SAP患儿预后不良危险因素单因素分析结果显示,发病年龄、患先心病等严重基础疾病、机械通气治疗、发生急性呼吸窘迫综合症(ARDS)、有肺不张等严重影像学改变、出现2个及2个以上肺外并发症与SAP预后不良密切相关(均P<0.05)。多因素分析结果显示:患先心病等严重基础疾病、出现2个及2个以上肺外并发症是SAP预后不良的独立危险因素(均P<0.05)。结论患有先心病等严重基础疾病、出现2个及2个以上肺外并发症是SAP预后不良的独立危险因素,在临床诊治过程中应积极进行干预,改善预后。
儿童; 重度; 腺病毒肺炎; 预后不良; 危险因素
[Chin J Infect Control,2016,15(8):587-591]
随着医疗技术水平的提高,病原学检测手段逐渐增多,越来越多的呼吸道感染性疾病最终可以获得病原学诊断,给医务工作者提供了极大的帮助。随着呼吸道免疫荧光、病毒血清学检测等技术日趋成熟,小儿腺病毒肺炎确诊病例也逐年增加,对重度腺病毒肺炎(severe adenovirus pneumonia, SAP)的认识水平较前明显提高。对SAP预后不良的患儿进行研究,分析危险因素,以期为疾病的早期诊断、治疗、干预,以及降低病死率提供帮助。
1 对象与方法
1.1研究对象选取重庆医科大学附属儿童医院儿科病房2012年1月—2014年1月确诊的91例SAP住院患儿。
1.2诊断标准所有患儿入院后均行鼻咽部脱落细胞直接免疫荧光技术测定腺病毒抗原,若抗原阳性,参照第7版《诸福棠实用儿科学》[1]腺病毒肺炎的诊断标准。若同时符合世界卫生组织(WHO)推荐重度、极重度肺炎诊断标准[2]即诊断为重度肺炎和极重度肺炎,标准如下:(1)2个月~5岁儿童出现胸壁吸气性凹陷或鼻翼扇动或呻吟之一表现者,提示有低氧血症,诊断为重度肺炎;(2)若出现中心性紫绀、严重呼吸窘迫、拒食或脱水征、意识障碍(嗜睡、昏迷、惊厥)之一表现者诊断为极重度肺炎。SAP预后不良判定标准:患儿住院期间内死亡,或因严重并发症、后遗症患儿家属要求放弃治疗。所有患儿根据病情使用GE Light Speed 64排VCT扫描仪进行胸部CT平扫,且至少1次/人。发生以下1种或1种以上影像学改变即判定为严重影像学改变:(1)肺部节段实变;(2) 三叶以上肺叶受累;(3)胸腔积液、胸膜改变;(4)肺不张。
1.3研究方法
1.3.1腺病毒检测方法标本制作:入院当天专科资深护士用一次性吸痰管插入患儿鼻腔深部7~8 cm 处,到达咽部以下位置,用吸痰管诱导吸取约2 mL分泌物。将分泌物置于10~15 mL离心管中,加入PBS 4~8 mL,置于漩涡振荡器中震荡5 min,在离心机中300~500 r/min离心30 min,再次加入PBS 4~8 mL,置入离心机中离心洗涤,取出沉淀物加入0.1~0.2 mL稀释后的PBS溶液混匀。用微量吸管吸取上述液体约25 μL 滴至7孔玻片;室温空气下干燥后用4℃丙酮固定10 min。结果观察:在制作好的标本上分别加入采用荧光标记的呼吸道合胞病毒,腺病毒,流感病毒A型、B型,副流感病毒I型、II型、III型七项病毒的单克隆抗体试剂(美国Chemicon公司生产),在37℃恒温箱中放置30 min,取出标本,然后用洗涤液洗片3次,风干后应用封闭液封片,并在荧光显微镜(IX-7免疫荧光镜,日本Olympus公司生产)下读片。阳性细胞在镜下可见细胞核和/或细胞浆内呈黄绿色荧光;阴性细胞无荧光,背景为淡蓝色(参照试剂盒提供的阳性及阴性对比照片进行判定)。
1.3.2临床资料采用回顾性调查方法,收集研究对象的临床资料并填写调查表,调查内容包括:性别,发病年龄,持续发热是否超过1周,是否有先天性心脏病、先天性气道发育异常等严重基础疾病,是否需要机械通气治疗,胸部CT影像学改变,各系统相关并发症,是否使用糖皮质激素,是否使用丙种球蛋白免疫支持治疗,以及最终预后等相关信息。
1.4统计分析应用SPSS 17.0软件进行统计分析,单因素分析计数资料用率表示,并采用χ2检验;多因素分析采用二分类的logistic分析,P≤0.05 为差异有统计学意义。
2 结果
2.1一般情况共收集91例SAP患儿,其中男性52例(57.14%),女性39例(42.86%);患儿年龄2个月~5岁,平均年龄(2.1±0.2)岁,其中2个月~1岁患儿56例(61.54%),1~5岁患儿35例(38.46%);有先天性心脏病(先心病)等严重基础疾病患儿31例(34.07%),机械通气患儿82例(90.11%),使用丙种球蛋白患儿84例(92.31%),使用肾上腺糖皮质激素患儿78例(85.71%),预后不良患儿23例(25.27%)。
2.2并发症所有研究对象均出现肺内并发症,其中出现急性呼吸窘迫综合征(ARDS)10例(10.99%);循环系统并发症主要为:心肌损害、心力衰竭、心律失常,共59例(64.84%);消化系统并发症主要为:腹泻、消化道出血,共40例(43.96%);电解质紊乱并发症为:高钠血症、低钠血症、高钾血症和低钾血症,共36例(39.56%);神经系统并发症主要为:热性惊厥、中毒性脑病和病毒性脑炎,共12例(13.19%);肝肾功能损害并发症共29例(31.87%);其中有2种及2种以上肺外并发症者31例(34.07%)。见表1。
表1预后不良与非预后不良组患儿并发症比较
Table 1Comparison of complications between poor prognosis group and non-poor prognosis group
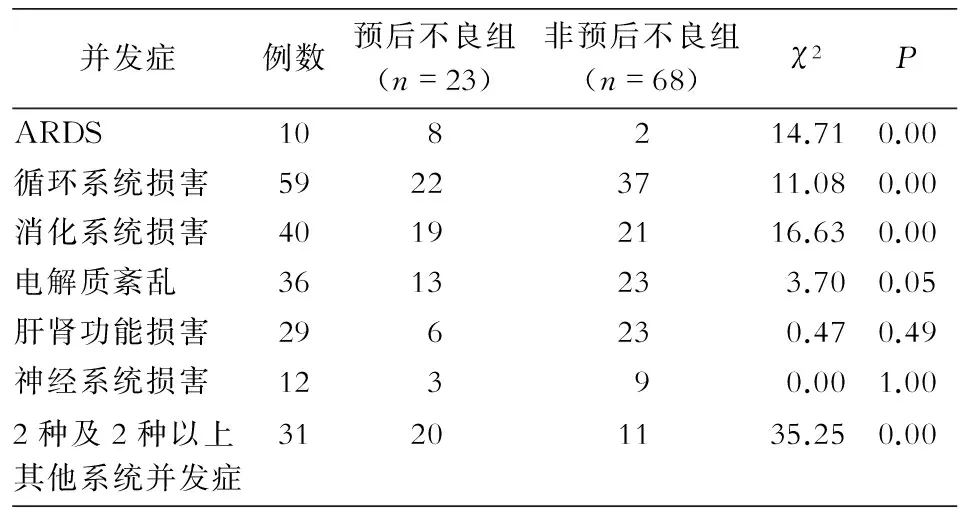
并发症例数预后不良组(n=23)非预后不良组(n=68)χ2PARDS108214.710.00循环系统损害59223711.080.00消化系统损害40192116.630.00电解质紊乱3613233.700.05肝肾功能损害296230.470.49神经系统损害12390.001.002种及2种以上其他系统并发症31201135.250.00
2.3影像学63例SAP患儿共计出现91例次严重肺部影像学改变,其中预后不良组22例出现41例次,非预后不良组41例出现50例次。严重影像学改变包括肺部节段实变36例次,三叶以上肺叶受累30例次,胸腔积液、胸膜改变15例次,肺不张10例次。详见表2。
表2 预后不良组与非预后不良组影像学改变比较(例次)
Table 2Comparison of radiological changes between poor prognosis group and non-poor prognosis group (No. of cases)

胸部CT表现预后不良组(n=22)非预后不良组(n=41)χ2P肺部节段实变162011.590.003叶以上肺叶受累13177.730.01胸腔积液、胸膜改变784.350.04肺不张553.980.04
2.4单因素分析结果显示,发病年龄、患先心病等严重基础疾病、机械通气治疗、发生ARDS、有肺不张等严重影像学改变、出现2个及2个以上肺外并发症与SAP预后不良相关(均P<0.05)。见表3。
2.5多因素分析结果显示:患先心病等严重基础疾病、出现2个及2个以上肺外并发症是SAP预后不良的独立危险因素(均P<0.05)。见表4。
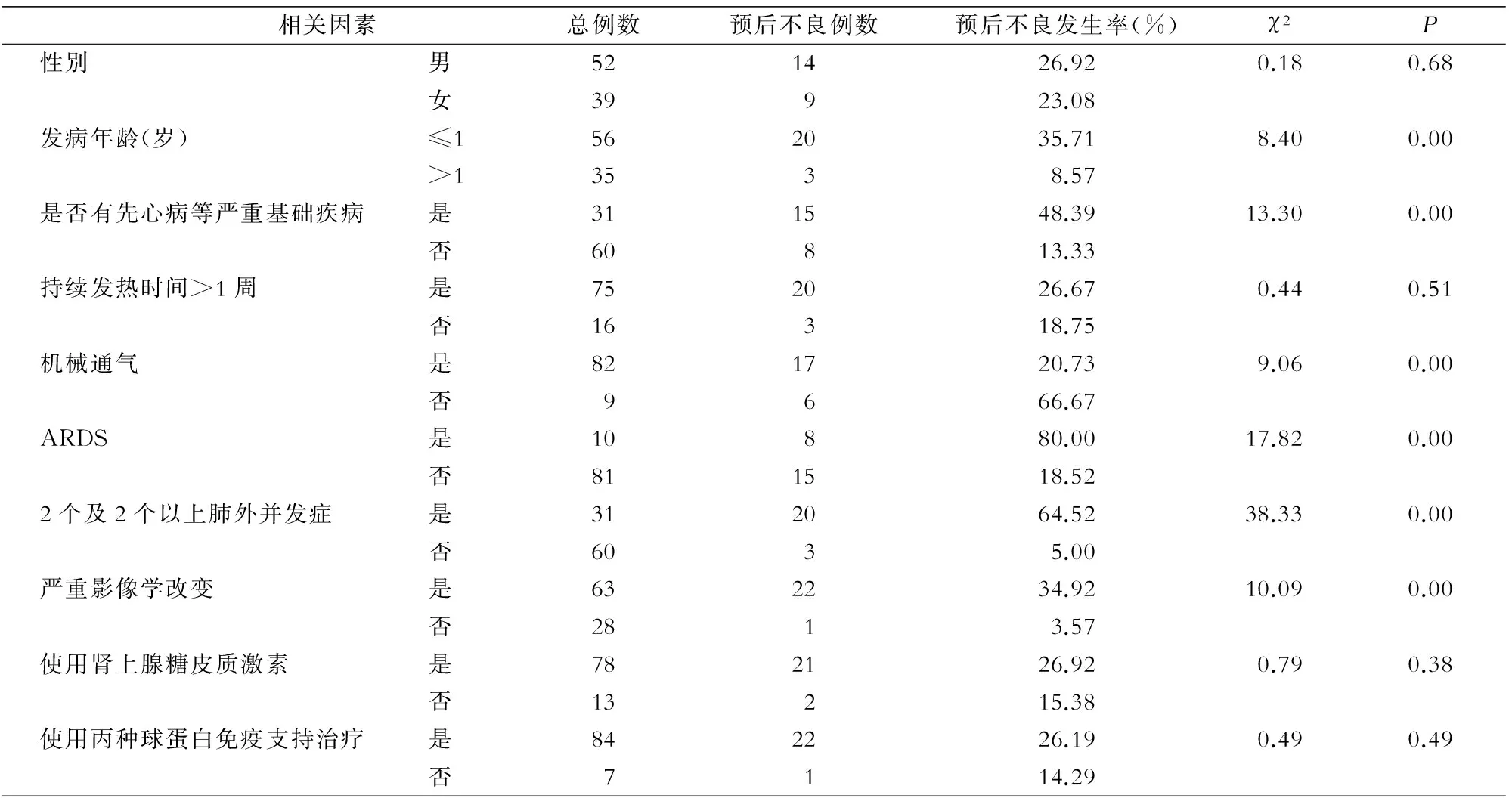
表3 SAP患儿预后不良的发生率及危险因素单因素分析

表4 SAP患儿预后不良相关危险因素的logistic回归分析
3 讨论
腺病毒是一种无外壳的双链DNA病毒,能感染人的腺病毒有A—G共7个组,其中最常见的致病型为1~8型,其中4型及7型最容易出现重症。腺病毒主要通过空气飞沫传播,婴幼儿、老年人,以及免疫力功能低下者较易感染并容易发展为重度肺炎,严重时危及生命[3]。不同地区腺病毒肺炎感染率存在较大区别。徐雷等[4]研究报道,齐鲁地区腺病毒肺炎在住院肺炎患儿中约占10%,而在重症肺炎患儿中占11.9%;余春梅等[5]研究表明,重庆地区SAP在婴幼儿重症肺炎中占19.3%;而北京儿童医院刘秀云等[6]报道腺病毒引起婴儿重症肺炎的比率高达32.2%,是目前所知的报道比率最高的地区。以上资料均表明腺病毒肺炎在婴幼儿肺炎中占据较高比例,尤其是婴幼儿重症肺炎。
目前,腺病毒检测技术主要有病毒分类培养、聚合酶链反应、免疫技术、酶联免疫吸附测定法,以及其他如基因芯片技术等,其中直接免疫荧光技术被普遍推荐[7],据报道其特异性可达86%,敏感性达95%,而且用时短,设备技术要求较低,在普通基层医院即可开展[8]。本研究选用直接免疫荧光技术作为腺病毒感染的判定标准,不足之处是未能进行腺病毒分型检测,未能提供更准确的病原学结果。
本研究严格按照WHO重度肺炎诊断标准选取2个月~5岁儿童作为研究对象,其平均年龄为(2.1±0.2)岁,参照刘爱良等[9]研究分析的结论,选取1岁作为分界点,单因素χ2检验分析提示,年龄≤1岁与发生SAP预后不良密切相关(P<0.05)。考虑原因有:≤1岁的婴儿吞噬细胞(主要为中性粒细胞)功能发育不完善,加上自身的解剖结构,如皮肤、黏膜发育不成熟,保护能力较弱,容易成为病毒侵犯的对象;其次,≤1岁婴儿时期,淋巴细胞的功能发育不成熟,病毒感染后产生特异性抗体均较低下,自6个月以后随着年龄增大来自母体提供的IgG水平降低,此阶段抵抗力较低,清除病毒的能力也较差,一旦有外来病原菌入侵,就容易出现重症表现[1];再者,1岁左右婴幼儿正处于对外界环境的适应期,此阶段婴儿正处于学步或刚刚能够独立行走状态,对外面陌生世界充满好奇,会经常主动要求出入广场、超市等人口密集场所,接触病原菌的机会也较多,而腺病毒主要传播途径即是通过飞沫、空气传播,所以此年龄段婴幼儿容易发生感染。因此,我们应尽量减少≤1岁婴幼儿到人口密集、空气不流通的公共场所的机会,尽可能地切断腺病毒感染的传播途径,降低感染率。
先天性心脏病是儿童最常见的一种先天性发育异常疾病,年龄越小发病率越高,并且未经治疗的各种先心病婴儿中约60%于1岁内死亡[1]。先天性气道发育异常,如气管软化、狭窄等疾病,随着影像学技术和纤维支气管镜的成熟应用,也越来越常见。本组91例SAP患儿中,有31例(34.07%)患儿合并有先天性心脏病和先天性气管发育异常,其中15例(48.39%)最终出现预后不良。统计分析显示,患严重基础疾病是SAP预后不良的一个独立危险因素,与杜芳等[10]研究结论吻合。先心病患儿,尤其是左向右分流的先心病患儿,可能长期存在慢性心功能不全,在发生肺部感染时,心肺负荷增加,极易出现呼吸衰竭、心力衰竭,而最终死亡。所以,当有先心病等严重基础疾病的患儿发生SAP时,我们应提高警惕,严密观察疾病的进展,在积极救治的同时,时刻与家属做好沟通工作,谨防预后不良事件的发生。
ARDS是一种具有复杂病理和发病机制的异质性综合征,是急性肺损伤的严重阶段,其主要病理生理变化过程包括肺泡毛细血管通透性增加、肺顺应性降低、通气/血流比失调、肺内分流增加等阶段,最后可导致临床上顽固的低氧血症,甚至通过机械通气辅助呼吸也难以纠正。儿童ARDS的病死率与当前各地的儿科重症监护病房(PICU)技术水平密切相关。据统计,最高住院病死率可达80%以上[11],ARDS的出现也经常预示着预后不良。本研究中,发生ARDS者10例(10.99%),其中8例最终出现预后不良。单因素χ2检验分析结果显示,ARDS与重度SAP预后不良密切相关。我们应高度重视SAP患儿呼吸系统自身的病情进展,时刻监测血气分析,警惕ARDS的发生。一旦有呼吸衰竭表现,即应早期评估,及时行机械通气治疗,尽早纠正低氧血症,阻止疾病进展。早期干预可以改善预后并提高存活率,最大限度地减少多器官功能衰竭、死亡的发生[12]。
本研究结果提示,患有2种及2种以上肺外并发症也是预后不良的独立危险因素。重症SAP除引起呼吸系统本身的损害外,还可以引起循环系统、消化系统等较为常见的肺外并发症。SAP患儿发生多系统并发症可能与患儿自身免疫功能及脏器功能发育不完善相关,同时出现多系统并发症也常预示着病毒血症的发生。腺病毒既可造成细胞溶解性感染,使感染细胞发生溶解、坏死,功能完全丧失;也可发生细胞转化性感染,使细胞的增生能力大大增强,功能受到损害;甚至有可能导致病毒核酸与细胞基因组DNA的整合,干扰细胞的正常基因表达或通过其他机制破坏细胞增殖的调控而形成肿瘤[1]。上述发病机制决定了SAP容易导致最终的预后不良。
本组91例SAP患儿,82例(90.11%)使用过机械通气进行治疗,考虑与SAP患儿呼吸系统本身损害严重相关。影像学显示,39.56%的SAP患儿出现肺部的节段实变,32.97%的SAP患儿可出现三叶以上肺叶受累,严重的影像学改变预示着大部分患儿需要进行机械通气的辅助治疗。单因素分析结果显示,机械通气与SAP预后不良相关,机械通气的正确使用很大程度上影响着SAP的预后。因此,医务工作者应不停学习,不断摸索,掌握最新的理念与技术,如机械通气的使用时机、小潮气通气量肺保护策略、允许性高碳酸血症策略等,保持与时俱进,最大限度地降低SAP预后不良的发生率。
本组SAP患儿常规行高分辨率胸部CT检查,至少1人次/例,根据严重影像学判断标准确定影像学改变,结果显示,严重的影像学改变与SAP预后不良密切相关。其中肺部节段实变、三叶以上肺叶受累最为常见,约占所有SAP的72.53%,可见SAP患儿肺部损害的严重性及多态性。严重影像学改变考虑可能与腺病毒感染肺炎的发病机制有关:腺病毒肺炎在肺泡上可出现肺泡出血性肺水肿,导致气道狭窄,分泌物增多,而婴幼儿咳嗽反射较弱,无法及时排出气道分泌物。当病变累及细支气管、支气管时即可形成肺部节段性实变、肺不张等病理改变。及时的胸部CT检查,不仅可以尽早了解疾病的严重程度,同时对后期并发症的随访也有着重要价值[13]。
总之,有较严重先心病等基础疾病、出现2个及2个以上其他系统并发症是重度SAP预后不良的独立危险因素,我们应早期判断,早期干预,以期避免不良后果的发生。
[1]吴瑞平,胡亚美,江载芳.诸福棠实用儿科学[M].7版.北京:人民卫生出版社,2002:1191-1194.
[2]中华医学会儿科学分会呼吸学组. 儿童社区获得性肺炎管理指南(2013修订)(上)[J]. 中华儿科杂志, 2013, 51(10):745-752.
[3]全军传染病专业委员会,新突发传染病中西医临床救治课. 腺病毒感染诊疗指南[J]. 解放军医学杂志, 2013, 38(7):529-534.
[4]徐雷, 陈蕾, 王冲,等. 儿童重症肺炎105例临床特征及高危因素分析[J]. 齐鲁医学杂志, 2012, 27(3):250-252.
[5]余春梅, 杨锡强, 许峰,等. 重庆地区婴幼儿重症肺炎呼吸道病毒病原分析[J]. 中华儿科杂志, 2010, 48(2):143-147.
[6]刘秀云, 江载芳. 小儿重症社区获得性肺炎31例病原分析[J]. 中国实用儿科杂志, 2005, 20(12):749-750.
[7]吴迪, 胡宇芳, 刘琼,等. 呼吸道感染患儿咽拭子病毒检测分析[J]. 中国感染控制杂志, 2015, 14(3):166-169.
[8]金玉霞. 呼吸道病毒检测方法的进展及意义[J]. 中华医院感染学杂志, 2013, 23(4):959-960.
[9]刘爱良, 黄英, 杨洋,等. 儿童重症腺病毒肺炎213例临床特征分析[J]. 临床儿科杂志, 2013,31(8):726-729.
[10] 杜芳, 黄英, 舒畅,等. 小儿重症腺病毒肺炎混合感染及高危因素分析[J]. 中国当代儿科杂志, 2013, 15(5):375-378.
[11] 牛志民, 李艳红, 姜舜杰,等. 儿童急性呼吸窘迫综合征预后及其影响因素分析[J]. 中国当代儿科杂志, 2011, 13(7):543-546.
[12] Marraro GA, Chen C, Piga MA, et al. Acute respiratory distress syndrome in the pediatric age: an update on advanced treatment[J]. Chin J Contemp Pediatr, 2014,16(5): 437-447.
[13] 刘成军, 王华华, 李静,等. 重症腺病毒肺炎患儿的临床和胸部影像学特征分析[J]. 华中科技大学学报:医学版, 2012, 41(3):379-381.
(本文编辑:孟秀娟)
Risk factors for poor prognosis of severe adenovirus pneumonia in children
ZHENGShen-jian1,HUJun1,WANGZhen-zhen1,FUWen-long2,LIUHe-lin1
(1XiaoganHospitalAffiliatedtoWuhanUniversityofScienceandTechnology,TheCentralHospitalofXiaogan,Xiaogan432000,China; 2ChongqingChildren’sHospital,ChongqingMedicalUniversity,Chongqing401122,China)
ObjectiveTo understand the risk factors for poor prognosis of severe adenovirus pneumonia (SAP) in children, and provide guidance for clinical diagnosis and prognosis.MethodsClinical data of 91 hospitalized children who diagnosed with SAP in Chongqing Children’s Hospital of Chongqing Medical University between January 2012 and January 2014 were analyzed retrospectively.ResultsOf 91 SAP children, 23(25.27%)had poor prognosis. Univariate analysis showed that risk factors for poor prognosis of SAP were age of onset, congenital heart disease and other serious underlying diseases, mechanical ventilation therapy, acute respiratory distress syndrome (ARDS), atelectasis and other serious radiological changes, and emergence of two and more extra-pulmonary complications (allP<0.05). Multivariate regression analysis showed that congenital heart disease and other serious underlying diseases, and emergence of two and more extra-pulmonary complications were independent risk factors for poor prognosis of SAP (allP<0.05).ConclusionCongenital heart disease and other serious underlying diseases, emergence of two and more extra-pulmonary complications are independent risk factors for poor prognosis of SAP, active intervention should be conducted during the process of clinical diagnosis and treatment, so as to improve the prognosis.
child; severe; adenovirus pneumonia; poor prognosis; risk factor
2015-09-12
郑申健(1978-),男(汉族),湖北省广水市人,主治医师,主要从事小儿呼吸系统疾病研究。
刘贺临E-maill:63686503@qq.com
R725.6
A
1671-9638(2016)08-0587-05
DOI:10.3969/j.issn.1671-9638.2016.08.012

