微藻水热液化生物油化学性质与表征方法综述
张冀翔,蒋宝辉,王 东,魏耀东
(中国石油大学(北京)重质油国家重点实验室,北京 102249)
微藻水热液化生物油化学性质与表征方法综述
张冀翔,蒋宝辉,王东,魏耀东
(中国石油大学(北京)重质油国家重点实验室,北京 102249)
微藻水热液化生物油由于性质较差,不能直接作为车载燃料使用,与现代石油炼制工艺结合是一种新的应用途径。综述了微藻生物油的化学性质,包括化学组成、官能团组成与杂原子化合物组成等信息,比较分析了GC-MS、FTIR、NMR和FT-ICR MS等表征方法的异同,简要回顾了微藻水热液化反应机理和精制方法。重点指出微藻水热液化生物油中含氧、含氮化合物含量较高,并具有较高的芳香度和不饱和度,催化加氢精制能够有效脱除杂原子,并增加烷烃含量。微藻基生物燃料的发展,不仅需要精制工艺的提升,也有赖于表征方法的进步。
生物油;微藻;水热液化;官能团;杂原子
DOI:10.11949/j.issn.0438-1157.20151582
水热液化工艺的系统研究始于20世纪70年代的石油危机时期。匹兹堡能源研究中心(Pittsburgh Energy Research Center)、劳伦斯伯克利实验室(Lawrence Berkeley Laboratory)和美国环保署水工程研究实验室(EPA's Water Engineering Research Laboratory)先后建立了水热液化的研究示范项目,同期,壳牌公司开始进行HTU®(Hydrothermal Upgrading)工艺的研发。但是随着20世纪80年代中后期原油价格回落,这些研究逐渐被终止放弃。Elliott等[1]对这段时间的研究进展进行了综述。Toor等[2]对水热液化工艺的放大及商业化尝试进行了总结,认为成本和严苛的反应条件是这些尝试最终未能成功的主要原因。
进入21世纪后,伴随着第三代生物质燃料——微藻基生物燃料的研究热潮,水热液化工艺研究进入新的阶段。相比传统农林生物质,微藻具有单位时间内单位面积生物质产量高、不占用农业耕地等优势,是理想的生物质原料来源。一方面,研究者将水热液化工艺与微藻应用相结合,如处理含油微藻萃取后的藻渣[3-4],或将用于污水处理的微藻进行能源化利用,或与微藻在电厂烟气固碳方向的应用相结合等[5];另一方面,研究者开始关注生物油油品的精制,如利用异相催化剂对水热液化工艺进行优化[6],或对制备得到的生物油进行精制等[7]。面对新的发展机遇,研究者也不断对水热液化工艺进行总结。国际上,Toor等[2]总结了水热条件下生物大分子的转化机理,Amin等[8]整理了不同工艺参数对水热液化工艺的影响,Savage等[9]对催化剂作用下水生植物的水热反应进行了总结,Skerget等[10]对农业和食品加工业废弃物水热反应的基本原理和研究进展进行了概括,Xiu等[11]对生物油的性质及精制方法进行了综述。在国内,陈裕鹏等[12]总结了藻类生物质中三组分模型化合物的水热液化特性,对比分析了藻类生物油与木质纤维类生物油的组成特性,丁冉冉等[13]对国内外藻类液化原油及其轻馏分的催化脱氧改质研究现状进行综述,胡见波等[14]对生物质中主要化合物的水热液化机理进行了阐述。此外,还有一些关于生物质热化学转化的综述[5,15-20],也对水热液化工艺进行了论述。
然而以上综述中针对生物油性质分析的篇幅较少。为填补上述空白,笔者已经对微藻生物油的物理性质进行了总结,包括密度、黏度、总酸值、元素组成及热值、馏程与原子量分布等。本文将对微藻水热液化生物油(以下简称微藻生物油)及其精制油的化学性质进行综述,包括化学组成、官能团组成和杂原子化合物组成等,简单总结了微藻水热液化反应机理和微藻生物油精制工艺,比较分析了GC-MS、FTIR、NMR和FT-ICR MS等不同表征方法之间的差异。工艺参数对微藻生物油化学性质的影响,本文也有简要论述,但不是重点。
1 微藻生物油的化学性质
微藻水热液化反应结束后,液相产物通常会在重力作用下分层,形成漂浮在水相产物上的油状产物。小型反应釜实验通常先将产物用溶剂萃取,再将溶剂蒸发脱除后得到生物油,而连续流实验一般直接利用重力分离两相产物[21]。由于微藻生物油的复杂性,单一分析手段往往无法全面揭示其化学性质。因此本文在总结微藻生物油化学性质的同时,比较分析了各种表征方法之间的差异,并阐述了不同表征结果之间的补充关系。
1.1化学组成
1.1.1GC-MS微藻生物油的化学组成是影响其油品性质的内在原因,其中一些组分与其劣质性直接相关,如酸类物质引起酸性和腐蚀性,含氧、含氮化合物导致热值降低及化学不稳定性,大分子物质提高黏度和重质组分含量等。气相色谱质谱联用(gas chromatography-mass spectrometer, GC-MS)是最常用的化学组成表征手段,其原理是将样品汽化后随气体流动相进入色谱柱分离,再进入质谱分析。由于受汽化温度的限制(≤350℃),GC-MS适用于表征相对分子质量较小(≤400)、沸点较低(≤500℃)、可挥发且热稳定的物质。而重质组分则难以进入色谱柱,因此无法被GC-MS检出。
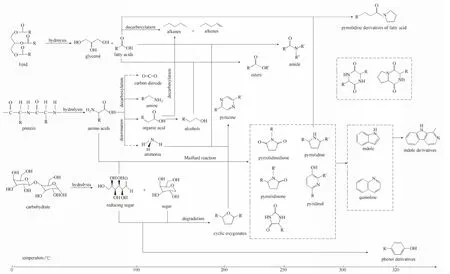
图1 低油脂藻水热液化整体化学反应路径[23]fig.1 General reaction network of HTLlow-lipid microalgae[23]
微藻生物油是一种复杂的混合物体系,研究者利用GC-MS检测出其中含有烃类以及多种含氧、含氮化合物,包括酸类、酮类、酯类、胺类、酚类、醇类和含氧、含氮杂环类化合物等。反应温度、时间和原料化学组成是影响其化学组成的重要因素,有研究者[22-26]将化学组分归类,利用组分簇的相对含量即峰面积变化,来分析反应条件对微藻生物油性质的影响,近几年文献中常用的最优反应条件是300~350℃和30~60 min。Ross等[27]利用多种微藻和模型化合物进行水热液化,发现清蛋白和大豆蛋白质的产物特征相似,主要包括酚类、吲哚、吡咯类和哌啶,葡萄糖和淀粉的产物特征相似,主要包括苯和酮类(特别是环酮类),葵花油的产物主要是脂肪酸类;相比模型化合物,微藻生物油的化学组成则更加复杂,不仅包括上述主要物质,还含有胺类和烃类;此外添加催化剂也对生物油化学组成有一定影响。
Py-GC-MS将热解技术与气相色谱耦合,用于分析常规气相色谱无法表征的大分子组分。Torri等[28]利用Py-GC-MS分析微藻Desmodesmus sp.生物油,并将其化学组分细分为15类,再利用分步热解结合热重数据对各组分类别进行了绝对定量,这是GC-MS无法独立完成的,并由此进一步分析工艺参数对生物油各组分产率的影响,推断可能的成油机理。
1.1.2微藻水热液化反应机理研究者通过分析不同反应温度和时间下生物油和水相产物的GC-MS结果,结合模型化合物的研究,推断微藻水热液化反应机理。Gai等[23]在Zhang等[29-30]研究基础上,进一步研究整理了微藻水热液化反应机理,如图1所示。在0~100℃反应温度区间内,微藻三基质(蛋白质、脂质、非纤维碳水化合物)将发生水解反应,生成氨基酸、脂肪酸、甘油和还原糖等中间产物;在100~200℃温度区间内,上述中间产物将进一步发生反应,如氨基酸的脱羧基和脱氨基反应,脂肪酸的脱羧基反应,还原糖的断键重聚反应等,生成胺类、酸类、烃类和环氧化合物等;在200℃以上温度区间内,将进一步发生脂肪酸的胺化和酯化反应,氨基酸和还原糖的Maillard反应等,生成脂肪胺类、酯类和多种氮氧杂环化合物。微藻水热液化机理,为实现水热液化过程中的高效脱氧、脱氮和化学组分调控提供了理论依据。
1.2官能团与杂原子化合物组成
微藻生物油中含有大量含氧、含氮化合物,降低了油品质量,需要在后续精制工艺中对氧、氮杂原子进行脱除。为开发更合适的微藻生物油精制工艺,特别是催化加氢精制工艺,还要进一步分析其中氧、氮杂原子的赋存形态及丰度,即官能团与杂原子化合物组成。另外,GC-MS难以表征的大分子和高沸组分,也需要其他方法进行分析。
1.2.1FTIR傅里叶转换红外线光谱分析仪(Fourier translation infrared spectroscopy, FTIR),是利用分子振动时吸收特定波长的红外光而产生的吸收光谱来分析化合物分子结构等信息的仪器。在红外光谱图的解析中,4000~1300 cm-1被称为官能区,可用于鉴别特定基团的存在性;1300~400 cm-1被称为指纹区,可用于鉴别化合物及其分子结构。对于生物油这一类复杂混合物体系,指纹区信息往往不可用,官能区特征峰也会发生重叠,给分析带来一定困难。
文献中FTIR常用于分析微藻生物油的官能团组成[7,30-35],典型的微藻生物油FTIR谱图如图2所示。谱图中得到的官能团信息与其化学组成基本一致,其中常见的吸收峰有:3200~3500 cm-1附近宽而强的吸收峰,可能是O—H和N—H伸缩振动峰的叠加,说明可能存在酚类、醇类和胺类物质;2850~3000 cm-1附近2~3个尖锐的吸收峰,是饱和C—H的伸缩振动峰,1375 cm-1和1465 cm-1附近中等强度的吸收峰,认为是饱和C—H的弯曲振动峰,对应烃类物质的存在;1700 cm-1附近的强吸收峰,是C═O的伸缩振动峰,说明可能存在酮类、醛类、酸类、酯类和酰胺类物质;1000~1300 cm-1附近的吸收峰,有认为是C—O的伸缩振动峰,说明可能存在酚类、醇类、酸类和酯类物质;1500~1650 cm-1附近2~3个中等强度的吸收峰,可能是N—H的弯曲振动峰,对应胺类和酰胺类物质的存在。FTIR分析生物油官能团组成的缺点在于难以得到丰度的定量信息。
FTIR也可以用于分析微藻水热液化的气相和固相产物。Ross等[36]利用FTIR分析微藻水热液化的气体产物,指出相比碱催化剂,有机酸催化剂能够降低水相产物中的氮含量,增加气相产物中的含氮组分含量。

图2 微藻D. tertiolecta水热液化生物油FTIR谱图[35]Fig.2 FTIR spectra of HTL bio-crude from D. tertiolecta[35]
1.2.2NMR核磁共振技术(nuclear magnetic resonance, NMR)是有机物结构分析的重要方法,其原理是磁性核(1H,13C等)在外磁场作用下发生能级分裂,共振吸收并辐射一定频率的射频辐射(60~1000 MHz),形成(1H NMR,13C NMR等)谱图。谱图中磁性核共振峰的化学位移反映了其所在的化学环境,进而识别磁性核所处的基团和基团所在的位置,推断样品的分子结构。
NMR谱图是微藻生物油分析的常用工具之一[6-7,23,33,37-39],同GC-MS类似,有研究者[23,33,37]将不同化学位移区间对应的官能团进行归类。一般认为,在1H NMR谱图中,δ=0.5~1.5对应饱和脂肪氢,1.5~3.0对应不饱和键和α-杂原子氢,3.0~4.4对应羟基和醚键氢,4.4~6.0对应甲氧基氢,6.0~8.5对应芳环和杂环氢;而在13C NMR谱图中,δ=0~28对应短链脂肪碳,28~55对应含支链长链脂肪碳,55~95对应羟基和醚键碳(醇类、糖类和醚类),95~165对应芳环、杂环及烯烃碳,165~180对应羧酸类羰基碳(酸类、酯类和酰胺类),180~215则对应醛酮类羰基碳(醛类和酮类)。典型的微藻生物油NMR谱图如图3所示,可以观察到在上述区间内都存在明显的吸收峰,说明微藻生物油具有比较复杂的官能团组成。
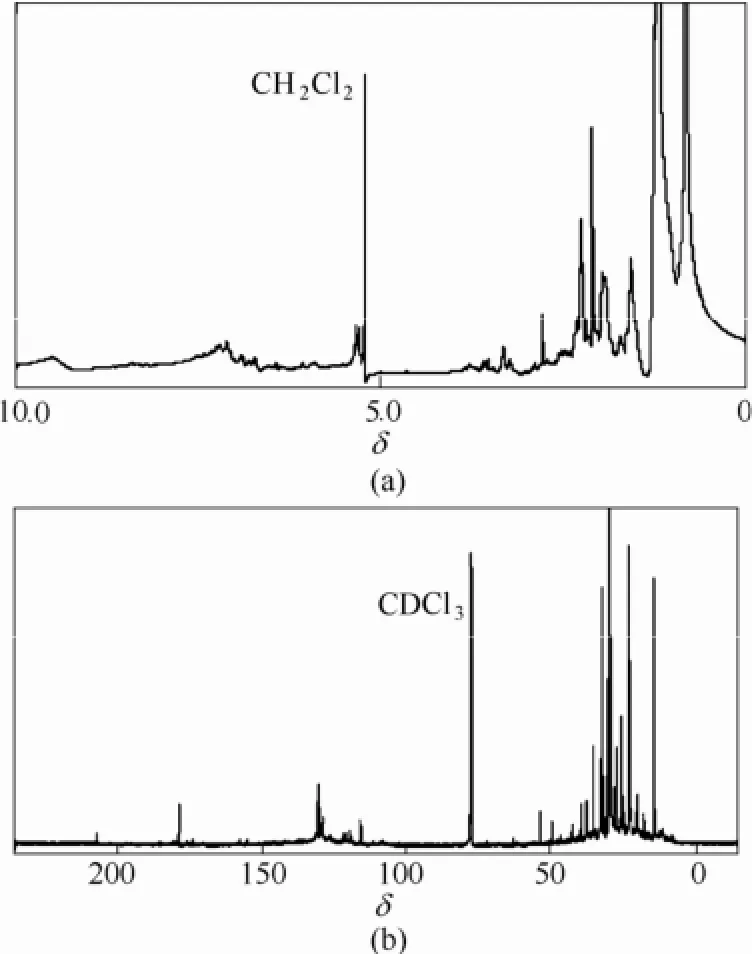
图3 微藻Nannochloropsis sp.水热液化生物油1H NMR谱图和13C NMR谱图[6]Fig.3 1H NMR(a) and13C NMR (b) spectrum of HTL bio-crude from Nannochloropsis sp.[6]
NMR不仅能够鉴别基团的存在性,还能确定基团所在的分子位置,因此得到的官能团信息更加丰富和准确。Vardon等[33]利用FTIR检测出微藻Spirulina生物油中含有C═O(1700 cm-1),但未在1H NMR谱图中检测到醛基氢(δ=9.0~10.0),进而排除了可能存在的醛类物质。NMR还能定量计算磁性核在不同官能团中的相对丰度,为比较微藻生物油与其精制油的化学性质差异和评价生物油精制工艺提供了手段。Vardon等[33,40]的研究显示,微藻Spirulina生物油具有较强的脂肪性(1H NMR δ=0.5~1.5约占53%,13C NMR δ=0~55约占65%),以及一定的芳香性和不饱和性(1H NMR δ=1.5~3.0和δ=6.0~8.5约占38%,13C NMR δ=95~165约占30%)。
1.2.3FT-ICR MS傅里叶变换离子回旋共振质谱仪(Fourier transform ion cyclotron resonance mass spectrometry, FT-ICR MS)是一种新型质谱分析技术,其原理是将待测物质电离后不经分离,离子同时在磁场作用下做回旋运动并产生感应电流,通过检测感应电流无损得到离子质荷比及丰度,因此具有超高质量分辨率,能够给出准确的元素组成和分子式等信息。
近年来,电喷雾技术(ESI)与FT-ICR MS结合为重质油中的极性杂原子化合物分析带来突破性进展[41]。Chiaberge等[42]分别使用ESI、APCI和APPI 3种电离源与FT-ICR MS结合对生物油进行了表征,结果显示ESI电离源对极性化合物更敏感。生物油精制需要脱除生物油中的氧、氮杂原子,研究者普遍使用ESI电离源结合FT-ICR MS分析极性杂原子化合物,其中正离子模式分析碱性化合物(主要是含氮化合物),负离子模式分析酸性化合物(主要是含氧化合物)。Sudasinghe等[43]利用ESI电离源结合FT-ICR MS分析了微藻N. salina生物油的杂原子组成,得到了氧、氮杂原子的赋存形态及相对丰度信息:生物油中的酸性化合物主要是O2化合物,其相对丰度超过80%,结合有效双键数(double bond equivalents, DBE)和碳原子数,认为O2化合物含有不同不饱和度的脂肪酸(C14~C20)和芳香酸(C7~C13),酸性化合物还包括少量O4化合物即二酸(C32);生物油中的碱性化合物分布较广泛,主要是含有0~3个氧原子的含氮化合物,其中N2化合物(C9~C28)相对丰度最高,超过35%,并集中分布在DBE=6,7, 9, 10处,如图4所示,结合线性离子阱质谱(linear ion trap MS2)分析确认,主要是咪唑衍生物(DBE=3)、吡嗪衍生物(DBE=4)以及附加更多苯环结构的咪唑类和吡嗪类衍生物(如喹喔啉DBE=7、吩嗪DBE=10等),N1化合物(C12~C27)主要包括吡啶衍生物和苯并吡啶(喹啉)衍生物等,N3化合物(C25~C30)推测包含烷基取代的吡啶基哌嗪等物质,NxOy化合物检测出酰胺类(N1O1)、氧化咪唑类(N2O1)、氧化吡嗪类(N2O2)、环缩二肽类(N2O2)及N3化合物的氧化物(N3O3)等物质,N1、N3以及各类NxOy化合物的相对丰度为5%~15%。Sudasinghe等[44]继续分析了不同反应温度下的微藻生物油,指出低温下(<225℃)生物油产率较低,其主要成分是甘油酯,即脂类的分解产物;随着反应温度的升高,蛋白质和糖类的分解使得生物油产率显著增加,但分解产物的交叉反应生成大量含氮、含氧化合物(N1, N2, N3,N1O1, N2O1, N2O2, N3O1, N3O2),导致生物油中氧、氮元素含量上升。

图4 水热液化生物油中N2化合物的DBE-碳数丰度云图[43]Fig.4 Color-coded abundance-contoured plots of DBE versus carbon number for N2compounds for HTL bio-oil[43]
Sanguineti等[45]利用APCI电离源结合FT-ICR MS分析了微藻N. salina生物油的组成,重点得到了ESI电离源选择性较差的烃类(HC)信息。生物油中的烃类其碳数集中在C27~C29,平均DBE为7~8,未检测到饱和烃。烃类芳香度随反应温度升高而增加,在300℃时检测到多环芳烃及其烷基取代物。
2 微藻生物油精制油的化学性质
除反应条件苛刻、设备投资成本较高外,微藻生物油的劣质性进一步限制了其作为化石燃料替代品的应用范围。微藻生物油的精制工艺有针对水热液化工艺改进的催化液化[36,46-47]和催化加氢液化[6,48-49],针对生物油油品质量提升的催化加氢精制[7,50-51]以及热加工精制[52]。使用的催化剂包括均相酸碱催化剂、分子筛催化剂和负载型贵金属或过渡金属催化剂。催化加氢液化,加氢催化剂与固体残渣混合后难以分离,且催化剂容易失活,不利于连续生产;催化液化,均相催化剂成本较低,无须考虑分离回收问题,但对生物油油品质量的提升效果有限;催化加氢精制,一般采用固定床反应器,方便催化剂再生,但受反应器结焦、催化剂成本和氢气消耗等因素的限制;热加工精制,无须金属催化剂和氢源,成本较低且工艺流程简单,但精制油碳收率较低。通常认为,催化加氢精制效果最佳,热加工精制次之,催化加氢液化和催化液化效果较差。考虑到微藻水热液化生物油与现代石油炼制工艺相结合,催化加氢精制和热加工精制是更具有发展潜力和应用前景的研究方向,且催化加氢精制研究广泛,而热加工精制的相关报道较少,故本节主要针对微藻生物油催化加氢精制油的化学性质进行综述。
相比微藻生物油,催化加氢精制油的氧、氮元素含量明显降低,表现为化学组成中烃类含量增加,酸类、酰胺类等含量减少,这一变化在GC-MS、FTIR和NMR谱图中都有体现。Duan等[7,31,50,53]使用负载型贵金属催化剂在超临界水条件400℃下对微藻生物油进行了催化加氢精制。GC-MS结果显示,精制油中脂肪酰胺含量减少,C11以上烷烃含量增加;FTIR谱图中,3200~3500 cm-1和1650~1700 cm-1附近吸收峰明显减弱,说明对应官能团O—H、N—H和C═O含量减少;13C NMR谱图中,δ=170~180范围内吸收峰消失,说明酸类和酰胺类物质得到脱除,对δ=110~160范围内峰面积定量分析结果显示,烯烃碳和芳香碳比例由14%提升至26%。Elliott等[51]利用连续流两段式加氢装置对微藻生物油进行了催化加氢精制,使用硫化Co-Mo催化剂,精制油氧元素含量由5%~8%下降到不足2%,氮元素含量由4%下降到小于0.25%,密度、黏度、总酸值和馏程等物理性质得到显著改善。GC-MS结果显示,除芳香烃和长链烷烃外,微藻生物油中还含有大量酚类、含氮杂环类(吲哚类)、环戊烯酮、脂肪酸和脂肪胺等物质,而精制油化学组成则包括大量环烷烃、芳香烃以及长链烷烃等物质,如图5所示。表1统计了微藻生物油催化加氢精制前后主要性质参数的变化。

图5 微藻生物油及其加氢精制油总流离子图[51]Fig.5 Total ion chromatograph of HTL bio-crude (a) and upgraded oil following hydrotreatment (b) from microalgae[51]
2-D NMR是将化学位移和耦合常数等信息展开在二维平面上,不仅减少了谱线的拥挤和重叠,而且提供了磁性核之间相互作用的信息,对推断复杂化合物分子结构具有重要作用。Sudasinghe等[54]利用2-D1H-13C NMR对松木水热液化生物油及其精制油进行表征,首先将谱图分为脂肪区[图6(a)]和芳香区[图6(b)],再进一步对不同区域进行辨认,最终识别出多种官能团。2-D NMR谱图上可以直接观察到加氢精制工艺导致官能团组成的变化,而目前尚未有研究者使用2-D NMR对微藻生物油进行分析,该技术可为产品表征和精制工艺评价提供有力数据。
3 结 论
微藻生物油与重质原油或常减压渣油相比,最明显的区别就是氧、氮元素含量较高,其化学性质表现为:从化学组成上看,含氧、含氮化合物特别是杂环类化合物含量较高,烃类组分中几乎不含烷烃;从官能团和杂原子组成上看,多种官能团和杂原子化学键并存,含氧化合物以脂肪酸类物质为主,含氮化合物分布则更为复杂,此外生物油还具有较高的芳香度和不饱和度。
本文所述表征方法中,GC-MS具有明显的分子量和沸点选择性,无法表征大分子、重质组分;FT-ICR MS与不同电离源结合能够分别表征酸性、碱性杂原子化合物和非极性化合物,具有超高质量分辨率;FTIR和NMR都能确认官能团的存在性,NMR不仅是对FTIR的补充,还能进行相对丰度的量化计算,但是微藻生物油复杂混合体系的特点给解谱造成一定困难。发展微藻基生物燃料,需要对微藻生物油的化学性质有更全面、深入的认识,单纯使用常规的分析技术已经无法满足这一要求,有必要引入新的分析测试技术,或将多种分离和表征手段进行耦合。
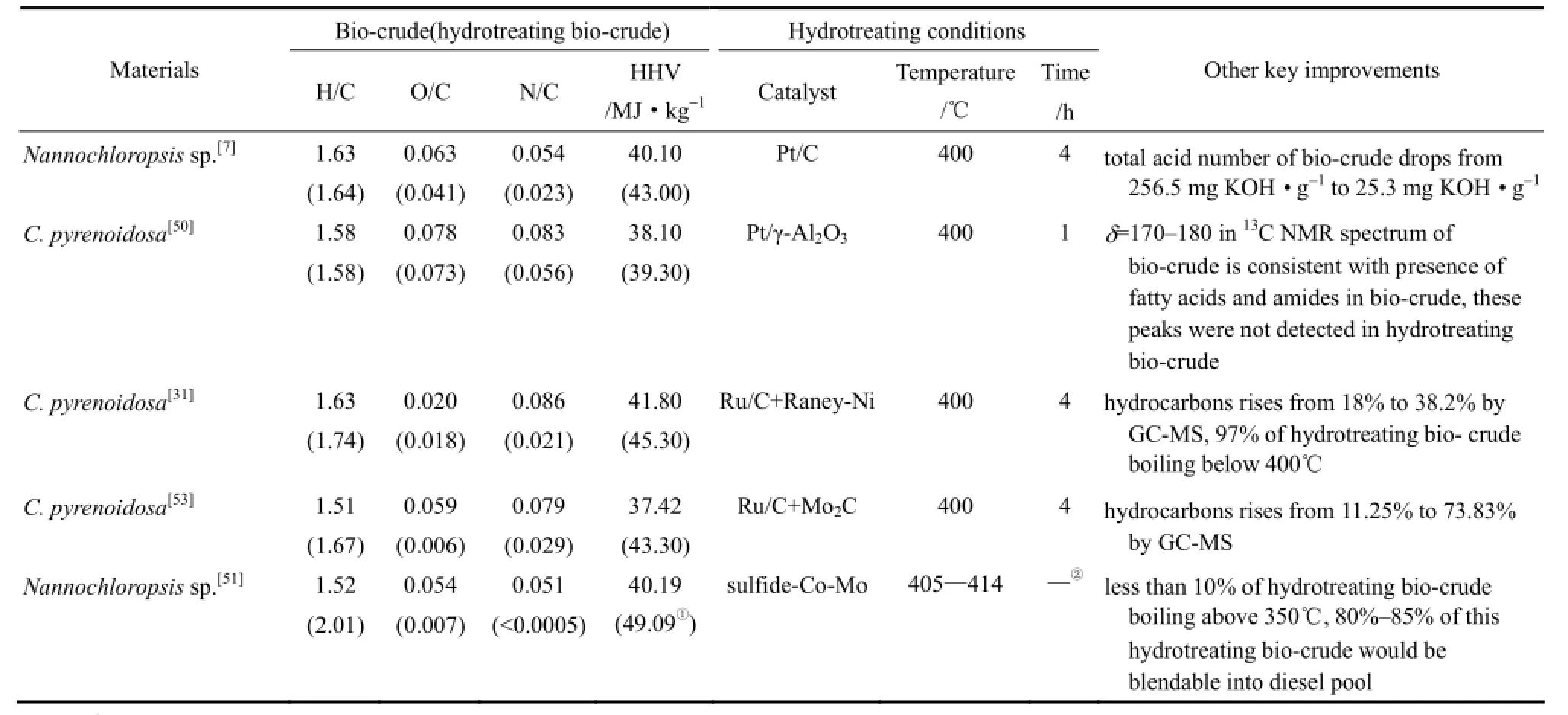
表1 R微藻水热液化生物油及催化加氢精制油性质Table 1 Properties of hydrothermal liquefaction bio-crude and hydrotreating bio-crude from microalgae

图6 松木水热液化生物油(蓝色)及其加氢精制油(红色)2-D1H-13C NMR谱图[54]Fig.6 Superposition of 2-D1H-13C NMR spectra of HTL bio-crude (blue peaks) and upgraded oil following hydrotreatment (red peaks) from pine feedstock[54]
References
[1] ELLIOTT D, BECKMAN D, BRIDGWATER A V, et al. Developments in direct thermochemical liquefaction of biomass:1983—1990 [J]. Energy & Fuels, 1991, 5(3): 399-410. DOI:10.1021/ef00027a008.
[2] TOOR S S, ROSENDAHL L, RUDOLF A. Hydrothermal liquefaction of biomass: a review of subcritical water technologies [J]. Energy, 2011, 36(5): 2328-2342. DOI: 10.1016/j.energy.2011.03.013.
[3] ZHU Y H, ALBRECHT K O, ELLIOTT D C, et al. Development of hydrothermal liquefaction and upgrading technologies for lipid-extracted algae conversion to liquid fuels [J]. Algal Research-Biomass Biofuels and Bioproducts, 2013, 2(4): 455-464. DOI: 10.1016/j.algal.2013.07.003.
[4] CHENG J, HUANG R, Yu T, et al. Biodiesel production from lipids in wet microalgae with microwave irradiation and bio-crude production from algal residue through hydrothermal liquefaction [J]. Bioresource Technology, 2014, 151: 415-418. DOI: 10.1016/j. biortech. 2013.10.033.
[5] BRENNAN L, OWENDE P. Biofuels from microalgae—a review of technologies for production, processing, and extractions of biofuels and co-products [J]. Renewable & Sustainable Energy Reviews, 2010,14(2): 557-577. DOI: 10.1016/j.rser.2009.10.009.
[6] DUAN P G, SAVAGE P E. Hydrothermal liquefaction of a microalga with heterogeneous catalysts [J]. Industrial & Engineering Chemistry Research, 2011, 50(1): 52-61. DOI: 10.1021/ie100758s.
[7] DUAN P G, SAVAGE P E. Upgrading of crude algal bio-oil in supercritical water [J]. Bioresource Technology, 2011, 102(2):1899-1906. DOI: 10.1016/j.biortech.2010.08.013.
[8] AKHTAR J, AMIN N A S. A review on process conditions for optimum bio-oil yield in hydrothermal liquefaction of biomass [J]. Renewable & Sustainable Energy Reviews, 2011, 15(3): 1615-1624. DOI: 10.1016/j.rser.2010.11.054.
[9] YEH T M, DICKINSON J G, FRANCK A, et al. Hydrothermal catalytic production of fuels and chemicals from aquatic biomass [J]. Journal of Chemical Technology and Biotechnology, 2013, 88(1):13-24. DOI: 10.1002/jctb.3933.
[10] PAVLOVIC I, KNEZ Z, SKERGET M. Hydrothermal reactions of agricultural and food processing wastes in sub- and supercritical water: a review of fundamentals, mechanisms, and state of research[J]. Journal of Agricultural and Food Chemistry, 2013, 61(34):8003-8025. DOI: 10.1021/jf401008a.
[11] XIU S N, SHAHBAZI A. Bio-oil production and upgrading research:a review [J]. Renewable & Sustainable Energy Reviews, 2012, 16(7):4406-4414. DOI: 10.1016/j.rser.2012.04.028.
[12] 陈裕鹏, 黄艳琴, 阴秀丽, 等. 藻类生物质水热液化制备生物油的研究进展 [J]. 石油学报(石油加工), 2014, 30(4): 756-763. DOI: 10.3969/j.issn.1001-8719.2014. 04.028. CHEN Y P, HUANG Y Q, YIN X L, et al. Research progress of producing bio-oil from hydrothermal liquefaction of algae[J].Acta Petrolei Sinica (Petroleum Processing Section), 2014, 30(4): 756-763. DOI: 10.3969/j.issn.1001-8719.2014.04.028.
[13] 丁冉冉, 吴玉龙, 陈宇, 等. 藻类液化生物油的催化脱氧改质进展[J]. 化工学报, 2014, 65(7): 2685-2695. DOI: 10.3969/j.issn.0438-1157. 2014.07.028. DING R R, WU Y L, CHEN Y, et al. Recent advances on catalytic deoxygenation upgrading of liquefaction microalgae bio-oil [J]. CIESC Journal, 2014, 65(7): 2685-2695. DOI: 10.3969/j.issn. 0438-1157.2014.07.028.
[14] 胡见波, 杜泽学, 闵恩泽. 生物质水热液化机理研究进展 [J]. 石油炼制与化工, 2012, 43(4): 87-92. HU J B, DU Z X, MIN E Z. Progress in research of reaction mechanism concering hydrothermal liquefaction of biomass [J].Petroleum Processing and Petrochemicals, 2012, 43(4): 87-92.
[15] PETERSON A A, VOGEL F, LACHANCE R P, et al. Thermochemical biofuel production in hydrothermal media: a review of sub- and supercritical water technologies [J]. Energy & Environmental Science, 2008, 1(1): 32-65. DOI: 10.1039/b810100k.
[16] HUBER G W, IBORRA S, CORMA A. Synthesis of transportation fuels from biomass: chemistry, catalysts, and engineering [J]. Chemical Reviews, 2006, 106(9): 4044-4098. DOI: 10.1021/ cr068360d.
[17] TRAN N H, BARTLETT J R, KANNANGARA G S K, et al. Catalytic upgrading of biorefinery oil from micro-algae [J]. Fuel,2010, 89(2): 265-274. DOI: 10.1016/j.fuel.2009.08.015.
[18] GUO Y, YEH T, SONG W H, et al. A review of bio-oil production from hydrothermal liquefaction of algae [J]. Renewable & Sustainable Energy Reviews, 2015, 48: 776-790. DOI:10.1016/j.rser.2015.04.049.
[19] TEKIN K, KARAGOZ S, BEKTAS S. A review of hydrothermal biomass processing [J]. Renewable & Sustainable Energy Reviews,2014, 40:673-687. DOI: 10.1016/j.rser.2014.07.216.
[20] 阎立峰, 朱清时. 以生物质为原材料的化学化工 [J]. 化工学报,2004, 55(12): 1938-1943. YAN L F, ZHU Q S. New chemical industry based on biomass [J]. Journal of Chemical Industry and Engineering (China), 2004, 55(12):1938-1943.
[21] OFEMIA K S, ZHANG Y, FUNK T. Hydrothermal processing of swine manure into oil using a continuous reactor system:development and testing [J]. Transactions of the Asabe, 2006, 49(2):533-541.
[22] LI H, LIU Z D, ZHANG Y H, et al. Conversion efficiency and oil quality of low-lipid high-protein and high-lipid low-protein microalgae via hydrothermal liquefaction [J]. Bioresource Technology,2014, 154: 322-329. DOI: 10.1016/j.biortech.2013.12.074.
[23] GAI C, ZHANG Y H, CHEN W T, et al. An investigation of reaction pathways of hydrothermal liquefaction using Chlorella pyrenoidosa and Spirulina platensis [J]. Energy Conversion and Management,2015, 96: 330-339. DOI: 10.1016/j.enconman.2015.02.056.
[24] JENA U, DAS K C, KASTNER J R. Effect of operating conditions of thermochemical liquefaction on biocrude production from Spirulina platensis [J]. Bioresource Technology, 2011, 102(10): 6221-6229. DOI: 10.1016/j.biortech.2011.02.057.
[25] TIAN C Y, LIU Z D, ZHANG Y H, et al. Hydrothermal liquefaction of harvested high-ash low-lipid algal biomass from Dianchi Lake:effects of operational parameters and relations of products [J]. Bioresource Technology, 2015, 184: 336-343. DOI:10.1016/j.biortech. 2014.10.093.
[26] TOMMASO G, CHEN W T, LI P, et al. Chemical characterization and anaerobic biodegradability of hydrothermal liquefaction aqueous products from mixed-culture wastewater algae [J]. Bioresource Technology, 2015, 178: 139-146. DOI: 10.1016/j.biortech. 2014.10.011.
[27] BILLER P, ROSS A B. Potential yields and properties of oil from the hydrothermal liquefaction of microalgae with different biochemical content [J]. Bioresource Technology, 2011, 102(1):215-225. DOI:10.1016/j.biortech.2010.06.028.
[28] TORRI C, ALBA L G, SAMORI C, et al. Hydrothermal treatment(HTT) of microalgae: detailed molecular characterization of HTT oil in view of HTT mechanism elucidation [J]. Energy & Fuels, 2012,26(1): 658-671. DOI: 10.1021/ef201417e.
[29] CHEN W T, ZHANG Y H, ZHANG J X, et al. Co-liquefaction of swine manure and mixed-culture algal biomass from a wastewater treatment system to produce bio-crude oil [J]. Applied Energy, 2014, 128: 209-216. DOI: 10.1016/j.apenergy.2014.04.068.
[30] ZHANG J X, CHEN W T, ZHANG P, et al. Hydrothermal liquefaction of Chlorella pyrenoidosa in sub- and supercritical ethanol with heterogeneous catalysts [J]. Bioresource Technology, 2013, 133: 389-397. DOI:10.1016/j.biortech.2013.01.076.
[31] BAI X J, DUAN P G, XU Y P, et al. Hydrothermal catalytic processing of pretreated algal oil: a catalyst screening study [J]. Fuel, 2014, 120: 141-149. DOI:10.1016/j.fuel.2013.12.012.
[32] DUAN P G, SAVAGE P E. Catalytic hydrotreatment of crude algal bio-oil in supercritical water [J]. Applied Catalysis B-Environmental, 2011, 104(1/2): 136-143. DOI: 10.1016/j.apcatb.2011.02.020.
[33] VARDON D R, SHARMA B K, SCOTT J, et al. Chemical properties of biocrude oil from the hydrothermal liquefaction of Spirulina algae,swine manure, and digested anaerobic sludge [J]. Bioresource Technology, 2011, 102(17): 8295-8303. DOI: 10.1016/j.biortech. 2011.06.041.
[34] GAI C, ZHANG Y H, CHEN W T, et al. Energy and nutrient recovery efficiencies in biocrude oil produced via hydrothermal liquefaction of Chlorella pyrenoidosa [J]. RSC Advances, 2014, 4(33): 16958-16967. DOI: 10.1039/c3ra46607h.
[35] ZOU S P, WU Y L, YANG M D, et al. Production and characterization of bio-oil from hydrothermal liquefaction of microalgae Dunaliella tertiolecta cake [J]. Energy, 2010, 35(12):5406-5411. DOI: 10.1016/j.energy.2010.07.013.
[36] ROSS A B, BILLER P, KUBACKI M L, et al. Hydrothermal processing of microalgae using alkali and organic acids [J]. Fuel,2010, 89(9): 2234-2243. DOI: 10.1016/j.fuel.2010.01.025.
[37] LEONARDIS I, CHIABERGE S, FIORANI T, et al. Characterization of bio-oil from hydrothermal liquefaction of organic waste by NMR spectroscopy and FTICR mass spectrometry [J]. ChemSusChem, 2013, 6(1): 160-167. DOI: 10.1002/cssc.201200314.
[38] XU D H, SAVAGE P E. Characterization of biocrudes recovered with and without solvent after hydrothermal liquefaction of algae [J]. Algal Research-Biomass Biofuels and Bioproducts, 2014, 6: 1-7. DOI:10.1016/j.algal.2014.08.007.
[39] AUDO M, PARASCHIV M, QUEFFELEC C, et al. Subcritical hydrothermal liquefaction of microalgae residues as a green route to alternative road binders [J]. ACS Sustainable Chemistry & Engineering, 2015, 3(4): 583-590. DOI: 10.1021/acssuschemeng. 5b00088.
[40] VARDON D R, SHARMA B K, BLAZINA G V, et al. Thermochemical conversion of raw and defatted algal biomass via hydrothermal liquefaction and slow pyrolysis [J]. Bioresource Technology, 2012, 109: 178-187. DOI: 10.1016/j.biortech. 2012.01.008.
[41] 史权, 赵锁奇, 徐春明, 等. 傅立叶变换离子回旋共振质谱仪在石油组成分析中的应用 [J]. 质谱学报, 2008, 29(6): 367-378. SHI Q, ZHAO S Q, XU C M, et al. Fourier transform ion cyclotron resonance mass spectrometry and its application in petroleum analysis[J]. Journal of Chinese Mass Spectrometry Society, 2008, 29(6):367-378.
[42] CHIABERGE S, LEONARDIS I, FIORANI T, et al. Bio-oil from waste: a comprehensive analytical study by soft-ionization FTICR mass spectrometry [J]. Energy & Fuels, 2014, 28(3): 2019-2026. DOI:10. 1021/ ef402452f.
[43] SUDASINGHE N, DUNGAN B, LAMMERS P, et al. High resolution FT-ICR mass spectral analysis of bio-oil and residual water soluble organics produced by hydrothermal liquefaction of the marine microalga Nannochloropsis salina [J]. Fuel, 2014, 119:47-56. DOI:10.1016/j.fuel.2013.11.019.
[44] SUDASINGHE N, REDDY H, CSAKAN N, et al. Temperaturedependent lipid conversion and nonlipid composition of microalgal hydrothermal liquefaction oils monitored by Fourier transform ion cyclotron resonance mass spectrometry [J]. BioEnergy Research,2015: 1-11. DOI: 10.1007/s12155-015-9635-9.
[45] SANGUINETI M M, HOURANI N, WITT M, et al. Analysis of impact of temperature and saltwater on Nannochloropsis salina bio-oil production by ultra high resolution APCI FT-ICR MS [J]. Algal Research, 2015, 9: 227-235. DOI: 10.1016/j.algal.2015.02.026.
[46] MINOWA T, YOKOYAMA S, KISHIMOTO M, et al. Oil production from algal cells of Dunaliella tertiolecta by direct thermochemical liquefaction [J]. Fuel, 1995, 74(12): 1735-1738. DOI: 10.1016/0016-2361(95)80001-X.
[47] JENA U, DAS K C, KASTNER J R. Comparison of the effects of Na2CO3, Ca3(PO4)2, and NiO catalysts on the thermochemical liquefaction of microalga Spirulina platensis [J]. Applied Energy, 2012, 98: 368-375. DOI: 10.1016/j.apenergy.2012.03.056.
[48] BILLER P, RILEY R, ROSS A B. Catalytic hydrothermal processing of microalgae: decomposition and upgrading of lipids [J]. Bioresource Technology, 2011, 102(7): 4841-4848. DOI: 10.1016/j.biortech. 2010.12.113.
[49] XU Y F, ZHENG X J, YU H Q, et al. Hydrothermal liquefaction of Chlorella pyrenoidosa for bio-oil production over Ce/HZSM-5 [J]. Bioresource Technology, 2014, 156: 1-5. DOI: 10.1016/j.biortech. 2014.01.010.
[50] DUAN P G, BAI X J, XU Y P, et al. Catalytic upgrading of crude algal oil using platinum/gamma alumina in supercritical water [J]. Fuel, 2013, 109: 225-233. DOI:10.1016/j.fuel.2012.12.074.
[51] ELLIOTT D C, HART T R, SCHMIDT A J, et al. Process development for hydrothermal liquefaction of algae feedstocks in a continuous-flow reactor [J]. Algal Research-Biomass Biofuels and Bioproducts, 2013, 2(4): 445-454. DOI: 10.1016/j.algal.2013.08.005.
[52] ROUSSIS S G, CRANFORD R, SYTKOVETSKIY N. Thermal treatment of crude algae oils prepared under hydrothermal extraction conditions [J]. Energy & Fuels, 2012, 26(8): 5294-5299. DOI:10.1021/ef300798b.
[53] DUAN P G, WANG B, XU Y P. Catalytic hydrothermal upgrading of crude bio-oils produced from different thermo-chemical conversion routes of microalgae [J]. Bioresource Technology, 2015, 186: 58-66. DOI: 10.1016/j.biortech.2015.03.050.
[54] SUDASINGHE N, CORT J R, HALLEN R, et al. Hydrothermal liquefaction oil and hydrotreated product from pine feedstock characterized by heteronuclear two-dimensional NMR spectroscopy and FT-ICR mass spectrometry [J]. Fuel, 2014, 137: 60-69. DOI:10.1016/j.fuel.2014.07.069.
Chemical properties and characterization methods for hydrothermal liquefaction bio-crude from microalgae: a review
ZHANG Jixiang, JIANG Baohui, WANG Dong, WEI Yaodong
(State Key Laboratory of Heavy Oil Processing, China University of Petroleum-Beijing, Beijing 102249, China)
Hydrothermal liquefaction (HTL) bio-crude from microalgae cannot be directly used as transportation fuels due to poor quality. A new approach for its application is integration of it and modern petroleum processing industry. The chemical properties of HTL bio-crude, including chemical composition, functional groups and heteroatom compounds constitution are summarized in this paper. The characterization methods including GC-MS,FTIR, NMR, FT-ICR MS were compared and analyzed. Formation mechanism and upgrading of HTL bio-crude were also briefly reviewed. The focus is on higher oxygenated and nitrogenous compounds content in HTL bio-crude, higher aromaticity and unsaturation degree comparing with heavy crude oil or residue oil. Catalytic hydrotreating could effectively remove heteroatom and increase hydrocarbon content. The development of microalgae-based bio-fuels depends on not only the progress in upgrading technique but also the improvement of characterization methods.
bio-crude; microalgae; hydrothermal liquefaction; functional group; heteroatom
引 言
生物质是唯一可以用于大规模制取液体燃料的含碳可再生能源。面对过度使用化石燃料带来的气候变化和环境污染等问题,由于生物质能的零碳特性,研究以生物质为原料生产液体运输燃料具有重大意义。以液体燃料为目标产物的生物质转化技术,包括生物化学转化和热化学转化两种途径,其中热化学转化又有快速热裂解、间接液化(气化—合成)和水热液化等不同工艺。水热液化是指生物质在中等温度(200~375℃)和水热条件下反应,生成一种油状产物(生物油),同时得到气体、水相成分和固体残渣等其他副产物的过程。水热液化工艺不需要对原料进行干燥,降低了过程能耗,特别适合处理含水量较高的生物质原料。
date: 2015-10-19.
ZHANG Jixiang, zhjx916@163.com
supported by the National Natural Science Foundation of China (21406265) and the Science Foundation of China University of Petroleum, Beijing (2462013YJRC022).
TK 6
A
0438—1157(2016)05—1644—10
2015-10-19收到初稿,2015-12-01收到修改稿。
联系人及第一作者:张冀翔(1986—),男,博士研究生,讲师。
国家自然科学基金项目(21406265);中国石油大学(北京)科研基金项目(2462013YJRC022)。

