血清鳞状上皮细胞癌抗原在宫颈癌中的应用
董晓霞 ,陈育梅,黄凌霄,胡艳君,方深慧(温州市人民医院,浙江 温州325000)
·病例报告·
血清鳞状上皮细胞癌抗原在宫颈癌中的应用
董晓霞 ,陈育梅,黄凌霄,胡艳君,方深慧
(温州市人民医院,浙江 温州325000)
目的探讨血清鳞状上皮细胞癌抗原(squamous cell carcinoma antigen,SCCAg)在宫颈癌中的应用。方法采用化学发光法测定53例宫颈癌患者、44例I/II期宫颈癌患者术后、35例宫颈上皮内瘤变患者及35例健康妇女的血清中SCCAg的水平。结果宫颈癌患者、宫颈上皮内瘤变患者及健康妇女的血清中SCCAg的中位浓度分别为2.25ng/mL、1.33ng/mL及0.70ng/mL。宫颈癌患者血清SCCAg浓度显著高于宫颈上皮内瘤变组及正常对照组(均P<0.01);宫颈上皮内瘤变组与正常对照组血清SCCAg浓度差异有统计学意义(P<0.05)。44例I/II期宫颈癌术前血清SCCAg的浓度的中位数为2.09ng/mL,术后血清SCCAg浓度的中位数为1.03ng/mL,手术前后血清SCCAg浓度差异有统计学意义(P<0.05)。SCCAg浓度与FIGO分期、肿瘤大小、有无淋巴结转移均有关(P<0.05)。结论血清SCCAg在宫颈癌的诊断、临床分期及手术治疗疗效判断方面均有一定的应用价值。
鳞状上皮细胞癌抗原;宫颈癌;化学发光法
宫颈癌是妇科最常见的恶性肿瘤之一,多年来,人们希望通过对宫颈癌诊断技术的不断研究,以期发现宫颈癌前病变及早期宫颈癌,并对宫颈癌进行临床分期及预后判断。研究表明,SCCAg广泛存在宫颈恶性病变的上皮细胞中,参与肿瘤的生长和表达[1]。在癌细胞合成、分化中产生大量SCCAg,从而导致血清中的SCCAg增加,并有很好的特异性。本文通过检测宫颈癌患者血清SCCAg的水平,探讨其在临床中的应用。
1 资料与方法
1.1一般资料选择本院2012年1月~2013年12月经病理确诊的53例宫颈癌患者,35例宫颈上皮内瘤变患者、35例健康体检者。宫颈癌临床分期按照FIGO分期标准,其中I/II期44例、III/IV期9例;按病理结果,其中子宫颈鳞癌41例,子宫颈腺癌12例。宫颈上皮内瘤变组35例包括宫颈上皮内瘤变I级8例,宫颈上皮内瘤变II级14例,宫颈上皮内瘤变III级13例。所有I/II期宫颈癌患者术前均未进行化疗和放疗治疗,所有I/II期患者均行广泛子宫切除加盆腔淋巴结切除术。所有观察对象均除外内分泌疾病、代谢性疾病、肝病、骨关节病及其他肿瘤病史。宫颈癌患者年龄34~61岁,中位年龄45岁;宫颈上皮内瘤变患者年龄28~60岁,中位年龄43岁;正常对照组27~58岁,中位年龄42岁。三组年龄差异均无统计学意义(P>0.05)。
1.2方法正常对照组于清晨空腹时收集血液标本,I/II期宫颈癌患者于术前3~5天抽取清晨空腹静脉血3mL,术后5~7天再次收集血液标本;III/IV期宫颈癌患者及宫颈上皮内瘤变患者于确诊时收集血液标本,采集后,室温凝固30分钟~1小时,4℃、2000 r/min离心20分钟,吸取血清,-80℃保存备用。所有标本避免溶血和反复冻融。SCCAg水平采用化学发光法测定,SCCAg试剂盒由瑞典CanAg公司生产。严格按试剂盒说明书步骤由专人进行操作。阳性判断标准:血清SCCAg>71.5ng/mL为阳性。
1.3统计学处理采用SPSS17.0软件进行统计学处理,血清SCCAg的浓度呈非正态分布,经自然对数变换后,各组数据均呈正态分布,故采用中位数及范围表示总体水平;经自然对数变换后的数据,率的比较采用χ2检验,两组间计量资料的比较采用t检验;三组间比较采用单因素方差分析、LSD法。
2 结果
2.1三组SCCAg的浓度比较宫颈癌患者、宫颈上皮内瘤变患者及健康妇女血清SCCAg的中位浓度分别为2.25ng/mL、1.33ng/mL及0.70 ng/mL。原始数据经自然对数变换后,宫颈癌患者血清SCCAg浓度显著高于宫颈上皮内瘤变组及正常对照组(t分别为4.235、8.631,均P<0.01);宫颈上皮内瘤变组与正常对照组SCCAg浓度差异也有统计学意义(P<0.05),见表1。宫颈癌患者血清SCCAg的阳性率(43/53,81.1%)高于宫颈上皮内瘤变患者(15/53,28.3%),差异有统计学意义(P<0.01)。

表1 三组血清SCCAg的浓度比较(ng/mL)
2.2I/II期宫颈癌手术前后血清SCCAg的动态变化44例I/II期宫颈癌患者术前血清SCCAg中位浓度为2.09ng/mL,术后血清SCCAg中位浓度为1.03ng/mL。原始数据经自然对数变换后,手术前后血清SCCAg浓度差异有统计学意义(P<0.05)。
2.3血清SCCAg浓度和临床特征的关系血清SCCAg浓度与FIGO分期有关,III/IV期宫颈癌患者血清SCCAg的浓度显著高于I/II期患者(t=2.915,P<0.05);SCCAg浓度与肿瘤大小、有无淋巴结转移有关(P<0.05)。见表2。
3 讨论
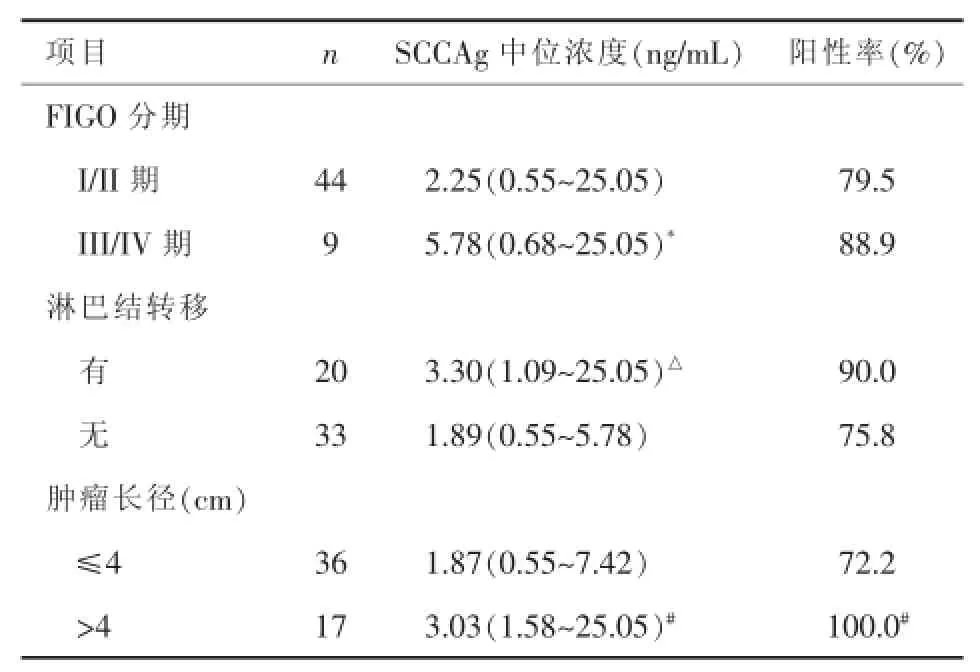
表2 血清SCCAg浓度和临床特征的关系
宫颈癌是最常见的妇科恶性肿瘤之一,其发病率居女性生殖系统恶性肿瘤之首,是导致女性死亡的第二大恶性肿瘤,死亡率仅次于乳腺癌。近年来,宫颈癌有逐渐上升趋势,其发病年龄不断的年轻化。人们希望通过对宫颈癌诊断技术的不断研究,以期发现宫颈癌前病变及早期宫颈癌,并对宫颈癌进行临床分期及预后判断。近年来,由于免疫学和细胞分子生物学的发展,被发现的宫颈癌肿瘤标志物日益增多。鳞状上皮细胞癌抗原(SCCAg)被认为是宫颈癌较好的血清标志物,在宫颈癌的应用中有一定的临床意义[2-3]。
肿瘤相关抗原TA-4是从人类宫颈癌组织中提取的一种糖蛋白。而SCCAg则是用单克隆技术从TA-4中提纯的蛋白片段,具TA-4抗原决定簇,能更有效的表达TA-4抗原生物活性。其分子量为48ku,主要有两个同源性非常高的基因编码SCCAg1、SCCAg2,位于染色体18Q21.3,其相互串联。SCCAg1位于细胞内,SCCAg2位于细胞外。由于靶细胞基因表达和调控失常,导致SCC值升高,而临床表现加重[4]。SCCAg作为一种肿瘤标记物,在临床上已被认为是宫颈癌及癌前病变的重要参考指标,且认为可以对宫颈癌患者的治疗疗效提供信息。Jeong等[5]报道,血清SCCAg的浓度在子宫颈癌患者中最高,明显高于宫颈上皮内瘤变组和正常对照组,且随着临床期别的增高,SCCAg的水平越高,差异有显著性。故本文的研究目的是进一步明确SCCAg水平在宫颈癌监测中的价值。
本研究发现,宫颈癌组SCCAg的浓度与宫颈上皮内瘤变组和正常对照组血清SCCAg的浓度差异有统计学意义;宫颈癌患者血清SCCAg的阳性率明显高于宫颈上皮内瘤变患者。III/IV期宫颈癌患者血清SCCAg浓度显著高于I/II期患者,这表明血清SCCAg在宫颈癌的诊断和临床分期上有一定的临床意义。I/II期宫颈癌患者术前、术后血清SCCAg的变化差异有统计学意义,提示血清SCCAg可能成为宫颈癌临床手术治疗疗效判断和治疗后随访中的的重要参考指标。另外,国内外的研究显示[6-7],宫颈癌患者术前血清SCCAg水平均与癌的持续状态和癌复发明显相关,并认为SCCAg是宫颈癌的一个独立的预后指标,其高水平预示着复发时间间隔短、生存期短和预后不良。提示血清SCCAg也是宫颈癌的一个独立预后监测指标。
此外,本研究还发现,SCCAg浓度与肿瘤大小、有无淋巴结转移均有关,提示血清SCCAg的表达水平可在一定程度上反应宫颈癌的生物学特征。
综上所述,检测SCCAg作为宫颈癌患者的生物标志物在宫颈癌诊断、临床分期、病情监测、预后判断和治疗后随访中具有重要意义。
[1] 魏矿荣,王亚娜,梁志恒,等.中山市1970-2007年宫颈癌发病分析.中国肿瘤,2012,21(7):495
[2]陈真云,盛修贵,李秀敏.SCCAg、CYFRA21-1、CEA联合检测在中晚期及复发宫颈鳞癌诊断及治疗中的临床价值.肿瘤学杂志,2013,19(8):595
[3]甘玉杰,熊小英,罗小婉,等.血清SCCAG在宫颈癌及癌前病变中的临床意义.中国妇幼保健,2012,27(19):2921
[4]Kim Byoung-Gie.Squamous cell carcinoma antigen in cervical cancer and beyond.J Gynecol Oncol,2013,24(4):291
[5]Jeong BK,Choi DH,Huh SJ,et al.The role of squamous cell carcinoma antigen as a prognostic and predictive factor incarcinomaofuterinecervix.RadiatOncolJ,2011,29(3):191
[6] Porika M,Vemunoori AK,Tippani R,et al.Squamous cell carcinoma antigen and cancer antigen 125 in southern Indian cervicalcancerpatients.AsianPacJCancerPrev,2010,11:1745
[7]梁卫江,李文超,杨叶青,等.血清肿瘤标志物在宫颈鳞癌诊断及预后预测中的价值.中国综合临床,2012,28(4):353

