“温度对酶活性影响”实验的再探究
姚 舒
(首都师范大学生命科学学院 北京 100048) 张 胜 (广东省深圳第三高级中学 518172)
1 实验背景
1.1 酶的概念 在一定条件下,酶在生物体内或体外均可催化各种生化反应。它与一般催化剂的共性在于:都是通过降低化学反应的活化能而加速反应进行(图1);不能改变化学反应的平衡点;反应前后酶的质量、性质不变[1]。
1.2 温度与酶催化反应的关系 酶催化底物反应以效应物与酶活性有关基团的碰撞—络合—解离为基础。从热力学的角度看,对于一个酶分子而言,只存在 “有活性”与“无活性”两种状态,不具有连续性。只有当酶成为一个“ 群体”时,因受温度与pH的影响,有些酶失活,有些酶仍有活性,才表现出来酶“群体”活性随温度或pH 变化的连续曲线[2]。酶的最适温度并非酶的特征常数,并不固定,而与测定酶活力的时间长短有关,因为酶可以短时间内耐受较高的温度。大多酶在40℃以上催化活力下降;60℃~70℃呈现可逆失活;70℃~80℃出现不可逆失活[1]。酶的变性有两方面的原因:温度和时间。在高温下变性比较快,但在较低温度下,变性也会缓慢发生[3]。在一般情况下,温度对酶活性影响实验中将自变量设定为温度,由于时间较短,不考虑时间对实验带来的影响。
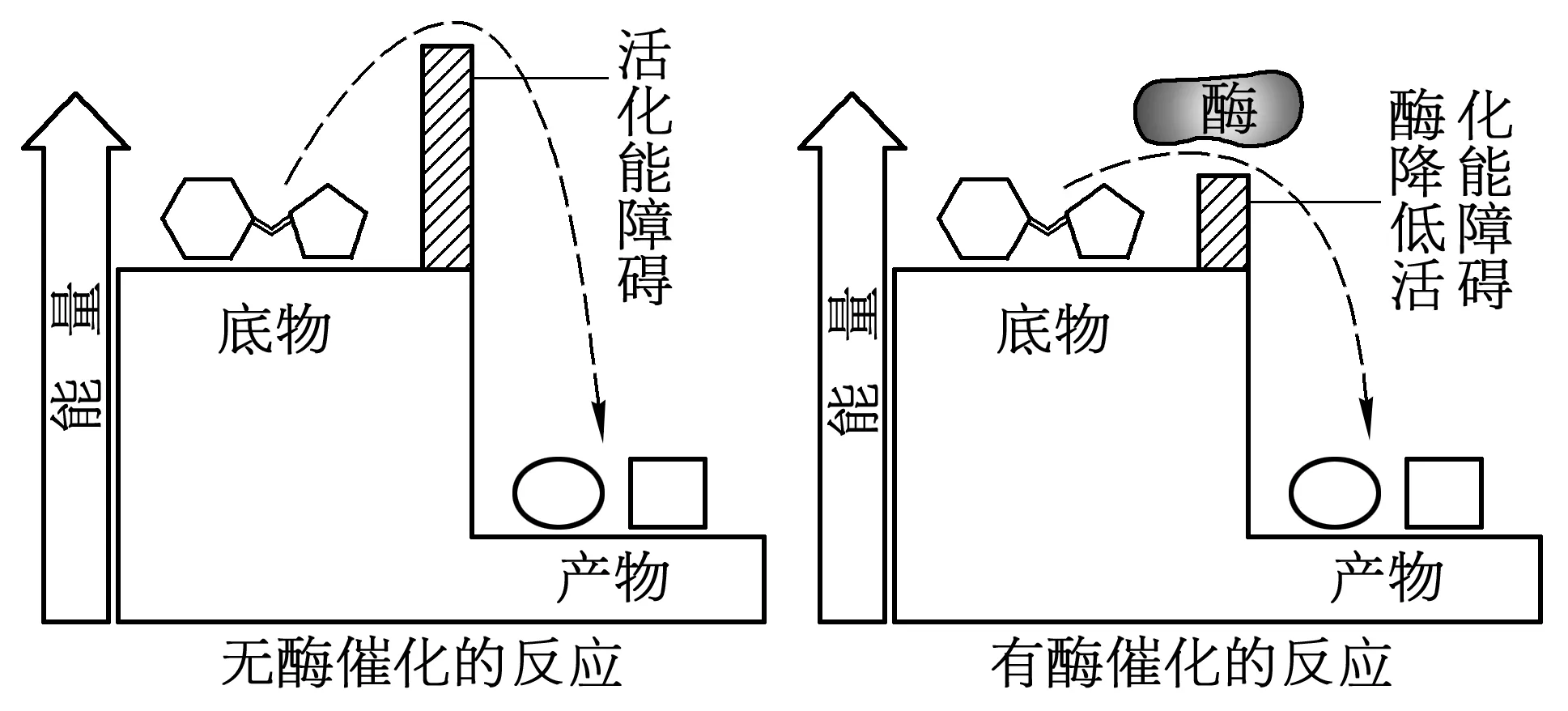
图1 酶催化机理——降低反应所需活化能
2 实验常见问题及改进
2.1 实验原理不合理 在碘-淀粉溶液中,由于配合与吸附作用产生了蓝色的淀粉—碘包合物。但是,当溶液温度升高时,淀粉的螺旋构象会遭到破坏,导致无法继续保持与碘的吸附状态,蓝色因此褪去[4]。因此,碘液不可在高温下检测淀粉。
2.2 实验过程的改进 用列表显示操作步骤会使学生一目了然,并在实验过程中进一步验证低温、高温对酶活性的影响。通过对实验过程的再设计,可使学生实验的成功率大大提高,并更为直观地验证酶的性质,丰富实验教学内容[5]。另外,底物淀粉和酶必须保存在同一温度中,防止淀粉和酶混合在一起温度突然发生变化,影响在冰浴和沸水浴中唾液淀粉酶的活性[6]。
2.3 新方法的尝试 有研究者尝试运用聚丙烯酰胺凝胶电泳技术对反应后的样本进行分离实验,来探究温度对酶活性的影响。由于蛋白酶活性在不同温度和时间下强弱不同,使得底物蛋白被切割的条带在聚丙烯酰胺凝胶上显示的粗细不同,据此可以判断酶活性的强弱[7]。该实验设计中涉及的几种实验材料对于普通中学来说不容易获得,且凝胶电泳装置也并不常见,因此不适宜推广。
3 温度对酶活性影响的再探究
参考美国主流生物学教材《生物实验手册》[8],采用儿茶酚溶液替代淀粉溶液设计探究实验。
3.1 实验原理 儿茶酚氧化酶从土豆提取液中获得。由于儿茶酚溶液为无色,苯醌为棕色,通过观察颜色变化来定性判断反应进行的程度。同时,颜色的逐渐变化可利用吸光度定量得出。
3.2 实验材料与方法 准备1%儿茶酚溶液、土豆提取液、冰箱、水浴锅、试管架、试管。实验过程如下:
(1)在40℃和80℃的水浴锅水浴或室温下以及4℃冰箱中放置1个试管架。
(2)取7支试管,并在试管上部依次编号1~7。
(3)取1管马铃薯提取液和1管1%儿茶酚溶液。
(4)如表1所示,将蒸馏水,pH缓冲液和马铃薯提取物添加到试管中,震荡马铃薯提取液至悬浮状态。
(5)将上述试管放在对应温度的水浴或冰箱里,每支管在各自对应的温度下静置5 min预热(预冷)。将1至4号试管放到试管架置于室温环境中(约22℃)或者20℃的水浴锅中。
(6)如表1所示,向2号以及4~7号试管添加1%儿茶酚溶液。立即记录每支试管此时的颜色变化,并在表1中记录。定性记录颜色变化,范围从0~5,0表示没有颜色变化,5表示剧烈变化。
(7)在接下来的20 min,每隔5 min观察记录一次颜色的变化,每次观察完要迅速将试管放回原来的位置(冰箱或水浴)。
(8)实验完毕后,清理实验台和实验材料,儿茶酚必须倒入专门的废弃物容器中,不能直接倒入水池。
4 实验讨论
从表1可见,试管1和3不含底物,试管2虽然有底物,不含酶。因此,试管1、2、3不会发生变化,保持原来的透明无色不变;试管4、5、6、7中的底物和酶完全相同,温度为自变量。儿茶酚氧化酶对温度敏感,最适温度为15℃,到45℃就完全失活。也有文献报道22℃为儿茶酚氧化酶的最适温度[9],反应条件可能有所差异。需要注意的是,在加入儿茶酚氧化酶之前需提前预热反应系统到设定温度,减少酶加入之后还未达到预设温度从而产生误差。

