氯霉素在过氧化聚多巴胺修饰电极上的电化学行为及测定
赵晓娟,张其美,陈海光,白卫东
(仲恺农业工程学院 轻工食品学院,广东 广州 510225)
氯霉素在过氧化聚多巴胺修饰电极上的电化学行为及测定
赵晓娟,张其美,陈海光,白卫东*
(仲恺农业工程学院轻工食品学院,广东广州510225)
利用多巴胺(DA)的自聚反应在玻碳电极(GCE)表面形成聚多巴胺(PDA)膜,将聚多巴胺修饰电极浸入碱溶液中进行电化学处理,制得过氧化聚多巴胺修饰电极(OPDA/GCE)。通过方波伏安法直接测定氯霉素在OPDA/GCE上的电化学响应信号,得到待测溶液中氯霉素的浓度。对多巴胺的自聚时间、氯霉素在修饰电极上的电化学性质、测试条件、溶解氧的影响及去除方法等进行考察。结果表明,氯霉素在OPDA/GCE上的还原峰电流与其浓度在3.0×10-6~1.1×10-3mol/L范围内呈良好的线性关系,检出限(S/N=3)为7.8×10-7mol/L,牛奶和蜂蜜样品的加标回收率分别为83.4%~94.1%和91.5%~108.6%。该修饰电极制备方法简便易行、成本低、便于批量制备,用其检测氯霉素操作简单、选择性好。
聚多巴胺;过氧化;自聚反应;修饰电极;氯霉素
氯霉素(Chloramphenicol,CAP)类抗生素被广泛用于动物各种细菌性传染疾病的治疗。研究表明,食品中的氯霉素类药物残留对人体有严重的副作用。我国农业部2002年发布《食品动物禁用的兽药及其他化合物清单》,禁止给所有食品动物使用氯霉素。但因其价格低、抑菌效果好,目前仍有违规使用现象。因此,对动物源性食品中的氯霉素残留进行测定具有重要意义。
目前,氯霉素残留的检测方法主要有色谱及色谱-质谱联用法[1-5]、光谱法[6-8]、免疫分析[9-11]和电化学传感分析法[12-14]等。电化学传感分析法快速灵敏、操作简便、易于微型化和实现现场分析,在氯霉素残留快速检测方面具有独特优势。近年来,氯霉素的生物电化学传感器和分子印迹传感器研究取得了一定的突破[15-19],但生物分子价格昂贵、环境耐受性差。虽然分子印迹聚合物克服了生物分子的上述缺陷,但寻找合适的功能单体和洗脱剂的过程费时费力。
本文通过多巴胺(DA)在玻碳电极(GCE)表面的自聚反应,得到聚多巴胺(PDA)膜修饰电极(PDA/GCE),进一步将PDA/GCE浸入碱溶液中进行电化学处理,制得过氧化聚多巴胺修饰电极(OPDA/GCE)。通过测定氯霉素在OPDA/GCE上的还原峰电流得到待测溶液中氯霉素的浓度,对市售牛奶和蜂蜜样品中的氯霉素残留进行检测,并进行加标回收率测定。该修饰电极制备及使用方法简单、成本低、便于批量制备、选择性好。
1 实验部分
1.1仪器与试剂
DY 2100B电化学分析仪(美国Digi-Ivy公司),三电极系统:工作电极为GCE、PDA/GCE或OPDA/GCE,参比电极为Ag/AgCl(饱和KCl溶液)电极,辅助电极为铂丝电极。
多巴胺(西格玛奥德里奇(上海)贸易有限公司),氯霉素(阿法埃莎(天津)化学有限公司),三(羟甲基)氨基甲烷(阿拉丁试剂有限公司),甲砜霉素(国药集团化学试剂有限公司),硫酸庆大霉素和盐酸金霉素(生工生物工程(上海)股份有限公司),新霉素硫酸盐、青霉素钾、盐酸强力霉素(广州市齐云生物技术有限公司);0.1 mol/L磷酸缓冲溶液(PBS,pH 7.0)由NaH2PO4·2H2O和 Na2HPO4·12H2O贮备液混合配制;0.01 mol/L Tris-HCl缓冲溶液(pH 8.5)由Tris和HCl储备液混合配制;所用试剂均为分析纯。实验用水为超纯水(18.2 MΩ·cm)。
1.2PDA/GCE的制备
将GCE依次用1.0,0.3,0.05 μm的α-Al2O3粉在抛光绒毛垫上抛光,每一步均用水洗净,然后依次在1∶1 HNO3溶液、无水乙醇和水中超声清洗,处理后的电极室温下晾干备用。将GCE浸入2 mg/mL DA的Tris-HCl缓冲溶液(0.01 mol/L,pH 8.5)中避光自聚反应2.5 h,取出电极后用水充分淋洗。
1.3OPDA/GCE的制备
将0.5 mol/L NaOH溶液置于电解杯中,通氮除氧15 min后,以PDA/GCE为工作电极,将三电极系统置于该碱溶液中,在-1.5~1.0 V电压范围内,以50 mV/s的扫速循环伏安扫描6圈,将处理后的电极用水充分淋洗,即得OPDA/GCE。
1.4检测方法
用0.1 mol/L PBS(pH 7.0)配制不同浓度的氯霉素标准溶液或稀释待测样品溶液。以OPDA/GCE为工作电极,将三电极系统置于经通氮处理15 min的氯霉素溶液中,采用方波伏安法(SWV)直接测定氯霉素在-0.65 V的还原峰电流。该还原峰电流与溶液中氯霉素的浓度成正比。根据电流与氯霉素浓度的对应关系,建立标准曲线,用于待测样品中氯霉素含量的测定。
SWV测定条件:起始电位为-0.2 V,终止电位为-1.0 V,电位增量为2 mV,方波振幅为100 mV,方波频率为20 Hz。
2 结果与讨论
2.1氯霉素在OPDA/GCE上的电化学行为
利用方波伏安法比较了GCE和OPDA/GCE在PBS和0.1 mmol/L氯霉素溶液中的电化学响应。在所考察的电位窗口内,GCE和OPDA/GCE在PBS中均未出现还原峰(图1a~b),而在氯霉素溶液中,GCE和OPDA/GCE分别于-0.55 V和-0.65 V处出现1个明显的还原峰(图1c~d)。与GCE相比,氯霉素在OPDA/GCE上的还原峰电流值显著增大,表明OPDA/GCE对氯霉素的电化学还原具有良好的催化作用。
2.2电极修饰与测试条件的选择
2.2.1PDA/GCE的过氧化处理为考察对PDA/GCE进行过氧化处理的作用,使用PDA/GCE和OPDA/GCE对0.1 mmol/L氯霉素溶液进行测定,结果如图2所示。与PDA/GCE相比,氯霉素在OPDA/GCE上的响应电流明显增强。这主要是由于过氧化处理使电极表面的聚多巴胺膜所带负电荷增加,与溶液中带正电荷的氯霉素分子之间的静电吸引作用力增强,氯霉素分子更易到达电极表面进行电化学反应。

图2 PDA/GCE(a)和OPDA/GCE(b)在0.1 mmol/L CAP溶液中的方波伏安图Fig.2 Square wave voltammograms for PDA/GCE(a) and OPDA/GCE(b) in 0.1 mmol/L CAP solution
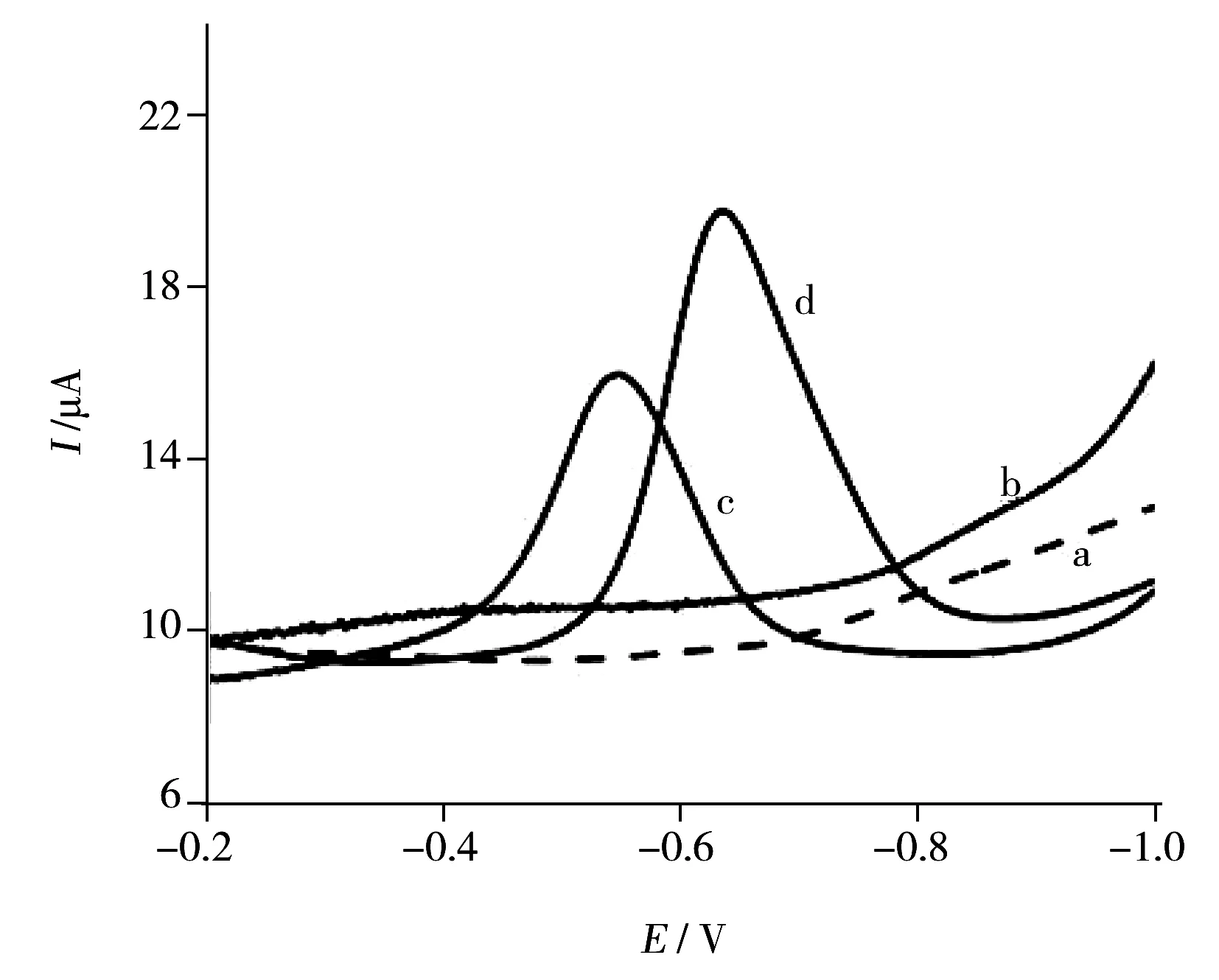
图1 GCE(a,c)和OPDA/GCE(b,d) 的方波伏安图Fig.1 Square wave voltammograms for GCE(a,c) and OPDA/GCE(b,d) a,b:0.1 mol/L PBS(pH 7.0);c,d:0.1 mmol/L CAP solution
2.2.2DA自聚时间的选择将GCE浸入2 mg/mL DA的Tris-HCl缓冲溶液中,分别避光自聚反应1,2,2.5,3,4,5,10,20 h,研究自聚不同时间下制备的OPDA/GCE对0.1 mmol/L氯霉素溶液的响应情况。结果表明,GCE在DA溶液中自聚反应2.5 h时制备的OPDA/GCE对氯霉素的响应电流值最大,因此选择2.5 h作为DA的自聚时间。
2.2.3溶解氧的影响及去除方法的选择取PBS和0.1 mmol/L氯霉素溶液各2份,对其中1份PBS和氯霉素溶液进行通氮除氧处理,然后用OPDA/GCE对上述4份溶液分别进行测定,考察溶解氧对OPDA/GCE测定效果的影响。结果显示,溶解氧的存在会使OPDA/GCE在PBS中于-0.55 V出现宽峰,同时在氯霉素还原峰的附近出现干扰峰,影响氯霉素在-0.65 V处还原峰电流的取值;而通氮除氧后的PBS检测基线平滑,氯霉素的响应峰形好,峰电流值大。因此,测定前需对溶液中的溶解氧进行去除。
分别在中性(pH 7.0)PBS和氯霉素溶液中加入0.1 mmol/L Na2SO3或抗坏血酸、在碱性(pH 12.0)溶液中加入0.1 mmol/L Na2SO3、在酸性(pH 2.0)溶液中加入0.1 mmol/L Na2CO3,超声混匀10 min后进行测定,将上述4种化学除氧方法的测定效果与通氮除氧的测定效果进行比较。结果表明,Na2CO3在本溶液体系中无去除溶解氧的作用;在中性溶液中加入Na2SO3虽有一定的除氧效果,但氯霉素的出峰位置负移较大;在碱性溶液中加入Na2SO3和在中性溶液中加入抗坏血酸均具有明显的除氧效果,但与通氮除氧相比,通过化学试剂去除溶解氧时响应曲线的基线不平稳,而且氯霉素的还原峰峰形较宽。因此,选择通氮气法去除测试溶液中的溶解氧。
2.2.4底液pH值的选择氯霉素是弱碱性化合物,其pKa值为9.61[20]。配制氯霉素溶液时底液的pH值影响氯霉素在溶液中的稳定性和存在状态,从而影响氯霉素与过氧化聚多巴胺膜的作用能力。分别用pH值为2.0,7.0,12.0的0.1 mol/L PBS配制0.1 mmol/L氯霉素溶液,考察OPDA/GCE在不同pH值的氯霉素溶液中的电化学响应。结果表明,pH 7.0的氯霉素溶液在OPDA/GCE上的还原峰电流值最大,主要是由于pH 7.0时,溶液中约99%以上的氯霉素以阳离子状态存在,与带负电荷的过氧化聚多巴胺膜之间的静电吸引力强,从而使氯霉素的响应灵敏度提高;pH 12.0时,溶液中的氯霉素主要以中性分子状态存在,不易到达电极表面发生反应,同时氯霉素在强碱性溶液中的稳定性降低,导致氯霉素在OPDA/GCE上的峰电流较小;pH 2.0时,氯霉素的稳定性较差,响应电流降低。由于氯霉素在中性和弱酸性条件下较稳定,且当溶液的pH值小于氯霉素的pKa值约2个单位时,氯霉素主要以阳离子状态存在,与过氧化聚多巴胺膜的作用能力强,因此,实验选择氯霉素测试底液的最佳pH值为7.0。

图3 OPDA/GCE测定不同浓度氯霉素溶液的方波伏安图Fig.3 Square wave voltammograms of CAP solutions with different concentrations on OPDA/GCE cCAP(a-q):0.003,0.005,0.007,0.009,0.011,0.021, 0.039,0.056,0.075,0.092,0.11,0.28,0.45,0.61, 0.77,0.92,1.1 mmol/L;insert:calibration curve of reductive peak currents vs.CAP concentration
2.3标准曲线与检出限
在优化实验条件下,使用方波伏安法考察不同浓度的氯霉素溶液在OPDA/GCE上的电流响应(如图3)。由图3可见,随着氯霉素浓度的增加,其在-0.65 V处的还原电流逐渐增大,且还原峰电流值(I,μA)与氯霉素浓度(c,mmol/L)在3.0×10-6~1.1×10-3mol/L范围内呈良好的线性关系,线性方程为I=25.27c+1.648(r=0.993,n=17)。基于3倍信噪比(S/N=3)计算得到该修饰电极对氯霉素的检出限为7.8×10-7mol/L。
2.4干扰实验
以0.1 mmol/L氯霉素溶液为对照,考察相同浓度、10倍浓度的硫酸庆大霉素、青霉素钾、新霉素硫酸盐、盐酸金霉素、盐酸强力霉素、甲砜霉素对氯霉素测定的干扰情况。结果显示,加入上述干扰物质后氯霉素的响应电流无明显变化,表明本实验制备的OPDA/GCE对氯霉素测定具有良好的选择性。
2.5重复性
取5支GCE,按相同方法进行修饰得到OPDA/GCE,并测定其对相同浓度氯霉素溶液的电流响应,测得还原峰电流值的相对标准偏差(RSD)为2.1%,表明该修饰电极的制备重复性好。
用同一支OPDA/GCE对相同浓度的氯霉素溶液测定8次,测得还原峰电流值的RSD为2.7%,表明该修饰电极对氯霉素的测试重复性好。
2.6实际样品的测定
选取市售牛奶和蜂蜜样品各2种,牛奶样品按照文献[21]方法前处理后,将上清液用磷酸盐配成pH 7.0的待测样品溶液;蜂蜜样品直接用0.1 mol/L PBS(pH 7.0)溶解后作为待测样品溶液。使用OPDA/GCE进行方波伏安法测试,未出现氯霉素的特征还原峰,表明所测牛奶和蜂蜜样品中不含氯霉素。为验证方法的准确性,取上述空白牛奶和蜂蜜样品各1种,分别添加0.039,0.92 mmol/L的氯霉素溶液,按照优化条件分别平行测定3次,其加标回收率分别为83.4%~94.1%和91.5%~108.6%,RSD分别为3.5%~5.7%和2.8%~7.4%,表明本方法具有较高的准确度和精密度。
3 结 论
本文利用多巴胺自聚反应和过氧化处理方法制得一种过氧化聚多巴胺修饰电极,通过测定氯霉素在修饰电极上的还原峰电流得到待测溶液中氯霉素的浓度,对修饰电极的制备方法和测试条件、氯霉素在修饰电极上的电化学行为等进行了考察和优化,并对市售牛奶和蜂蜜样品中的氯霉素残留进行了检测。实验结果表明,该修饰电极制备及使用方法简单、成本低、便于批量制备、选择性好;经过氧化处理的聚多巴胺膜修饰电极对氯霉素的响应灵敏度显著增强,相关研究可为今后修饰电极的制备与开发提供思路和参考。
[1]Vosough M,Esfahani H M.Talanta,2013,113:68-75.
[2]Liu T S,Xie J,Zhao J F,Song G X,Hu Y M.FoodAnal.Methods,2014,7(4):814-819.
[3]Sniegocki T,Posyniak A,Gbylik-Sikorska M,Zmudzki J.Anal.Lett.,2014,47(4):568-578.
[4]Lu Y,Yao H,Li C,Han J,Tan Z J,Yan Y S.FoodChem.,2016,192:163-170.
[5]Liu Y D,Zhang Q,Chen W S,Hong L.J.Instrum.Anal.(刘彦东,张权,陈文生,洪亮.分析测试学报),2015,34(3):362-366.
[6]Ji W,Yao W R.Spectrochim.ActaPartA,2015,144:125-130.
[7]Hegazy M A,Lotfy H M,Rezk M R,Omran Y R.Spectrochim.ActaPartA,2015,140:600-613.
[8]Wang C Y,Xiang B R,Zhang W,Wang Z W,Chen C Y.FoodSci.(王彩云,相秉仁,张伟,王正武,陈昌云.食品科学),2009,30(6):184-187.
[9]Yu X X,He Y,Jiang J,Cui H.Anal.Chim.Acta,2014,812:236-242.
[10]Xia X H,Xu Y,Ke R Q,Zhang H,Zou M Q,Yang W,Li Q G.Anal.Bioanal.Chem.,2013,405(23):7541-7544.[11]Tao X Q,Jiang H Y,Zhu J H,Wang X,Wang Z H,Niu L L,Wu X P,Shi W M,Shen J Z.FoodAgric.Immunol.,2013,25(1):137-148.[12]Yadav S K,Agrawal B,Chandra P,Goyal R N.Biosens.Bioelectron.,2014,55:337-342.
[13]Kor K,Zarei K.J.Electroanal.Chem.,2014,733:39-46.
[14]Zhai H Y,Liang Z X,Chen Z G,Wang H H,Liu Z P,Su Z H,Zhou Q.Electrochim.Acta,2015,171:105-113.[15]Pilehvar S,Mehta J,Dardenne F,Robbens J,Blust R,De Wael K.Anal.Chem.,2012,84(15):6753-6758.
[16]Pilehvar S,Dierckx T,Blust R,Breugelmans T,De Wael K.Sensors,2014,14(7):12059-12069.
[17]Shao Y J,Mo F L,Wei X P,Li J P.J.GuilinUniv.Technol.(邵义娟,莫方楼,魏小平,李建平.桂林理工大学学报),2013,33(4):737-742.
[18]Zhang J H,Zhang W,Li M X,Chen R R,Zhao X J,Liu J,Bai W D,Chen H G.GuangdongAgric.Sci.(章锦涵,张威,李美欣,陈蓉蓉,赵晓娟,刘佳,白卫东,陈海光.广东农业科学),2015,42(19):95-100.
[19]Yang G M,Zhao F Q.Biosens.Bioelectron.,2015,64:416-422.
[20]Qian M R,Wu L Q,Zhang H,Liu F,Li R,Chen Z M,Li T,Fang L Z.J.Instrum.Anal.(钱鸣蓉,吴俐勤,章虎,刘飞,李锐,陈志民,李婷,方丽珍.分析测试学报),2011,30(9):1018-1022.
[21]Jeon M,Kim J,Paeng K J,Park S W,Paeng I R.Microchem.J.,2008,88:26-31.
Electrochemical Behavior and Determination of Chloramphenicol on Overoxidized Polydopamine Film Modified Electrode
ZHAO Xiao-juan,ZHANG Qi-mei,CHEN Hai-guang,BAI Wei-dong*
(College of Light Industry and Food Science,Zhongkai University of Agriculture and Engineering,Guangzhou510225,China)
Polydopamine(PDA) film was modified on the surface of glassy carbon electrode(GCE) by the self-polymerization of dopamine(DA).Then the overoxidized polydopamine film modified electrode(OPDA/GCE) was obtained by electrochemical treatment of PDA film in alkaline solution.Furthermore,the chloramphenicol(CAP) concentration was obtained by using square wave voltammetry to detect directly the reduction current of CAP on OPDA/GCE.Self-polymerization time of DA,electrochemical response of CAP on OPDA/GCE,electrochemical test condition,and influence and removal methods of dissolved oxygen,etc. were investigated and optimized.The results indicated that the reduction peak current of CAP on OPDA/GCE showed a good linear relationship in the contentraiton range of 3.0×10-6-1.1×10-3mol/L,and the detection limit was 7.8×10-7mol/L based on the signal to noise ratio of 3.The recoveries for milk and honey samples were in the ranges of 83.4%-94.1% and 91.5%-108.6%,respectively.The preparation method of the modified electrode is simple,inexpensive and convenient for batch preparation.The detection method of CAP is also simple and high-selective.
polydopamine;overoxidized;self-polymerization;modified electrode;chloramphenicol
2016-02-16;
2016-04-02
国家自然科学基金项目(21005091);广东省科技计划项目(2016A040403116);广东省高等学校优秀青年教师培养计划资助项目(Yq2013097)
白卫东,硕士,教授,研究方向:食品化学与食品安全,Tel:020-89003179,E-mail:whitebai2001@163.com
doi:10.3969/j.issn.1004-4957.2016.07.012
O657.1;O629.5
A
1004-4957(2016)07-0849-05

