miRNA在皮肤瘢痕组织中的表达研究
杨 平, 武晓莉, 周轶群, 朱晶晶, 郭 妤, 陈 亮, 杨清建, 卢勇舟, 贾传龙, 刘天一
实验研究
miRNA在皮肤瘢痕组织中的表达研究
杨 平, 武晓莉, 周轶群, 朱晶晶, 郭 妤, 陈 亮, 杨清建, 卢勇舟, 贾传龙, 刘天一
目的 研究正常皮肤组织、非增生性瘢痕和瘢痕疙瘩组织中miRNA的表达,筛选对瘢痕异常增生可能发挥作用的miRNA。方法 使用miRNA芯片检测正常皮肤组织(C)、非增生性瘢痕(T1)和瘢痕疙瘩(T2)中miRNA的表达谱,并对各组miRNA进行对比,筛选共同表达但表达有差异的miRNA部分,再选取其中表达差异较为明显的miRNA,对其进行Real-Time quantitative PCR验证实验。结果 共计测得miRNA 2539条,差异表达结果为:T1/C,上调2/下调17;T2/C,上调3/下调94;T2/T1,上调9/下调87。选取差异表达显著的miRNA,从C至T2,miR-100、miR-29a表达呈现下调趋势,而miR-181a、miR-198表达呈现上调趋势。结论 非增生性瘢痕和瘢痕疙瘩的miRNA表达均有别于正常皮肤组织,而miR-100、miR-29a、miR-181a、miR-198对瘢痕组织内成纤维细胞增殖和胶原合成过程中发挥作用的重要信号通路均有影响。瘢痕增生是多基因复合性表达作用的结果。
miRNA; 正常皮肤组织; 非增生性瘢痕; 瘢痕疙瘩; 瘢痕增生
MicroRNA(miRNA) 是一类小的、内源性的非编码RNAs,主要是通过转录后调控的方式实现对基因表达进行调控。自2013年1月至2015年12月,复旦大学附属华东医院整形美容科对临床获取的正常皮肤组织、非增生性瘢痕和瘢痕疙瘩进行miRNA芯片检测和验证,探讨在瘢痕形成过程中,miRNA表达情况以及miRNA对瘢痕异常增生的部分作用机制。
1 对象与方法
1.1 试剂和仪器设备
TRIzol Reagent、Amino AllylMessageAmpTMⅡ aRNA、Amplification Kit、Trizol (美国INVITROGEN公司),Mono Cy5 reactive Dye(美国GE公司),Whole Genome OneArray Microarray(美国PHALANX公司),RNA酶抑制剂(美国PROMAGE公司),反转录酶、10×RT缓冲液、2×Sybrgreen PCR mix(德国QIAGEN公司),2.5 mM dNTP 混合液(dATP,dGTP,dCTP和dTTP各2.5 mM),TBE、6×Loading buffer(上海捷兰生物技术有限公司);微量分光亮度計 #NanoDrop 2000(美国THERMO SCIENTIFIC公司),核酸扩增仪(PCR,美国ABI公司),水平电泳设备(mini agarose gel electrophoresis system,美国ADVANCE CO公司)核酸真空浓缩干燥机(speed vacuum,德国EPPENDORF公司),Hybridization incubator (rotor+orbital shaking,美国COCONO公司),Oven (orbital shaker,中国台湾YIH DER公司),Agilent Microarray Scanner(美国AGILENT公司)。
1.2 取材及分组处理
实验标本均来自华东医院整形美容科患者,男女不限,年龄15~22岁。非增生性瘢痕和瘢痕疙瘩病程均超过1年,未进行任何治疗。正常皮肤组织取自皮瓣修整患者,男女不限,年龄26~32岁。手术切取标本后,去除表皮和皮下脂肪,立即置于液氮内送达实验室。将其分为正常皮肤组(C),非增生性瘢痕组(T1),瘢痕疙瘩组(T2),每组3例。均取得患者知情同意。
2 实验方法
2.1 芯片检测实验
miRNA提取和芯片检测。
2.1.1 总RNA抽提 取少许样品组织,用Trizol-氯仿法提取1 μl总RNA测OD260,并定量。
2.1.2 微小核酸分离纯化 将总核酸使用Nanosep 100 k (Pall)和Vivaspin 500 3 k (sartorius stedim biotech)离心,保留上层溶液即为分离纯化之微小核酸溶液,进行OD测定,置于冰上,等待荧光标定步骤。
2.1.3 ΜLS 荧光标定 将ΜLS试剂按标准操作程序与微小核酸溶液混合,离心。将溶液进行OD测定荧光吸收光谱,计算荧光标定值,避光置于冰上,等待杂交反应。
2.1.4 前杂交处理 ⑴将芯片取出,置入100%乙醇,静置20 s。⑵取出置入E-box,以纯水清洗,上下摇晃3 min后,置入已预热好之前杂交溶液于42℃烘箱静置2 h。⑶取出置入已装入新鲜纯水之E-box清洗,上下摇晃3 min后,取出芯片离心甩干,避光备用。
2.1.5 miRNA OneArrayTM杂交反应 ⑴微小RNA芯片完成前杂交反应后,与OneArray Double Chamber黏合,并翻转确认Chamber胶框完全密合。⑵将以标定之荧光小核酸样品与 2×miRNA OneArray Hyb Buffer混合并加纯水将总体积制备为 90 μl。⑶样品进行PCR加热 95℃,2 min后,以微量吸量管加入一端样品注入口,注入后将注入口以圆形黏性贴将Chamber两端封口。⑷将以注入样品之芯片置于以预热之37℃ 杂交烘箱中,2 r/min垂直转速, 16 h。并预热清洗溶液。⑸16 h后,将芯片取出,并于预热37℃清洗溶液 (buffer Ⅰ) 拆除Chamber,进行清洗。buffer Ⅰ 37℃, 5 min,80 r/min;buffer Ⅱ 37℃, 5 min, 80 r/min;再进行1次 buffer Ⅱ 5 min,25℃后,以 buffer Ⅲ,室温清洗5 min,最后离心,将芯片甩干。避光,等待扫描。
2.1.6 影像扫描与数据选取 miRNA OneArray®芯片使用的扫描仪为Agilent Microarray Scanner。由适当的荧光强度与分辨率(10 μm) 获得最佳影像。利用GenePixTM4进行影像数据而选取,获得初级数据格式gpr档案,即将影像转成数值,进行后续数据分析。
2.2 Real Time quantitive PCR 检测实验
2.2.1 cDNA合成 总RNA抽提步骤同上。⑴primer合成列表,见表1。⑵操作方法:按标准RT反应程序添加试剂并在PCR仪进行RT反应,反应结束后,将其放在冰上待用。
2.2.2 实时定量PCR 所有cDNA样品分别配制Realtime PCR反应体系。按照标准程序进行体系配置,于Realtime PCR仪上进行PCR反应。
2.2.3 结果与计算 对各样品的目的miRNA和内参(U6)分别进行Realtime PCR反应。数据采用2-△△ CT法进行分析。
3 结果
3.1 芯片检测结果
芯片原始图像:正常皮肤真皮组织、非增生性瘢痕、瘢痕疙瘩,共检测到miRNA 2539条(图1);柱状图显示所有检出的基因探针于分组比对中,信号差异的分布。柱状图的横坐标以 log2 表示差异倍数,纵坐标则代表探针数目(图2);火山图显示分组比对中差异基因探针的分布。横坐标以log2表示差异倍数,纵坐标以负 log (P值)代表差异的显著性。红色/绿色虚线分别代表P值及倍数筛选的阈值。图中每一个点为一个检出的基因探针, 差异探针标示为蓝色点(图3)。图4中每一列为1张芯片,每一列为1个基因探针。红绿色阶标示了探针信号上调/下调的变化幅度。线的长度则代表距离指标,同簇样本或基因的相似性高 (模式相近)。差异基因的筛选条件设定为 log2 |Fold change|≥0.8,且P<0.05,见表2。

表1 引物碱基序列
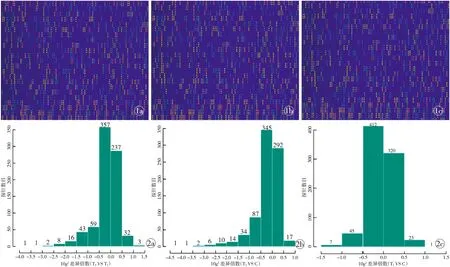
图1 芯片图像 a.正常皮肤真皮组织 b.非增生性瘢痕 c.瘢痕疙瘩 图2 基因探针分组比对中信号差异的分布 a.T2/T1b.T2/C c.T1/C
Fig 1 Microarray image. a. normal skin dermal tissue. b. Non-hypertrophic scar. c. Keloid. Fig 2 The different signal distribution of gene probe in group comparison. a. T2/T1. b. T2/C. c. T1/C.
3.2RealTime-PCR检测结果分析
根据差异表达水平筛选和文献报道,选择miR-100、miR-29a、miR-181a、miR-198进行RT-PCR检测

表2 miRNA各组表达差异对比
分析。结果显示,从C至T2,miR-100、miR-29a表达呈现下调趋势,而miR-181a、miR-198表达呈现上调趋势(图5)。

图3 火山图示分组比对中差异基因探针的分布 a.T2/T1b.T2/C c.T1/C 图4 聚类分析图 图5 各组特异miRNA相对表达量 a.mir-29a相对表达量 b.mir-100相对表达量 c.mir-181a相对表达量 d.mir-198相对表达量
Fig 3 Distribution of differentially expressed genes in the group comparison of the volcano maps. a.T2/T1. b.T2/C. c.T1/C. Fig 4 Image of clustering analysis. Fig 5 Relative expression of specific miRNA in each group. a.miR-29a relative expression. b.miR-100 relative expression. c.miR-181a relative expression. d.miR-198 relative expression.
4 讨论
病理性瘢痕是皮肤损伤后发生的异常瘢痕愈合,表现为增生性瘢痕或瘢痕疙瘩。通常是真皮损伤后组织异常修复的结果,组织学上以成纤维细胞的过度增生和细胞外基质的过度聚集为特征。病理性瘢痕的发病机制和防治一直是长期困扰整形外科的难题之一。由于瘢痕增生的发病机制复杂,影响因素多,至今尚未完全明确,因而缺乏针对性的治疗,目前常规的治疗方法包括手术切除、类固醇激素、抗代谢药、免疫抑制剂的治疗以及放射疗法等。治疗效果往往不够理想,复发率极高[1]。
当前对于增生性瘢痕的发病机制研究取得了一些进展,研究已经深入基因和细胞因子水平,部分瘢痕疙瘩易感基因位点已经确定,并且证实部分生长因子如端粒酶逆转录酶和caspase-3[2]以及信号通路,如TGF-β-smads信号途径[3]、磷脂酰肌醇3激酶/PKB信号通路[4]等均参与了瘢痕增生的过程。近期的研究表明,在其他人体组织中,成纤维细胞增殖,分化和细胞外基质合成过程中发挥重要作用的信号通路,都有miRNA的调节作用出现。有研究证实,在体外培养的IMR-90细胞系中,施加TGF-β可下调miR-29的表达,继发效应为磷脂酰肌醇3-激酶和蛋白激酶B的磷酸化水平上调;miR-29还通过抑制磷脂酰肌醇3-激酶-蛋白激酶B信号途径的磷酸化,下调Ⅰ型胶原蛋白A链(细胞外基质成分)的表达。该途径对于IMR-90细胞的增殖及肺纤维化过程发挥重要作用[5]。在对肺成纤维细胞中Wnt/β连环蛋白信号通路的研究结果显示,miR-29a起到了类似的作用[6]。Suh等[7]研究发现,miR-29a的靶基因编码胶原和细胞外基质蛋白成分,并且与细胞进入增殖周期相关。在对胶质细胞瘤患者病变组织与正常组织样品中的研究发现,成纤维细胞因子受体3 (fibroblast growth factor receptor 3, FGFR3) 有非常高的表达,与之对应的是miR-100的表达水平非常低,二者表达水平呈负性相关[8]。芯片和生物信息学分析表明,miR-100结合在FGFR3 mRNA的3′-UTR 端,从而抑制其翻译。Bi等[9]研究显示,在骨肉瘤(osteosarcoma,OS)中,癌细胞内过度表达的miR-100降低了FGFR3蛋白表达水平,抑制了肿瘤细胞生长,分化和化疗敏感性,而抑制miR-100表达起到了相反的结果。miR-181家族成分被证实常常过度表达于人类肿瘤细胞[10]。有研究表明,在乳腺癌细胞中,miR-181表达水平受TGFβ调节,并以此调节细胞的侵蚀性生长和迁移,这一生长模式与瘢痕疙瘩类似[11]。瞿连喜等发现在前列腺癌细胞内miR-181的过度表达促进了癌细胞的增殖。结合以上结论,我们分析,miR-181的表达水平与肿瘤细胞增殖呈现正性相关,与我们的实验结果一致,说明瘢痕组织内的miR-181表达水平升高可能是引起瘢痕细胞增生的因素之一。miR-198被发现其高表达与细胞增殖的抑制效应有关[12]。Wang等[13]研究发现,在结直肠癌癌细胞系中,过度表达的miR-198降低了其靶基因岩藻糖基转移酶(fucosyl transferase 8, FUT8)的表达,同时细胞的增殖,转移和侵袭性生长均受到抑制。而作用机制同样是miR-198结合于FUT8的mRNA3′-UTR端,从而抑制其翻译,进而下调其表达水平。 Wang等[14]研究发现,miR-198抑制周期素D2(Cyclin D2, CCND2)基因翻译。CCND2表达产物是细胞周期推进的重要调节因素之一,miR-198过度表达,抑制CCND2翻译蛋白水平,导致细胞周期停滞于G1期,增殖受阻。这一结论与我们的实验结果相反。我们分析,就瘢痕增殖而言,是一个多因子,多环节参与的过程,在瘢痕疙瘩的形成过程中,miR-198并未发挥主导作用。
我们的研究证实了从正常皮肤组织、非增生性瘢痕至瘢痕疙瘩,miRNA 的表达谱存在明显差异,且差异表达明显的部分miRNA相对表达量呈线性改变,生物信息学及文献报道证实这些miRNA 对机体其他组织成纤维的增殖和细胞外基质合成有明显调节作用,说明miRNA对瘢痕增生的作用是可能是多基因综合影响的结果。而这些作用的模式,诸如靶基因的预测和验证实验尚需进一步研究。
[1] 杨 琳, 王 伟, 刘 玲. 得宝松注射联合放射疗法治疗颌面部瘢痕疙瘩的效果观察[J]. 中国美容整形外科杂志, 2015,26(11):696-697.
[2] 于冬梅, 丁 爽, 尚 勇, 等. 瘢痕疙瘩中人端粒酶逆转录酶和caspase-3基因的表达及意义[J]. 中国美容整形外科杂志, 2015,26(3):132-134.
[3] 张 奇, 王 琛. microRNA-21调控TGF-β通路促进增生性瘢痕形成的机制研究[J]. 组织工程与重建外科杂志, 2014,(6):318-323.
[4] 祝立丽, 肖明明, 表贞淑, 等. 病理性瘢痕中整合素链激酶、磷脂酰肌醇3激酶蛋白和mRNA表达及其临床意义[J]. 中国美容整形外科杂志, 2014,25(4):252-254.
[5] Yang T, Liang Y, Lin QL, et al. miR-29 mediates TGF β1-induced extracellular matrix synthesis through activation of PI3K-AKT pathway in human lung fibroblasts[J]. J Cell Biochem, 2013,114(6):1336-1342.
[6] Wang Y, Liu J, Chen J, et al. miR-29 mediates TGFβ1-induced extracellular matrix synthesis through activation of Wnt/β-catenin pathway in human pulmonary fibroblasts[J]. Technol Health Care, 2015,23 Suppl 1:119-125.
[7] Suh EJ, Remillard MY, Legesse-Miller A, et al. A microRNA network regulates proliferative timing and extracellμlar matrix synthesis during cellular quiescence in fibroblasts[J]. Genome Biol, 2012,13(12):R121.
[8] Luan Y, Zhang S, Zuo L, et al. Overexpression of miR-100 inhibits cell proliferation, migration, and chemosensitivity in human glioblastoma through FGFR3[J]. Onco Targets Ther, 2015,8:3391-3400.
[9] Bi Y, Jing Y, Cao Y. Overexpression of miR-100 inhibits growth of osteosarcoma through FGFR3[J]. Tumour Biol, 2015,36(11):8405-8411.
[10] Lee SH, Lee CR, Rigas NK, et al. Human papillomavirus 16 (HPV16) enhances tumor growth and cancer stemness of HPV-negative oral/oropharyngeal squamous cell carcinoma cells via miR-181 regulation[J]. Papillomavirus Res, 2015,1:116-125.
[11] Neel JC, Lebrun JJ. Activin and TGFβ regulate expression of the microRNA-181 family to promote cell migration and invasion in breast cancer cells[J]. Cell Signal, 2013,25(7):1556-1566.
[12] Yang J, Zhao H, Xin Y, et al. MicroRNA-198 inhibits proliferation and induces apoptosis of lung cancer cells via targeting FGFR1[J]. J Cell Biochem, 2014,115(5):987-995.
[13] Wang M, Wang J, Kong X, et al. miR-198 represses tumor growth and metastasis in colorectal cancer by targeting fucosyl transferase 8[J]. Sci Rep, 2014,4:6145.
[14] Wang J, Dan G, Shangguan T, et al. miR-198 represses the proliferation of HaCaT cells by targeting cyclin D2[J]. Int J Mol Sci, 2015,16(8):17018-17028.
Expression of miRNA in skin scar tissue
YANGPing,WUXiao-li,ZHOUYi-qun,ZHUJing-jing,GUOYu,CHENLiang,YANGQing-jian,LUYong-zhou,JIAChuan-long,LIUTian-yi.
(DepartmentofPlasticSurgery,HuadongHospitalofShanghaiFudanUniversity,Shanghai200040,China)
LIUTian-yi,Email:yangwesternblot@126.com
Objective To research the expression of several kinds of miRNA in normal skin, non-hypertrophic scar and keloid, and try to find some special kinds of miRNA that express differently in the three kinds of tissues. Methods miRNA array was used to detect the expression of miRNA in normal skin tissue (C), non-hypertrophic scar (T1) and keloid (T2), and the miRNAs of each group were compared to screen the miRNA which were co-expressed but with differentiated expression. Furthermore, the miRNA with one of the more obvious differences in expression was chosen. Then quantitative Real-Time PCR was used to verify the remarkable expression of miRNA. Results In total, 2539 miRNA were detected, the differential expression results: T1/C, up-regulation 2/down-regulation 17;T2/C, up 3/ down 94;T2/T1, up 9/ down 87. From C, T1to T2, miR29a expression showed a downward trend, and miR181a, and miR198 expression showed an upward trend. Conclusion The expression of miRNA in non-hypertrophic scar and keloid was different from that in normal skin tissue. The miR29a,miR181a and miR198 play an important role in the signal pathways that affect the proliferation and collagen synthesis of fibroblasts in hypertrophic scar tissue. Scar hyperplasia is the result of the expression of multiple genes.
miRNA; Normal skin tissue; Non-hypertrophic scar; Keloid; Scar hyperplasia
上海市卫计委面上项目科研基金(20124302);华东医院骨干人才培养基金(HDGG2014009) 作者单位:200040 上海,复旦大学附属华东医院 整形美容科(杨 平, 周轶群, 朱晶晶, 郭 妤, 陈 亮, 杨清建, 卢勇舟, 贾传龙, 刘天一);上海交通大学医学院附属第九人民医院 整复外科(武晓莉) 第一作者:杨 平(1978-),男,山东潍坊人,主治医师,硕士. 通信作者:刘天一,200040,复旦大学附属华东医院 整形美容科,电子信箱:yangwesternblot@126.com
10.3969/j.issn.1673-7040.2016.07.020
R619.6
A
1673-7040(2016)07-0443-05
2016-03-11)

