SUDOSCAN仪筛查2型糖尿病患者肾脏病变应用研究
黄 雪,赵德明,史琳涛,沈白玉,杨月莹,刘彦君*
(1.北京大学解放军第306医院教学医院内分泌科,北京 100101;2.中国人民解放军第306医院内分泌科,北京 100101)
SUDOSCAN仪筛查2型糖尿病患者肾脏病变应用研究
黄雪1,赵德明2,史琳涛2,沈白玉1,杨月莹2,刘彦君2*
(1.北京大学解放军第306医院教学医院内分泌科,北京 100101;2.中国人民解放军第306医院内分泌科,北京 100101)
[摘要]目的探讨SUDOSCAN仪评价2型糖尿病(type 2 diabetes mellitus,T2DM)患者肾脏病变的可行性与准确性。方法本研究共纳入297例T2DM患者,根据肾小球滤过率(estimated glomerular filtration rate,eGFR)以及尿白蛋白肌酐比(urinary albumin to creatinine ratio,UACR)分为糖尿病肾功能正常组(对照组)和糖尿病肾病(diabetic kidney disease,DKD)组。结果DKD组患者血肌酐(serum creatinine,SCr)、血尿素氮(blood urea nitrogen,BUN)、UACR高于对照组,eGFR低于对照组(P<0.05)。2组间总胆固醇(total cholesterol,TC)、三酰甘油(triglyceride,TG)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)以及高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)差异均无统计学意义(P>0.05)。DKD组双手电化学汗液电导率平均值(hand electrochemical skin conductance,HESC)、双足电化学汗液电导率平均值(foot electrochemical skin conductance,FESC)以及糖尿病肾脏疾病修正指数(SUDOSCAN-modification of diabetic renal disease,SUDOSCAN-MDRD)均低于对照组,差异有统计学意义(P<0.05)。年龄、病期、糖化血红蛋白(hemoglobin A1c,HbA1c)与 HESC呈负相关,eGFR与HESC呈正相关(P<0.05)。年龄、病期、收缩压(systolic blood pressure,SBP)、HbA1c与FESC呈负相关,eGFR与FESC呈正相关(P<0.05)。年龄、病期、SBP、BUN与SUDOSCAN-MDRD呈负相关,与eGFR呈正相关(P<0.05)。以SUDOSCAN-MDRD预测肾脏损伤明显优于其他指标,其预测DKD的最佳切点为57.50 uSi,ROC曲线下面积为67.7%,敏感度为60.0%,特异度为75.0%,准确度为68.7%,阳性预测值为63.6%,阴性预测值为72.1%。结论SUDOSCAN检测指标与肾功能损伤显著相关,可辅助用于T2DM患者DKD的早期风险筛查。
[关键词]糖尿病,2型;糖尿病肾病;肾小球滤过率
doi:10.3969/j.issn.1007-3205.2016.05.004
糖尿病肾脏病变(diabetic kidney disease,DKD)是糖尿病主要的微血管并发症之一,也是导致终末期肾病(end stage renal disease,ESRD)的主要原因[1-3]。随着全球范围内的糖尿病患者的不断增加,DKD的患病人数也在不断增加,DKD在2型糖尿病(type 2 diabetes mellitus,T2DM)中的患病率为20%~40%[4-5]。关于DKD的治疗,目前仅能依靠改善血糖、血压水平及应用肾素-血管紧张素系统(renin-angiotensin system,RAS)抑制剂延缓DKD的进展和降低心血管并发症的发生率[6-8]。许多糖尿病患者在确诊DKD时,肾脏组织已发生了不可逆的损伤。所以,DKD的防治应该从传统的诊断治疗转向早期筛查,并及时给予干预。当前筛查DKD的主要手段是依据估计的肾小球滤过率(estimated glomerular filtration rate,eGFR)以及尿白蛋白肌酐比(urinary albumin to creatinine ratio,UACR),因其需要抽血与留尿检测,耗时冗长,因此亟需一种简便易行、无创快捷、精确度高的筛查方法来早期识别DKD高风险人群。SUDOSCAN技术采用反向离子电渗和计时电流分析法检测泌汗神经功能,是目前最新的糖尿病并发症早期筛查创新型设备。目前国际上有关SUDOSCAN技术的研究十分有限,已有文献证实其能有效评估对称感觉神经病变和糖尿病心血管自主神经病变[9-11]。国内的研究偏向于应用SUDOSCAN仪评估糖尿病及代谢综合征发病风险的早期筛查[12],涉及糖尿病肾功能损伤相关研究报道较少。基于糖尿病神经病变和血管病变是相互影响、相互联系的,并且DKD是糖尿病导致的微血管并发症之一,本研究主要探讨SUDOSCAN仪检测指标与T2DM患者肾功能损伤之间的关联性,验证其筛查肾脏功能损伤的可行性与准确性。现报告如下。
1 资料与方法
1.1一般资料2014年8月1日—2015年8月1日,在中国人民解放军第306医院内分泌科就诊的T2DM患者297例。入选者均排除1型糖尿病、病毒性肝炎、白血病、痛风、恶性肿瘤及精神疾病。根据eGFR以及UACR分为:糖尿病肾功能正常组(对照组)172例,男性105例,女性67例,年龄22~75岁,平均(55.27±9.04)岁;DKD组125例,男性70例,女性55例,年龄36~87岁,平均(63.06±11.78)岁。2组性别、舒张压(diastolic blood pressure,DBP)、糖化血红蛋白(hemoglobin A1c,HbA1c)、病程、空腹血糖(fasting plasma glucose,FPG) 和餐后血糖(postprandial blood glucose,PPG)差异均无统计学意义(P>0.05);DKD组年龄、收缩压(systolic blood pressure,SBP)、脉压差大于对照组,体质量指数(body mass index,BMI)小于对照组,差异均有统计学意义(P<0.05)。见表1。
所有患者均签署知情同意书,自愿参加本研究。
表12组临床及生化指标比较


组别例数男性(例,%)年龄(岁)BMISBP(mmHg)DBP(mmHg)对照组 172105(61.0)55.27±9.0426.47±4.68126.83±14.7776.31±8.24DKD组12570(56.0)63.06±11.7824.93±3.69132.05±18.0477.14±10.40t/χ20.7626.1893.0492.7350.772P0.3830.0000.0030.0070.441组别例数脉压差(mmHg)HbA1c(%)病程[月,M(QR)]FPG(mmol/L)PPG(mmol/L)对照组 17250.52±13.437.98±1.8890(104)8.28±2.8312.28±4.61DKD组12554.90±15.788.05±2.05109(110)8.50±3.1911.96±5.54t/Z2.5760.3261.8210.6160.527P0.0100.7450.0690.5380.598
1.2研究方法患者在直立、免冠、脱鞋、穿单衣情况下测量体质量(kg)及身高(m),计算BMI= 体质量(kg)/身高2(m2)。测血压:休息10 min以上,使用台式血压计测量右侧肱动脉血压,间隔5 min再测,取2次平均值。应用日立7600全自动生化分析仪检测血尿酸(uric acid,UA)、血肌酐(serum creatinine,SCr)、血尿素氮(blood urea nitrogen,BUN)、血总胆固醇(total cholesterol,TC)、血三酰甘油(triglyceride,TG)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)及低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C),高效液相色谱法测定HbA1c。应用SUDOSCAN仪进行检测并记录左手电化学汗液电导率(left hand electrochemical skin conductance,LHESC)、右手电化学汗液电导率(right hand electrochemical skin conductance,RHESC)、左足电化学汗液电导率(left foot electrochemical skin conductance,LFESC)、右足电化学汗液电导率(right foot electrochemical skin conductance,RFESC)、糖尿病肾脏疾病修正指数(SUDOSCAN-modification of diabetic renal disease,SUDOSCAN-MDRD)等测量值。计算双手电化学汗液电导率平均值(hand electrochemical skin conductance,HESC) =1/2×(LHESC+RHESC),双足电化学汗液电导率平均值(foot electrochemical skin conductance,FESC)=1/2×(LFESC + RFESC)。
1.3诊断标准
1.3.1糖尿病诊断标准符合1999年WHO 糖尿病诊断标准[13]:典型症状(多饮、多尿、多食和不明原因的体质量下降)加随机血糖≥11.1 mmol/L,或FPG≥7.0 mmol/L,或75g葡萄糖负荷后2 h血糖≥11.1 mmol/L。需重复1次确认,诊断才能成立。 采用Cockcroft-Gault公式计算eGFR[14],男性:eGFR(mL·min-1·1.73 m-2)=(140-年龄)×体质量(kg)×1.23/血清肌酐(μmol/L);女性:eGFR(mL·min-1·1.73 m-2)=0.85×相应的男性计算值。
1.3.2肾功能诊断指标和分期美国糖尿病学会(American Diabetes Association,ADA)推荐筛查和诊断微量白蛋白尿采用测定即时尿标本的UACR,UACR<30 μg/mg、30~299 μg/mg和≥300 μg/mg分别为正常、微量白蛋白尿和大量白蛋白尿。美国肾脏病基金会肾脏病生存质量指导专家组对CKD分期的建议[15]:CKD 1期,eGFR≥90 mL·min-1·1.73 m-2;CKD 2期,eGFR(60~89)mL·min-1·1.73 m-2;CKD 3期,eGFR(30~59) mL·min-1·1.73 m-2;CKD 4期,eGFR(15~29) mL·min-1·1.73 m-2;CKD 5期(ESRD),eGFR<15 mL·min-1·1.73 m-2。本研究将UACR<30 μg/mg且eGFR>90 mL·min-1·1.73 m-2定义为非糖尿病肾病对照组,UACR>30 μg/mg或eGFR<60 mL·min-1·1.73 m-2定义为DKD组。

2 结 果
2.12组肾功能指标比较DKD组SCr、BUN、UACR高于对照组,eGFR低于对照组(P<0.05),2组间UA差异无统计学意义(P>0.05),见表2。
表22组肾功能指标比较

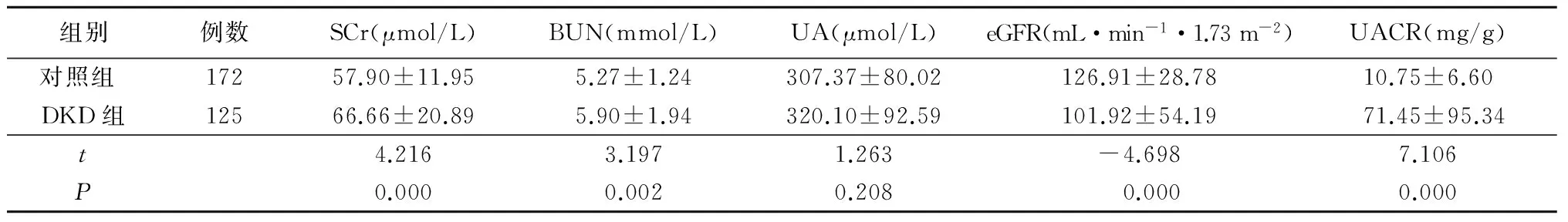
组别例数SCr(μmol/L)BUN(mmol/L)UA(μmol/L)eGFR(mL·min-1·1.73m-2)UACR(mg/g)对照组 17257.90±11.955.27±1.24307.37±80.02126.91±28.7810.75±6.60DKD组12566.66±20.895.90±1.94320.10±92.59101.92±54.1971.45±95.34t4.2163.1971.263-4.6987.106P0.0000.0020.2080.0000.000
2.22组血脂水平比较2组间TC、TG、LDL-C以及HDL-C差异均无统计学意义(P>0.05),见表3。
表32组血脂水平比较
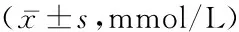
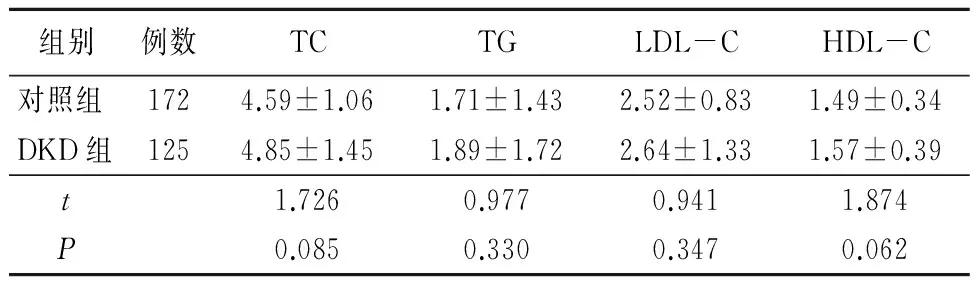
组别例数TCTGLDL-CHDL-C对照组1724.59±1.061.71±1.432.52±0.831.49±0.34DKD组1254.85±1.451.89±1.722.64±1.331.57±0.39t1.7260.9770.9411.874P0.0850.3300.3470.062
2.32组SUDOSCAN仪检测指标比较DKD组HESC、FESC以及SUDOSCAN-MDRD均低于对照组,差异有统计学意义(P<0.05),见表4。
2.4Spearman相关分析年龄、病期、HbA1c与 HESC呈负相关,eGFR与HESC呈正相关(均P<0.05),SBP、SCr、BUN与HESC无相关(P>0.05);年龄、病期、SBP、HbA1c与FESC呈负相关,eGFR与FESC呈正相关(P<0.05),SCr、BUN与 FESC无相关(P>0.05);年龄、病期、SBP、BUN与SUDOSCAN-MDRD呈负相关,eGFR与SUDOSCAN-MDRD呈正相关(P<0.05),HbA1c、SCr与SUDOSCAN-MDRD无相关(P>0.05)。见表5。
表42组SUDOSCAN仪检测指标比较

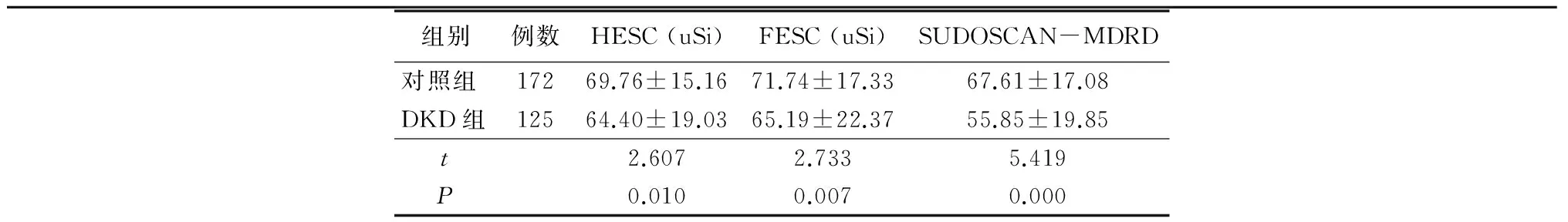
组别例数HESC(uSi)FESC(uSi)SUDOSCAN-MDRD对照组17269.76±15.1671.74±17.3367.61±17.08DKD组12564.40±19.0365.19±22.3755.85±19.85t2.6072.7335.419P0.0100.0070.000
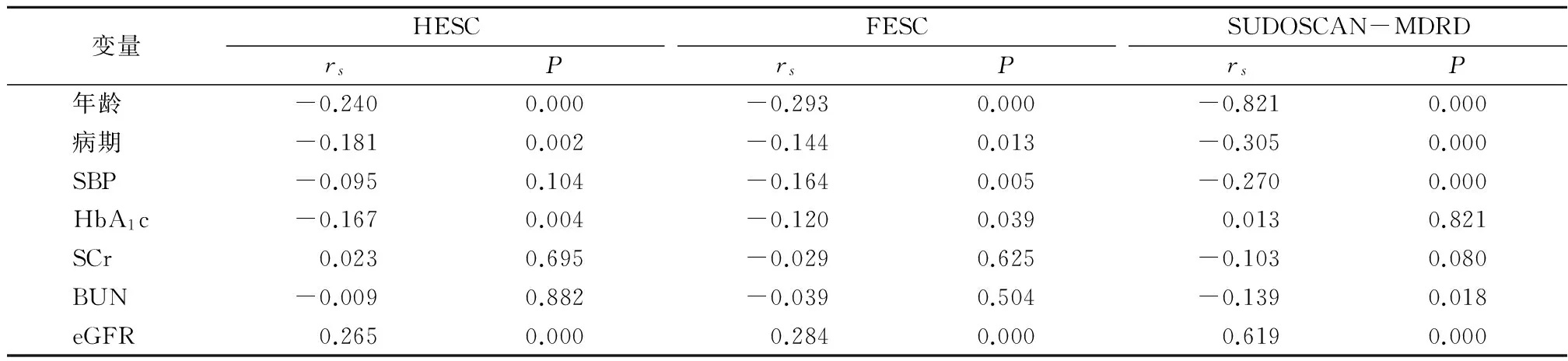
表5 HESC、FESC、SUDOSCAN-MDRD与各变量的Spearman 相关分析
2.5SUDOSCAN不同指标对DKD的筛查价值本研究以eGFR及UACR作为诊断DKD的标准,以SODUSCAN检测指标绘制ROC曲线(图1),其曲线下面积(area under curve,AUC)分别为58.2%、57.9%和67.7%,相对应的界值分别为71.75 uSi、64.25 uSi和57.50 uSi。其中,以SUDOSCAN-MDRD预测肾脏损伤明显优于其他指标,其敏感度为60.0%,特异度为75.0%,准确度为68.7%,阳性预测值为63.6%,阴性预测值为72.1%。当SUDOSCAN-MDRD低于57.50 uSi时,肾脏病变风险较大。见表6。
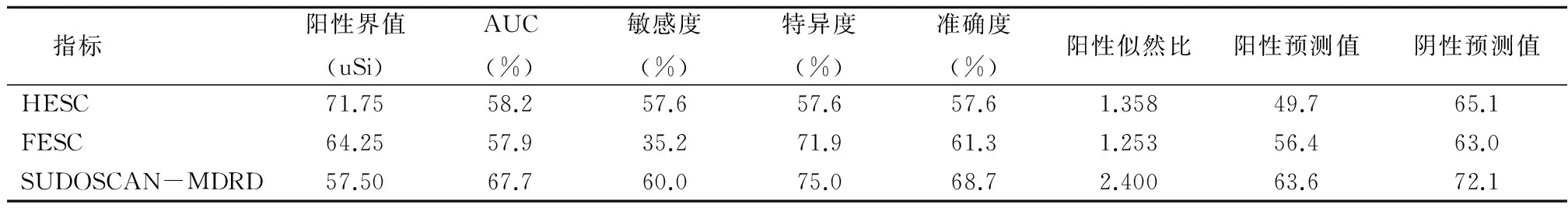
表6 SUDOSCAN不同指标对DKD的筛查价值
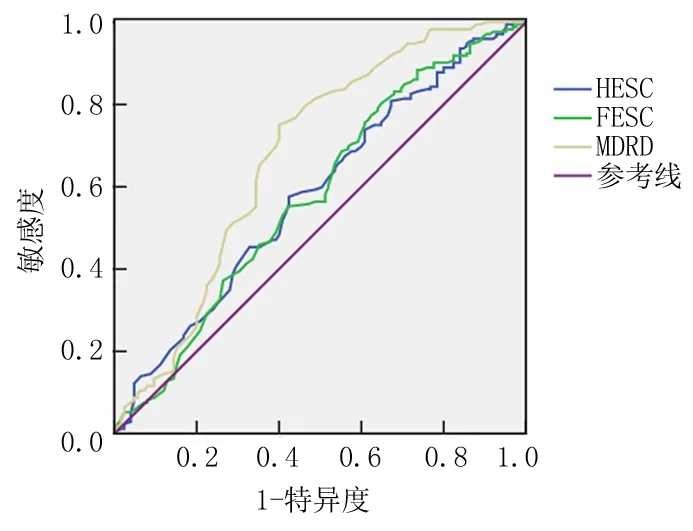
图1SUDOSCAN不同指标筛查DKD的ROC曲线
Figure 1ROC curves of different SUDOSCAN indexes in screening DKD
3 讨 论
DKD是糖尿病全身微血管病变在肾脏的表现,鉴于DKD发病的隐匿性,早期筛查DKD高危人群,及早实行干预治疗尤为关键,不但可以延缓病情的进一步发展,更重要的是可以使DKD早期的肾脏损害仍处在一个可以逆转的阶段。
目前,国内外评价肾功能最佳指标为eGFR,它是病情判断、疗效观察、决策是否进入血液透析以及肾移植术后有无并发症等的客观指标。当前临床上常以UACR作为临床DKD的早期诊断及防治的标准。DKD患者在早期是没有任何临床表现的,尿常规测定尿蛋白常为阴性,SCr及BUN都在正常范围,但是这些并不能说明肾脏没有受到损伤,此时测定UACR时往往是增高的,可能原因为机体长时间处在一个高糖和胰岛素水平低下的环境中对肾脏微血管造成一定程度的损伤,导致尿中微量白蛋白的漏出,排除的尿肌酐减少,使UACR升高。因UACR受很多因素的干扰,如运动、血压、营养状况以及尿路感染等,所以在诊断DKD中单独采用一个检测指标存在一定片面性。因此,本研究联合eGFR与UACR诊断DKD,可能在一定程度上避免了误诊,也在一定程度上提升了DKD患者的检出率。
SUDOSCAN应用低直流电压诱发的反向离子电渗技术测量汗腺电化学皮肤电导率。检测过程中对手足的皮肤施加逐渐递增的直流低电压(<4 V);电流穿过不锈钢传感器,吸引来自汗腺(手掌和足底)中的氯离子,从而形成氯离子电流;低电压下,皮肤的角质层是绝缘的电容器,因此只有汗腺管有氯离子转运,这确保了检测到的只是泌汗神经控制下的汗腺释放氯离子的能力。泌汗神经是一种交感神经,是人体最小的自主神经纤维,因此检测泌汗神经功能可用以评价末梢小神经的正常与否以及损伤程度,从而诊断糖尿病周围神经病变(diabetic peripheral neuropathy,DPN)。DPN与DKD均为常见的糖尿病微血管并发症,其发病机制复杂,血管因素和代谢因素在其发生发展中起着重要作用。已有众多研究表明长期的高血糖与血脂异常等代谢紊乱导致的氧化应激是DPN发生的重要机制[16]。大量活性氧自由基的产生引起神经内膜缺血缺氧、神经外膜血管损伤,微血管血流减少,血压黏滞度增加,血液性状发生改变,导致了DPN的发生。氧化应激水平的增强不仅参与了DPN的发生,也与血管病变的发生明显相关。氧自由基产生可以损伤血管内皮细胞,进一步可使动脉内膜及平滑肌受损,肾小球基底膜增厚及系膜基质增宽,终致肾小球硬化、纤维化,肾小球内出现高压、高灌注及高滤过等情况,促使DKD的发生发展[2]。临床上,DPN患者常常合并有DKD,它们的发生在发病机制上具有一致性,在发生发展上具有平行性[17]。因此,SUDOSCAN也可能反映DKD的发病风险。
糖尿病患病时间的长短反映了糖尿病患者在多种危险因素下暴露的程度。病程越长,糖尿病并发症的发病风险越高。Ito等[18]证实较长的糖尿病病程是DKD发生的独立危险因素(OR1.08,95%CI1.05~1.12,P<0.01)。因此,要注意DKD的筛查,做到早期发现和治疗。高血压、高血糖与高血脂是DKD的独立危险因素[19]。长期的高血压会导致肾入球动脉的玻璃样变性,管壁增厚,管腔狭窄,致使肾小球缺血、纤维化,相应的肾小管因缺血而萎缩、消失,病变相对较轻的肾小球代偿性肥大,肾小管代偿性扩张;长期的高血糖导致血液黏滞度增加,血流缓慢,血小板聚集性增加,同时,血红蛋白糖基化,红细胞携氧和释氧能力下降,组织缺血、缺氧,微血管损伤,从而引起DKD。Ozaki等[20]2011年报道SUDOSCAN-MDRD与eGFR呈显著正相关(r=0.67,P<0.05)。本研究结果显示,随着年龄、病程的延长,SBP、HbA1c水平的增加,HESC、FESC与SUDOSCAN-MDRD越低,更容易患DKD,SUDOSCAN-MDRD与eGFR呈显著正相关(rs=0.619,P<0.05)。与之前研究结果一致。
本研究未发现HESC、FESC、SUDOSCAN-MDRD与SCr有相关性,可能原因为肉类食物中含有肌酐以及剧烈肌肉运动会产生额外肌酐,其影响因素较多。同时也未发现血脂与DKD的关系,可能是因为本研究纳入的人群为T2DM,大部分有脂代谢紊乱的状况,服用调脂药物会对结果产生一定影响。因此,对于DKD的预防和治疗,控制血压、血糖、血脂都是关键。
在本研究当中,应用SUDOSCAN-MDRD预测DKD的最佳切点为57.50 uSi,其敏感度为60.0%,特异度为75.0%,阳性似然比为2.4,即SUDOSCAN-MDRD低于57.50 uSi的患者患DKD的概率是那些高于57.50 uSi的患者的2.4倍。Luk等[21]应用SUDOSCAN评估筛查DKD的有效性,选取163例DKD患者,2 670例非DKD患者作为对照组,其研究结果为SUDOSCAN-MDRD预测DKD的最佳切点为53 uSi,其敏感度为77%,特异度为63%,阳性似然比为2.1。其敏感度较高可能是由于样本量相对较大。另外,种族、入选标准、试验设计的不同也会导致研究结果的差异,但总体上都证实了SUDOSCAN仪评估DKD的有效性。
本研究的不足:首先,本研究为横断面的病例观察研究,仅是一观察性研究,结论推断受研究方法的限制;其次,本研究只为单中心研究,样本量较局限,还需要进行多中心大样本研究来进一步验证;再者,研究中选用的参考标准为一次性生化指标检验所得,可能会受到一些混杂因素影响,参考指标并非“金标准”,因此需要临床“金标准”(核素显影等)以及长时间的随访来进一步验证其准确性。为此我们计划下一步开展多中心的前瞻性研究,进一步评估SUDOSCAN筛查DKD风险的准确性。
综上所述,SUDOSCAN技术是一项简便快捷、无创筛查外周自主神经功能的新方法,鉴于其检测的泌汗神经功能与肾功能损伤指标之间的关联性,提示SUDOSCAN可辅助用于DKD的早期风险筛查。
[参考文献]
[1]Zanatta CM,Crispim D,Sortica DA,et al. Endothelin-1 gene polymorphisms and diabetic kidney disease in patients with type 2 diabetes mellitus[J]. Diabetol Metab Syndr,2015,7(1):1-8.
[2]Pourghasem M,Shafi H,Babazadeh Z. Histological changes of kidney in diabetic nephropathy[J]. Caspian J Intern Med,2015,6(3):120-127.
[3]白净洁,李英.尿微量白蛋白对早期糖尿病肾病诊断价值[J].临床荟萃,2015,30(6):715-718.
[4]Blaslov K,Bulum T,Duvnjak L. Pathophysiological factors in the development of diabetic nephropathy--new insights[J]. Acta Med Croatica,2014,68(2):135-140.
[5]张洁,谈力欣,王战建,等.发酵冬虫夏草菌粉治疗早期糖尿病肾病临床观察[J]. 河北医科大学学报,2015,36(8):881-883.
[6]Johnson SA,Spurney RF. Twenty years after ACEIs and ARBs:emerging treatment strategies for diabetic nephropathy[J]. AM J Physiol Renal Physiol,2015,309(10):F807-820.
[7]Toth-Manikowski S,Atta MG. Diabetic kidney disease:pathophysiology and therapeutic targets[J]. J Diabetes Res,2015,2015:697010.
[8]Martínez-Castelao A,Navarro-Gonzlez JF,Grriz JL,et al. The concept and the epidemiology of diabetic nephropathy have changed in recent years[J]. J Clin Med,2015,4(6):1207-1216.
[9]Yajnik CS,Kantikar V,Pande A,et al. Screening of cardiovascular autonomic neuropathy in patients with diabetes using non-invasive quick and simple assessment of sudomotor function[J]. Diabetes Metab,2013,39(2):126-131.
[10]Smith AG,Lessard M,Reyna S,et al. The diagnostic utility of Sudoscan for distal symmetric peripheral neuropathy[J]. J Diabetes Complicat,2014,28(4):511-516.
[11]Selvarajah D,Cash T,Davies J,et al. SUDOSCAN:A simple,rapid,and objective method with potential for screening for diabetic peripheral neuropathy[J]. PLoS One,2015,10(10):e0138224.
[12]Chen L,Chen X,Ding R,et al. Evaluation of EZSCAN as a screening tool for impaired glucose metabolism[J]. Diabetes Res Clin Pract,2013,100(2):210-214.
[13]Bennett PH. Impact of the new WHO classification and diagnostic criteria[J]. Diabetes Obes Metab,1999,1(Suppl 2):S1-6.
[14]Thompson-Martin Y,McCullough PA,Agrawal V. Impact of an educational program for advanced practice nurses on knowledge of kidney disease outcomes quality initiative guidelines[J]. Nephrol Nurs J,2015,42(5):455-460,496;quiz 461.
[15]National Kidney Foundation. K/DOQI clinical practice guidelines for chronic kidney disease:evaluation,classification,and stratification[J]. Am J Kidney Dis,2002,39(2 Suppl 1):S1-266.
[16]El Boghdady NA,Badr GA. Evaluation of oxidative stress markers and vascular risk factors in patients with diabetic peripheral neuropathy[J]. Cell Biochem Funct,2012,30(4):328-334.
[17]Tahrani AA,Dubb K,Raymond NT,et al. Cardiac autonomic neuropathy predicts renal function decline in patients with type 2 diabetes:a cohort study[J]. Diabetologia,2014,57(6):1249-1256.
[18]Ito H,Omoto T,Abe M,et al. Relationships between the duration of illness and the current status of diabetes in elderly patients with type 2 diabetes mellitus[J]. Geriatr Gerontol Int,2015[Epub ahead of print].
[19]Ahmad J. Management of diabetic nephropathy:recent progress and future perspective[J]. Diabetes Metab Syndr,2015,9(4):343-358.
[20]Ozaki R,Cheung KK,Wu E,et al. A new tool to detect kidney disease in Chinese type 2 diabetes patients:comparison of EZSCAN with standard screening methods[J]. Diabetes Technol Ther,2011,13(9):937-943.
[21]Luk AO,Fu WC,Li X,et al. The clinical utility of SUDOSCAN in chronic kidney disease in chinese patients with type 2 diabetes[J]. PLoS One,2015,10(8):e0134981.
(本文编辑:许卓文)
[收稿日期]2016-03-28;[修回日期]2016-04-06
[基金项目]:国家自然科学基金项目(21331001);国家科技重大专项子课题(2011ZX09307-001-08);北京市自然科学基金资助项目(7122109)
[作者简介]黄雪(1990-),女,河北廊坊人,北京大学解放军第306医院教学医院医学硕士研究生,从事内分泌与代谢疾病诊治研究。 *通讯作者:E-mail: yanjunl@yeah.net
[中图分类号]R587.1
[文献标志码]A
[文章编号]1007-3205(2016)05-0510-06
SUDOSCAN technology to screen kidney disease in patients with type 2 diabetes
HUANG Xue1, ZHAO De-ming2, SHI Lin-tao2,SHEN Bai-yu1, YANG Yue-ying2, LIU Yan-jun2*
(1.Department of Endocrinology, the 306th Hospital of PLA-Peking University Teaching Hospital, Beijing 100101, China;2.Department of Endocrinology, the 306th Hospital of PLA, Beijing 100101, China)
【Abstract】ObjectiveTo explore the feasibility and accuracy of SUDOSCAN in screening kidney disease in patients with type 2 diabetes mellitus(T2DM). MethodsTwo hundred and ninety-seven patients with T2DM were recruited in our study. The patients were divided into the normal kidney function group(control group) and diabetic kidney disease(DKD) group according to estimated glomerular filtration rate(eGFR) and urinary albumin to creatinine ratio(UACR). ResultsSerum creatinine(SCr), Blood urea nitrogen(BUN), UACR in DKD group were significantly higher than control group and eGFR was significantly lower than control group(P<0.05). There were no statistical differences in total cholesterol(TC), triglyceride(TG), low-density lipoprotein cholesterol(LDL-C) and high-density lipoprotein cholesterol(HDL-C) between the two groups(P>0.05). HESC, FESC and SUDOSCAN-MDRD in DKD group were significantly lower than control group(P<0.05). HESC was negatively correlated with age, disease duration and HbA1c, but was positively correlated with eGFR(P<0.05). FESC was negatively correlated with age, disease duration, systolic blood pressure(SBP) and HbA1c, but was positively correlated with eGFR(P<0.05). SUDOSCAN-MDRD was negatively correlated with age, disease duration, SBP and BUN, but was positively correlated with eGFR(P<0.05). Predicting kidney disease with SUDOSCAN-MDRD was better than other indicators. The best cut-off value of SUDOSCAN-MDRD was 57.50 uSi. The area under the curve for DKD was 67.7%. The sensitivity was 60.0%, the specificity was 75.0%, accuracy was 68.7%, positive predictive value was 63.6% and negative predictive value was 72.1%. ConclusionSUDOSCAN indexes were correlated with kidney damage and may be used for early risk screening for DKD among T2DM patients.
[Key words]diabetes mellitus, type 2; diabetic nephropathies; glomerular filtration rate

