运动时不同吸氧浓度对慢性阻塞性肺疾病大鼠活性氧类物质产生的影响①
刘衡,温宝伶,王晓龙
运动时不同吸氧浓度对慢性阻塞性肺疾病大鼠活性氧类物质产生的影响①
刘衡1,温宝伶2,王晓龙2
目的探讨运动时吸氧浓度差异性对慢性阻塞性肺疾病(COPD)活性氧类物质(ROS)产生的影响及可能机制。方法Wistar大鼠80只建立COPD模型,分为低氧(LO,n=20)、常氧(NO,n=20)、吸氧(IO,n=20)运动组及常氧非运动对照(C,n=20)组。前3组每天分别置氧体积浓度13.6%、21%、25%环境中跑台运动1 h,C组于氧浓度21%下置静止跑台上1 h。各组运动后1周(n= 10)、4周(n=10),流式细胞仪检测血中性粒细胞凋亡率及ROS含量,免疫组化检测肺组织还原型谷胱甘肽(GSH)表达,Western blotting检测骨骼肌细胞色素C氧化酶亚基Ⅳ(COXⅣ)蛋白表达。结果运动1周时,LO组、NO组ROS较C组升高(P<0.05),中性粒细胞凋亡率下降(P<0.05),GSH及COXⅣ与C组无显著性差异(P>0.05)。运动4周时,LO组ROS含量较C组升高(P<0.05),NO组和IO组ROS较C组减低(P<0.05);NO组和IO组GSH、COXⅣ含量较C组增加(P<0.05),LO组较C组减少(P<0.05)。结论非低氧状态COPD患者进行长期康复运动,可能通过促进中性粒细胞凋亡、增强抗氧化能力等抑制体内ROS产生。
慢性阻塞性肺疾病;运动;氧浓度;吸氧;活性氧类物质;大鼠
[本文著录格式]刘衡,温宝伶,王晓龙.运动时不同吸氧浓度对慢性阻塞性肺疾病大鼠活性氧类物质产生的影响[J].中国康复理论与实践,2016,22(7):784-788.
CITED AS:Liu H,Wen BL,Wang XL.Effect of oxygen concentration during exercise on reactive oxygen species production in chronic obstructive pulmonary disease rats[J].Zhongguo Kangfu Lilun Yu Shijian,2016,22(7):784-788.
活性氧类物质(reactive oxygen species,ROS)是慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)发生发展的重要因素[1-2],运动对COPD患者ROS产生的影响报道不一。有研究表明,运动可以诱导COPD患者血液、肺、骨骼肌等部位ROS产生[3],而ROS的产生进一步加重全身炎症反应及骨骼肌损害[4];而Garcia-Aymerich等研究发现,规律运动可通过抗氧化应激损伤延缓COPD患者肺功能下降[5]。
复习文献发现,影响上述结论的关键因素有两点:一是运动时间长短,二是运动时患者血氧浓度。运动对COPD的康复意义不言而喻[6],但如何运动才合理,值得探讨。本研究观察COPD大鼠模型在运动时吸入不同氧浓度,并运动不同时间,阐明运动时间及运动时吸氧浓度对COPD患者体内ROS生成的影响及可能机制。
1材料与方法
1.1材料
Wsitar大鼠80只,雌雄不拘,体质量(250±30)g:重庆医科大学动物实验中心。脂多糖:SIGMA公司。ROS检测试剂盒:美国细胞生物实验公司(OxiSelectTMROS)。荧光素标记的连接素V-碘化丙锭(annexinV-fluoresceinisothiocyanate/propidiumiodide,FITC-PI)双染色凋亡试剂盒:BD公司。抗还原型谷胱甘肽(glutathione,GSH)多克隆抗体、细胞色素C氧化酶亚基Ⅳ(cytochrome C oxidaseⅣ,COXⅣ)单抗:SANTA CRUZ生物公司。SAP免疫组化试剂盒:南京建成生物工程研究所。
1.2模型建立
采用气管滴注脂多糖加香烟薰雾法[7]。实验第1天和第14天,大鼠气管内滴入1 μg/μl脂多糖200 μl,次日将大鼠放入5%香烟烟雾的有机玻璃仓内,每天0.5 h。共30 d。
1.3分组与干预
按随机数字表法将造模后大鼠分为低氧(low oxygen,LO)、常氧(normal oxygen,NO)、吸氧(inhaled oxygen,IO)三个运动组及常氧非运动对照(control,C)组,每组20只。所有大鼠非运动状态时均可自由摄食、饮水。
运动组根据Bedford摄氧量回归方程确定大鼠运动模式:5°跑台运动,速度15 m/min(53%VO2max),每天1 h,每周5 d。C组每天置于静止跑台1 h。运动时将运动跑台置于氧浓度可调节动物实验箱(长沙华曦电子科技有限公司)内,C组和NO组氧浓度均为21%,LO组和IO组分别为13.6%和25%。
1.4中性粒细胞凋亡率及ROS含量检测
大鼠于运动1周或4周后次日,各取10只大鼠,抽股静脉血行中性粒细胞分离纯化,分离后1 h内参照文献[8]进行中性粒细胞凋亡率及ROS含量检测。以Annexin V-FITC阳性、PI阴性表示凋亡细胞。计算凋亡细胞占检测细胞总数的百分比为凋亡率。
1.5肺组织GSH表达
预定时间点断颈处死大鼠,予4%多聚甲醛单肺灌注固定后常规石蜡切片,厚7µm。免疫组化检测按说明书进行,以不加一抗作为阴性对照,DAB显色。胞质染为棕褐色者为阳性细胞。
1.6骨骼肌COXⅣ表达
处死大鼠后迅速分离股四头肌,差速离心法提取骨骼肌线粒体[9]。BCA试剂盒行蛋白定量,取蛋白40 μg加入12%SDS-PAGE垂直电泳,半干转移至硝酸纤维膜上。5%脱脂奶粉封闭,加入COXⅣ单克隆抗体(1∶1000),以β-tubulin作为内参,4℃过夜。1∶5000辣根过氧化酶标记的二抗处理后,化学发光法检测。以测得结果与内参的比值作为最终结果。
1.7统计学分析
2结果
2.1中性粒细胞凋亡率及ROS含量
运动1周,LO组、NO组中性粒细胞凋亡率较C组降低(P<0.05),ROS含量增高(P<0.05)。运动4周,NO组、IO组中性粒细胞凋亡率较C组增加(P<0.05),ROS含量减低(P<0.05)。与运动1周相比,运动4周NO组、IO组中性粒细胞凋亡显著上升(P<0.001),ROS含量减少(P<0.05)。见表1、表2。
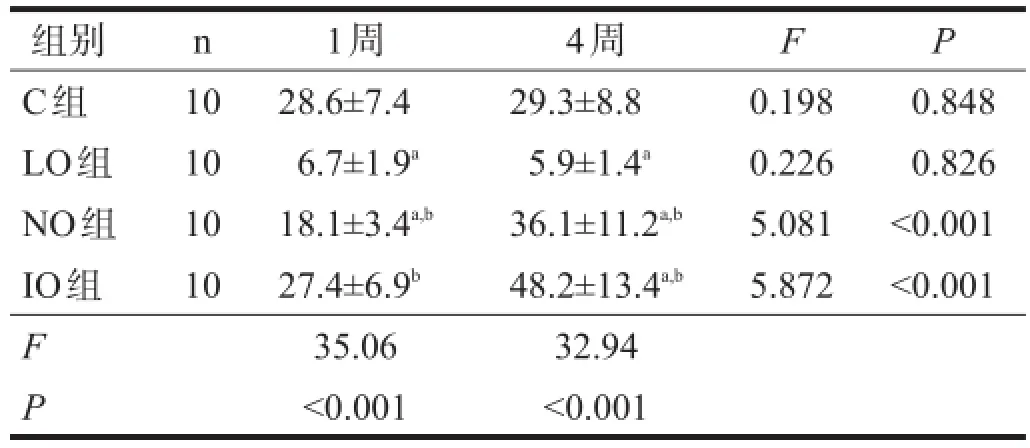
表1 各组运动后不同时间中性粒细胞凋亡率比较(%)
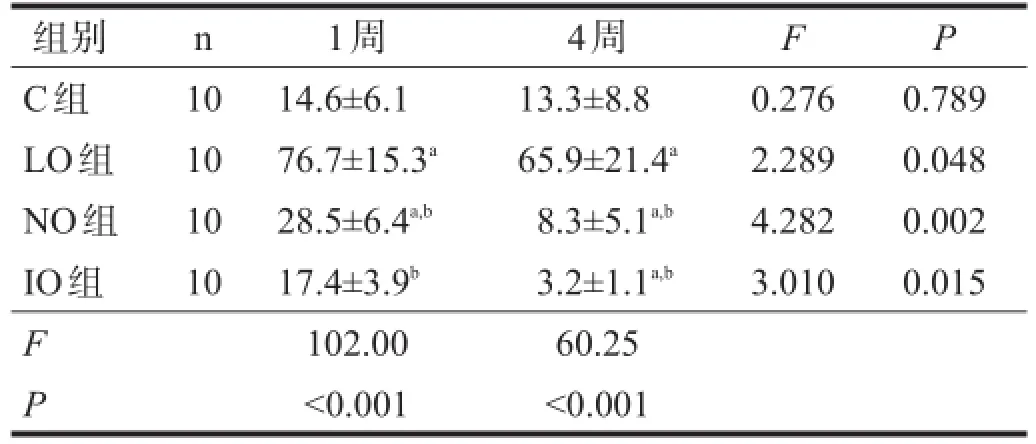
表2 各组运动后不同时间中性粒细胞ROS含量比较(103/mg)
2.2GSH表达
各组肺泡腔均扩大,肺泡间隔变窄,符合COPD病理表现。运动1周,各运动组肺组织GSH表达与C组无显著性差异;运动4周后,NO、IO组GSH表达较C组增加。见图1。

图1 肺组织GSH表达(免疫组化染色,400×)
2.3COXⅣ表达
运动1周及4周后,LO组COXⅣ水平均较C组降低;运动4周后,NO组和IO组较LO组升高,IO组较NO组升高。见图2。
3讨论
COPD患者因肺功能受损,氧储备能力降低,运动后因氧化能力不足,导致血液、肺、骨骼肌等ROS含量增加,进一步加剧全身炎症反应[10]。既然低氧血症是导致COPD患者运动后产生ROS的重要原因,吸氧后运动可能会改善。我们建立COPD大鼠模型,通过控制运动时吸入氧浓度来模拟COPD患者不同的氧合状态,以期为COPD运动康复提供参考。
中性粒细胞是COPD重要的炎症细胞[11],其凋亡延迟是COPD炎症持续的重要原因[12]。本研究显示,无论运动1周或4周,低氧均会导致中性粒细胞凋亡显著延迟,同时伴ROS增加。也就是说,发生Ⅰ型呼吸衰竭的COPD患者,无论运动时间长短,运动后均可能通过抑制中性粒细胞凋亡增加ROS生成。氧合正常状态下运动1周时,中性粒细胞凋亡仍然延迟,ROS含量增加;运动4周后,反而促进中性粒细胞凋亡。吸入低浓度氧后,在运动第1周即表现出促中性粒细胞凋亡的作用。这与Hanneke等研究结果[13]一致:鼻导管4 L/min吸氧后可抑制COPD患者运动后IL-6的产生及中性粒细胞活化。我们推测,COPD患者基础氧合状态是运动后导致ROS产生的重要因素,运动时吸氧可有效降低ROS产生,可能的机制是促进中性粒细胞凋亡。
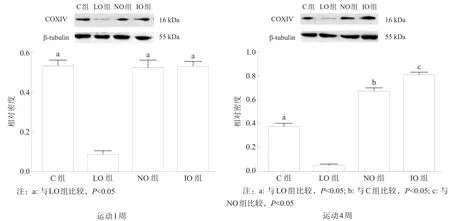
图2 骨骼肌COXⅣ表达
氧化-抗氧化失衡也是COPD进行性恶化的重要原因[14-15],GSH不足与COPD相关[16]。本研究显示,NO组运动1周时中性粒细胞凋亡受到抑制,而运动4周后中性粒细胞凋亡率明显升高,ROS含量减低。其机制难以单纯用运动时吸入氧浓度来解释。进一步研究发现,运动4周后,NO组肺组织GSH表达较1周时增加。推测经过较长时间运动后,体内抗氧化机制激活,促进体内GSH等抗氧化物质的表达,进而促进中性粒细胞凋亡,使ROS含量减少。然而,低氧状态下运动4周后,GSH并未增加;而吸氧运动4周后,GSH显著增加。因此,运动对COPD患者抗氧化物质生成的影响有时间因素及运动时吸入氧浓度双重因素作用,非低氧血症患者经过较长时间运动,可以促进体内抗氧化物质的生成;而低氧状态下,即便较长时间运动也未见GSH增加,氧对GSH等抗氧化物质的合成有“允许”作用。
COPD患者骨骼肌常常因ROS等作用,功能受到影响,导致运动耐力下降[17]。已有研究表明,COPD患者可能因为低氧血症及运动减少而出现骨骼肌线粒体合成障碍[18];线粒体合成障碍使骨骼肌成为COPD患者运动后ROS又一重要来源[19-20]。我们选择线粒体呼吸链标志蛋白COXⅣ作为衡量指标[21]。研究显示,低氧是骨骼肌线粒体合成障碍的重要因素,这与文献[22-23]报道一致;非低氧状态下,COPD大鼠运动4周后COXⅣ明显增加。
对COPD患者进行肺康复教育及训练无疑非常重要[24-25]。本研究结果提示,偶尔、短期运动可能对改善COPD氧化应激状态无益;长期运动康复对COPD患者ROS生成的影响也需要区别对待。非低氧状态COPD患者可通过长期运动改善体内氧化应激状态,而伴低氧者则可能需要运动时吸入氧才能获益。
当然,运动时吸入何种浓度氧及不同运动强度对ROS影响等问题则需要进一步深入探讨。
[1]郭美华,王健,钟南山,等.氧化应激在慢性阻塞性肺疾病发病中的作用及机制研究[J].中华结核和呼吸杂志,2015,38(3): 222-224.
[2]钟琳晔,杨汀,肖飞.氧化应激及其评价指标在慢性阻塞性肺疾病中的作用[J].中华结核和呼吸杂志,2014,37(7): 524-527.
[3]Couillard A,Maltais F,Saey D,et al.Exercise-induced quadriceps oxidative stress and peripheral muscle dysfunction in patients with chronic obstructive pulmonary disease[J].Am J Respir Crit Care Med,2003,167(12):1664-1669.
[4]van Helvoort HA,van de Pol MH,Heijdra YF,et al.Systemic inflammatory response to exhaustive exercise in patients with chronic obstructive pulmonary disease[J].Respir Med,2005,99(12):1555-1567.
[5]Garcia-Aymerich J,Lange P,Benet M,et al.Regular physical activity modifies smoking-related lung function decline and reduces risk ofchronic obstructive pulmonary disease:a popula-tion-based cohort study[J].Am J Respir Crit Care Med,2007,175(5):458-463.
[6]何顺平,黄江,刘志锋,等.定量步行运动和呼吸锻炼在慢性阻塞性肺疾病患者社区康复治疗中的应用[J].中华结核和呼吸杂志,2013,35(5):371-374.
[7]李红梅,崔德健,马楠,等.细胞外基质重塑在大鼠慢性阻塞性肺疾病模型气流阻塞中的作用[J].中华结核和呼吸杂志,2002,25(7):403-407.
[8]秦开秀,李醇文,王晓龙,等.百草枯诱导产生的活性氧类物质对中性粒细胞凋亡的影响[J].中国应用生理杂志,2015,31 (2):111-114.
[9]王静,李东野,夏勇,等.转染Aktl基因对缺血再灌注大鼠心肌线粒体通透性转换的影响[J].中国病理生理杂志,2010,26 (1):8O-85.
[10]Kirkham PA,Barnes PJ.Oxidative stress in COPD[J].Chest,2013,144(1):266-273.
[11]邓帆,董航明,邹梦晨,等.支气管哮喘与慢性阻塞性肺疾病及其重叠综合征患者中性粒细胞极性化的差异[J].中华医学杂志,2014,94(12):3796-3800.
[12]徐芝君,许国根,徐远胜,等.慢性阻塞性肺疾病急性加重期患者血小板活化与中性粒细胞凋亡的相关性研究[J].中国急救医学,2013,33(12):1110-1113.
[13]Hanneke AC,Yvonne FH,Leo MA,et al.Supplemental oxygen prevents exercise-induced oxidative stress in muscle-wasted patients with chronic obstructive pulmonary disease[J].Am J Respir Crit Care Med,2006,173(10):1122-1129.
[14]Hwang JW,Rajendrasozhan S,Yao H,et al.FOXO3 deficiency leads to increased susceptibility to cigarette smoke-induced inflammation,airspace enlargement,and chronic obstructive pulmonary disease[J].J Immunol,2011,187(2):987-998.
[15]Michaeloudes C,Sukkar MB,Khorasani NM,et al.TGF-beta regulates Nox4,MnSOD and catalase expression,and IL-6 release in airway smooth muscle cells[J].Am J Physiol Lung Cell Mol Physiol,2011,300(2):L295-L304.
[16]Tager M,Piecyk A,Kohnlein T,et al.Evidence of a defective thiol status of alveolar macrophages from COPD patients smokers[J].Free Radic Biol Med,2000,29(11):1160-1165.
[17]Puente-Maestu L,Pérez-Parra J,Godoy R,et al.Abnormal mitochondrial function in locomotor and respiratory muscles of COPD patients[J].Eur Respir J,2009,33(5):1045-1052.
[18]Koechlin C,Maltais F,Saey D,et al.Hypoxaemia enhances peripheral muscle oxidative stress in chronic obstructive pulmonary disease[J].Thorax,2005,60(10):834-841.
[19]Wiegman CH,Michaeloudes C,Haji G,et al.Oxidative stressinduced mitochondrial dysfunction drives inflammation and airway smooth muscle remodeling in patients with chronic obstructive pulmonary disease[J].J Allergy Clin Immunol,2015,136(3):769-780.
[20]Mathur S,Brooks D,Carvalho CR.Structural alterations of skeletal muscle in COPD[J].Front Physiol,2014,5(3):1-8.
[21]李竹石,杨洋,许彩民.亚硒酸钠诱导NB4细胞中细胞色素C氧化酶亚基Ⅳ的下调机制[J].中国医学科学院学报,2009,31 (6):686-691.
[22]薄海,彭朋,秦永生,等.低氧复合运动对大鼠骨骼肌线粒体含量的影响[J].中国病理生理杂志,2014,30(8):1461-1466.
[23]Zou D,Liu P,Chen K,et al.Protective effects of myricetin on acute hypoxia-induced exercise intolerance and mitochondrial impairments in rats[J].PLoS One,2015,10(4):e0124727.
[24]何霏,张雯,赵莹楚,等.健康教育在慢性阻塞性肺疾病社区康复中的意义[J].中国康复理论与实践,2015,21(5): 595-601.
[25]陈贵华,周向东,虞乐华,等.肺康复对中重度慢性阻塞性肺疾病患者运动耐力和生活质量的影响[J].中华物理医学与康复杂志,2012,34(6):444-447.
Effect of Oxygen Concentration during Exercise on Reactive Oxygen Species Production in Chronic Obstructive Pulmonary Disease Rats
LIU Heng1,WEN Bao-ling2,WANG Xiao-long2
1.Sports Institute of Chongqing Universty,Chongqing 400030,China;2.Emergency Department,the 2nd Affiliated Hospital of Chongqing Medical University,Chongqing 400010,China
Correspondence to WANG Xiao-long.E-mail:xiaolongwang126@126.com
Objective To investigate the effect of various concentration of inhaled oxygen during exercise on reactive oxygen species (ROS)production in chronic obstructive pulmonary disease(COPD)rats and the possible mechanism.Methods Eighty COPD Wistar rats were divided into low oxygen(LO,n=20),normal oxygen(NO,n=20)and inhaled oxygen(IO,n=20)exercising groups,which ran on treadmill in the conditions of 13.6%,21%,25%oxygen,respectively,and non-exercising normal oxygen group(C,n=20),which stood on still treadmill in the condition of 21%oxygen.Their apoptosis percentage of neutrophils and ROS content were measured with flow cytometry,glutathione(GSH)in lung with immunohistochemistry and cytochrome C oxidase IV(COXIV)in skeletal muscle with Western blotting,as one and four weeks of exercising.Results For one week of exercise,the ROS was more in LO and NO groups than in C group(P<0.05),while the neutrophils apoptosis percentage was less(P<0.05);and there was no difference among C,LO,NO,IO groups in expression of GSH and COXIV(P>0.05).For four weeks of exercise,the ROS was more in LO group but less in NO and IO groups than in C group(P<0.05);while the expression of GSH and COXIV increased in NO and IO groups compared with those in C group(P<0.05).Conclusion A long term exercise in non-hypoxic state may inhibit ROS production for COPD patients,by promoting neutrophils apoptosis and antioxidant expression.
chronic obstructive pulmonary disease;exercise;oxygen concentration;inhaled oxygen;reactive oxygen species;rats
10.3969/j.issn.1006-9771.2016.07.009
R562.2
A
1006-9771(2016)07-0784-05
中央高校基本科研业务费(No.106112015CDJXY250002)。
1.重庆大学体育学院,重庆市400030;2.重庆医科大学第二临床学院急救部,重庆市400010。作者简介:刘衡(1975-),女,汉族,重庆市人,硕士,讲师,主要研究方向:运动与康复医学。通讯作者:王晓龙(1974-),男,汉族,重庆市人,博士,副教授,主要研究方向:中毒与慢性病康复。E-mail:xiaolongwang126@126.com。
2015-12-04
2016-01-22)

