守恒法和差量法巧解化学计算题
福建省长泰县第一中学 王锐勇
守恒法和差量法巧解化学计算题
福建省长泰县第一中学王锐勇
摘 要:化学计算是中学化学学习的重要内容,是高考命题考查的重点之一,是化学学习的难点。解答化学计算题中常采用一些计算技巧,这样可以大大简化运算过程,提高运算准确度。高中化学计算有定义法、公式法、平均值法、极值法等,而差量法和守恒法是化学计算题中常用的方法。
关键词:守恒法 差量法 化学计算题
一、守恒法
守恒法包括质量守恒、电荷守恒、电子得失守恒,活用“守恒法”能起到事半功倍的效果。
1.活用质量守恒原理。例1,标况下,0.1mol烃与1mol的O2(过量)混合,完全燃烧后通过足量的Na2O2固体,固体增重15g,从Na2O2中逸出的全部气体为16.8L(标况),该烃的分子式是( )
A.C4H8B.C4H10C.C5H10D.C5H12
解析:由质量守恒可推知,0.1mol烃与1mol的O2的质量之和等于反应后Na2O2固体增加的质量与逸出O2的质量之和。
设:该烃的质量为X

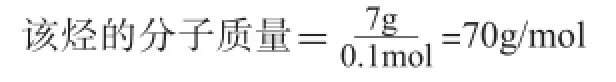
所以该烃的分子式为C5H10。
2.活用电荷守恒原理。例2,向铝粉和过氧化钠的混合物中滴加足量的水振荡,当混合物全部溶解后得无色透明溶液并放出7g气体,向溶液中滴加5mol/L的盐酸有白“↓”生成,当加入盐酸为280ml时,该沉淀恰好溶解,求原混合物中铝和过氧化钠的物质的量比。
解析:由题意可知:①H2质量+O2质量=7g。②最后溶液中的溶质为NaCl、AlCl3其中的正负电荷应守恒。
设铝粉物质的量为X,Na2O2物质的为Y
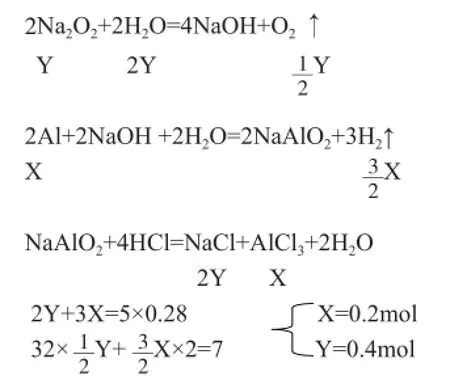
3.活用电子得失守恒原理。得失电子守恒计算适用解有关氧化还原反应的计算题。
例 3,3BrF3+5H2O=HBrO3+Br2+O2↑+ 9HF中,5mol的 BrF3可氧化多少摩尔水?
解析:只要抓住氧化剂得电子数等于还原剂失电子数这一原则就可使问题迎刃而解。
1mol的BrF3作氧化剂时转移3mol电子,5molBrF3作氧化剂时共转移3×5=15mol电子,1mol水作还原剂转移2mol电子,设Xmol水可转移15mol电子,则2X=15mol,X=0.75mol。
从以上例子看出,若采用常规解法解题不仅浪费很多时间,还使计算过程复杂,而若能灵活运用各种解法就能快速简捷地解出答案。
二、差量法
差量法是根据化学反应中反应物与生成物的某种差量关系列出比例式求解的解题方法。高中涉及的固体质量差、气体质量差、气体体积差等类型的化学反应都可用差量法求解。解题关键是注意观察题目,抓住造成差量的实质,即根据题意确定符合某一理论差量,再根据题目提供的实际差量列出正确的比例式,求出正确答案。差量法包括质量差法、体积差法、物质的量差法等。
1.质量差法 。例1,将12.8g铜片放入足量AgNO3溶液中,一段时间后取出铜片洗净烘干,称得质量为13.56g,计算有多少克铜被氧化。
解析:铜与AgNO3发生反应:
Cu+2 AgNO3= Cu( NO3)2+2Ag,64g铜被氧化,生成216g金属银,固体质量增加152g,它与题中给出的固体质量差量构成对应比例关系,可用差量法求解。
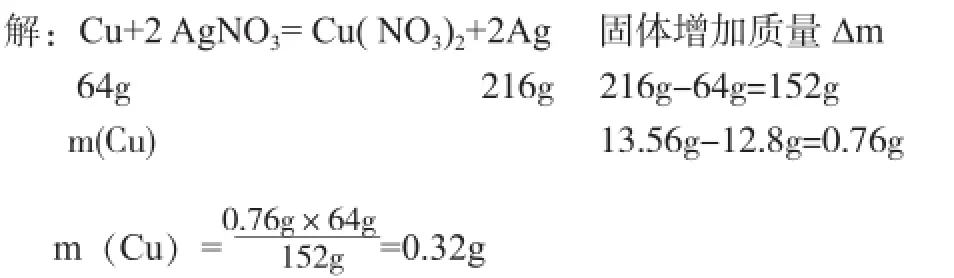
2.体积差法 。例2.将充满45mL NO和NO2混合气体的试管,倒立于水槽中,过一段时间后气体的体积为25 mL ,求原混合气体中NO和NO2的体积之比?
解析:原混和气体总体积为45毫升,反应后为25毫升,体积减少20毫升。剩余气体应是生成的NO和原来的NO。
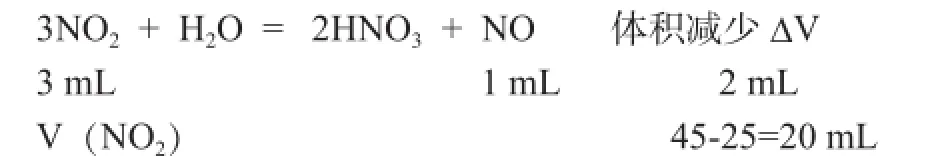
计算可得V(NO2)=30 mL,原混合气体中NO和NO2的体积之比为(45mL-30 mL)∶30ml=1∶2
3.物质的量差法。例3,白色固体PCl5受热即挥发并发生分解:PCl5(气)= PCl3(气)+ Cl2(气) ,现将5.84克PCl5装入2.05升真空密闭容器中,2770C达到平衡时,容器内的压强为1.01×105Pa, 经计算可知平衡时容器内混和气体物质的量为0.05摩,求平衡时PCl5的分解百分率。
解析:原PCl5的物质的量为0.028摩,反应达到平衡时物质的量增加了0.022摩,根据化学方程式进行计算。计算可得有0.022摩PCl5分解,所以结果为78.6%。
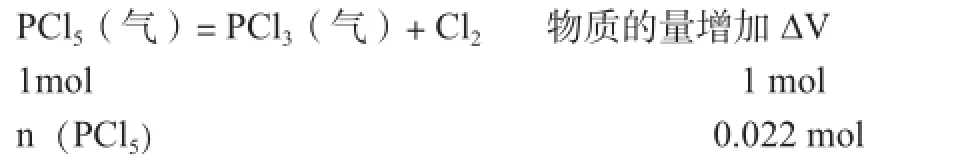
通过以上例子可以看出,不同题目采用不同的计算技巧不仅可以减少计算量,简化计算过程,还可以明确思路,从而提高解题准确率。
文章编号:ISSN2095-6711/Z01-2016-05-0158

