可可西里豆科植物根瘤内生细菌系统发育及促生特性研究
王金平, 齐雅琳, 韩素贞
(首都师范大学生命科学学院, 北京 100048)
可可西里豆科植物根瘤内生细菌系统发育及促生特性研究
王金平, 齐雅琳, 韩素贞*
(首都师范大学生命科学学院, 北京 100048)
[目的]研究可可西里豆科植物根瘤内生细菌系统发育、抗菌特性和分泌IAA能力。[方法]对分离自可可西里的豆科植物OxytropisfalcateBunge的根瘤内生细菌进行了16S rDNA全序列分析、抗菌试验以及IAA分泌能力检测。[结果]16S rDNA全序列分析结果表明,17株供试菌有12株属于芽孢杆菌属(Bacillus);有1株供试菌CNU097903与短杆菌属Brevibacteriumhalotolerans处于同一分支,相似性达99.9%;菌株CNU097916与Agrobacteriumtumefaciens处于同一分支,相似性达99.8%;菌株CNU097914和CNU097915处于一个单独的分支,其系统发育地位有待进一步确定。抗菌试验结果表明,10株供试菌对G-黄单胞杆菌(XanthomonasCampestris)、G+金黄色葡萄球菌(Staphylococcusaureus)、番茄灰霉(Botrytiscinerea)和瓜果腐霉(Pythiumaphanidermatum)4种指示菌表现出不同程度的抗性:菌株CNU097906抗菌谱最广,对4种指示菌都有抗性;菌株CNU097902对番茄灰霉的抗性最强,抑菌圈直径达38 mm;菌株CNU097908对黄单胞杆菌的抗性最强,抑菌圈直径达38 mm;菌株CNU097901对金黄色葡萄球菌的抗性最强,抑菌圈直径达41 mm。采用 Salkowski 比色法测定供试菌分泌 IAA 的能力,结果表明,10供试菌都具有分泌IAA的能力。[结论]该研究为进一步探究内生细菌的生防机制和途径奠定基础,为可可西里内生菌资源的研究和合理开发利用提供理论依据。
根瘤内生菌;系统发育;抗菌活性;IAA
Endophytic nodule bacteria; Phylogeny; Antimicrobial activity; IAA
近年来,从根瘤中分离到非共生菌的报道越来越多[1-3]。内生菌对宿主植物的主要作用有促进生长、抗虫害、抗病害、抗逆 性、促进次生代谢产物合成等[4]。可可西里位于我国西北部,是青藏高原上最大的高寒地区,具有海拔高、年降雨量较少、日照时间长和温差较大等高寒气候特征,有“人类生存禁区”之称。此前对该地区豆科植物根瘤内生菌的研究较少,笔者对可可西里豆科植物OxytropisfalcateBunge根瘤内生细菌的系统发育及其抗菌特性和分泌IAA能力进行研究,旨在丰富根瘤菌内生菌种质资源,为其应用奠定理论基础。
1 材料与方法
1.1材料对采集自青海可可西里的豆科植物OxytropisfalcataBunge根瘤进行表面灭菌[5],用无菌镊子将其夹碎,于YMA 平板划线分离,置于20 ℃培养2~6 d后,挑取单菌落划线纯化。获得的单菌落即为供试菌,用20%甘油保存于-80 ℃冰箱待用。选用供试菌株共17株,详情见表 1。
1.216S rDNA 全序列分析 DNA提取步骤参考文献[6],以总DNA为模板,引物P1为5′-AGAGTTTGATCCTGGCT-

表1 供试菌详情
CAGAACGAACGCT-3′,其序列对应于E.coli16S rDNA 基因第8~37 碱基位置;P6为5′-TACGGCTACCTTGTTACGACTTCACCCC-3′,其序列为对应第1 479~1 506 碱基位置[7]。16S rDNA PCR方法步骤参考文献[8]。PCR产物经电泳检测后交由上海生工生物公司进行测序,将测得序列与GenBank中已知种序列通过MEGA 5.0 中的ClustalW 进行多序列比对。系统发育树的构建采用邻接法(Neighbour-joining)[9],相似性计算采用Kimura two-parameter模型[10],自展值(Bootstrap)[11-12]为1 000并计算各菌株之间的相似性距离。
1.3抑菌试验指示菌采用G-黄单胞杆菌(XanthomonasCampestris)、G+金黄色葡萄球菌(Staphylococcusaureus)、番茄灰霉(Botrytiscinerea)和瓜果腐霉(Pythiumaphanidermatum)。黄单胞杆菌和金黄色葡萄球菌用液体牛肉膏蛋白胨培养基振荡培养过夜,番茄灰霉和瓜果腐霉用液体马铃薯培养基振荡培养2~3 d。
将供试菌接种于200 mL YMA液体培养基,130 r/min、20 ℃振荡培养3~5 d。将发酵液8 000 r/min离心5 min后用0.22 μm过滤膜过滤后,40 ℃、0.02 bar悬蒸至发酵液剩余2~3 mL,将剩余发酵液于40 ℃烘箱烘干,溶于20 mL甲醇,保存待用。
取 100 μL指示菌液分别均匀涂布于YMA平板,平板中放入3个灭菌牛津杯,分别加入200 μL浓缩发酵液、未浓缩发酵液和甲醇,置于20 ℃培养3 d后用游标卡尺测量抑菌圈大小,计算平均值。
1.4供试菌分泌IAA能力的检测采用 Salkowski 比色法测定供试菌分泌 IAA 的能力[12]。
2 结果与分析
2.116S rDNA 全序列分析对17株供试菌进行了 16S rDNA 全序列测定,并根据测序结果构建了系统发育树状图(图1)。由图1可知,17株供试菌有12株属于芽孢杆菌属(Bacillus),其中,CNU097902、CNU097904与Bacillusaryabhattai的相似性为100%,CNU097909、 CNU097911和CNU097912与Bacillussubtilis的相似性为100%,CNU097905与Bacillusaxarquiensis的相似性为99.9%, CNU097910、CNU097913、CNU097908、CNU097907和CNU097906与Bacillusmojavensis聚在一起,相似性达100%;CNU097901在Bacillus中处于一个单独的分支,有可能是一个新种,有待进一步试验确定。有1株供试菌CNU097903与短杆菌属Brevibacteriumhalotolerans处于同一分支,相似性达99.9%。菌株CNU097916与Agrobacteriumtumefaciens处于同一分支,相似性达99.8%。菌株CNU097914和CNU097915处于一个单独的分支,其系统发育地位有待进一步确定。

图1 根瘤内生菌16S rDNA全序列系统发育树状图Fig.1 Phylogenetic tree of the complete sequence of 16S rDNA in the root nodule
2.2部分内生菌的抗菌特性采用2种农作物常见病害真菌瓜果腐霉和番茄灰霉及2种农作物常见病害细菌金黄色葡萄球菌和黄单胞杆菌作为供试菌,测定10株供试菌抗真菌和抗细菌活性,结果见表2。从表2可以看出,10株供试菌对4种指示菌表现出不同程度的抗性。菌株CNU097906抗菌谱最广,对4种指示菌都有抗性;菌株CNU097902对3种指示菌有抗性,仅对瓜果腐霉不敏感;菌株CNU097901和 CNU097903对瓜果腐霉和金黄色葡萄球菌有抗性,菌株CNU097905对瓜果腐霉和黄单胞杆菌有抗性;菌株CNU097904、CNU097909和 CNU097910 对番茄灰霉有抗性,
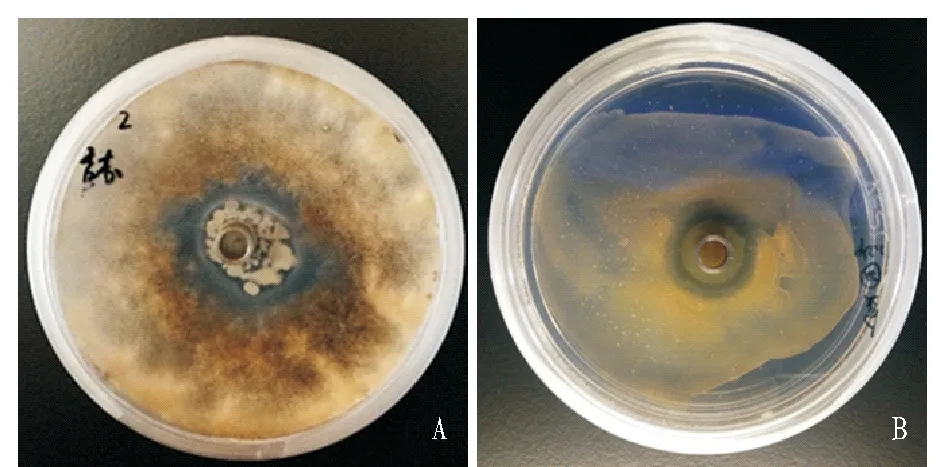
注:A.CNU097905 抗番茄灰霉;B.CNU097903 抗金黄色葡萄球菌。 Note:A.CNU097905 resistance to Botrytis cinere,B.CNU097903 resistance to Staphylococcus aureus.图 2 供试菌抑菌圈Fig.2 Bacterial inhibition zone
菌株CNU097907和CNU097908对黄单胞杆菌有抗性。供试菌抑菌圈见图2。菌株CNU097902对番茄灰霉抗性最强,抑菌圈直径达38 mm;菌株CNU097908对黄单胞杆菌的抗性最强,抑菌圈直径达38 mm;菌株CNU097901对金黄色葡萄球菌抗性最强,抑菌圈直径达41 mm。

表2 10株供试菌对4种常见病菌的抑菌率
2.5IAA产生能力由图3可知,10供试菌都具有分泌IAA的能力。各菌株分泌IAA的能力有差异;用NA培养基培养菌株分泌IAA的量少于用King2培养的菌株分泌IAA的量。供试菌无论用NA还是用King2都能分泌IAA,色氨酸是供试菌产生IAA的重要前体物质。

注:1~20依次为CNU097901~CNU097910(两两一组前为NA培养,后为KING 2 培养),21为标准品对照,22为空白对照。Note:1-20.CNU097901- CNU097910(two of a group,the left was NA culture,the right was KING 2 culture,21 was standard CK,22 was blank CK.图3 IAA分泌能力测试结果Fig.3 Detection results of secreting IAA capacity
3 讨论
3.1根瘤内生细菌的多样性许多研究者从豆科植物根瘤内分离出多种根瘤内生细菌,它们大多分属于芽孢杆菌属(Bacillus)、土壤杆菌属(Agrobacterium)、肠杆菌属(Enterobacter)、假单胞菌属(Pseudomonas)等[13-15]。代金霞等[16]从荒漠植物柠条根瘤内分离到40 株内生细菌,其中,21株属于芽孢杆菌属(Bacillus),7株属于固氮螺菌属(Inquilinus),3株属于申氏杆菌属(Shinella),2株属于不动杆菌属(Acinetobacter)。邓振山[17]从西北地区苦马豆根瘤中分离到的65株内生细菌分别属于副球菌属(Paracoccus)、鞘脂单胞菌属(Sphingomonas)、固氮螺菌属(Inquilinus)、假单胞菌属(Pseudomonas)、沙雷氏菌属(Serratia)、分枝杆菌属(Mycobacterium)、诺卡氏菌属(Nocardia)、链霉菌属(Strptomyces)、类芽孢杆菌属(Paenibacillus)、短短芽孢杆菌属(Brevibacillus)、Lysinibacillus、葡萄球菌属(Staphylococcus)和芽孢杆菌属(Bacillus),其中,芽孢杆菌为优势菌,占所分离菌株的58.5%。龚明福等[18]对新疆苦豆子根瘤内生细菌进行调查,分离出的60株菌分属于Bacillussp.和Aerobacillussp。由此可知,根瘤内生细菌具有极大的多样性,而芽孢杆菌属是根瘤内优势内生细菌。
该研究从青海可可西里豆科植物OxytropisfalcataBunge根瘤分离了17株内生细菌,除2株分类地位需进一步试验确定外,12株属于芽孢杆菌属,1株属于短杆菌属(Brevibacterium),2株属于土壤杆菌属(Agrobacterium),与目前报道结果相一致。芽孢杆菌抗逆性强,其在高寒地区豆科植物根瘤内占优势地位,可能是与环境相适应的结果。
3.2根瘤内生细菌的促生作用根瘤内生细菌在根瘤菌与豆科植物共生固氮过程中,与宿主、根瘤菌相互作用,在复杂环境条件下可能对根瘤菌的共生固氮具有促进作用。2002年,Bai等[19]发现部分Bacillus属的菌株在与B.japonicum共同接种大豆时,能够增加大豆重量。Mhamdi等[20]研究发现,土壤杆菌属的细菌影响根瘤菌的结瘤特性,它们能通过与根瘤菌共接种侵入根瘤。某些根瘤内生细菌可以产生植物生长调节物质,如乙烯、生长素(IAA)、细胞激动素等,促进植物根系发育,进而有利于根瘤菌与豆科植物的根系相互作用并共生结瘤固氮[21]。李丽[22]发现从甘草根瘤中分离到的内生细菌中,有75%的菌株具有产生IAA的能力,且Agrobacterium属的菌株最强。根瘤中分离到的内生细菌普遍具有抗菌活性[23],潘巧娜[24]发现从黄芪根瘤中分离到的内生菌对金黄色葡萄球菌的抑制作用明显高于大肠杆菌。Velazhahan 等[25]指出,植物内生细菌在宿主中可以产生具有拮抗性、竞争性的次级代谢产物或酶类,能够直接或间接地抑制或杀死病原菌。
该研究抗菌试验结果表明,10株供试菌对G-黄单胞杆菌(XanthomonasCampestris)、G+金黄色葡萄球菌(Staphylococcusaureus)、番茄灰霉(Botrytiscinerea)和瓜果腐霉(Pythiumaphanidermatum)4种指示菌表现出不同程度的抗性:菌株CNU097906抗菌谱最广,对4种指示菌都有抗性;菌株CNU097902对番茄灰霉抗性最强,抑菌圈直径达38 mm;菌株CNU097908对黄单胞杆菌的抗性最强,抑菌圈直径达38 mm;菌株CNU097901对金黄色葡萄球菌抗性最强,抑菌圈直径达41 mm。这表明试验菌株的抗菌谱较广,对植物病原真菌和细菌均有抑制作用。分离到的试验菌株对金黄色葡萄球菌、黄单胞杆菌、 瓜果腐霉、番茄灰霉的抑制活性不同。其中,CNU097902对番茄灰霉以及CNU097908对黄单胞杆菌的抑制率都达40%以上。从菌株数量和抑制率看,试验菌株对于瓜果腐霉的抑制作用相对较低。采用 Salkowski 比色法测定供试菌分泌 IAA 的能力,结果表明,10供试菌都具有分泌IAA的能力。
特殊生境下植物内生菌的研究具有重要的理论意义和应用价值,是极具开发潜力的微生物资源;内生菌所发挥的重要生理和生态作用己在农业、林业和医药领域表现出来,内生菌及其次生代谢产物己成为发现新的天然药物和生物活性成分的重要资源库[26]。对青海可可西里OxytropisfalcataBunge根瘤内生菌抑菌活性和IAA分泌能力的研究,旨在为进一步探究内生细菌的生防机制和途径奠定基础,为可可西里内生菌资源的研究和合理开发利用提供理论依据。
[1] LAJUDIE P D,WILLEMS A,NICK G,et al.Agrobacterium,bv.1 strainsisolated from nodules of tropical legumes[J].Systematic & applied microbiology,1999,22(1):119-132.
[2] GAO J,TEREFEWORK Z,CHEN W,et al.Genetic diversity of rhizobia isolated fromAstragalusadsurgens, growing in different geographical regions of China[J].Journal of biotechnology,2001,91(2/3):155-168.
[3] ZAKHIA F,JEDER H,WILLEMS A,et al.Diverse bacteria associated with root nodules of spontaneous legumes in Tunisia and first report fornifH-like gene within the generaMicrobacteriumandStarkeya[J].Microbial ecology,2006,51(51):375-393.
[4] 刘杰,汪恩涛,陈文新.豆科植物根瘤内生细菌的发现及其研究进展[J].微生物学报,2011,51(8):1001-1006.
[5] VINCENT J.The cultivation,isolation and maintenance of rhizobia[M]//VINCENT E V M.A manual for the practical study of the root-nodule bacteria.Oxford:Blackwell Scientific,1970:1-13.
[6] CHEN W P,KUO T T.A simple and rapid method for the preparation of gram -negative bacterial genomic DNA[J].Nucleic acids research ,1993,21(9):2260.
[7] WEISBURG W G,BARNS S M,PELLETIER D A,et al.16S ribosomal DNA amplification for phylogenetic study[J].Journal of bacteriology,1991,173(2):697-703.
[8] SAITOU N,NEI M.The neighbor-joining method:A new method for reconstructing phylogenetic trees[J].Molecular biology and evolution,1987,4:406-425.
[9] KIMURA M.A simple method for estimationg evolutionary rates of base substitutions through comparative studies of nucleotide sequences[J].Journal of molecular biology ,1980,16:111-120.
[10] JUKES T H,CANTOR C R.Evolution of protein molecule.Mammalian protein metabolism[M].New York:Academic Press,1969:21-132.
[11] FELSENSTEIN J.Confidence limits on phylogenies:An approach using the bootstrap[J].Evolution,1985,39:783-791.
[12] VERSALOVIC J,SCHNEIDER M,DE BRUIJIN F J,et al.Genomic fingerprinting of bacteria using repetitive sequence based polymerase chain reaction[J].Methods in molecular and cellular biology,1994,5:25-40.
[13] WANG L L,WANG E T,LIU J,et al. Endophytic occupation of root nodules and roots ofMelilotusdentatusbyAgrobacteriumtumefaciens[J].Microbial ecology,2006,52:436-443.
[14] BENHIZIA Y,BENHIZIA H,BENGUEDOUAR A,et al. Gamma proteobacteria can nodulate legumes of the genusHedysarum[J]. Systematic and applied microbiology,2004,27:462-468.
[15] LI J H,WANG E T,CHEN W F,et al. Genetic diversity and potential for promotion of plant growth detected in nodule endophytic bacteria of soybean grown in Heilongjiang Province of China[J].Soil biology and biochemistry,2008,40:238-246.
[16] 代金霞,王玉炯,吴雪娟,等.柠条根瘤内生细菌的抗逆性及遗传多样性[J].应用生态学报,2012,23(2):519-524.
[17] 邓振山.西北地区苦马豆根瘤中内生细菌遗传多样性及其促植物生长特性的研究[D].杨凌:西北农林科技大学,2010.
[18] 龚明福,马玉红,李超,等.苦豆子根瘤内生细菌分离及表型多样性分析[J].西北植物学报,2009,29(2):408-411.
[19] BAI Y,D′AOUST F,SMITH D,et al.Isolution of plant-growth-promotingBacillusstrain from soybean root nodules[J].Canadian journal of microbiology,2002,48:230-238.
[20] MHAMDI R,MRABET M,LAGUERRE G,et al.Colonization ofPhaseolusvulgaris, nodules byAgrobacterium-like strains[J].Canadian journal of microbiology,2005,51(2):105-111.
[21] HALLMANN J,QUADT-HALLMANN W F,MAHAFFEE A,et al.Bacterial endophytes in the agricultural crops[J].Canadian journal of microbiology,1997,43:895-914.
[22] 李丽.中国西北地区甘草根瘤内生细菌多样性和系统发育研究[D].杨凌:西北农林科技大学,2011.
[23] STROBEL G A.Rainforest endophytes and bioactive products[J].Critical reviews in biotechnology,2002,22(4):315-333.
[24] 潘巧娜.黄芪根瘤内生细菌GBL18-2次生代谢产物化学成分及抑菌活性研究[J].江西农业学报,2008,20(10):57-58.
[25] VELAZHAHAN R,SAMIYAPPAN R,VIDHYASEKARAN P.Relationship between antagonistic activities ofPseudomonasfluorescensisolates againstRhizoctoniasolaniand their production of lytic enzymes[J].J Plant Dis Prot,1999,106(3):244-250.
[26] 贾栗,陈疏影,翟永功,等.近年国内外植物内生菌产生物活性物质的研究进展[J].中草药,2007,38(11):1750-1754.
Study on the Phylogeny and Growth Promoting Effect of Endophytes Isolated from Legume Root Nodules in Hoh Xil
WANG Jin-ping,QI Ya-lin,HAN Su-zhen*
(College of Life Science,Capital Normal University,Beijing 100048)
[Objective] The aim was to study the phylogeny,antimicrobial activity and secreting IAA capacity of endophytes isolated from legume root nodules in Hoh Xil.[Method] The endophyte strains isolated from the nodules ofOxytropisfalcateBunge in Hoh Xil were used to do the 16s sequences analysis,antimicrobial test and IAA detection.[Result] The result of 16s rDNA sequence analysis showed that 12 of 17 test strains belong to Bacillus.CNU097903 and Brevibacterium halotolerans,CNU097916 and Agrobacterium tumefaciens were at the same branch respectively,which similarity were as high as 99.9% and 99.8%.CNU097914 and CNU097915 were in a separate branch and their system development status remained to be further confirmed.The antimicrobial experiment result showed that 10 strains had the different degrees of resistance to Xanthomonas campestris,Staphylococcusaureus,Botrytiscinerea,andPythiumaphanidermatum.CNU097906 had the highest resistant spectrum which could resist to all 4 indicator bacteria.CNU097902 and CNU097908 had the strongest resistance toBotrytiscinerea,Xanthomonascampestrisrespectively and the bacteriostatic circle of 38 mm in diameter.CNU097901 had the strongest resistance forStaphylococcusaureus,and the bacteriostatic circle of 41 mm in diameter.The Salkowski colorimetric method showed that all the 10 selected strains had the ability to secrete IAA.[Conclusion] The study lays a foundation for further research on prevention mechanism and ways of endophytic bacteria,provides theoretical basis for research of endophytic bacteria in Hoh Xil and rational decelopment.
A
0517-6611(2016)17-177-04
王金平(1988- ),男,山东日照人,硕士研究生,研究方向:细菌分类。*通讯作者,副教授,博士,硕士生导师,从事细菌分类研究。
2016-05-19
S 432.4+2

