基于血清药理学方法的头花蓼抗炎有效提取物筛选
徐 丹, 赵菲菲, 杨 馨, 李 靖, 徐国波, 廖尚高*
(1.贵州医科大学药学院,贵州贵阳 550004;2.民族药与中药开发应用教育部工程研究中心,贵州贵阳 550004 ;3.贵州省药物制剂重点实验室,贵州贵阳 550004)
基于血清药理学方法的头花蓼抗炎有效提取物筛选
徐 丹1,2, 赵菲菲1,3, 杨 馨1,3, 李 靖1,2, 徐国波1,2, 廖尚高1,2*
(1.贵州医科大学药学院,贵州贵阳 550004;2.民族药与中药开发应用教育部工程研究中心,贵州贵阳 550004 ;3.贵州省药物制剂重点实验室,贵州贵阳 550004)
[目的]通过血清药理学方法,研究头花蓼不同提取物及热淋清颗粒含药血清对小鼠单核巨噬细胞(RAW264.7细胞)释放炎症因子的影响,筛选出头花蓼抗炎有效提取物。[方法]采用头花蓼血清药理学评价方法,10 ng/mL 脂多糖(LPS)建立RAW264.7细胞炎症损伤模型,MTT法检测细胞存活率,Griess试剂法检测细胞上清液中NO的释放量,酶联免疫吸附法(ELISA)检测细胞上清液中TNF-α和IL-6的释放量,以考察头花蓼水提物、水提醇沉提取物、水提醇沉沉淀物及热淋清颗粒含药血清(WEPS、PCWEPS、DPCWEPS、RLQS)对巨噬细胞释放炎症因子的影响。[结果]与模型组比较,WEPS、PCWEPS、DPCWEPS、RLQS均能显著抑制LPS刺激的RAW 264.7细胞释放炎症因子NO、TNF-α和IL-6,PCWEPS组抑制细胞释放NO、TNF-α和IL-6的作用最强。[结论]头花蓼水提醇沉提取物为头花蓼主要的抗炎有效提取物。
头花蓼;热淋清颗粒;血清药理学;RAW 264.7细胞;炎症因子
头花蓼为蓼科蓼属植物头花蓼的全草,是贵州地道药材,收载于2003版《贵州省中药、民族药质量标准》,对泌尿系统感染类疾病有独特疗效。致病体长期侵袭尿路粘膜或组织会产生炎症,造成尿路感染,持续的炎症反应还将加重泌尿系统感染[1]。抑制炎症反应,防止泌尿系统感染的恶化,对此类疾病的治疗具有重要意义。以头花蓼水提物为主要原料的热淋清颗粒在临床上用于治疗泌尿系统感染,并收载于2010年版《中国药典》。研究表明,热淋清颗粒具有显著的抗炎活性[2],但临床中每天的服用量较大[3]。为研究头花蓼水提物经醇沉后对其本身抗炎活性的影响,该研究采用能较好地模拟药物在体内环境中产生药理效应真实过程的血清药理学方法[4],考察头花蓼不同提取物含药血清,即水提物、水提醇沉提取物、水提醇沉沉淀物及热淋清颗粒含药血清(WEPS、PCWEPS、RLQS)对脂多糖(lipopolysaccharide,LPS)刺激的小鼠单核巨噬细胞(RAW264.7 细胞)释放炎症因子NO、TNF-α和IL-6的影响,从而筛选出头花蓼的抗炎有效提取物。
1 材料与方法
1.1材料
1.1.1细胞株与动物。小鼠单核巨噬细胞株购自中国科学院上海生命科学研究院细胞资源中心;Wistar大鼠,雌雄各半,体重(200±20)g,SPF级,由贵州医科大学实验动物中心提供,动物合格证号CXK(黔)2012-0001。
1.1.2药材。头花蓼药材购于贵州省施秉县头花蓼GAP种植基地,由贵州医科大学生药学教研室龙庆德副教授鉴定为蓼科蓼属植物头花蓼PolygonumcapitatumBuch-Ham. ex D. Don的全草。
1.1.3试剂。DMEM高糖培养基(Gibco公司),胎牛血清(Hyclone公司),LPS(Sigma公司),MTT(Sigma公司);磺胺、N-(1-萘基)-乙二胺、二甲基亚砜(DMSO)均为国药集团产品;小鼠TNF-α ELISA试剂盒(RayBio公司),小鼠IL-6 ELISA试剂盒(RayBio公司)。醋酸地塞米松磷酸钠注射液(贵州光正制药有限责任公司),热淋清颗粒(贵州威门药业股份有限公司)。
1.1.4仪器。CO2培养箱(美国Thermo scientific公司),倒置显微镜(日本Nikon公司),低速台式离心机(上海安亭科学仪器厂),水浴锅(天津市泰斯特仪器有限公司),超低温冰箱(Thermo Fisher公司),680型酶标仪(上海伯乐生命医学产品有限公司),数显立式压力蒸汽灭菌器(上海博讯实业有限公司医疗仪器厂),超净工作台(北京东联哈尔仪器制造有限公司),所用细胞培养瓶、培养板、离心管均为美国Corning公司产品。
1.2方法
1.2.1头花蓼提取物的制备。头花蓼全草粉末(一号筛)水提取4次,每次2 h,合并滤液回收至浸膏得头花蓼水提物(WEP),此为头花蓼单方制剂热淋清颗粒的主要成分;水提物用水溶解后加入3倍量95%乙醇沉淀24 h,过滤,合并滤液回收至浸膏得头花蓼水提醇沉提取物(PCWEP),滤渣则为头花蓼水提醇沉沉淀物(DPCWEP)[5]。
1.2.2空白血清和含药血清的制备。SD大鼠50只雌雄各半,随机分为5组,灌胃前12 h禁食不禁水,分别灌胃给予超纯水、头花蓼水提物、水提醇沉提取物、水提醇沉沉淀物以及热淋清颗粒药液[生药量6 g/(kg·d),头花蓼单方制剂热淋清颗粒的临床剂量],每天2 次,连续4 d[6],末次给药后90 min,尾静脉取血,以2 000 r/min、4 ℃离心10 min分离上层血清,过滤除菌,分装,-20 ℃保存备用。
1.2.3RAW264.7细胞的体外培养。RAW264.7细胞培养于含10%胎牛血清、100 μg/mL 青霉素及100 μg/mL 链霉素的DMEM细胞培养液中,置于温度为37 ℃、5%CO2培养箱中培养。取对数生长期细胞用于试验。
1.2.4空白血清及含药血清对RAW264.7细胞的影响。RAW264.7细胞用0.25%的胰蛋白酶消化,以2×105个/mL 的浓度接种于96孔培养板中,每孔100 μL,细胞培养24 h后,弃去上清。试验分为:①正常对照组(CON组),无大鼠血清的培养基;②试验组,不同体积分数(0.5%、1.0%、1.5%、2.0%)的空白血清或含药血清(WEPS、PCWEPS、DPCWEPS、RLQS),培养24 h后,每孔加入终浓度为 2.5 g/L的MTT,继续孵育4 h,弃上清液,加入100 μL DMSO,振荡10 min后,在490 nm用酶联免疫检测仪测定各孔吸光度值A,每组设6个平行孔。按照公式:细胞存活率(%)= 试验组A/对照组A平均值 × 100%,计算细胞存活率。
1.2.5空白血清对RAW264.7细胞释放NO的影响。参照“1.2.4”项,每孔体积100 μL。试验分为:①对照组(CON-1),无大鼠血清的培养基;②空白血清组(CON-2),体积分数为1.5%的空白血清培养液;③无血清模型组(LPS-1),终浓度为10 ng/mL 的LPS溶液;④空白血清模型组(LPS-2),终浓度为10 ng/mL 的LPS和空白血清体积分数为1.5%的培养液。细胞培养24 h后,吸取细胞培养液上清50 μL至酶标板中,加入等体积的Griess试剂(1%磷酸磺胺溶液与0.1% N-(1-萘基)-乙二胺等体积混合液),室温反应10 min后于540 nm处测定各孔吸光度A,每组设6个平行孔。用浓度为1.56、3.12、6.25、12.50、25.00、50.00 μmol/L NaNO2溶液绘制标准曲线,根据NaNO2标准曲线计算细胞培养液上清中NO的释放量。
1.2.6头花蓼及热淋清颗粒含药血清对细胞释放NO的影响。参照“1.2.5”项,试验分为①正常对照组(CON组),无大鼠血清的培养基;②模型组(LPS组),培养基中加入终浓度为10 ng/mL 的LPS;③地塞米松组(DEXA组),培养基中加入终浓度为50 μg/mL 的地塞米松和10 ng/mL 的LPS共培养;④头花蓼及热淋清颗粒含药血清组,培养基中分别加入体积分数为1.5%的含药血清(WEPS、PCWEPS、DPCWEPS、RLQS)和10 ng/mL LPS共培养。每组设6个平行孔。根据NaNO2标准曲线计算细胞培养液上清中NO的释放量。
1.2.7头花蓼及热淋清颗粒含药血清对细胞释放TNF-α和IL-6的影响的影响。参照“1.2.6”项,每组设6个平行孔,收集细胞上清液,按照相应的ELISA试剂盒说明书方法进行测定,根据试剂盒标准曲线计算各组细胞上清中TNF-α和IL-6的释放量。
2 结果与分析
2.1空白血清及含药血清对RAW264.7细胞的影响由表1可知,当空白血清及含药血清的体积分数为0.5%~1.5%时,作用细胞24 h,与对照组(CON-1)比较,细胞存活率无显著性差异。表明在此体积范围内空白血清及含药血清对于RAW264.7细胞本身的生长无显著影响。超过此添加量,随着血清体积的增加,RAW264.7细胞的生长受到显著影响。为有效反映药物的药效,在后续试验中,血清体积分数设定为1.5%。
表1空白血清及含药血清对细胞存活率的影响(n=6)
Table 1Effects of blank serum and drug-containing serum on the viability of RAW264.7 cells

组别Group体积分数Volumefraction∥%细胞存活率Cellviability%对照组Controlgroup(CON-1)—100.00±0.50空白血清组0.5100.76±0.36Blankserumgroup(CON-2)1.0100.93±0.371.599.62±0.252.094.32±0.43**WEPS组WEPSgroup0.5100.35±0.301.0100.18±0.431.598.83±0.302.095.84±0.27**PCWEPS组PCWEPSgroup0.5100.38±0.291.0100.05±0.271.599.24±0.202.095.29±0.25**DPCWEPS组DPCWEPSgroup0.5100.74±0.361.0100.46±0.241.599.83±0.282.094.82±0.54**RLQS组RLQSgroup0.5100.46±0.221.0100.25±0.181.599.04±0.432.095.47±0.50**
注:**表示与对照组比较P<0.01。
Note: Compared with control group, ** wasP< 0.01.
2.2空白血清对RAW264.7细胞释放NO的影响由表2可知,采用1.5%体积的空白血清作用于10 ng/mL LPS诱导的RAW264.7细胞24 h,与空白对照组比较,无血清模型组(LPS-1,相对于CON-1)和空白血清模型组(LPS-2,相对于CON-2)均有显著性差异(P<0.01),表明细胞炎症模型建立成功;空白血清组(CON-2)与对照组(CON-1)比较无显著性差异,空白血清模型组(LPS-2)与无血清模型组(LPS-1)比较也无显著性差异,表明当空白血清体积为1.5%时,既不影响RAW264.7细胞的生长,也不影响LPS刺激所产生的NO释放的检测,以此确定试验中含药血清的添加体积为1.5%。同时,采用无血清模型组(LPS-1)作为后续试验的模型组(LPS)。

表2 空白血清对RAW264.7细胞释放NO的影响(n=6)
注:##表示与CON-1组比较P<0.01;**表示与CON-2组比较P<0.01。
Note: Compared with CON-1 group,## wasP< 0.01. Compared with CON-2 group,** wasP< 0.01.
2.3头花蓼及热淋清颗粒含药血清对细胞释放NO的影响由表3可知,与对照组比较,模型组(LPS组)显著诱导RAW264.7细胞释放NO(P<0.01);与模型组比较,WEPS、PCWEPS、RLQS均能不同程度地抑制RAW264.7细胞释放NO(P<0.05或P<0.01);与PCWEPS组比较,WEPS组和RLQS组NO的释放量具有显著性差异(P<0.01)。因此,PCWEPS具有较强地抑制细胞释放NO的作用。
表3含药血清对RAW264.7细胞释放NO的影响(n=6)
Table 3Effect of drug-containing serum on NO production in RAW264.7 cells
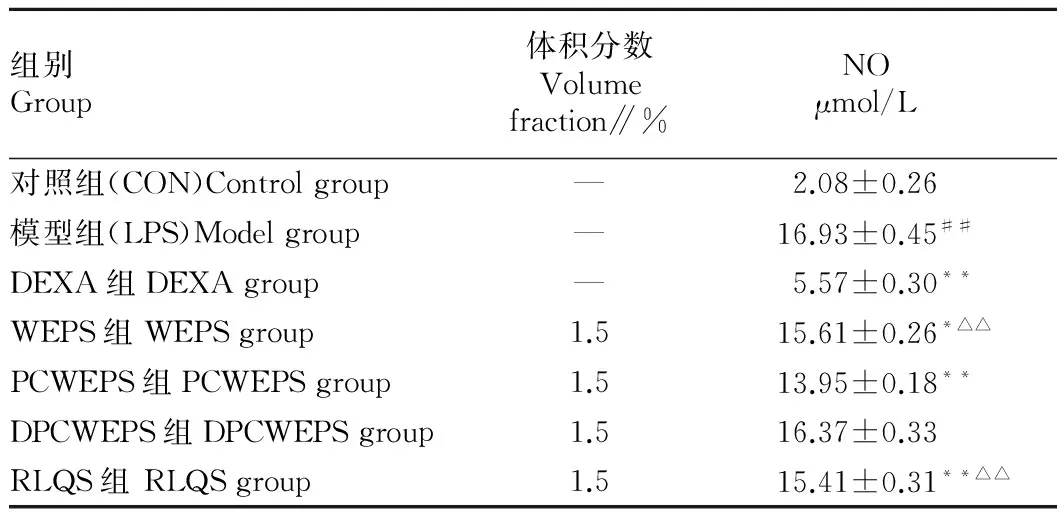
组别Group体积分数Volumefraction∥%NOμmol/L对照组(CON)Controlgroup—2.08±0.26模型组(LPS)Modelgroup—16.93±0.45##DEXA组DEXAgroup—5.57±0.30**WEPS组WEPSgroup1.515.61±0.26*△△PCWEPS组PCWEPSgroup1.513.95±0.18**DPCWEPS组DPCWEPSgroup1.516.37±0.33RLQS组RLQSgroup1.515.41±0.31**△△
注:##表示与对照组比较P<0.01;*、**分别表示与模型组比较P<0.05、P<0.01;△△表示与PCWEPS组比较P<0.01。
Note:Compared with control group,## wereP<0.01. Compared with model group,* and ** wasP<0.05 andP<0.01,respectively. Compared with PCWEPS group,△△ indicatedP<0.01.
2.4头花蓼及热淋清颗粒含药血清对细胞释放TNF-α和IL-6的影响由表4可知,与对照组比较,模型组显著诱导RAW264.7细胞释放TNF-α和IL-6(P<0.01);与模型组比较,WEPS、PCWEPS、DPCWEPS、RLQS均能不同程度地抑制RAW264.7细胞释放TNF-α和IL-6(P<0.01);与PCWEPS组比较,WEPS、DPCWEPS、RLQS组TNF-α和IL-6的释放量具有显著性差异(P<0.05或P<0.01)。因此,PCWEPS具有较强地抑制细胞释放TNF-α和IL-6的作用。

表4 含药血清对RAW264.7细胞释放TNF-α和IL-6的影响 (n=6)
注:##表示与对照组比较P<0.01;**表示与模型组比较P<0.01;△、△△分别表示与PCWEPS组比较P<0.05、P<0.01。
Note:Compared with control group,## wereP<0.01. Compared with model group,** wereP<0.01. Compared with PCWEPS group,△ and △△ indicatedP<0.05 andP<0.01,respectively.
3 讨论与结论
LPS诱导RAW264.7细胞的体外炎症模型被广泛用于抗炎药物的评价[7]。当机体发生炎症时致炎物质和炎症介质会增加NO的合成和释放,过量的NO及其稳定性衍生物过氧亚硝基阴离子对细胞具有毒性作用,因此限制NO的过量释放可以预防和治疗炎症[8];TNF-α 作为一个重要的早期炎症因子可诱发IL-6以及继发性炎症介质NO的释放[9],因此抑制TNF-α 的释放在治疗炎症的过程中也显得尤为重要;现有研究表明在多种炎症相关疾病中均伴有明显的IL-6水平升高,因此IL-6表达水平也是常用的抗炎检测指标[10]。该研究发现,头花蓼各提取物及热淋清颗粒含药血清均能够抑制RAW264.7细胞释放炎症因子NO、TNF-α及IL-6,其中头花蓼水提醇沉提取物含药血清抑制细胞释放炎症因子的作用最强,因此其为头花蓼主要的抗炎有效物质。
4组含药血清抑制LPS刺激RAW264.7细胞释放NO、TNF-α、IL-6的作用强度从强到弱依次为PCWEPS、RLQS、WEPS、DPCWEPS。头花蓼水提醇沉沉淀物中主要为多糖和蛋白类化合物,其抗炎活性较弱。热淋清颗粒以头花蓼水提物为主要原料,可能是由于热淋清颗粒的制备工艺较为成熟使其更易于吸收,导致其含药血清的抗炎活性略优于头花蓼水提物含药血清的抗炎活性。PCWEPS的抗炎活性最强,可能是由于乙醇沉淀法有效除去蛋白质、多糖、鞣质等杂质,有效成分得到富集[3],其中富含槲皮素、没食子酸、山奈酚、儿茶素以及多种酚酸类等化合物[11],使其含药血清的抗炎活性得到较大程度的提高,这为改善热淋清颗粒临床用量较大提供了理论依据。
综上所述,头花蓼水提物、水提醇沉提取物、水提醇沉沉淀物及热淋清颗粒含药血清均能不同程度地通过抑制炎症因子NO、TNF-α和IL-6的释放而发挥抗炎作用,其中头花蓼水提醇沉提取物为头花蓼主要的抗炎有效物质,因此采用水提后醇沉的方法能够提高头花蓼的抗炎活性,这为从细胞水平上深入探讨头花蓼在治疗泌尿系统感染中的作用奠定了基础,也为头花蓼的进一步开发应用提供了理论依据。
[1] ANJU B,SANJAY C,KUSUM H. Pseudomonas quinolone signaling system:A component of quorum sensing cascade is a crucial player in the acute urinary tract infection caused byPseudomonasaeruginosa[J].Int J Med Microbiol,2014,304(8):1199-1208.
[2] 王重洋,潘舒,吴亚利,等.热淋清颗粒药理作用实验研究[J].实用中医内科杂志,2012,26(3):12-14.
[3] 龚金炎,陈丽春,张蕾,等. 乙醇沉淀法对头花蓼水提物活性成分和抗氧化活性的影响研究[J].中成药,2014,36(5):1072-1074.
[4] YIN J J,LUO Y Q,DENG H L,et al. Hugan Qingzhi medication ameliorates hepatic steatosis by activating AMPK and PPARα pathways in L02 cells and HepG2 cells[J].J Ethnopharmacol,2014,154(1):229-239.
[5] 张丽娟. 苗药头花蓼抗菌物质基础研究[D].贵阳:贵阳医学院,2012:3-14.
[6] 田友清,尚靖,何婷,等. 基于中药血清化学及血清药理学方法探讨香青兰保护心肌细胞缺氧/复氧损伤物质基础[J].中国中药杂志,2012,37(5):620-624.
[7] 张馨方,王强松,崔元璐. 痹褀胶囊提取物对RAW264.7细胞模型的抗炎作用[J].中成药,2014,36(1):26-30.
[8] 汪娟,蒋维,王毅. 降香中黄酮类化合物对脂多糖诱导的RAW264.7细胞抗炎作用研究[J].细胞与分子免疫学杂志,2013,29(7):681-684.
[9] 张晓红,董莉,杨雅欣,等. 紫金龙乙醇组分对脂多糖诱导的RAW264.7细胞分泌炎症因子的影响[J].中国实验方剂学杂志,2014,20(21):149-152.
[10] 刘晶,潘晓华,宋珍,等. 牛蒡低聚果糖对脂多糖诱导下RAW264.7细胞炎症模型的抗炎作用[J].山东大学学报(医学版),2012,50(12):41-46.
[11] LIAO S G,ZHANG L J,SUN F,et al. Identification and characterisation of phenolics inPolygonumcapitatumby ultrahigh-performance liquid chromatography with photodiode array detection and tandem mass spectrometry[J].Phytochem Anal,2013,24(6):556-568.
Screening of Effective Anti-inflammatory Extracts fromPolygonumcapitatumBased on Serum Pharmacological Method
XU Dan1, 2,ZHAO Fei-fei1, 3,YANG Xin1, 3, LIAO Shang-gao1, 2*et al
(1. School of Pharmacy, Guizhou Medical University, Guiyang, Guizhou 550004; 2. Engineering Research Center for the Development and Application of Ethnic Medicines and TCM, Ministry of Education, Guiyang, Guizhou 550004; 3. Guizhou Provincial Key Laboratory of Pharmaceutics, Guiyang, Guizhou 550004)
[Objective] To research the effects of different extracts fromPolygonumcapitatumand drug-containing serum of Relinqing granules on releasing inflammatory factor of mouse monocyte-macrophage (RAW264.7 cell) by serum pharmacological method, and to screen effective anti-inflammatory extracts fromP.capitatum. [Method] Serum pharmacological evaluation method ofP.capitatumwas adopted. The inflammatory cell model was produced by LPS (10 ng/mL)-treated RAW264.7 cells. The cell viability was detected by MTT method. NO production was detected by the Griess assay, TNF-α and IL-6 were quantitated by the enzyme-linked immunosorbent assay (ELISA) in the cell culture supernatant to investigate the effect of drug-containing serum ofPolygonumcapitatumof its water extract (WEPS), protein-free water extract (PCWEPS), deposition of protein-free water extract (DPCWEPS) and Relinqing granules (RLQS) on inflammatory cytokines in macrophage cells. [Result] The drug-containing serums could significantly inhibit the release of NO, TNF-α and IL-6 in LPS-induced RAW264.7 cells compared with the model group (P<0.05,P<0.01), in which PCWEPS had the best effect on NO, TNF-α and IL-6 inhibitory. [Conclusion] Protein-free water extract ofPolygonumcapitatumis the main extract for anti-inflammatory.
Polygonumcapitatum; Relinqing granules; Serum pharmacology; RAW264.7 cells; Inflammatory cytokines
国家自然科学基金项目(81160516,81560570)。
徐丹(1991- ),女,江苏镇江人,硕士研究生,研究方向:药物化学。*通讯作者,教授,博士,硕士生导师,从事天然药物的化学、药理和代谢研究。
2016-05-16
S 567.23+9
A
0517-6611(2016)17-134-03

