基于硼酸-二醇特异性识别作用的层层组装薄膜对肌红蛋白的吸入及其电化学研究
姚惠琴, 黄 珊, 苏巧玲, 史可人, 甘倩倩, 王明科
(1. 宁夏医科大学药学院, 基础医学院, 银川 750004; 2. 宁夏大学能源化工国家重点实验室, 银川 750021)
基于硼酸-二醇特异性识别作用的层层组装薄膜对肌红蛋白的吸入及其电化学研究
姚惠琴1, 黄珊1, 苏巧玲1, 史可人2, 甘倩倩1, 王明科1
(1. 宁夏医科大学药学院, 基础医学院, 银川 750004; 2. 宁夏大学能源化工国家重点实验室, 银川 750021)
摘要合成了既含有苯硼酸(PBA)基团又含有羧酸基团的聚电解质PAA-PBA(PAA: 聚丙烯酸). 采用层层组装(LbL)技术, 利用PAA-PBA和葡聚糖(Dex)之间的硼酸-二醇特异性识别作用, 在热解石墨电极(PG)表面构筑了{PAA-PBA/Dex}nLbL薄膜, 该薄膜从溶液中吸入肌红蛋白(Mb)形成{PAA-PBA/Dex}n-Mb薄膜. 采用循环伏安方法研究了{PAA-PBA/Dex}n薄膜中Mb的直接电化学及对氧气和过氧化氢的电催化还原过程. 结果表明, 该薄膜为保持Mb的生物活性提供了良好的微环境, 是一种新型的可固定蛋白质的LbL薄膜, 为设计基于酶的直接电化学生物传感器提供了新思路.
关键词直接电化学; 电催化; 层层组装; 硼酸-二醇特异性识别作用; 肌红蛋白
氧化还原蛋白质或酶在基底上的固定是不依赖于媒介体的电化学生物传感器、 生物反应器及其它生物装置的重要前提, 已引起了研究者的广泛关注[1]. 在固体表面固定酶或蛋白质并有效实现蛋白质直接电化学的方法之一是将其固定在修饰于电极表面的薄膜中[2]. 在各种制备薄膜的方法中, 层层组装(LbL)技术表现出显著的优势, 它能够根据预先设计的方案在纳米或分子层次上控制薄膜的组成与厚度, 且组装程序非常简便[3,4].LbL组装的成膜驱动力既包括静电作用力也包括各种非静电作用力, 如离子-偶极作用力、 氢键作用和特异性相互作用等[5,6]. 在各种特异性相互作用中, 硼酸基团和二醇单元之间的相互作用在构筑薄膜方面引起了许多研究者的兴趣[7~12]. 苯硼酸(PBA)及其衍生物能够与各种1,2-或1,3-顺二醇化合物(如多元醇、 糖类化合物)之间形成共价键, 并生成五元或六元环状的硼酯复合物[13]. 如聚乙烯醇或甘露糖可以与含有PBA基团的聚电解质构筑LbL薄膜[10,11]. 1个单糖分子通常含有5个—OH基团, 而1个PBA基团可以与2个—OH基团结合, 因此它们可以形成1∶2型糖-PBA复合物[10,14]. 葡聚糖(Dex)是以葡萄糖为单体的聚多糖, 其分子骨架上含有多个可以与PBA基团结合的葡萄糖单元[10,15]. 虽然Dex和PBA之间的特异性亲和作用已有报道, 但是由Dex与含有PBA基团的聚电解质构筑的蛋白质层层组装薄膜至今未见报道.
吸入型蛋白质LbL薄膜是一种新型的蛋白质LbL薄膜[3,16~18], 它通过将固体基底表面组装的聚合物和/或纳米粒子LbL薄膜浸泡在蛋白质溶液中, 使蛋白质自发吸入薄膜而形成. 与通常的直接用蛋白质和其它组分构筑的蛋白质LbL薄膜相比, 吸入型蛋白质LbL薄膜中的蛋白质是自发地扩散进入薄膜内部, 并且独立于LbL薄膜的组装过程, 因此该方法在保持蛋白质的原有结构和生物活性方面表现出独特的优点. 在电极上构筑不同类型的吸入型蛋白质LbL薄膜的研究已有报道, 并实现了氧化还原蛋白质在该类型薄膜电极上的直接电化学[19,20].
本文首先通过氨基苯硼酸与聚丙烯酸(PAA)羧基之间的缩合反应将PBA基团接枝到PAA骨架上, 得到产物PAA-PBA[11]; 然后利用PAA-PBA与Dex之间的硼酸-二醇特异性识别作用, 在热解石墨(PG)电极表面上组装{PAA-PBA/Dex}nLbL薄膜, 最后再从溶液中吸入Mb, 制得{PAA-PBA/Dex}n-Mb薄膜. 该薄膜为保持Mb的生物活性提供了良好的微环境, 并实现了Mb在薄膜中的直接电化学及其对氧和过氧化氢的电催化还原, 扩展了蛋白质LbL薄膜成膜材料的范围, 有助于发展新型的基于蛋白质或酶直接电化学的电化学生物传感器.
1实验部分
1.1试剂
马骨骼或肌肉肌红蛋白(Mb, MW≈17800)、 3-氨基苯硼酸半硫酸盐(APBA)、 聚丙烯酸(Mw≈100000, 质量分数35%水溶液)、 4-羟乙基哌嗪乙磺酸(HEPES, 纯度99.5%)、 N-(3-二甲氨基丙基)-N′-乙基-碳二亚胺盐酸盐(EDC)、 N-羟基丁二胺磺酸钠(NHS)、 葡聚糖(Mw≈200000)和壳聚糖(CS, 酰胺化程度大于85%, Mw≈200000)、 醋酸钠和磷酸二氢钠均为分析纯, 购自Sigma-Aldrich公司.K3Fe(CN)6、K4Fe(CN)6和过氧化氢(H2O2, 质量分数30%)购自北京化工厂. 缓冲溶液为0.1mol/L的醋酸钠溶液(pH=4.0~6.0)、 0.05mol/L的磷酸二氢钠溶液(pH≈7.0~8.5)和0.05mol/L的硼酸溶液(pH=9.0), 用稀HCl或KOH溶液调节到所需pH值, 缓冲溶液中均含有0.1mol/LNaCl. 所有溶液均用经过离子交换和蒸馏纯化的三次蒸馏水配制. 实验用水均为经过离子交换和蒸馏纯化的三次水.
1.2PAA-PBA的合成
根据文献[19,21], 使PAA与APBA在交联剂NHS和EDC的存在下发生缩合反应, 将PBA接枝到PAA骨架上来合成PAA-PBA聚电解质使, 其合成路线如Scheme1所示, 具体过程如下: 将0.57gPAA水溶液(含有2.77mmol单体)用HEPES缓冲溶液(20mL, 50mmol/L)稀释, 将溶液pH值调至8.5; 将APBA(20mL, 61mmol/L)同样溶于pH=8.5的HEPES缓冲溶液(20mL, 50mmol/L)中; 然后将上述2种溶液混合, 再滴入含有NHS(4mL, 31mmol/L)的HEPES缓冲溶液(50mmol/L,pH=8.5), 并搅拌10min. 将含有EDC(4mL, 310mmol/L)的HEPES缓冲溶液(50mmol/L,pH=8.5)加入到上述反应混合溶液中, 室温下搅拌12h. 然后将上述溶液透析7d以除去所有小分子量的杂质, 冷冻干燥后得到白色粉末状固体产物PAA-PBA.

Scheme 1 Synthetic route of PAA-PBA
1.3{PAA-PBA/Dex}n-Mb薄膜的组装
PG电极的制作: 用热缩管将直径为4.5mm、 长为6mm左右的圆柱型BasalplanePG(AdvancedCeramic公司)密封在直径与之相等的不锈钢圆柱棒一端. 使PG的一侧表面紧贴在不锈钢棒一端的表面, 从而形成导电通路, 而PG的另一侧表面作为电极表面. 将电极表面在320目的金相砂纸上打磨后, 再在蒸馏水中超声30s, 洗净吹干后作为实验中的工作电极. 电极表面的几何面积为0.16cm2.
将处理好的PG电极首先在带有正电荷的CS溶液(1mg/mL,pH=5.0)中浸泡15min, 使之在PG表面吸附一层CS前驱膜. 然后将PG/CS电极交替浸入带有负电荷的PAA-PBA(1mg/mL,pH=9.0)和中性Dex(1mg/mL,pH=9.0)水溶液中各15min, 溶液转换时用水清洗并吹干, 可在电极表面形成一个PAA-PBA/Dex双层. 重复上述过程直到在PG/CS表面上形成所需双层数(n)的{PAA-PBA/Dex}nLbL薄膜. 将组装好的上述薄膜电极浸入1mg/mL的Mb溶液(pH=5.0, 含0.2mol/LNaCl)中使Mb分子扩散到薄膜内部, 然后取出洗涤并吹干, 制得薄膜{PAA-PBA/Dex}n-Mb. 然后将固载了Mb的薄膜转移到pH=7.0的空白缓冲溶液中进行电化学研究.
1.4测试

2结果与讨论
2.1{PAA-PBA/Dex}nLbL薄膜的层层组装

Fig.1
打磨后的PG电极暴露出一些棱面(edge面), 因此既具有疏水性也具有亲水性. 由于棱面的碳被氧化后连接有O-,OH-等基团, 因此表面带有负电荷[22].CS在pH=5.0时因pKa≈6.5[23]而带有正电荷, 因此可以作为前驱膜吸附在PG电极表面[22].PAA-PBA的分子骨架中含有大量的自由的—COOH基团,PAA在水溶液中的pKa约为6.0[24~27], 因此在pH=9.0时PAA-PBA中自由的羧基被离子化而带负电荷, 这样带负电荷的PAA-PBA可以被静电吸附到带有相反电荷的PG/CS膜表面. 因此PG电极与CS之间、CS与PAA-PBA之间的组装驱动力主要是静电作用力. 后续组装的Dex是一种不带电荷的中性聚多糖,Dex在PAA-PBA表面的吸附以及后续{PAA-PBA/Dex}n多层膜的组装主要通过硼酸-二醇特异性识别作用相结合.
图1为以K3Fe(CN)6为电活性探针监测的{PAA-PBA/Dex}n薄膜在PG电极表面的循环伏安曲线. 在裸的PG或PG/CS薄膜电极上,K3Fe(CN)6在pH=7.0的溶液中于0.17V附近出现一对良好的、 近乎可逆的氧化还原峰. 而当{PAA-PBA/Dex}nLbL薄膜组装到PG/CS表面后, 探针的氧化还原峰电流显著下降, 这是因为在电极表面形成的薄膜屏障阻碍了探针到达底层的电极表面并进行电子交换. 随着薄膜双层膜数n的增加,K3Fe(CN)6的电流逐渐降低, 由此表明在PG电极表面构筑了{PAA-PBA/Dex}n多层薄膜.
2.2{PAA-PBA/Dex}n薄膜对Mb的吸入
在合适的条件下,Mb能够从其水溶液中被自发地吸入到{PAA-PBA/Dex}n薄膜之中, 形成{PAA-PBA/Dex}n-Mb薄膜. 图2是以Fe(CN)3-/4-6为电活性探针裸的PG电极、PG/CS薄膜电极和PG/CS/{PAA-PBA/Dex}6薄膜电极的电化学阻抗谱. 对于裸的PG电极和PG/CS薄膜电极,Fe(CN)3-/4-6的EIS响应在pH=7.0的溶液中都表现为一条Warburg直线(图 2曲线a和b), 这是受扩散控制的电化学过程的特征. {PAA-PBA/Dex}6薄膜在Mb溶液中浸泡9h后, 在高频区可以观察到1个明显的半圆形响应(曲线d), 其EIS响应的半圆直径远远大于吸入Mb之前的{PAA-PBA/Dex}6薄膜的半圆直径(曲线c). 半圆的直径通常等于探针的电荷转移电阻[28]. 对于薄膜体系, 电荷转移电阻主要反映了探针在薄膜中扩散的难易程度, 与薄膜的通透性直接相关[29]. 由此说明吸入{PAA-PBA/Dex}6薄膜中的Mb作为物理屏障进一步阻碍和限制了探针到达电极表面, 从而反过来证实了Mb在薄膜中的吸入.
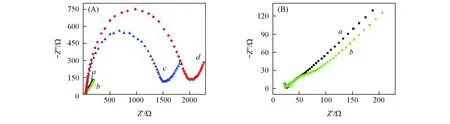
Fig.2 EIS responses of bare PG(a), PG/CS film(b), PG/CS {PAA-PBA/Dex}6 film(c) and PG/CS{PAA-PBA/Dex}6-Mb film(d) at 0.17 V in pH=7.0 buffers containing 5.0 mmol/L Fe(CN)3-/4-(A) and magnification of curves a and b of (A) (B)
Mb的等电点为6.8[30], 其表面净电荷在pH=5.0时为正. 而{PAA-PBA/Dex}6薄膜是由带负电荷的PAA-PBA和不带电荷的Dex两种成膜材料组成, 因此{PAA-PBA/Dex}6薄膜带负电荷. 在pH=5.0条件下, 带负电荷的薄膜将吸引带正电荷的Mb. 因此,Mb和{PAA-PBA/Dex}6薄膜中PAA-PBA组分之间的静电吸引力也是促使薄膜吸入Mb的另一重要驱动力.
由于薄膜中的Mb具有电活性, 可以作为指示剂, 因此其吸入过程也可以通过CV响应来监测. 例如, 将组装了{PAA-PBA/Dex}6薄膜的PG电极浸入Mb溶液中一定时间后水洗、 吹干, 然后转移到pH=7.0的空白缓冲溶液中, 在0.1~-0.8V的电位范围为进行CV扫描, 在-0.34V(vs.SCE)处可以观察到一对可逆性良好的还原氧化峰[图3(A), 曲线b~k], 这是Mb中血红素Fe(Ⅲ)/Fe(Ⅱ)电对的特征峰[3,31]. 平行实验中的6组PG/CS{PAA-PBA/Dex}6-Mb薄膜电极的平均式量电位[E°′CV氧化峰和还原峰的峰电位的平均值]为-0.34V, 标准偏差为0.011V, 表明薄膜的重现性非常好. 而不含Mb的{PAA-PBA/Dex}6薄膜在此电位范围内没有任何CV响应[图3(A), 曲线a].Mb的CV还原峰电流(Ipc)随着{PAA-PBA/Dex}6多层膜在Mb溶液中浸泡时间的延长而增加, 在大约9h后达到稳态[图3(B)]. 因此, 在以后的实验中多层膜在Mb溶液中的浸泡时间均为9h. {PAA-PBA/Dex}6-Mb薄膜的CV阴极峰和阳极峰的峰高和峰面积几乎相等, 且在0.05~2.0V/s范围内峰电流与扫速呈线性关系, 表明该薄膜中Mb的伏安行为具有典型的非扩散控制的薄层电化学的特征[32]. 在此条件下, 对{PAA-PBA/Dex}6-Mb薄膜的CV阴极峰进行积分, 可得到薄膜中全部电活性的Mb发生还原反应时的电量Q, 根据法拉第定律Q=NAFΓ*[其中N是电子转移数(1), A是PG电极表面的几何面积(0.16
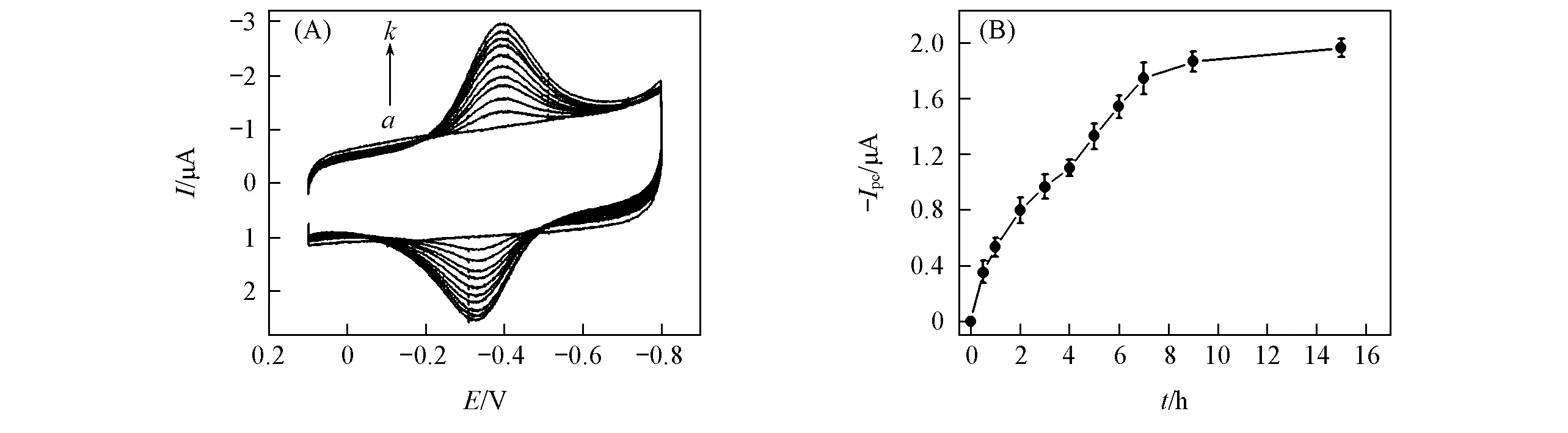
Fig.3 CVs in pH=7.0 buffers at a scan rate of 0.2 V/s for {PAA-PBA/Dex}6-Mb film after {PAA-PBA/Dex}6 film was immersed in 1 mg/mL Mb solutions at pH=5.0 for different time(A) and effect of the immersing time in Mb solution on reduction peak currents of electroactive Mb(Ipc) for {PAA-PBA/Dex}6-Mb film(B) (A) t/h: a. 0; b. 0.5; c. 1.0; d. 2.0; e. 3.0; f. 4.0; g. 5.0; h. 6.0; i. 7.0; j. 9.0; k. 15.0.
cm2), F为法拉第常数(96487C/mol)], 可以将Q进一步换算为电活性Mb在薄膜电极上的表面浓度(Г*,mol/cm2)[32]. 如果采用Γ*9h表示在Mb溶液中浸泡9h后薄膜中电活性Mb的表面浓度, 则6组平行实验的{PAA-PBA/Dex}6-Mb薄膜的平均Γ*9h约为1.25×10-10mol/cm2.
对于双层数n不同的{PAA-PBA/Dex}n-Mb薄膜,Mb在薄膜电极上的表面浓度Γ*与浸泡时间的关系表现出相同的趋势, 即Γ*随着浸泡时间的延长而增大, 在大约9h后趋于稳态. 双层数不同时, {PAA-PBA/Dex}n-Mb薄膜在Mb溶液中浸泡9h后表现出不同的Γ*值(图4), Γ*值随着双层数n的增加而增大, 当n=6时, Γ*达到最大值, 继而呈现下降趋势(因此在以后的实验中选择双层数为6的{PAA-PBA/Dex}6-Mb薄膜作为研究对象), 这是因为随着薄膜双层数n从1增加到6, {PAA-PBA/Dex}n薄膜变得越来越厚, 这样可以吸纳更多的Mb分子, 因而倾向于获得更大的Γ*值; 但是同时薄膜的通透性会随着薄膜厚度的增加而降低, 因此溶液中小分子量的对离子进出薄膜变得越来越困难, 导致Mb分子之间的电子自交换更加困难, 故Γ*值呈减小的趋势. 这2种效果相反的因素共同作用, 使得Γ*值在n=6时达到最大值.

Fig.4 Effect of different number of bilayers(n) on the surface concentration of electroactive Mb(Γ*) after {PAA-PBA/Dex}n films were immersed in 1 mg/mL Mb solutions for 9 h

Fig.5 CVs at a scan rate of 0.2 V/s for {PAA-PBA/Dex}6-Mb films in pH=7.0 buffers a. The first cycle; b. after 200 cycles; c. after the films were immersed in pH=7.0 buffers for 7 d.
将{PAA-PBA/Dex}6-Mb薄膜置于空白缓冲溶液中, 在所研究的电位范围内进行CV扫描200圈后,CV峰的位置仍然保持不变, 峰高只下降了约1.5%; 将{PAA-PBA/Dex}6-Mb薄膜于空白缓冲溶液中浸泡7d后, 其峰电流值仍能够保持其起始峰高的80%(图5).
2.3薄膜的表面形貌

Fig.6 SEM top views of {PAA-PBA/Dex}6(A), {PAA-PBA/Dex}6/PAA-PBA(B) and {PAA-PBA/Dex}6-Mb films(C) assembled on PG/CS surface
用SEM对组装在PG/CS表面的{PAA-PBA/Dex}6, {PAA-PBA/Dex}6/PAA-PBA和{PAA-PBA/Dex}6-Mb层层组装薄膜的表面形貌进行了表征. 由图6可以看出, 在相同的放大倍率下, {PAA-PBA/Dex}6薄膜和{PAA-PBA/Dex}6/PAA-PBA薄膜的表面形貌比较平整, 并能观察到一些孔洞或通道, 没有表现出明显的差异, 表明组装过程中相邻的PAA-PBA与Dex层有一定程度的相互交错或渗透. 而{PAA-PBA/Dex}6-Mb薄膜显示出相对粗糙的表面, 说明溶液中的Mb分子不但被吸入到薄膜的内部, 而且吸附在{PAA-PBA/Dex}6薄膜的表面. 被吸入到薄膜内部的Mb对{PAA-PBA/Dex}6-Mb直接电化学响应做出了主要贡献, 这是因为溶液中的Mb在薄膜表面的吸附过程一般不到30min即可达到稳态[33], 而本实验中Mb在{PAA-PBA/Dex}6薄膜中的固载达到稳态所需要的时间大约为9h, 表明蛋白质进入薄膜是一个相对缓慢的过程.
2.4测试底液的pH值和支持电解质的影响

Fig.7 CVs of {PAA-PBA/Dex}6-Mb films at a scan rate of 0.2 V/s in buffers at different pH pH: a. 4.0; b. 6.0; c. 7.0; d. 8.5. Inset: influence of pH of testing solutions on the formal potential(E°′) estimated by CV at a scan rate of 0.2 V/s for {PAA-PBA/Dex}6-Mb film.
将已经吸入Mb达稳态的{PAA-PBA/Dex}6-Mb薄膜电极置于不同pH值的0.1mol/LNaCl测试底液中进行CV扫描, 由图7可见,Mb的CV峰位置表现出明显的移动. 体系的式量电位E°′随着底液pH值的增加而负移. 在pH=4.0~9.0范围内, E°′与测试底液的pH值呈线性关系, 斜率为-53.3mV/pH[图7插图]. 该值近似于具有相同质子与电子转移数的伴随着有质子转移的可逆电极反应的理论值(-58mV/pH, 20 ℃)[34]. 由此说明该薄膜电极上Mb的血红素辅基在发生单电子传递的同时, 很可能伴随着1个质子的转移:
(1)
根据电子跳跃机理, {PAA-PBA/Dex}6-Mb薄膜中Mb分子与电极之间发生电子交换时为了补偿电子转移过程中造成的薄膜内的电荷改变, 即维持薄膜相的电中性, 溶液相中的对离子必须能够进入或离开薄膜相以补偿由于电子转移造成的薄膜内部电荷的不均衡. 例如, 当薄膜内MbFe(Ⅲ)发生还原时, 薄膜内会产生多余的负电荷, 因此需要薄膜相中的阴离子转移到溶液相, 或者溶液相中的阳离子转移到薄膜相, 以补偿由于电子转移所产生的多余负电荷[35]. 不同类型支持电解质对{PAA-PBA/Dex}6-Mb薄膜电化学行为的影响如图8所示. 可见, 不同支持电解质对{PAA-PBA/Dex}6-Mb薄膜CV峰形的影响很小, 它们峰高和峰电位基本一致.

Fig.8 CVs at before and after different volume of air was injected 0.2 V/s for {PAA-PBA/Dex}6-Mb films in pH=7.0 buffers containing 0.1 mol/L different supporting electrolytes a. NaCl; b. KCl; c. NaBr.

Fig.9 CVs at 0.2 V/s in 10 mL of pH=7.0 buffers for {PAA-PBA/Dex}6(a), {PAA-PBA/Dex}6-Mb films before(b) and {PAA-PBA}6-Mb films(c—j) after different volume of air was injected V(air)/nL: b. 60; c. 50; d. 10; e. 15; f. 20; g. 30; h. 40; i. 60; j. 90.
2.5{PAA-PBA/Dex}6-Mb薄膜的电催化性质
用循环伏安法研究了{PAA-PBA/Dex}6-Mb薄膜电极对氧气和过氧化氢等底物的电化学催化还原行为. 当用注射器向经过除氧的pH=7.0的缓冲溶液中注入一定量的空气后(图9), 与通入空气之前相比, 可以观察到{PAA-PBA/Dex}6-Mb薄膜电极在大约-0.4V左右的CV还原峰电流随着空气通入量的增加而显著增加, 并且伴随着MbFe(Ⅱ)氧化峰的消失, 这是由于MbFe(Ⅱ)已经与溶液中的氧发生了化学反应. 而对于不含Mb的{PAA-PBA/Dex}6薄膜电极, 氧气直接还原的峰电位大约在-0.9V左右. 因此, {PAA-PBA/Dex}6-Mb薄膜中的Mb使氧的还原过电位降低了大约0.5V. 结果证明薄膜中的Mb可以有效地电催化还原O2.
{PAA-PBA/Dex}6-Mb薄膜电极也可以用来电催化还原H2O2(图 10). 将H2O2注入pH=7.0的缓冲溶液中,CV结果显示, {PAA-PBA/Dex}6-Mb薄膜电极中Mb的CV氧化峰降低而还原峰显著增大, 并随着溶液中H2O2浓度的增大, 还原峰电流值逐渐增高, 线性范围为2.0~85μmol/L[图10(B)]. 然而对于不含Mb的{PAA-PBA/Dex}6薄膜, 在扫描电位0.1~-1.2V的范围内则没有观察到H2O2的直接电化学还原信号(曲线 a).

Fig.10 CVs at a scan rate of 0.2 V/s for {PAA-PBA/Dex}6 films in buffers(pH=7) containing 100 μmol/L H2O2(a), {PAA-PBA/Dex}6-Mb films(b), {PAA-PBA/Dex}6-Mb films with 20(c), 40(d), 60(e), 80(f), 100(g) and 150 μmol/L(h) H2O2 in pH=7.0 buffers, respectively(A) and dependence of CV Ipc on the concentration of H2O2 for {PAA-PBA/Dex}6-Mb film at 0.2 V/s(B)
3结论
合成了既含有PBA基团又含有羧酸基团的聚电解质PAA-PBA, 并将其用作成膜材料, 利用PAA-PBA和Dex二者之间的硼酸-二醇特异性识别作用, 采用层层组装技术, 在电极表面上构筑了{PAA-PBA/Dex}nLbL薄膜. 生物大分子Mb可以自发地从pH=5.0的缓冲溶液中进入该多层薄膜中, 形成稳定的{PAA-PBA/Dex}n-MbLbL薄膜. {PAA-PBA/Dex}n薄膜为保持Mb的生物活性提供了适宜的微环境, 并实现了Mb在薄膜中的直接电化学及其对氧和过氧化氢的电催化还原. 采用循环伏安法、 电化学阻抗法和扫描电子显微镜等表征了{PAA-PBA/Dex}n多层膜的组装及{PAA-PBA/Dex}n-Mb薄膜的性质. 结果表明, 利用硼酸-二醇特异性识别作用构筑的{PAA-PBA/Dex}n-Mb吸入型蛋白质层层组装薄膜是一种新型的蛋白质LbL薄膜, 可作为不依赖于媒介体的电化学生物传感器的基础, 为设计基于酶的直接电化学的生物传感器提供了新思路.
参考文献
[1]ChaplinM.F.,BuckeC., Enzyme Technology, Cambridge University Press,Cambridge, 1990
[2]RuslingJ.F., Acc. Chem. Res., 1998, 31, 363—369
[3]DecherG.,SchneloffJ.B., Multilayer Thin Films: Sequential Assembly of Nano-composite Materials,Wiley-VCH,Weinheim,Germany, 2012, 23—36
[4]DuanY.,AnQ.,ZhangQ.,ZhangY., Chem. Res. Chinese Universities, 2015, 31(4), 674—679
[5]JiangM.,EisenbergA.,LiuG.J.,ZhangX., Macromolecular Self-Assembly,ScientificPress,Beijing, 2008, 150—175
[6]SunJ.,ZhuZ.Y.,LaiJ.P.,LuoJ.,LiuX.Y., Chem. J. Chinese Universities, 2015, 36(3), 581—588(孙军, 朱正意, 赖健平, 罗静, 刘晓亚. 高等学校化学学报, 2015, 36(3), 581—588)
[7]EaawaY.,MikiR.,SekiT., Materials, 2014, 7, 1201—1220
[8]IwamiY.,YamamotoH.,KanekiyoY., Chem. Lett., 2013, 42(10), 1214—1216
[9]LiuL.,XiaN.,XingY.,DengD., Int. J. Electrochem. Sci., 2013, 8, 11161—11174
[10]LacinaK.,SkladalP.,James,T., Chem. Central J., 2014, 8, 60—77
[11]LevyT.,DejugnatC.,SukhorukovG.B., Adv. Funct. Mater., 2008, 18, 1586—1594
[12]SongS.Y.,YoonH.C., Sens. Actuators,B, 2009, 140, 233—239
[13]JamesT.D.,PhillipsM.D.,ShinkaiS., Boronic Acids in Saccharide Recognition,RSCPublishing,Cambridge, 2006, 13—33
[14]LiS.,DavisE.N.,AndersonJ.,LinQ.,WangQ., Biomacromolecules, 2009, 10, 113—118
[15]ZhangJ.,GeddesC.D.,LakowiczJ.R., Anal. Biochem., 2004, 332, 253—260
[16]ArigaK.,JiQ.,HillJ.P., Adv. Polym. Sci., 2010, 229, 51—87
[17]SongW.,SongX.,YangC.,GaoS.,KlausenL.H.,ZhangY.,DongM.,KjemsJ., Int. J. Nanomed., 2015, 10, 2335—2346
[18]HammondP.T., Materials, 2012, 15(5), 196—206
[19]YaoH.,GuoH.,HuN., Electrochim. Acta, 2009, 54, 7330—7338
[20]GuoX.,ZhangH.,HuN., Nanotechnology, 2008, 19, 055709—055719
[21]LevyT.,DejugnatC.,SukhorukovG.B., Adv. Funct. Mater., 2008, 18, 1586—1594
[22]HillH.A.O., Pure Appl. Chem., 1987, 59, 743—748
[23]Nilsen-NygaardJ.,StrandS.P.,VarumK.M.,DragetK.I.,NordgardC.T., Polymer, 2015, 7, 552—579
[24]MittalK.L., Acid-Base Interactions: Relevance to Adhesion Science and Technology,VSP,Utrecht,Vol. 2, 2000, 18—25
[25]LaguecirA.,UlrichS.,LabilleJ.,Fatin-RougeF.,StollS.,BuffleJ., Eur. Polym. J., 2006, 42, 1135—1144
[26]DelaittreG.,NicolasJ.,LefayC.,SaveM.,CharleuxB., Chem. Commun., 2005, 614—616
[27]GregorH.P.,LuttingerL.B.,LoeblE.M., J. Am. Chem. Soc., 1954, 76, 5879—5880
[28]KatzE.,WillnerI., Electroanalysis, 2003, 15, 913—918
[29]SabataniE.,Cohen-BoulakiaJ.,BrueningM.,RubinsteinI., Langmuir, 1993, 9, 2974—2980
[30]BellelliA.,AntoniniG.,BrunoriM.,SpringerB.A.,SligarS.G., J. Biol. Chem., 1990, 265, 18898—18901
[31]LvovY.,LuZ.,ZuX.,SchenkmanJ.,RuslingJ., J. Am. Chem. Soc., 1998, 120, 4073—4077
[32]MurrayR.W.;BardA.J.(Ed.); Electroanalytical Chemistry, Vol. 13,MarcelDekker,NewYork, 1984, 191
[33]LvovY.;LvovY.,MöhwaldH.Eds.; Protein Architecture: Interfacing Molecular Assemblies and Immobilization Biotechnology,MarcelDekker,NewYork, 2000, 125
[34]BondA.M., Modern Polarographic Methods in Analytical Chemistry,MarcelDekker,NewYork, 2011, 15—34
[35]LiuY.,LiuH.,GuoX.,HuN., Electroanalysis, 2010, 22, 2261—2268
(Ed.:S,Z,M)
†SupportedbytheProgramofScientificStudiesoftheNingxiaHigherEducationInstitutions,China(No.NGY2014101)andtheNationalInnovationExperimentProgramforUniversityStudents,China(No.20140315).
doi:10.7503/cjcu20150943
收稿日期:2015-12-10. 网络出版日期: 2016-04-22.
基金项目:高等学校科学研究项目(批准号: NGY2014101)和国家级大学生创新实验计划项目(批准号: 20140315)资助.
中图分类号O646; O657.1
文献标志码A
LoadingofMyoglobinintoLayer-by-layerFilmsAssembledThroughBoronicAcid-diolSpecificRecognitionandItsElectrochemicalStudy†
YAOHuiqin1*,HUANGShan1,SUQiaoling1,SHIKeren2*,GANQianqian1,WANGMingke1
(1. College of Pharmacy, College of Basic Medical Science, Ningxia Medical University, Yinchuan 750004, China;2. State Key Laboratory of Energy Sources & Engineering, Ningxia University, Yinchuan 750021, China)
AbstractA polyelectrolyte PAA-PBA containing both phenylboronic acid(PBA) moieties and carboxylic acid groups[PAA=poly(acrylic acid)] was synthesized. PAA-PBA and dextran(Dex) were then assembled into {PAA-PBA/Dex}n layer-by-layer(LbL) films by LbL assemble technique on pyrolytic graphite(PG) electrode surface through boronic acid-diol specific recognition between them. Myoglobin(Mb) in a buffer solution(pH=5.0) was loaded into the films, forming stable {PAA-PBA/Dex}n-Mb films. By cyclic voltammetry(CV) technique, the {PAA-PBA/Dex}n-Mb film electrodes demonstrated the direct electrochemistry of Mb and could be used to electrocatalyze reduction of various substrates(e.g. O2 and H2O2).
KeywordsDirect electrochemistry; Electrocatalysis; Layer-by-layer assembly; Boronic acid-diol specific recognition; Myoglobin
联系人简介: 姚惠琴, 女, 博士, 副教授, 主要从事生物/药物电分析化学研究.E-mail:huiqin_yao@163.com
史可人, 男, 博士, 副教授, 主要从事材料电化学研究.E-mail:shikeren@163.com

