小脑延髓池注射纳洛酮对心肺复苏大鼠脑组织c-Fos mRNA及蛋白表达的影响
朱明辉 陆婉晖 黎靖麟 成秋生 胡广奋 刘四红 邓穗德 喻宁芳
广州市第一人民医院急诊内科(广州 510180)
小脑延髓池注射纳洛酮对心肺复苏大鼠脑组织c-Fos mRNA及蛋白表达的影响
朱明辉陆婉晖黎靖麟成秋生胡广奋刘四红邓穗德喻宁芳
广州市第一人民医院急诊内科(广州 510180)
【摘要】目的探讨小脑延髓池注射纳洛酮对心肺复苏大鼠脑神经保护的作用机制。 方法将30只雄性SD大鼠随机分为假手术组、常规复苏组和纳洛酮复苏组。采用窒息法建立大鼠心脏骤停模型,复苏的同时给予药物治疗。恢复自主循环(ROSC)后24 h取脑组织,荧光定量PCR法检测脑组织c-Fos mRNA表达水平,免疫组化法检测脑组织c-Fos蛋白的表达。结果与常规复苏组比较,纳洛酮可显著降低大鼠脑组织c-Fos mRNA及蛋白表达量(P<0.01)。 结论小脑延髓池注射纳洛酮可及时有效的作用于c-Fos基因,发挥脑神经保护作用。
【关键词】小脑延髓池纳洛酮心肺复苏脑缺血再灌注c-Fos基因
纳洛酮是非竞争性阿片肽受体拮抗剂,已在临床广泛应用于救治颅脑外伤、 脑缺血、休克、呼吸衰竭等。它可以特异性地阻断β内啡肽(β-EP)的毒性作用,并通过非阿片受体样作用增加心肺复苏的成功率,如兴奋延髓的呼吸中枢,稳定细胞膜对Ca+的通透性,解除胞内Ca2+超载,对脑组织及神经发挥一定的保护作用[1-2]。传统的给药方法易受血脑屏障的影响,而影响心肺复苏的效果。小脑延髓池注射给药可使药物通过局部作用或其他的局部渗透方法到达脑组织发挥作用,避免了血脑屏障的影响。
研究认为c-fos是神经元内的一种原癌基因,当机体受到刺激时,c-fos 的基因和蛋白均产生表达。c-fos 作为内源性伤害因子,其表达程度是经元的损伤程度的标志[3]。前期研究表明[4]小脑延髓池注射纳洛酮对心肺复苏大鼠脑组织的保护效果明显优于传统的治疗药物肾上腺素。本研究采用窒息法建立大鼠心脏骤停模型,探讨脑缺血再灌注损伤后,小脑延髓池注射纳洛酮对脑缺血后即早基因c-fos基因及蛋白表达的影响。
1材料与方法
1.1药品纳洛酮注射液(2 mg/2 mL,贵州景峰注射剂有限公司);肾上腺素注射液(1 mg/mL,福州海王福药制药有限公司)。
1.2动物SD大鼠,雄性,SPF级别,由广州中医药大学实验动物中心提供,合格证号:SCXK(粤)2013-0020,于广州市第一人民医院中心实验室实验动物中心中饲养,喂以标准的颗粒饲料,正常饮水。本实验由广州市第一人民医院伦理委员会监督,符合动物保护、动物福利和伦理原则,符合国家实验动物福利伦理的相关规定。
1.3仪器与与试剂Rabbit Anti-c-fos antibody(北京博奥森生物科技有限公司,bs-10172R)SOD试剂盒(南京建成生物工程研究所,批号:20150204);微量丙二醛(MDA)试剂盒)(南京建成生物工程研究所,批号:20150131);即用型UItraSensitive s-p超敏试剂盒(兔)(购自迈新生物技术有限公司,货号:KIT-9706);DAB显色试剂盒(购自迈新生物科技有限公司,货号:DAB-0031);高纯总RNA快速提取试剂盒(离心柱型,takara,批号:RP1201);Recombinant DNase I (RNase-free)(takara,批号:2270A);Recombinant Ribonuclease Inhibitor(takara,批号:2313A);Oligo d(T)18 Primer(takara,批号:3806);Reverse Transcriptase M-MLV (RNase H-) (takara, 批号:2641A);dNTP Mixture(takara,批号:T4019);A100PCR仪(LongGene);GelDoc XR凝胶成像系统(Bio-RAD);JY200C电泳仪(君意);5804R低温离心机(Eppendorf)。
1.3动物分组取雄性SD大鼠30只,随机分为假手术组、常规复苏组、纳洛酮处理组共3组,10只/组。各组大鼠在体质量、基线血压和心脏脉搏等生理参数差异均无统计学意义。
1.4模型制备及给药手术前将SD大鼠禁食不禁水12 h,以10 %水合氯醛(0.35 mL/100 g)腹腔注射麻醉。常规复苏组及纳洛酮处理组采用夹闭气管窒息法建立大鼠心跳骤停模型[4-5]并进行心肺复苏,假手术组不予以夹管窒息和心肺复苏。心跳骤停2 min后,采用Utstein模式[6]进行心肺复苏,开放夹闭的气管,接动物呼吸机行机械通气,并进行胸外按压复苏(按压频率160次/min,按压深度为大鼠胸廓前后径的1/3)。复苏的同时,各组大鼠给药治疗,常规复苏组静脉注射肾上腺素注射液0.2 mg/kg[7];纳洛酮处理组小脑延髓池穿刺注射纳洛酮注射液2 mg/kg。假手术组作为对照静脉注射生理盐水。待自主呼吸完全恢复后,停止按压,缝合伤口,并放回饲养笼中。
1.5q-PCR法检测脑组织c-Fos mRNA表达取大鼠脑组织,剪取50 mg,加入适量Trizol匀浆,按照试剂说明书提供的参考步骤制备总RNA,经SmartSpec plus核酸蛋白检测仪测定 OD260/OD280比值,要求比值在2.0左右,并计算RNA 浓度。将总 RNA 依据逆转录试剂盒说明逆转录成cDNA。RT-PCR的引物、内参配置及逆转录聚合酶链反应按照Invitrogen公司说明进行,c-Fos的引物序列是:Forward primer:CCT TCA GCA CAG ATT GCG AC ,Reverse primer:CAC GTT TGG AAG AGC AAG CC,扩增片段长度为330 bp;内参GAPDH的引物序列是:Forward primer:AGC GAG CAT CCC CCA AAG TT,Reverse primer:GGG CAC GAA GGC TCA TCA TT,扩增片段长度为150 bp。反应体系为20 μL,Rotor-Gene QPCR仪上反应。反应条件是94 ℃预变性1 min,94 ℃变性15 s,56 ℃退火15 s,72 ℃延伸45 s,共40个循环,在每个循环的延伸阶段收集荧光信号,将检测的临界点设定在PCR扩增过程中,荧光信号由本底进入指数增长阶段的拐点所对应的循环数值,即CT值,记录下其数值,得到相应的扩增曲线。并利用反应仪和电脑记录基因的熔解曲线。以假手术组为对照组,应用2-⊿⊿Ct相对定量法计算实验组与对照组之间c-Fos mRNA基因表达的差异。PCR 产物在 12 % 琼脂糖凝胶电泳,溴化乙锭染色,结果在凝胶成像系统分析验证。
1.6免疫组化法检测脑组织c-Fos蛋白表达ROSC后 24 h,用乙醚麻醉大鼠,取脑组织,固定于4 %多聚甲醛溶液中。经切片、脱蜡,用枸橼酸橼抗原修复液修复过氧化酶孵育15 min,阻断内源性过氧化物酶的活性;PBS冲洗,非免疫性动物血清孵25 min,加50 μl anti-c-fos antibody (1:100) 4 ℃孵育过夜。PBS冲洗3次,每次10 min;加50 μl生物素标记的二抗,室温下孵育30 min。PBS冲洗3次,每次10 min;加50 μl链霉菌抗生物素-过氧化物酶溶液,室温下孵育15 min。 PBS冲洗3次每次10 min;加入DAB溶液苏木素复染组织脱水封片显微镜下观察。阴性对照组以PBS代替一抗。在高倍视野下(10×40),观察各组大鼠脑海马组织。胞核有棕色颗粒者为阳性细胞,选取5个高倍视野统计分析阳性细胞的百分率。阳性细胞百分率=阳性细胞数 /(阳性细胞数+阴性细胞数)×100 %。

2结果
2.1对c-Fos mRNA表达的影响结果显示,常规复苏组c-Fos mRNA表达量显著高于假手术组(P<0.01);纳洛酮复苏组c-Fos mRNA表达量显著高于常规复苏组(P<0.01)(c-Fos mRNA相对表达量假手术组1,常规复苏组1.47±0.01,纳洛酮复苏组1.12±0.09)。图1为各组大鼠脑组织c-Fos mRNA PCR产物电泳结果。
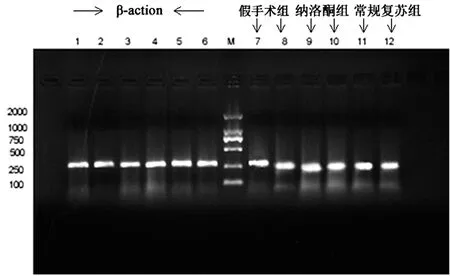
图1 各组大鼠脑组织c-Fos mRNA PCR产物电泳图
2.2对c-Fos蛋白表达的影响结果显示,常规复苏组较假手术组c-Fos蛋白表达量增加(见图2),阳性细胞率(%)显著升高(P<0.01);纳洛酮复苏组较常规复苏组c-Fos蛋白表达量降低(见图2),阳性细胞率(%)显著降低(P<0.01)(阳性细胞率%:假手术组6.6±2.70,常规复苏组69.8±9.42,纳洛酮复苏组32.2±7.42)。
3讨论
c-fos基因定位于细胞核,是一种即刻早期基因。研究发现多种刺激因子,如缺氧、光线刺激、机械刺激、疼痛刺激等均可诱导中枢神经系统(CNS)中c-fos基因的表达,且其在脑功能活动时信号转导和调控过程中起到重要作用[8]。当细胞受到缺氧刺激时,胞核内的c-fos基因被激活,转录形成mRNA,并最终进入细胞浆,翻译合成分子量为55kD的核磷蛋白,即Fos蛋白。Fos蛋白经过磷酸化修饰后返回胞核与Jun/AP-1蛋白通过各自的α螺旋区以光价键结合形成亮氨酸拉链。Fos-Jun/Ap-l复合物与目的基因结合,激活其转录活性。因此,c-fos被认为是介导外界刺激,传递信息引起细胞病理反应的第三信使[9]。

图2各组大鼠脑组织c-Fos蛋白表达量(A:假手术组c-Fos阳性细胞数较少见;B:常规复苏组c-Fos阳性细胞数较多,如箭头所示,神经元细胞的胞核及胞浆被染为棕黄色,Original magnification:×400)
低水平的c -fos表达,可直接参与神经元的分化、 生长、 学习记忆以及神经突触的可塑性变化等多种生理过程[10]。而高表达的c -fos 可能对机体产生伤害。心肺复苏后脑神经细胞c-fos表达量增多,引起受体依赖的 Ca2+细胞内流,而Ca2+细胞内超载被认为是导致神经细胞死亡的最后共同通路。钙超载学说认为,细胞内超载的Ca2+大量聚集在线粒体,导致线粒体肿胀、功能失调,进一步导致ATP合成障碍[11],当Ca2+超载到一定程度可激活多种酶,从而引起细胞功能紊乱、坏死。另一方面,Ca2+超载还可以损伤血管内皮细胞,促进血管源性的脑水肿[12],是心脏停搏心肺复苏后脑损伤的初始因素。本研究也发现常规复苏组c-Fos mRNA及蛋白表达量均较假手术组升高,而小脑延髓池注射纳洛酮可显著降低脑组织c-Fos mRNA及蛋白表达水平。本研究表明小脑延髓池注射纳洛酮可及时有效的作用于脑神经细胞的c-fos基因,从而发挥脑神经损伤的保护作用。该方法在动物模型上具有一定的可行性及可操作性,对今后急救医疗和临床抢救,特别是心肺脑复苏有一定的指导意义。
参考文献:
[1] 陈健,王冰舒. 纳洛酮药理研究及临床应用进展[J]. 医学综述, 2008,07:1095-1096.
[2] 吴伟中. 纳洛酮作用机制及临床应用探讨[J]. 海南医学, 2010,21(10):112-114.
[3] ZHENG W, NIU L, ZHANG C, et al. Brain edema and protein expression of c-Fos and c-Jun in the brain after diffused brain injury[J]. Int J Clin Exp Pathol, 2014, 7(6): 2809-2817.
[4] 朱明辉, 陆婉晖,黎靖麟,等. 小脑延髓池注射纳洛酮对心肺复苏大鼠脑组织的保护作用[J]. 第二军医大学学报, 2015,36 (7):794-798.
[5] 陈寿权,李章平,王姗姗,等.窒息法致大鼠心脏骤停模型复苏的影响因素[J]. 中华急诊医学杂志, 2005,14(10):814-817.
[6] BOLLER M, FLETCHER DJ, BRAINARD BM, et al. Utstein-style guidelines on uniform reporting of in-hospital cardiopulmonary resuscitation in dogs and cats. A RECOVER statement [J]. J Vet Emerg Crit Care (San Antonio). 2016, 26(1):11-34.
[7] 靖颖霞. 三种心脏骤停大鼠模型心肺复苏效果及脑损伤程度的研究[D]. 长沙:中南大学, 2012.
[8] 卢静,戴体俊,曾因明. c-fos基因表达的相关机制和意义[J]. 国外医学.麻醉学与复苏分册,2004,25(5):273-275.
[9] VELAZQUEZ FN, CAPUTTO BL, BOUSSIN FD.c-Fos importance for brain development [J]. Aging (Albany NY). 2015, 7 (12):1028-1029.
[10] 颜玲,黄德斌. 黄芪多糖对缺血脑损伤大鼠海马神经递质及c-fos mRNA表达的影响[J]. 中国病理生理杂志, 2012, 28(2):263-268.
[11] GOURIOU Y, DEMAUREX N, BIJLENGA P, et al. Mitochondrial calcium handling during ischemia-induced cell death in neurons [J]. Biochimie.2011, 93(12):2060-2067.
[12] ETIENNE-MANNEVILLE S, MANNEVILLE JB, ADAMSON P, et al. ICAM-1-coupled cytoskeletal rearrangements and transendothelial lymphocyte migration involveintracellular calcium signaling in brain endothelial cell lines[J]. J Immunol,2000, 165(6):3375-3383.
基金项目:广东省科技计划项目(2013B022000028)
通信作者:朱明辉,E-mail:Minghui_z@163.com
DOI:10.3969/j.issn.1000-8535.2016.02.002
(收稿日期:2015-01-12)
Effects of naloxone injected into cisterna magna on expression of c-Fos proteins and c-Fos mRNA in brain tissues of rats following cardiopulmonary resuscitation
ZhuMinghui,LuWanhui,LiJinglin,etal.
DepartmentofEmergency,GuangzhouFirstPeople’sHospital,Guangzhou510180,China
【Abstract】ObjectiveTo investigate the neuroprotective mechanism of naloxone injected into cisterna magna on cerebral ischemia-reperfusion.MethodsThirty adult male SD rats were randomly divided into sham group, conventional cardiopulmonary resuscitation (CPR) group and naloxone CPR group. Asphyxiation was used to set up rat cardiac arrest model, and corresponding drugs were given when the resuscitation was carried out. The Brain tissues were taken at 24 h after restoration of spontaneous circulation (ROSC). Fluorescence quantitative polymerase chain reaction (PCR) and immunohistochemical was used to detect the expression of c-Fos proteins was used to detect the expression of c-Fos mRNA level.ResultsCompared with the conventional CPR group, Naloxone could significantly decrease the expression of c-Fos protein and c-Fos mRNA in rat brain.ConclusionNaloxone injected into cisterna magna can promptly and effectively act on c-Fos gene, playing a neuroprotective role.
【Key words】Cisterna magna; Naloxone; Cardiopulmonary resuscitation; Cerebral ischemia and reperfusion; c-Fos

