大水面控养条件下水葫芦与浮游藻类间的相互作用
徐寸发,刘海琴,徐为民,秦红杰,闻学政,张迎颖,张志勇*. 江苏省农业科学院农业资源与环境研究所,江苏 南京 004;. 江苏省农业科学院中心实验室,江苏 南京 004
大水面控养条件下水葫芦与浮游藻类间的相互作用
徐寸发1, 2,刘海琴1,徐为民2,秦红杰1,闻学政1,张迎颖1,张志勇1*
1. 江苏省农业科学院农业资源与环境研究所,江苏 南京 210014;2. 江苏省农业科学院中心实验室,江苏 南京 210014
摘要:在滇池外海北岸重污染水域的0.25 km2封闭性蓝藻治理试验示范区内控养水葫芦(Eichhornia crassipe),通过鉴定与计数水体浮游藻类及监测水葫芦生理指标的变化,研究大水面控养条件下水葫芦与浮游藻类间的相互作用。6月底按 9.30 kg·m-2投放水葫芦种苗,12月底进行采收,水葫芦控养面积为2.51 hm2。结果显示,该水域共鉴定出浮游藻类隶属7门46种(属),控养水葫芦未显著影响浮游藻类群落结构;水葫芦控养区浮游藻类生物量高于对照区,控养区浮游藻类最大生物量为1.76×109cells·L-1,是对照区的2.2倍;蓝藻门生物量占浮游藻类总生物量的88.0%以上,且以微囊藻为优势种群,控养区微囊藻生物量高达1.75×109cells·L-1,是对照区的2.4倍;水葫芦根系对浮游藻类具有明显吸附作用,吸附的微囊藻最大生物量为1.67×109cells·m-2。吸附于水葫芦根系的高浓度浮游藻类未影响植株株高、根长、生物量的变化,对根系活力与叶片生理变化影响也较小,平均根系表面积和活跃面积分别为0.62和0.28 m2·g-1,平均叶片可溶性糖和可溶蛋白质分别为2.81 和0.15 mg·g-1。综上分析,控养水葫芦改变浮游藻类空间分布特征,将其有效吸附滞留于控养区,防止其随风布满湖面;水葫芦根系吸附的高浓度浮游藻类未影响水葫芦正常生长。
关键词:水葫芦;浮游藻类;相互作用
引用格式:徐寸发, 刘海琴, 徐为民, 秦红杰, 闻学政, 张迎颖, 张志勇. 大水面控养条件下水葫芦与浮游藻类间的相互作用[J]. 生态环境学报, 2016, 25(5): 850-856.
XU Cunfa, LIU Haiqin, XU Weimin, QIN Hongjie, WEN Xuezheng, ZHANG Yingying, ZHANG Zhiyong. Interaction between Eichhornia crassipe and Phytoplankton under Large Water Surface Controlled Growth of Eichhornia crassipe [J]. Ecology and Environmental Sciences, 2016, 25(5): 850-856.
水葫芦,学名凤眼莲(Eichhornia crassipe),属雨久花科凤眼莲属,多年生漂浮植物,其具有生长迅速、生物量大、富集氮磷能力强等特点,被国际公认为高效去除水体氮、磷的高等水生植物之一(常会庆等,2010;万志刚等,2004;Jayaweera et al.,2004),被广泛应用于富营养化湖泊治理。而浮游藻类是水环境中的初级生产者,也是食物链和营养结构的基础环节,在能量转化与物质循环过程中起重要的作用。目前,关于水葫芦与浮游藻类间的相互作用多集中于水葫芦对浮游藻类抑制机理方面的研究,其主要是室内模拟实验。据已有报道,水葫芦通过营养盐和光照的竞争(Yang et al.,1992),以及根系分泌化感物质(Kim et al.,2000)等途径抑制浮游藻类繁殖生长。根系分泌的化感物质有N-苯基-2-萘胺、亚油酸甘油酯、亚油酸、丙酰胺、壬酸、脱水 B-D吡喃葡萄糖、2,2-二甲基环戊酮等(杨善元等,1992;Jin et al.,2003);Almeida et al.(2006)研究发现,水葫芦对绿藻具有选择性的抑制作用。而有关大水面控养水葫芦修复富营养化湖泊的研究也主要集中于水葫芦对水体理化指标的改善(张志勇等,2015a;Wang et al.,2013)及对浮游动物和底栖动物的影响方面(Chen et al.,2012;王智等,2012),而生长期内水葫芦与浮游藻类间的相互作用研究较少。
在滇池外海北岸水域,每年夏天受气象、湖流等的作用,大量的浮游藻类聚集于岸边,形成大片的蓝藻聚集区,引起水体溶解氧显著下降、水体发臭、鱼类死亡等现象。云南省环境科学研究院于2011年在该水域利用不透水软围隔材料构建了0.25 km2封闭性水域,简称蓝藻治理试验示范区。2013年江苏省农业科学院在蓝藻治理试验示范区内开展控养水葫芦修复富营养化水体示范工程。本研究基于示范工程的平台,通过分析控养期内水葫芦对浮游藻类生物量及其群落结构的作用,以及监测水葫芦生物量、根系与叶片生理指标变化等,着重研究富营养化湖泊中水葫芦与浮游藻类间的相互作用,以期为水葫芦控养修复富营养化湖泊工程提供科学依据。
1 材料与方法
1.1 试验方法
于2013年5月在滇池外海北岸蓝藻治理试验示范区内,利用钢管(5 cm×600 cm)和泡沫浮球(ø300 cm×500 cm)等材料构建4个水葫芦单体控养围栏,围栏构建示意图如图1所示,具体构建方法及参数详见专利(专利号:ZL201520097706.4)(张志勇等,2015b)。围栏面积共计2.51 hm2,其中1个边长均为100 m,另外3个边长均为71 m。同年6月利用机动船将水葫芦种苗托运至试验水域,按9.30 kg·m-2放养于4个围栏内,覆盖度占0.25 km2水域的10%,并在试验水域设置8个采样点,其中W1~W4为水葫芦控养区(Planting region)采样点,W5~W8为对照区(CK)采样点,如图2所示。试验期为2013年7—12月,即水葫芦控养期,试验结束后将水葫芦打捞上岸进行资源化利用。试验期间,以1次/月的频率采集水葫芦植株样品和浮游藻类样品,监测水葫芦控养区和对照区水体浮游藻类的生物量及群落,以及测定水葫芦根系单位面积吸附的浮游藻类生物量;同时监测水葫芦株高、根长、单位面积生物量、根系表面积、活跃面积及叶片可溶性糖与可溶性蛋白质含量。试验前水域水质如表1所示。
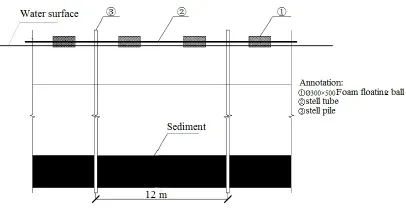
图1 围栏构建示意图Fig. 1 Schematic diagram of enclosure
1.2 样品的采集与处理
水体浮游藻类定量样品:利用容量为5 L的有机玻璃采水器采集水体表层(距表层0~0.5 m)、中层(距表层1.0~1.5 m)、底层(湖底上0.5 m)3层次的水样等量均匀混合后,取其中1 L水样加10 mL鲁哥试剂固定,静置48 h后浓缩至50 mL。

图2 采样点分布图Fig. 2 Distribution diagram of sampling sites

表1 试验水域6月份水质状况Table 1 Water quality of the water area
定性样品:用25号的浮游生物网(64 μm)过滤采集的水样,然后将生物网内的浮游藻类转移至50 mL的塑料瓶中,加入1 mL鲁哥试剂固定。
此外,在每个控养围栏内随机采集 10株水葫芦,测定株高、根长,然后选取其中5株采用软毛刷和6 L去离子水清洗水葫芦根系,取混合均匀的清洗液1 L加入10 mL鲁哥试剂固定,静置48 h浓缩至50 mL后作为水葫芦根系吸附的浮游藻类定量样品。最后将清洗后的水葫芦根系与叶子分开,选取部分根系和叶子分别测定根系表面积和活跃面积、叶片可溶性糖、可溶性蛋白质。
1.3 分析方法与数据处理
浮游藻类定性和定量样品的鉴定与计数参照文献进行(章宗等,1991;胡鸿钧等,2006);采用甲烯蓝吸附法测定根系表面积及活跃面积(陈建勋等,1985);通过水葫芦根系吸附的浮游藻类生物量与根系表面积得到水葫芦根系单位面积吸附的浮游藻类生物量。采用考马斯亮蓝法、蒽酮比色法分别测定叶片可溶性蛋白质、叶片可溶性糖(张志良等,2002)。根长和株高采用米尺测定;单位面积水葫芦生物量(鲜重)测定是将将1 m2内全部植株从水中捞起放在筛网上,直至无滴水时称重而得。各采样点指标均重复3次测定,最后试验数据结果用平均值±标准偏差表示,利用Origin 8.0软件作图。
2 结果与分析
2.1 水葫芦对浮游藻类的作用
2.1.1 浮游藻类群落结构变化
由表2可以看出,7—12月试验水域共鉴定出浮游藻类隶属7门46种(属),不同月份控养区和对照区浮游藻类群落组成存在差异,不过均有蓝藻门、绿藻门、硅藻门和隐藻门,且种(属)数排序为绿藻门>蓝藻门>硅藻门>隐藻门。各月份控养区浮游藻类总种(属)数低于对照区,但差异不明显,表明控养水葫芦对浮游藻类的群落结构影响较小。其中,8月因是蓝藻暴发高峰期,可能因蓝藻生物量大而抑制了其他藻类生长,导致浮游藻类总种(属)数显著减少。随着蓝藻开始衰亡,其他藻类开始出现,9月后出现裸藻类,12月后出现了适宜在贫营养化水体中生长的金藻类。
2.1.2 浮游藻类生物量变化及群落分布
根据图3知,浮游藻类生物量变化表现为先升后降的趋势。控养区浮游藻类生物量高于对照区,这表明水葫芦将浮游藻类吸附滞留于控养区,改变了浮游藻类的空间分布特征。其中,8月因蓝藻暴发使浮游藻类生物量迅速增加,控养区为1.76×109cells·L-1,是对照区8.11×108cells·L-1的2.2倍;9月因降雨较多,部分浮游藻类下沉,浮游藻类生物量显著下降;12月由于气温下降,浮游藻类衰亡沉降,使浮游藻类生物量急剧下降。同时,结合图4,可知微囊藻是该水域水体浮游藻类中的绝对优势种群,也是蓝藻门的优势种群。试验期微囊藻生物量变化趋势与浮游藻类生物量变化趋势基本一致,且控养区微囊藻生物量高于对照区。其中,在蓝藻暴发高峰期(8月),控养区微囊藻生物量高达1.75×109cells·L-1,是对照区7.31×108cells·L-1的2.4倍。
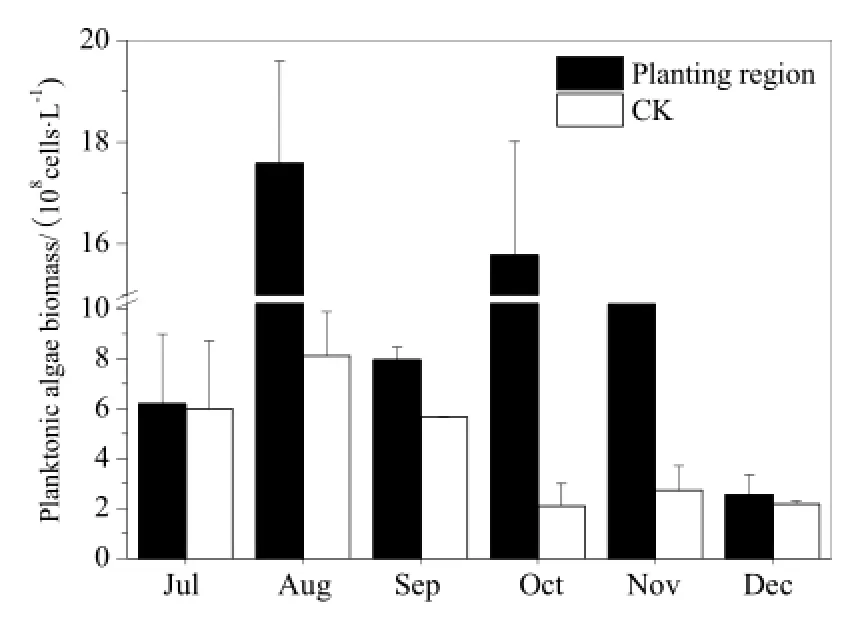
图3 浮游藻类生物量变化Fig. 3 Monthly variation of planktonic algae biomass
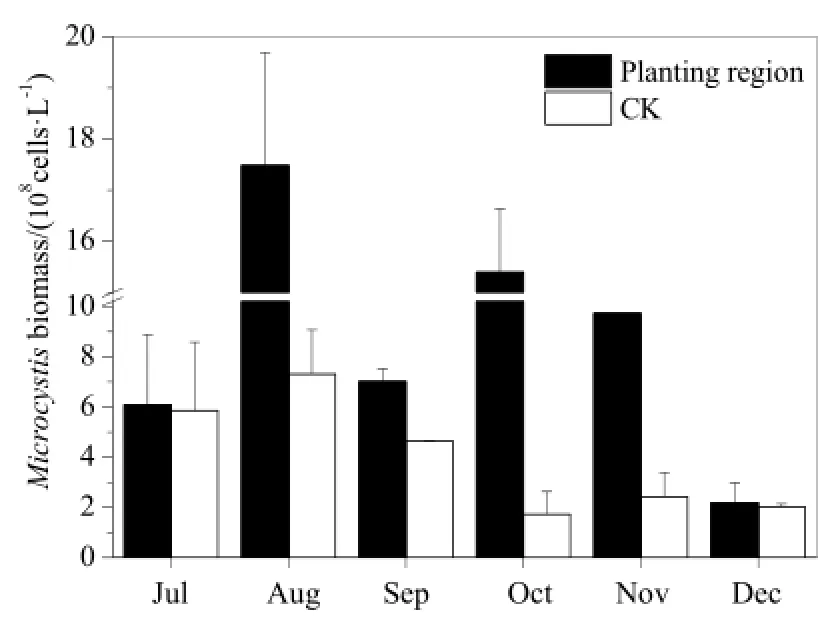
图4 微囊藻生物量变化Fig. 4 Monthly variation of Microcystis biomass
由表 3可知,蓝藻门生物量占总浮游藻类生物量比例最大,绿藻门次之,且控养区蓝藻门生物量高于对照区,绿藻门则相反。各月份蓝藻门生物量占总浮游藻类生物量的比例均超过88.0%。9月对照区绿藻门占总浮游藻类的 10.21%,高于其他月份,原因可能是 9月因天气原因,减缓了蓝藻门的扩增速率,削弱了蓝藻门对其他藻门生长的抑制作用。
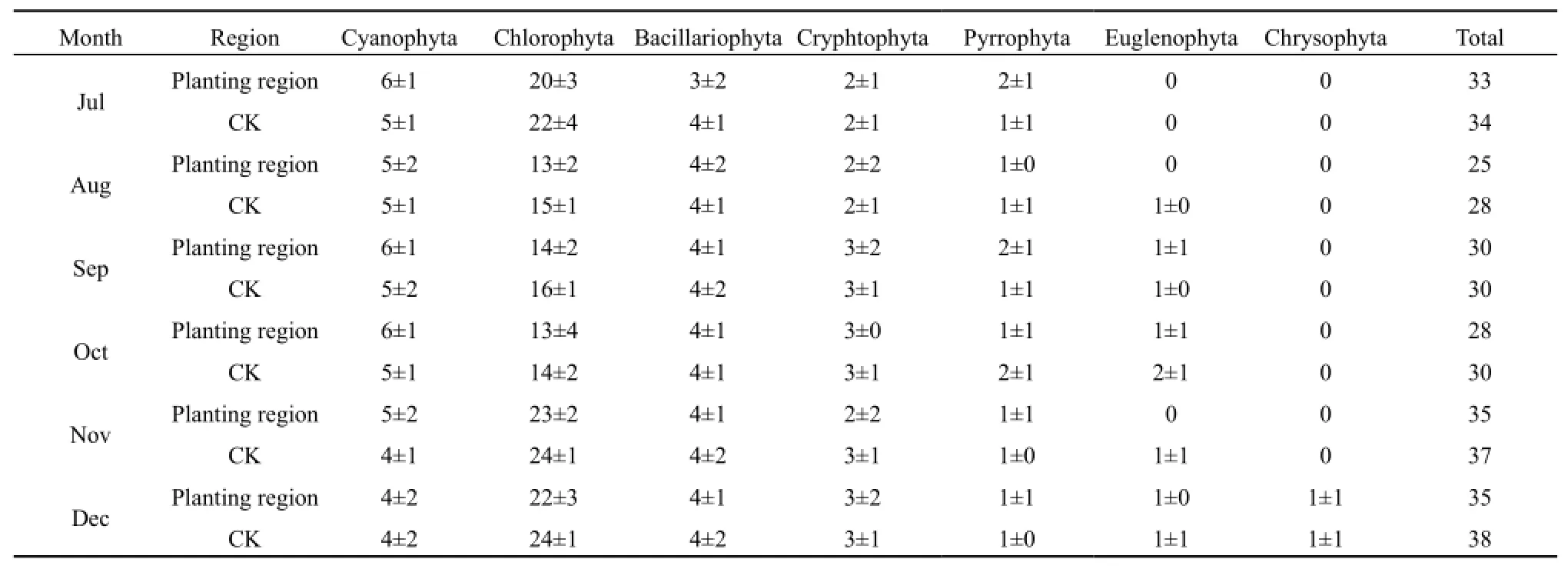
表2 浮游藻类群落结构的变化(单位:种(属))Table 2 Monthly variation of community structure of planktonic algae at different area (unit: species (genus))

表3 浮游藻类群落分布Table 3 Distribution of planktonic algae community at different area
2.1.3 水葫芦根系对浮游藻类的吸附效果
水葫芦根系吸附的微囊藻生物量变化如图5所示,呈现先升后降再升的变化趋势。其中,8月吸附的微囊藻生物量最大,为 1.67×109cells·m-2,远高于其他月份,这与蓝藻暴发密切相关。9月因降雨较多,气温降低导致微囊藻生长减缓,同时附在根系的部分微囊藻脱离根系,从而导致单位面积根系附着的微囊藻生物量较其他月份少。后期虽有上升趋势,但由于蓝藻暴发期已过,根系吸附的微囊藻生物量低于8月份。
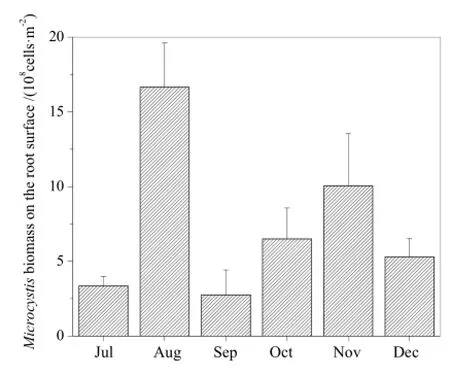
图5 水葫芦根系吸附的微囊藻生物量变化Fig. 5 Monthly variation of Microcystis biomass on the root surface of Eichhornia crassipes
2.2 浮游藻类对水葫芦的作用
2.2.1 水葫芦生长状况
试验期间(7—12月),水葫芦生长状况如表4所示。各月份水葫芦植株高、根长均无明显差异,株高和根长分别在0.41~0.64和0.20~0.40 m之间;生物量呈先增后减的变化规律,其中 10月生物量最大,为42.90 kg·m-2,是7月份18.74 kg·m-2的2.3倍;10月后因温度下降及生长空间限制,水葫芦生物量呈现负增长。
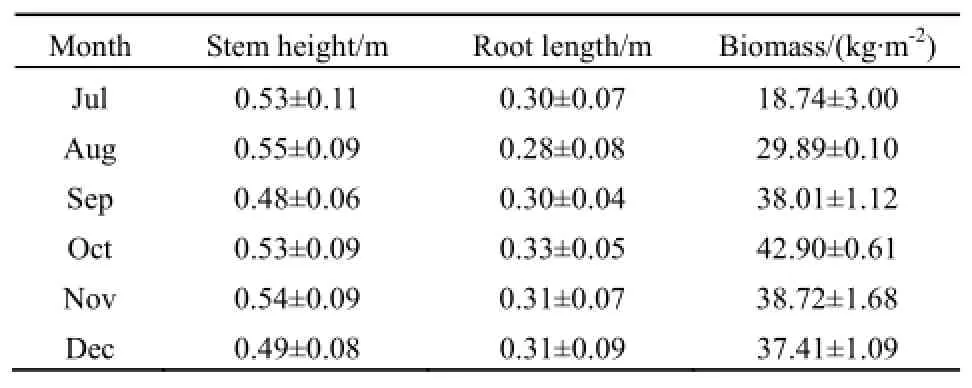
表4 水葫芦生长状况Table 4 Growth state of Eichhornia crassipes
2.2.2 水葫芦根系的表面积和活跃面积变化
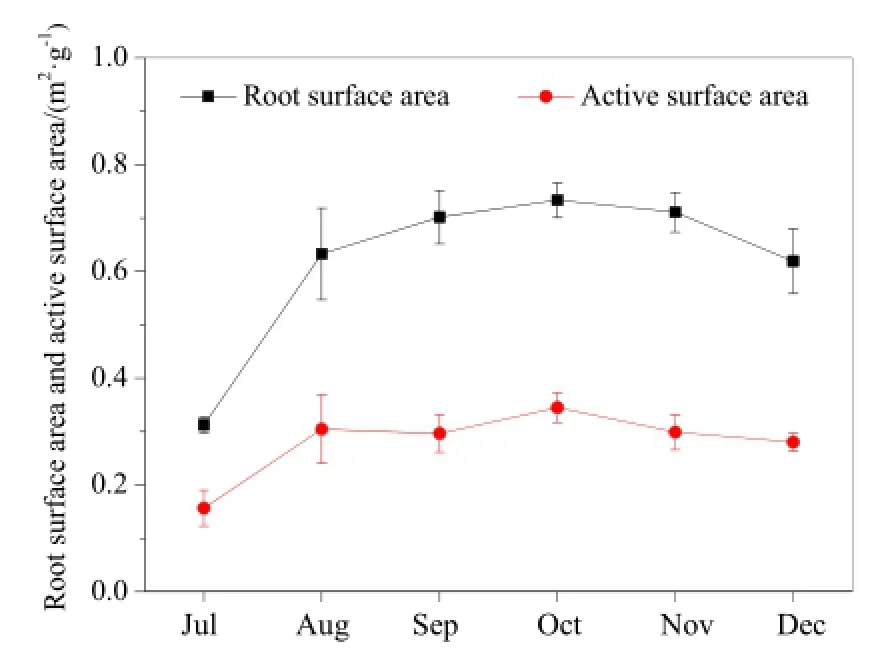
图6 根系表面积和活跃面积变化Fig. 6 Monthly variation of root surface area and active surface area
水葫芦根系表面积和活跃面积变化如图 6所示,根系表面积及其活跃面积均呈先升后降的变化趋势,符合水葫芦正常生长规律。7—12月,水葫芦根系表面积和活跃面积分别在 0.31~0.73和0.16~0.34 m2·g-1之间变化,平均分别为0.62和0.28 m2·g-1。其中,10月时根系表面积和活跃面积最大,分别为0.7和0.34 m2·g-1。
2.2.3 水葫芦叶片可溶性糖和可溶性蛋白质变化
由图 7可以发现,随着水葫芦的生长,叶片可溶性糖呈不断上升的趋势。7月叶片可溶性糖为1.56 mg·g-1,12月时增至4.60 mg·g-1,整个生长期间叶片可溶性糖平均为 2.81 mg·g-1,这表明水葫芦生长良好,吸附于根系的高浓度浮游藻类未明显影响水葫芦生长。其中,9月可能因降雨较多,叶片光合作用减弱,从而减缓了叶片可溶性糖的合成速率。
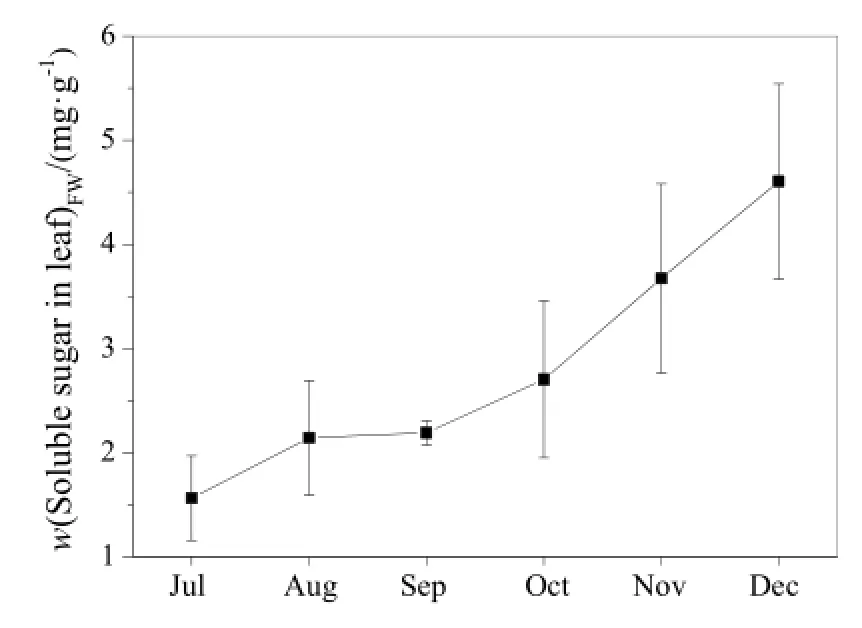
图7 叶片可溶性糖变化Fig. 7 Monthly variation of leaf soluble sugar
从图8中可看出,水葫芦叶片可溶性蛋白质与可溶性糖变化趋势略有不同,但整体上也表现为上升趋势,属于正常变化规律。在7—12月间,叶片可溶性蛋白质在0.10~0.20 mg·g-1之间,平均为0.15 mg·g-1。其中,11月时叶片可溶性蛋白质较其他月份大的原因可能是 11月时水葫芦仍有一定生长能力,叶片仍能产生代谢酶。
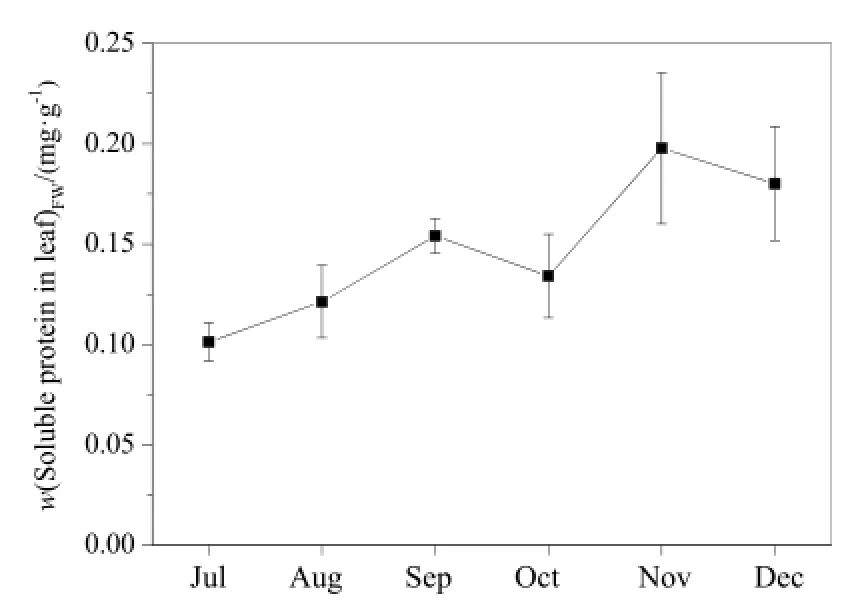
图8 叶片可溶性蛋白质变化Fig. 8 Monthly variation of leaf soluble protein
3 讨论与结论
3.1 讨论
一般认为浮游藻类受温度、水流、光照和营养等各种环境因子及种间作用的影响(Montecino et al.,1982;Ascioti et al.,1993)。根据前人的研究发现,富营养型湖泊中的浮游藻类以绿藻、蓝藻类为主,中营养型湖泊以硅藻、隐藻和甲藻为主,贫营养型湖泊则以黄藻、金藻类为主(张志明,2009)。而试验水域是滇池外海北污染最严重的区域之一,属重度富营养化水体,本试验结果表明该水域浮游藻类以蓝藻类和绿藻类为主,蓝藻门中的微囊藻为优势种群,符合富营养化湖泊浮游藻类优势种群的规律;11月后出现甲藻类、金藻类,可能说明水质好转;试验期内,水葫芦控养区和对照区水体蓝藻门生物量占据浮游藻类总生物量的绝大部分,且控养区蓝藻门生物量远高于对照区,改变了浮游藻类空间分布特征,这一结果与Brendonck et al.(2003)在乌干达Chivero湖沿岸水葫芦种养区的研究结果相一致,这是由于水葫芦发达的根系吸附了大量浮游藻类的缘故。不过Brendonck等研究发现水葫芦种养区浮游藻类生物量是非种养区的10~30倍,远高于本研究结果,这应该是试验水域富营养化程度不同而导致水葫芦根系生长差异引起的差异。同时,周庆等(2012)784-785在太湖竺山湾水域的研究发现,水葫芦种养区与非种养区浮游藻类群落结构差异较小,这与本研究结果一致。因此,控养水葫芦显著地吸附浮游藻类,将浮游藻类滞留于水葫芦控养区,有效阻止浮游藻类的迁移,同时水葫芦又能吸收利用藻类衰亡释放到水体中的污染物,减轻外部空白水域水质恶化的压力。
水葫芦根系由不定根和侧根组成,根系发达,表面积巨大,可有效吸附浮游藻类,在本试验中也得到验证。然而吸附在根系的大量浮游藻类对水葫芦生长是否产生不利的作用目前尚不清楚。在本试验中,7—12月水葫芦根系吸附的微囊藻生物量均较大,不过水葫芦株高、根长变化较小,生物量呈现正常的变化规律,这说明吸附在根系的浮游藻类并未影响到水葫芦的表观生长。某种程度上,根系表面积、活跃面积可代表根系活力强弱,而根系活力反映植物生长情况。叶片可溶性糖是光合作用的初级产物,是植物体内多糖、蛋白质、脂肪等大分子化合物合成的物质基础,反映了植株生长的能力(刘浩荣等,2007)。叶片可溶性蛋白质是多种酶系构成的非膜结合蛋白体系,反映了叶片代谢酶类的总体水平(翁伯琦等,2014)。根据试验期内水葫芦根系表面积、活跃面积、叶片可溶性糖和可溶性蛋白质含量变化,显示水葫芦根系活力及叶片代谢并未受到显著影响,这与周庆等(2012)786-790研究得出的水葫芦对水华藻类的吸附未对其自身造成不利影响的结果相一致。此外,吴婷婷等(2015)通过模拟实验发现蓝藻浓度低于60 g·L-1的处理中,水葫芦叶片可溶性糖和可溶性蛋白质含量逐渐增加,不受蓝藻的胁迫作用。本该研究结果显示,7 —12月水葫芦叶片可溶性糖和可溶性蛋白质含量呈上升趋势,这也表明控养区根系吸附的浮游藻类未对水葫芦叶片光合作用与代谢水平产生胁迫作用。结合水葫芦生长过程中表观现象与生理状况变化,表明水葫芦根系吸附的高浓度浮游藻类并未影响水葫芦正常生长。
因此,将水葫芦大面积控养于藻型富营养化湖泊,既能改变浮游藻类群体空间分布,又能将浮游藻类滞留于特定水域,且高浓度浮游藻类对水葫芦生长无明显影响。在污染严重水域可利用水葫芦构建漂浮植物带吸附蓝藻水华,在削减水体N、P负荷的同时有效阻止浮游藻类随风聚集于岸边。另外,氮、磷、钾等植物营养元素含量较高的水葫芦打捞后可以进行资源化再利用。
3.2 结论
(1)试验水域共鉴定出浮游藻类隶属 7门 46种(属),水葫芦控养区浮游藻类总种(属)数低于对照区,但差异较小。控养区浮游藻类生物量高于对照区,控养区最大生物量为1.76×109cells·L-1,对照区为8.11×108cells·L-1。此外,蓝藻门生物量占浮游藻类总生物量的88.0%以上,以微囊藻为优势种群,控养区微囊藻生物量高达1.75×109cells·L-1,对照区为7.31×108cells·L-1。水葫芦根系有效地吸附了大量的浮游藻类,吸附的微囊藻生物量高达1.67×109cells·m-2。
(2)吸附于水葫芦根系的高浓度浮游藻类未影响水葫芦的正常生长。试验期间水葫芦植株高、根长变化不明显,水葫芦生物量、根系表面积和活跃面积均呈正常变化规律,平均根系表面积和活跃面积分别是0.62和0.28 m2·g-1;水葫芦叶片可溶性糖和可溶性蛋白质含量均呈上升趋势,均值分别是2.81和0.15 mg·g-1。
参考文献:
ALMEIDA A S, GONCALVES A M, PEREIRA J L, et al. 2006. The impact of Eichhornia crassipes on green algae and cladocerans [J]. Fresenius Environmental Bulletin, 15(12a): 1531-1538
ASCIOTI F A, BELTRAMI E, CANOLL T O, et al. 1993. Is there chaos in plankton dynamics [J]. Plankton Research, 15(7): 613-617.
BRENDONCK L, MAES J, ROMMENS W, et al. 2003. The impact of E. crassipe (Eichhornia crassipes) in a eutrophic subtropical impoundment (Lake Chivero, Zimbabwe). II. Species diversity [J]. Archiv Fur Hydrobiologie, 158(3): 389-405.
CHEN H G, PENG F, ZHANG Z Y, et al. 2012. Effects of engineered use of E. crassipes (Eicchornia crassipes) on the zooplankton community in Lake Taihu, China [J]. Ecological Engineering, 38(1): 125-129.
JAYAWEERA M, KASTURIARACHCHI J. 2004. Removal of nitrogen and phosphorus from industrial wastewaters by phytoremediation using E. crassipe (Eichhornia crassipes (Mart.) Solms) [J]. Water Science Technology, 50(6): 217-225.
JIN Z H, ZHUANG Y Y, DAI S G, et al. 2003. Isolation and identification of extracts of Eichhornia crassipes and their allelopathic effects on algae [J]. Bulletin of Environmental Contamination and Toxicology,71(5): 1048-1052.
KIM Y, KIM W J. 2000. Roles of E. crassipes and their roots for reducing algal concentration in the effluent from waste stabilization ponds [J]. Water research, 34(13): 3285-3294.
MCVEA C, BOYD C E. 2005. Effects of water-hyacinth cover on water chemistry,phytoplankton and fish in ponds [J]. Journal of Environmental Quality, 4(3): 375-378.
MONTECINO V, CABRERA S. 1982. Phytoplankton activity and standing crop in an inpoundment of central Chile [J]. Plankton Research, 4(4): 943-950.
WANG Z, ZHANG Z Y, ZHANG Z Y, et al. 2013. Nitrogen removal from Lake Caohai, a typical ultra-eutrophic lake in China with large scale confined growth of Eichhornia crassipes [J]. Chemosphere, 92(2): 177-183.
YANG S Y, YU Z W, SUN W H, et al. 1992. Isolation and identification of antialgal compounds from root system of E. crassipe [J]. Acta Phytophysiologica Sinica, 18(4): 399-402.
常会庆, 王世华. 2010. 水生植物对重富营养化水体修复效果研究[J].水土保持研究, 19(5): 262-265.
陈建勋, 王晓峰. 1985. 植物生理实验指导(第2版)[M]. 北京: 高教出版社: 68-147.
胡鸿钧, 魏印心. 2006. 中国淡水藻类——系统、分类及生态[M]. 北京:科学出版社.
刘浩荣, 宋海星, 刘代平, 等. 2007.油菜茎叶可溶性糖与游离氨基酸含量的动态变化[J]. 16(1): 123-126.
万志刚, 沈颂东, 顾福根, 等. 2004. 几种水生维管束植物对水中氮、磷吸收率的比较[J]. 淡水渔业, 34(5): 6-8.
王智, 张志勇, 张君倩, 等. 2012. 水葫芦修复富营养化湖泊水体区域内外底栖动物群落特征[J]. 中国环境科学, 32(1): 142-149.
翁伯琦, 郑向丽, 赵婷, 等. 2014. 不同生育期花生叶片蛋白质含量及氮代谢相关酶活性分析[J]. 植物资源与环境学报, 23(1): 65-70.
吴婷婷, 刘国峰, 韩士群, 等. 2015. 蓝藻水华聚集对水葫芦生理生态的影响[J]. 环境科学, 36(1): 114-120.
杨善元, 俞子文, 孙文浩, 等. 1992. 凤眼莲根系中抑藻物质分离与鉴定[J]. 植物生理学报, 18(4): 399-402.
张志良, 瞿伟菁. 2002. 植物生理学实验指导(第三版)[M]. 北京: 高等教育出版社: 38.
张志明. 2009. 高原湖泊富营养化发生机制与防治对策初探[J]. 环境科学导刊, 28(3): 52-56.
张志勇, 刘海琴, 秦红杰, 等. 2015b. 一种适用于大风浪开放水体的漂浮性水生植物安全种养设施: 中国, ZL201520097706.4[P].09-02.
张志勇, 徐寸发, 刘海琴, 等. 2015a. 规模化控养水葫芦改善滇池外海水质效果研究[J]. 生态环境学报, 24(4): 665-672.
章宗, 黄祥飞. 1991. 淡水浮游生物研究方法[M]. 北京: 科学出版社: 5-80.
周庆, 韩士群, 严少华, 等. 2012. 富营养化湖泊规模化种养的水葫芦与浮游藻类的相互影响[J]. 水生生物学报, 36(4): 783-791.
共同第一作刘海琴(1971年生),女,副研究员,主要从事水体污染生物修复方面的研究。E-mail: zh84391231@163.com
DOI:10.16258/j.cnki.1674-5906.2016.05.018
中图分类号:X52
文献标志码:A
文章编号:1674-5906(2016)05-0850-07
基金项目:国家“十二五”滇池水专项项目(2012ZX07102-004-6)
作者简介:徐寸发(1991年生),男,硕士,主要从事水体污染生物修复方面的研究。E-mail: jaasxucunfa@163.com
*通信作者。E-mail: jaaszyzhang@126.com
收稿日期:2016-03-22
Interaction between Eichhornia crassipe and Phytoplankton under Large Water Surface Controlled Growth of Eichhornia crassipe
XU Cunfa1, 2, LIU Haiqin1, XU Weimin2, QIN Hongjie1, WEN Xuezheng1,ZHANG Yingying1, ZHANG Zhiyong1*
1. Institute of Agricultural Resource and Environmental Sciences, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China;2. Central Laboratory, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China
Abstract:In order to discuss the interaction between phytoplankton and Eichhornia crassipe under large water surface controlled condition, phytoplankton were indentified and counted, and the physiological changes of E. crassipe were investigated in cyanoabacterial governance zone, an enclosed area (0.25 km2), nearby north shore of Wai hai, Dianchi Lake. 9.30 kg·m-2E. crassipe seedlings were planted with covering area of 2.51 hm2at the end of June and harvested at the end of December. Results showed that 46 species of phytoplankton belonging to 7 genera were identified in the water area; the confined growth of E. crassipe had no significant effects on the structure of the phytoplankton. The biomass of phytoplankton was higher in the region with E. crassipe than the area without E. crassipe, and the maximum biomass of phytoplankton in the region with E. crassipe was 1.76×109cells·L-1,which was 2.2 times higher than the area without E. crassipe. Cyanobacteral biomass was more than 88.0% of the total phytoplankton biomass, and Microcystis was shown as the dominant species in the water area. The maximum biomass of Microcystis in the region with E. crassipe was 1.75×109cells·L-1, which was 2.4 times higher than the area without E. crassipe. Considerable Microcystis were absorbed by E. crassipe root-mats, which the maximum biomass of Microcystis was 1.67×109cells·L-1. Phytoplankton absorbed on the E. crassipe root-mats had no effects on changes of stem height, root length and E. crassipe biomass,and on the root activity and leaf physiological change were not affected by phytoplankton. The average root surface area and root active surface area were 0.62 and 0.28 mg2·g-1, respectively. The average leaf soluble sugar and soluble protein content were 2.81 and 0.15 mg·g-1, respectively. Results indicated that E. crassipe could change spatial distribution of phytoplankton, strand them in special water area and prevent them from covering lake with the wind. Meanwhile, E. crassipe could grow normally under high concentration of phytoplankton condition.
Key words:Eichhornia crassipe; phytoplankton; interaction

