微波辅助法合成3,4-二氢嘧啶-2(1H)-酮衍生物
尹晓刚,吴小云,王 野,陈治明,陈 卓
(贵州师范大学 化学与材料科学学院;贵州省功能材料化学重点实验室,贵州 贵阳 550001)
微波辅助法合成3,4-二氢嘧啶-2(1H)-酮衍生物
尹晓刚,吴小云,王野,陈治明,陈卓*
(贵州师范大学 化学与材料科学学院;贵州省功能材料化学重点实验室,贵州 贵阳550001)
摘要:路易斯酸固载蒙脱土催化,微波辅助条件下以芳香醛、乙酰乙酸乙酯及脲为原料,通过Biginelli反应合成3,4-二氢嘧啶-2(1H)-酮衍生物。使用单因素法考察催化剂、溶剂对产率的影响,正交试验法优化反应温度、时间及原料摩尔比。实验结果表明:在反应温度90℃,微波时间10min,芳香醛、乙酰乙酸乙酯和脲的摩尔比为1.2∶1∶1,催化剂为氯化铜固载蒙脱土,催化剂用量为10%(醛摩尔比)的最优条件下,产率最高可达95.7%,催化剂重复使用3次后产率仍可达84.0%。产物通过红外、核磁、熔点进行表征。与现有合成方法相比,微波辅助法具有收率高、用时短等优点,具有潜在的应用前景。
关键词:Biginelli反应;微波辅助法;固载路易斯酸蒙脱土
0引言
3,4-二氢嘧啶-2(1H)-酮衍生物具有广泛的生理活性,如抗病毒、抗菌、抗癌、消炎、降血压等,同时可以作为钙离子通道拮抗剂使用,其合成受到广泛关注[1-3]。通过Biginelli反应,以芳醛、乙酰乙酸乙酯和脲为原料,可以制备此类化合物[4]。此方法虽然操作简单,但反应时间长达18h,产率在20%~50%之间,且使用的强酸催化剂对设备腐蚀严重。近年来3,4-二氢嘧啶-2(1H)-酮衍生物的合成受到广泛关注,但现有方法仍存在反应时间长、催化剂腐蚀性较大且不易回收、产物后处理步骤复杂等问题[5-9]。
1986年,Richard Gedye等[10]在苯胺酸性水解反应中首次引入微波辐照,显著缩短了反应时间。微波反应可以提供非常特殊的物理环境,有效加速反应,降低能耗并提高反应收率。微波辐射法具有如下的优势[11]:1)微波的穿透作用使其不受反应容器的限制,热效应均匀迅速,具有良好的加热效率;2)微波可以减少反应时间从而降低能耗,符合“绿色化学”的要求。我们实验室通过微波辅助法完成了KP550,季鏻盐及芦竹碱等多种化合物的合成[12-14]。试验通过使用微波辅助合成7种Hantzsch酯,单因素法考察催化剂、溶剂对产率的影响,设计正交试验考察温度、反应时间、原料摩尔比对产率的影响,产物通过红外、核磁、熔点进行表征。
1实验部分
1.1实验试剂及仪器
实验试剂:脲、乙酰乙酸乙酯,重庆江川化工有限公司;苯甲醛,成都市科龙化工试剂厂;邻甲氧基苯甲醛、对甲氧基苯甲醛、邻氯苯甲醛、对氯苯甲醛、间硝基苯甲醛、对硝基苯甲醛、对甲基苯甲醛、二甲氨基苯甲醛、N,N-二甲基甲酰胺、蒙脱土K-10,阿拉丁试剂有限公司;乙醇、甲醇,重庆川东化工(集团)有限公司;二氯甲烷,重庆川江化学试剂厂;正己烷、乙酸乙酯,天津市致远化学试剂有限公司;氯化锌、氯化铝、氯化铜、氯化铁、氯化镍,国药集团化学试剂有限公司。以上试剂均为分析纯。路易斯酸固载蒙脱土,自制,实验用水为蒸馏水。
实验仪器:AR1140型电子分析天平,美国OHAUS公司;ZF-I型三用紫外分析仪,上海顾村电光仪器厂;RE-52型旋转蒸发仪,上海亚荣生化仪器厂;SHB-B95型循环水式多用真空泵,郑州世纪双科实验仪器有限公司;Nova型单模微波合成仪,上海屹尧仪器科技发展有限公司。
1.2实验步骤
1.2.1路易斯酸固载蒙脱土的制备(以MMT/CuCl2为例)
固载蒙脱土(MMT)/路易斯酸催化剂参考文献制备[14]:在加有50mL无水甲醇的圆底烧瓶加入0.04mol(6.82g)CuCl2·2H2O,待其溶解后加入10g蒙脱土(MMT),室温下搅拌1h,减压蒸馏出溶剂,120℃活化4h,即得MMT/CuCl2,放入干燥器备用。以氯化铝(AlCl3)、氯化锌(ZnCl2)、氯化铁(FeCl3)、氯化镍(NiCl2)为原料,相同方法制备得催化剂:MMT/AlCl3、MMT/ZnCl2、MMT/FeCl3、MMT/NiCl2。
1.2.23,4-二氢嘧啶-2(1H)-酮衍生物
以醛、乙酰乙酸乙酯和脲为原料,蒙脱土固载路易斯酸为催化剂,微波辅助制备3,4-二氢嘧啶-2(1H)-酮类衍生物,合成路线如图1所示:
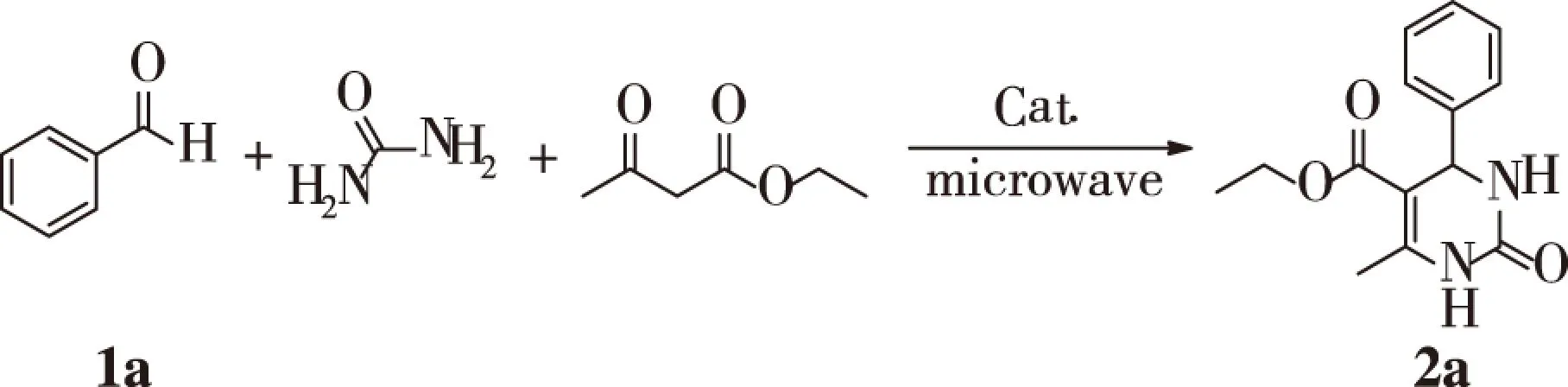
图1 3,4-二氢嘧啶-2(1H)-酮衍生物的合成路线Fig.1 Synthesis routes of 3, 4-dihydropyrimidine-2(1H)-ketone
在加有磁力搅拌子的微波反应仪套管中加入2mmol脲、2mmol苯甲醛、2mmol乙酰乙酸乙酯及催化剂(10%mol醛),0.5mL乙醇作溶剂,在一定温度下微波反应。待反应结束后,冷却至室温。冰水浴中静置30min,减压抽滤得固体;将其溶于乙酸乙酯中,柱层析得白色针状晶体。
1.3产物的表征
所得化合物2a~2g均为已知化合物,通过红外(IR)、核磁(1H-NMR)及熔点表征:
2a. IR(KBr):vN-H3 245cm-1(m),3 117cm-1(w);vC=O1 725cm-1(s),1 700cm-1(s);vHN-CO-NH1 648cm-1(s);vC-O-C1 222cm-1(s),1 091cm-1(s);698cm-1(m),757cm-1(m)芳香环一元取代。1H-NMR(DMSO-d6,400MHz):δ1.08(t,3H),2.24(s,3H),3.99(q,2H),5.12(d,1H),7.21~7.34(m,5H,ArH),7.73(s,1H,NH),9.20(s,1H,NH)。m.p.202~204℃(lit[15]204~205℃)。
2b. IR(KBr):vN-H3 246cm-1(m),3 118cm-1(w);vC-H2 920cm-1(w);vC=O1 723cm-1(s),1 705cm-1(s);vHN-CO-NH1 648cm-1(s);vC-O-C1 223cm-1(s),1 089cm-1(s);788cm-1(m)芳香环1,4二元取代。1H-NMR(DMSO-d6,400MHz):δ1.08(t,3H),2.23(s,3H),3.95(q,2H),5.05(d,1H),6.86~6.70(m,4H,ArH),7.69(s,1H,NH),9.15(s,1H,NH)。m.p.205~208℃(lit[15]205~206℃)。
2c. IR(KBr):vN-H3 245cm-1(w),3 114cm-1(w);vC-H2 956cm-1(w);vC=O1 724cm-1(s),1 705cm-1(s);vHN-CO-NH1 651cm-1(s);δ=C-H1 612(w),1 513(m),1 458(m);vC-O-C1 223cm-1(s),1 089cm-1(s),1 032(m);791cm-1(m)芳香环1,4二元取代。1H-NMR(DMSO-d6,400MHz):1H-NMR(DMSO-d6,400MHz):δ1.10(t,3H),2.18(s,3H),3.94(q,2H),5.05(d,1H),6.89~7.13(m,4H,ArH),7.13(s,1H,NH),9.11(s,1H,NH)。m.p.204~206℃(lit[16]201~202℃)。
2d. IR(KBr):vN-H3 257cm-1(w),3 111cm-1(w);vC-H2 958cm-1(w);vC=O1 725cm-1(s),1 701cm-1(s);vHN-CO-NH1 636cm-1(s);δ=C-H1 598(w),1 487(m),1 463(m);vC-O-C1 216cm-1(s),1 026cm-1(w);787cm-1(w),763cm-1(m)芳香环1,2二元取代1H-NMR(DMSO-d6,400MHz):δ1.08(t,3H),2.19(s,3H),3.89(q,2H),5.16(d,1H),7.31~7.52(m,4H,ArH),7.13(s,1H,NH),9.21(s,1H,NH)。m.p.260~262℃。
2e. IR(KBr):vN-H3 245cm-1(w),3 116cm-1(w);vC-H2 976cm-1(w);vC=O1 721cm-1(s),1 702cm-1(s);vHN-CO-NH1 648cm-1(s);δ=C-H1 618(m),1 526(m),1 448(w);vC-O-C1 228cm-1(s),1 093cm-1(s);785cm-1(m)芳香环1,4二元取代。1H-NMR(DMSO-d6,400MHz):δ1.08(t,3H),2.20(s,3H),2.85(s,3H),3.94(q,2H),5.01(d,1H),6.62~7.03(m,4H,ArH),7.55(s,1H,NH),9.04(s,1H,NH)。m.p.256~258℃(lit[16]253~255℃)。
2f. IR(KBr):vN-H3 230cm-1(w),3 115cm-1(w);vC-H2 977cm-1(w);vC=O1 695cm-1(s);vHN-CO-NH1 640cm-1(s);vC-O-C1 228cm-1(s),1 096cm-1(s);745cm-1(m)芳香环1,2二元取代。1H-NMR(DMSO-d6,400MHz):δ0.99(t,3H),2.29(s,3H),3.87(q,2H),5.62(d,1H),7.28~7.42(m,4H,ArH)7.73(s,1H,NH),9.29(s,1H,NH)。m.p.223~225℃。
2g. IR(KBr):vN-H3 219cm-1(m),3 106cm-1(w);vC-H2 966cm-1(w);vC=O1 708cm-1(s),1 689cm-1(m);vHN-CO-NH1 630cm-1(m);vC-O-C1 224cm-1(s),1 088cm-19(s);795cm-1(w),816cm-1(w)芳香环1,4二元取代。1H-NMR(DMSO-d6,400MHz):δ0.96(t,3H),2.23(s,3H),3.57(q,2H),5.45(d,1H)7.1~7.22(m,4H,ArH),7.21(s,1H,NH),9.01(s,1H,NH)。m.p.244~245℃。
2结果与讨论
2.1催化剂及溶剂对产率的影响
在反应瓶中加入2mmol(0.1201g)脲、2mmol(0.2603g)乙酰乙酸乙酯、2mmol(0.2122g)苯甲醛,10%mol的催化剂及一滴浓盐酸,在60℃下微波反应2min,分别考察不同催化剂及溶剂对3,4-二氢嘧啶-2(1H)-酮产率的影响(表1)。实验结果表明:MMT/CuCl2作催化剂时产率最高,可达66.2%;MMT/ZnCl2及MMT/FeCl3的催化效果稍有下降,分别为58.5%及55.5%;MMT/AlCl3的催化产率为48.0%;MMT/NiCl2用作催化剂时,仅为10.7%;纯的MMT催化时产率有27.8%。酸性中等的CuCl2有利于此反应的进行,而路易斯酸酸性太强或太弱都将阻碍此反应的进行,选用MMT/CuCl2为催化剂。
以优选出的MMT/CuCl2为催化剂,考察不同溶剂对产率的影响。实验结果表明:在强极性质子溶剂乙醇和甲醇中的产率分别为66.2%和64.9%,在极性较强的溶剂二氯甲烷产率为11.5%,乙酸乙酯中的产率为8.1%;DMF中产率为43.2%;石油醚做溶剂时,产率为17.6%,由此可见质子性溶剂有利于此反应的进行;无溶剂条件下产率为37.5%;水作溶剂时产率有9.4%,可能原因是:脲易溶于水,不利于其与有机相的反应。因此,选用乙醇作溶剂。
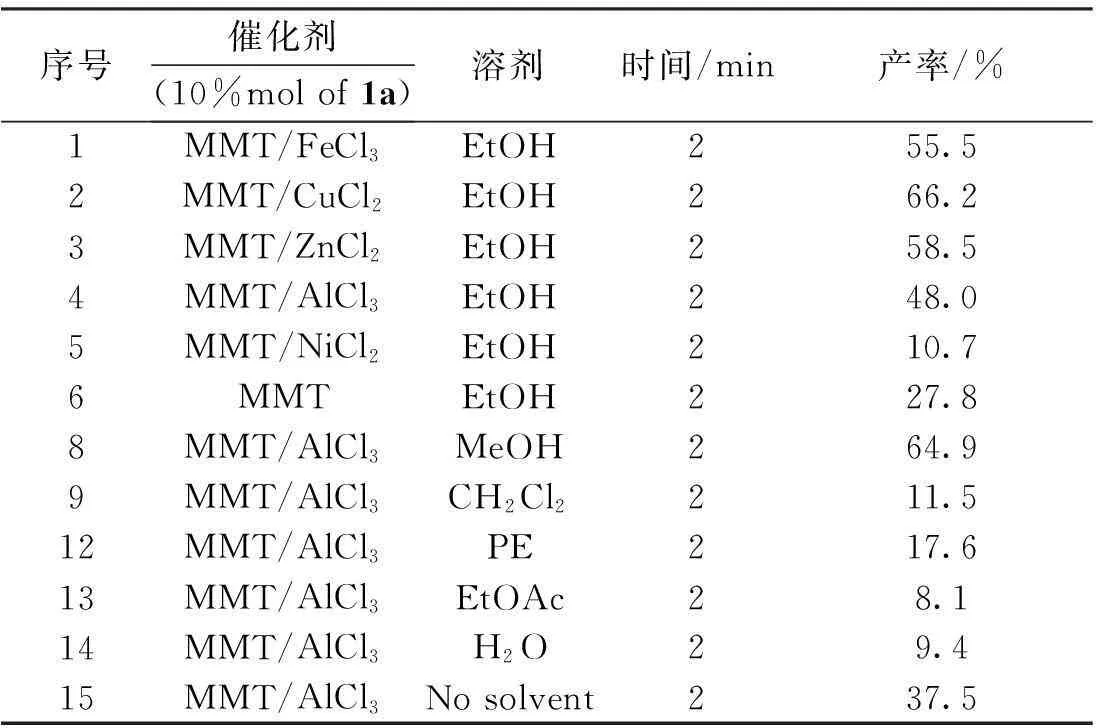
表1 催化剂及溶剂的筛选
2.2反应温度、时间及各原料用对产率的影响
以反应温度、时间,苯甲醛、脲及乙酰乙酸乙酯的用量为5因素,设计L16(4)5正交实验表(见表2)进行实验。以MMT/CuCl2为催化剂,乙醇作溶剂,根据正交试验表进行16个正交试验,考察反应温度、时间及原料用量对产率的影响。
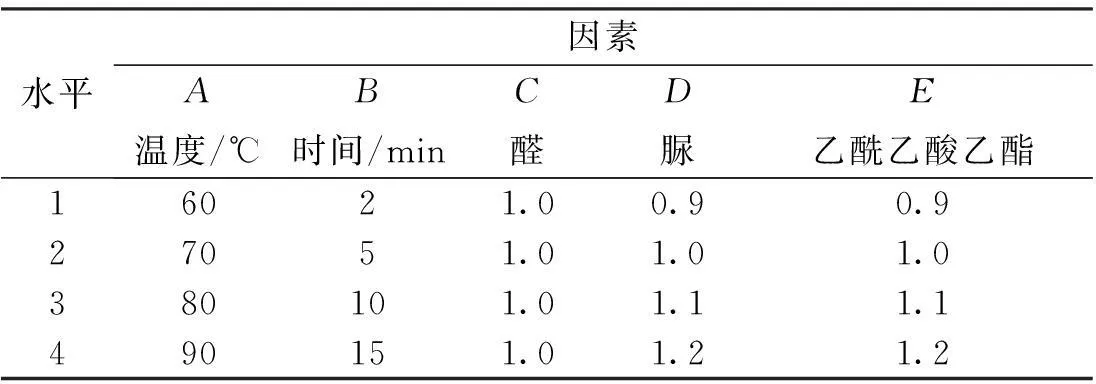
表2 正交实验因素与水平
2.2.1正交实验数据处理
根据上述五因素四水平的正交实验设计表,进行了16次正交实验,得到不同实验条件下的产率,并对实验数据进行直观分析(表3)及方差分析(表4)。

表3 直观分析表
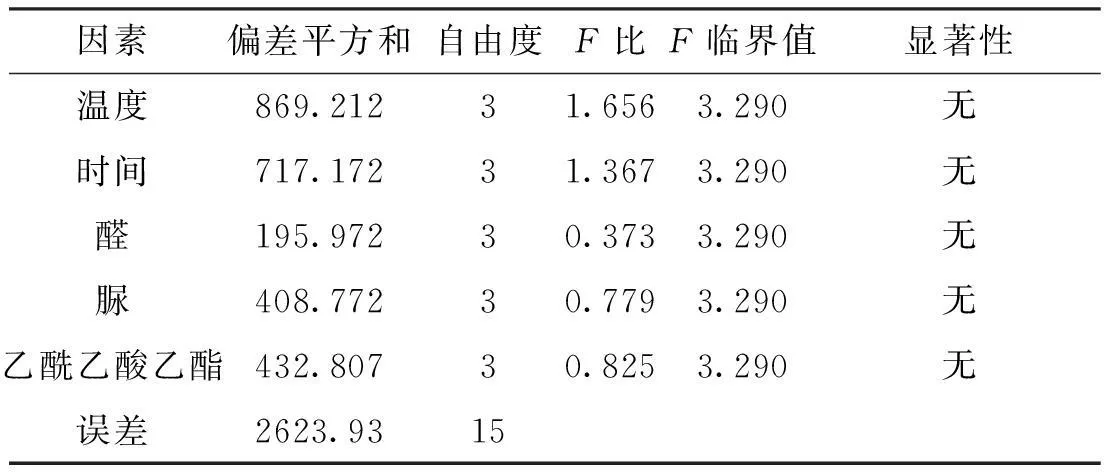
表4 方差分析表
从直观分析表中得出:因数A、D、E的最大均值皆为均值4,B、C的均值3最大,因此A、D、E优选出的水平为第四水平,B、C的最优水平为3,即通过16个正交试验得到:反应温度为90℃、时间10min,原料摩尔比苯甲醛:脲:乙酰乙酸乙酯为1.0∶1.2∶1.2。在直观分析表中,极值:A>B>D>E>C,因此各因数的影响顺序为A>B>D>E>C,既反应温度对此反应的影响最大,时间次之,脲的用量稍小,乙酰乙酸乙酯用量较小,而苯甲醛用量对此反应的影响最小。通过方差分析表,可以的出,这5个因素对此反应均无显著性影响。
因此,结合前面的实验拟合得到此反应的最优条件为:以MMT/CuCl2(10mol%醛)为催化剂,乙醇作溶剂,反应温度为90℃、时间10min,原料摩尔比:苯甲醛/脲/乙酰乙酸乙酯为1.0/1.2/1.2。但此拟合条件并未在上述的任何实验中出现,为考察此条件的优越性,进行了三次验证实验(表5)。
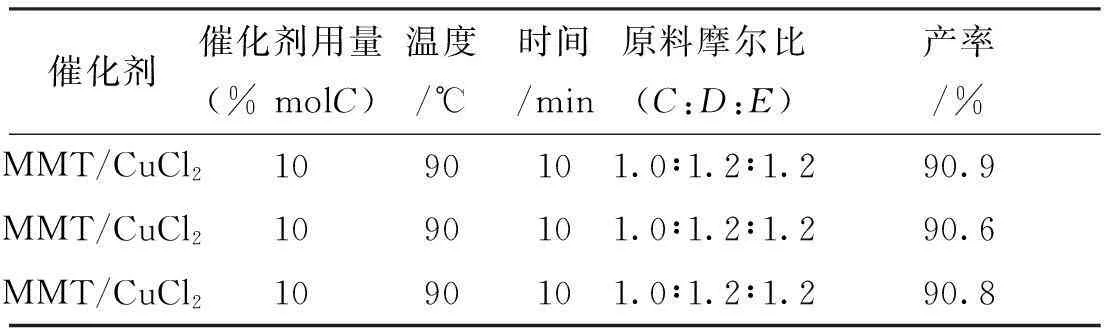
表5 最佳条件验证实验
2.3催化剂循环使用效率
在优选出来的最佳条件下,通过连续投料的方式对催化剂的循环使用效率进行了考察(表6)。实验结果显示:连续投料2次即催化剂循环使用1次时,产率为92.4%;催化剂回收2次和3次时,产率分别为87.8%和84.0%。虽然随着催化剂循环使用的次数增加,产率呈下降趋势,但在回收3次时,产率仍可达到84.0%,说明在一定循环次数内,此催化剂有一定的循环使用效率。
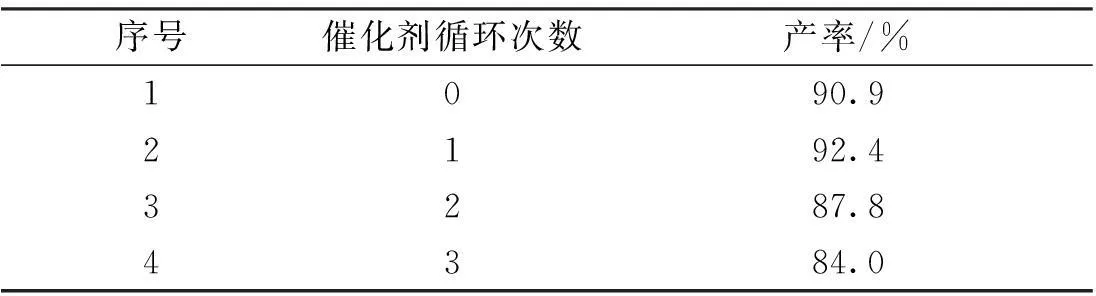
表6 催化剂回收利用次数对产率的影响
2.4底物扩展
在最优条件下,考察不同醛与乙酰乙酸乙酯和脲的反应(表7)。实验结果表明:在此条件下,邻甲氧基苯甲醛与乙酰乙酸乙酯和脲的反应效果最好,产率可达95.7%(2d);苯甲醛次之,为90.9%(2a);对甲基苯甲醛的产率为84.5%(2b);对甲氧基苯甲醛的产率为80.3%(2c);邻氯苯甲醛及对二甲氨基苯甲醛的产率中等,分别为78.8%及78.5%(2f,2g);间硝基苯甲醛的产率最低,仅有73.6%(2h)。可以看出,该条件底物适应性较好,最优条件下芳香醛取代基为供电子基有利于此反应的进行,而吸电子基可能降低效率。

图2 芳香醛与脲及乙酰乙酸乙酯的反应Fig.2 The reaction of aromatic aldehyde,urea and ethyl acetoacetate

序号产物R产率/%12aH90.922bp-CH384.532cp-OCH380.342do-OCH395.752fp-N(CH3)278.562go-Cl78.872hm-NO273.6
3结果与讨论
1)在微波辅助下合成3,4-二氢嘧啶-2(1H)-酮衍生物的最优条件为:反应温度90℃,微波时间10min,芳香醛/乙酰乙酸乙酯/脲的摩尔比为1.2/1/1,催化剂为氯化铜固载蒙脱土,催化剂用量为10%(醛摩尔比)。在最优条件下,产率最高为95.7%;催化剂重复使用3次后产率仍可达84.0%,说明该催化剂有一定的循环使用能力。
2)采用微波辅助合成3,4-二氢嘧啶-2(1H)-酮衍生物,可在缩短反应时间的前提下,提高产率,该合成方法具有高效、节能、快速等优点。
总之,采用微波辐射技术,以路易斯酸固载蒙脱土催化芳香醛、乙酰乙酸乙酯及脲的三组分反应顺利进行,合成7种3,4-二氢嘧啶-2(1H)-酮衍生物,该方法具有收率高、用时短、后处理简单等优点,具有潜在的应用前景。
参考文献:
[1] LEWIS R W,MABRY J,POLISAR J G,et al.Polisar3,4-dihydropyrimidin-2(1H)ones positive modulation ofδ-subunit-containingγ-aminobutyric acid type a receptors,including an epilepsy-linked mutant variant[J].Biochemistry,2010,49(23):4841-4851.
[2] SEHON C A,WANG G Z,VIET A Q,et al.Potent,selective and orally bioavailable dihydropyrimidine inhibitors of Rho kinase (ROCK1) as potential therapeutic agents for cardiovascular diseases[J].J Med Chem,2008,51(21):6631-6634.
[3] BARROW J C,NANTERMET P G,SELNICK H G,et al.In vitro and in vivo evaluation of 3,4-dihydropyrimidin-2(1H)ones C-5 amides as potent and selective α1 receptor antagonists for the treatment of benign prostatic hyperplasia[J].J Med Chem,2000,43(14):2703-2718.
[4] BIGINELLI P.Synthesis of 3,4-dihydropyimidin-2(1H)-ones[J].Chimica Italiana,1893,23:360-366.
[5] 安琳,张玲,郑友广,等.微波辐射促进选择性合成4,6-二芳基-3,4-二氢嘧啶-2(1H)-酮和嘧啶-2(1H)-酮[J].有机化学,2012,32(6):1108-1111.
[6] 徐玉林,龚文朋,杨水金.二氧化硅负载磷钨酸催化合成3,4-二氢嘧啶-2(1H)-酮衍生物[J].应用化学,2014,31(10):1203-1209.
[7] 宋志国,孙啸虎,杨喜宝.硫酸氢钾高效催化一锅法合成5-未取代的3,4-二氢嘧啶-2(1H)-酮[J].化学通报,2014,77(10):990-993.
[8] 任凤兰.超声波下β-环糊精催化合成3,4-二氢嘧啶-2(1H)-酮[J].河南化工,2014,31(6):33-35.
[9] 王勤,裴文.超声波辐射下草酸催化合成3,4-二氢嘧啶-2(1H)-酮[J].化学试剂,2010,32(4):372-374.
[10]GEDYE R,SMITH F,WESTAWAY K,et al.The structures of spirasine V and pirasine VI[J].Tetrahedron Let,1986,27(3):279-292.
[11]KREMSNER J M,KAPPE C O.Microwave-assisted organic synthesis innear-criti[J].Polym Prepr,2008,49:951-981.
[12]尹晓刚,张林,赵正容,等.微波辅助法合成KP550[J].工业水处理,2013,30(12):56-58.
[13]尹晓刚,赵正容,肖维军,等.微波辅助法合成季鏻盐[J].日用化学工业,2014,44(1):15-18.
[14]吴伟,吴小云,吴江,等.负载型蒙脱土催化芦竹碱的微波合成[J].合成化学,2015,23(6):543-546.
[15]李明,郭维斯,文丽荣,等.新型无毒离子液体催化“一锅煮”合成3,4-二氢嘧啶-2(1H)-酮[J].有机化学,2005,25(9):1062-1065.
[16]刘园,刘晓玲,黄国文,等.氟化钙催化的Biginelli反应——一锅法合成3,4-二氢嘧啶-2-酮[J].江西师范大学学报(自然科学版),2010,34(4):374-379.
文章编号:1004—5570(2016)03-0079-06
收稿日期:2016-03-25
基金项目:国家自然基金项目(No.21362006);贵州省科学技术基金项目(黔科合J字[2014]2129号);贵州省科技创新人才团队建设项目(黔科合人才团队[2014]4006号)
作者简介:尹晓刚(1976-),男,副教授,博士,研究方向:有机合成,E-mail: m13885115516@163.com. *通讯作者:陈卓(1971-),女,教授,研究方向:有机合成及环境化学,E-mail: chenzhuo19@163.com.
中图分类号:O629.32
文献标识码:A
Preparation of 3,4-dihydropyrimidin-2(1H)ones derivatives under microwave conditions
YIN Xiaogang,WU Xiaoyun,WANG Ye,CHEN Zhiming,CHEN Zhuo*
(School of Chemistry and Materials Science, Guizhou Normal University, Guiyang, Guizhou 550001, China;Key Laboratory of Functional Materials Chemistry of Guizhou Province, Guiyang, Guizhou 550001, China)
Abstract:A new method of microwave-assisted synthesis of 3,4-dihydropyrimidin-2(1H) ones derivatives was developed. All products was synthesized using aromatic aldehydes, acetacetic ester and urea as starting material with immobilized montmorillonite/Lewis acid as catalyst. Influences of catalysts, solvents on yields were investigated using single factor methods and the temperature, microwave time and quivalency of starting materials were investigated using orthogonal tests. Yields were up to 95.7% under optimal conditions and 84.0% after catalyst recycled three times.The products were confirmed by1HNMR, IR and MP. Microwave assisted synthesis of 3,4-dihydropyrimidin-2(1H)ones has such advantages as higher yield,shorter reaction time,which has a potential application prospect.
Key words:Biginelli reaction; microwave assisted; immobilized montmorillonite/Lewis acid

