玫瑰种群生物学研究进展
金飞宇,束华杰,刘 建,管章楠,张淑萍,*
1 山东大学生命科学学院生态学与生物多样性研究所,济南 250100 2 山东大学环境研究院,济南 250100
玫瑰种群生物学研究进展
金飞宇1,束华杰1,刘建2,管章楠1,张淑萍1,*
1 山东大学生命科学学院生态学与生物多样性研究所,济南250100 2 山东大学环境研究院,济南250100
摘要:玫瑰(Rosa rugosa Thunb.)原产于我国东部沿海、日本、朝鲜半岛和俄罗斯远东地区,18世纪作为园艺种引入欧洲后逃逸并入侵至北海和波罗的海周边多个国家以及北美沙质海岸,而中国野生种群却在过去30年间持续萎缩,成为珍稀濒危物种。从玫瑰种群生物学角度,通过文献比较和综合,在阐明玫瑰生态学特性和野生分布变化的基础上,全面论述了玫瑰种群在我国的生境退化、种群动态、种子繁殖、遗传多样性、濒危机理、保育方面的成果和悬疑问题;并结合欧洲入侵种群分布范围和敏感生境、对本地群落和物种的影响、种子繁殖、遗传变异、种群扩张和模拟预测、管理和控制方面的研究进展,分析了濒危种群和入侵种群数量动态、群落组成、幼苗更新、遗传变异、管理策略方面的差异及其影响因素;进而提出未来的玫瑰研究可从濒危种群和入侵种群的比较研究、种群和灌丛的动态监测、适合度相关性状的变异及其遗传基础、基于种群生物学的保育或控制4个方面为切入点,集中探索玫瑰种群濒危和入侵动态的规律、遗传基础和主要驱动力,为玫瑰保育和管理提供理论依据,为相似物种的适应和进化机制研究提供例证。
关键词:玫瑰;生物入侵;入侵物种;濒危物种;中国;欧洲
玫瑰(Rosarugosa)是蔷薇科、蔷薇属落叶灌木,野生种群原产于中国山东、辽宁沿海沙滩和吉林图们江河谷,在朝鲜、日本及俄罗斯远东地区亦有分布[1-2]。该物种常在沙质海岸和河谷开放沙丘形成单优灌丛,具有良好的固沙、护堤作用;其花粉、花蜜、果实既可供人食用,也是野生昆虫、鸟类和小型啮齿类动物的重要食物来源[3],是沙质海岸的生态关键种和重要的资源植物。玫瑰野生种群还是栽培玫瑰及蔷薇属花卉育种的重要种质资源库,其丰富的抗寒、抗旱[4]、耐盐[5]、抗黑斑病、抗白粉病基因和芳香基因及其进化机制受到育种学家和生态遗传学家的高度关注[6]。
然而,20世纪80年代以来,由于生境破坏、过度利用、气候变化等因素,中国的野生玫瑰种群持续萎缩,局部种群已经灭绝或濒临灭绝,甚至出现生长、繁殖能力和遗传多样性下降特征[7-8]。中国学者对中国玫瑰种群的濒危机理[9]、群落结构[3]、遗传变异[8,10-11]、繁殖繁育和保护对策[4,12-15]等方面进行了大量研究。由于玫瑰是典型的配子体自交不亲和性植物[16-17],自花授粉的花朵仅有13% 能产生含少量瘦果的很小的蔷薇果[18]。因此种群持续缩小可能导致遗传多样性丧失和基因型减少,引发有性生殖障碍,从而降低物种的适应性,加剧种群濒危甚至灭绝。
非常有趣的是,玫瑰在18世纪被引入欧洲后迅速逃逸,成为影响最为严重的入侵种之一[1]。入侵的玫瑰种群在海岸和海岛沙丘常形成密集连续的大灌丛。大量本地植物被排挤出原有生境,对昆虫、鸟类等动物多样性也产生了影响。入侵种群扩散的机理和驱动因素研究受到生态学家和自然保护部门的高度重视,并对欧洲野生玫瑰种群的入侵机理、入侵动态[19-20]、种群监测和预测[21-22]、遗传变异[23-24]和控制对策[25-26]等方面进行了大量研究。
玫瑰为何会在中国濒危而在欧洲入侵?中国和欧洲学者分别对濒危和入侵种群的种群数量、群落组成、种子繁殖、遗传变异及其与种群衰退或扩张的联系进行了大量研究,并在此基础上对濒危种群的保护和入侵种群的控制提出了一些建议。玫瑰作为一个在原产地濒危而在引入地入侵的物种,为保护生物学、入侵生物学和进化生物学提供了一个不可多得的研究系统,对探讨种群衰退和扩张过程的驱动因素及其遗传过程、适应进化、生态影响都具有重要价值。本文将以种群动态为主线索,在中国濒危玫瑰种群和欧洲入侵玫瑰种群研究进展进行深入比较分析的基础上,探讨玫瑰种群研究的热点领域和空白点,提出未来研究的框架和重要方向。
1玫瑰的生态学特性和分布
1.1玫瑰的生态学特征
玫瑰是主要分布于沿海沙质海岸的喜光灌木,耐寒、耐旱、耐盐、耐贫瘠,喜湿润不耐涝,对土壤要求不严格,在低碱性土壤中也能生长[27]。玫瑰常见于排水良好的滨海沙滩,或者无乔木覆盖的开放沙丘,形成大面积的单优群落[28]。玫瑰所在群落结构一般比较简单,只有灌木层、草本层、地被层(苔藓、地衣),偶见有稀疏乔木覆盖。
在适宜的生境中,玫瑰主要通过根状茎的无性繁殖实现就地扩张,也可以通过虫媒传粉产生大量可育的种子,实现远距离传播和种群的实生苗更新[29]。在欧洲,海流和鸟类被认为是玫瑰种子远距离传播的主要动力,田鼠、野兔等小型啮齿类可参与种子的近距离传播[1],国内关于玫瑰种子传播和幼苗更新的研究不多。
1.2 野生玫瑰分布变化
中国的野生玫瑰分布从20世纪80年代开始经历了迅速衰退和生境破碎化的过程。与1980年以前种群数量多、生境连续面积大、灌丛多而茂盛形成鲜明对比的是,现在的玫瑰野生种群种群数量少、生境狭窄破碎化、灌丛少而退化。
以吉林珲春为例,1988年在珲春敬信图们江河谷有大约400 hm2的沙丘湿地中有野生玫瑰灌丛分布[30],到1993年锐减至50 hm2[31],至2005年有玫瑰灌丛分布的沙丘湿地面积仅余20多hm2[32]。虽然吉林珲春对野生玫瑰分布区实行了严格的封育保护,但未能改变玫瑰种群持续衰退的趋势。同时,威海成山头、成山林场、金海湾和大连长山岛、金州等地的种群大部分已经消失或仅存零星的单株[7]。
玫瑰在瑞典[33]、德国[34]、荷兰[35]、丹麦[36]、挪威[37]、立陶宛等地被认为是入侵种,自1845年从日本引入北美后也迅速扩散,在美国的19个州以及加拿大的6个省都记录到野生分布[1]。玫瑰灌丛在欧美海岸沙滩或沙丘一旦建立,即迅速扩散,很难清除。目前,德国、丹麦、瑞典等国均已经建立了对该物种分布的监控和评估体系。
2中国玫瑰濒危种群研究进展
玫瑰野生种作为国家二级保护植物[9],1992年编入《中国植物红皮书》中[38]。《吉林省野生动植物保护管理暂行条例》中定其为省级一类重点保护植物。我国学者对其生境、种群、群落、繁殖等方面进行了大量调查和研究。
2.1种群数量和群落组成调查
目前文献报道的国内规模较大的野生玫瑰种群仅有吉林珲春[32]、辽宁长山岛[28]、庄河和营口[13]、山东牟平[7-8],共5个种群。其中以吉林珲春和山东牟平的种群规模较大,灌丛数量均超过40个。1990到2006年间,珲春玫瑰灌丛内每平方米的平均分株数从5.27下降至1.69[9],盖度从42.7%下降至17.2%,而北海道天然玫瑰灌丛每平方米的平均分株数为8.9[39],火烧后可增至23.3。入侵种群的分株密度更大,盖度最高可达100%[27]。可见,中国野生玫瑰种群相对于日本本地种群和欧洲入侵种群的长势明显较弱。
在山东沿海的开放沙滩或者林缘,玫瑰常形成单优群落或者与其他灌木或高大草本的共优群落。在靠近高潮线的一侧与肾叶打碗花(Calystegiasoldanella)、砂钻苔草(Carexkobomugi)等低矮草本共生或相间分布,伴生沙滩黄芩(Scutellariastrigillosa)、海边香豌豆(Lathyrusmaritimus)、珊瑚菜(Glehnialittoralis)、砂引草(Messerschmidiasibirica)等典型沙生植物。在靠近林缘的一侧与粗毛鸭嘴草(Ischaemumbartatum)、艾蒿(Artemisiaargyi)、白茅(Imperatacylindrical)等高大草本共生或相间分布,伴生萱草(Hemerocallisfulva)、烟台补血草(Limoniumfranchetii)、兴安天门冬(Asparagusdauricus)等。乔木层以人工种植的黑松(Pinusthunbergii)为主,伴生灌木有单叶蔓荆(Vitexrotundifolia)、苦参(Sophoraflavescens)和紫穗槐(Amorphafruticosa)等。在吉林珲春图们江河口的河谷沙丘上,玫瑰常形成单优灌丛,草本层以砂钻苔草、东方野豌豆(Viciajaponica)、艾蒿、野古草(Arundinellahirta)为主,伴生月见草(Oenotherabiennis)、木贼(Equisetumhyemale)、问荆(Equisetumarvense)、桔梗(Platycodongrandiflorus)等。在沙丘高处散生山楂(Crataeguspinnatifida)、杞柳(Salixintegra)等小乔木。辽宁营口鲅鱼圈地区野生玫瑰的主要伴生植物有: 结缕草(Zoysiajaponica)、砂钻苔草、艾蒿、砂引草等[13]。
在中国玫瑰群落中,虽然玫瑰在灌木层占据绝对优势,但艾蒿、月见草、东方野豌豆等高大或缠绕草本的盖度常可超过50%,与玫瑰在群落上层形成竞争。在日本北海道,玫瑰也是分布于沙滩和海岸栎林(Quercus)之间的狭长地带,伴生与中国玫瑰群落物种相同或近缘的植物,但玫瑰在灌丛中的盖度更高,常形成单优群落[40]。在欧洲玫瑰群落中,也伴生少量相似的种类,如沙生苔草(Carexarenaria)、沙生赖草(Leymusarenarius)、披碱草 (Elymusrepens) 等,主要集中于近地面,且数量随玫瑰盖度的增加迅速减少[27],极少种类如沙棘(Hippopha⊇rhamnoides)、帚石楠(Callunavulgaris)、马兰草(Ammophilaarenaria)等可与玫瑰竞争共存[1]。
2.2气候、土壤
中国的野生玫瑰种群集中分布的山东、辽宁、吉林东部沿海或近海地区均属于暖温带或温带海洋性气候,较为湿润温和,利于玫瑰生长。玫瑰生长的土壤以排水良好的沙质土为主,在辽宁长山岛也常见于海岸粗砂或砾石山坡。在全球气候变化的大背景下,1960—1999年间烟台地区气候表现出显著的干暖化趋势,90年代比60年代年均降水量减少了56.7 mm,约8%,年平均气温上升了1℃[41]。降水减少和土壤变干均可能对玫瑰的生长、繁殖产生负面影响[7,9]。而在玫瑰入侵较为严重的欧洲北海和波罗的海周边国家,受大西洋暖流影响,气候比中国更加湿润,夏季凉爽,冬季温和,非常适宜玫瑰生长[1]。在全球温暖化影响下,多年记录表明瑞典北部地区年均气温每10年上升0.099℃[42],北海和波罗的海沿岸冬季气温多在0℃上下波动,利于玫瑰种子的层积和翌年春季萌发。日本北海道的年平均气温与我国珲春相近,但年降水量却达到900 mm以上,珲春仅为 600 mm;俄罗斯堪察加地区最为寒冷,年均温只有1.6℃,年降水量却达到1000 mm 以上。日本和俄罗斯玫瑰分布区冷湿的气候为玫瑰的生长提供了良好条件(www.en.climate-data.org)。
2.3遗传多样性
适当的遗传多样性及其保持是种群适应和进化的重要基础,遗传多样性可通过影响物种的适应性而影响种群动态。赵娟娟[11]用RAPD标记对山东荣成野生种群遗传多样性和遗传结构进行分析,表明随着生境破碎化加剧,灌丛间的基因交流逐渐降低;翟雯[28]用RAPD标记对大连长山岛种群遗传多样性和遗传结构进行分析,说明与其它地区种群相比,大连长山岛野生玫瑰种群生境相对较好,遗传多样性水平高,但灌丛间基因交流较小,遗传漂变较大;杨继红对山东牟平、山东荣成、大连长山岛、吉林珲春4个种群的遗传多样性研究表明:随着空间距离的增大,灌丛间遗传距离显著升高;珲春种群遗传多样性水平最高,但各种群均有特异等位基因存在[8]。这些研究对于探讨我国野生玫瑰的濒危水平和保护策略提供了很多证据,尚未涉及遗传多样性与种群适应性的关系与机制,无法确定遗传多样性丧失对种群适应性的影响方式和程度。
与欧洲入侵玫瑰种群和日本、韩国、俄罗斯的本地玫瑰种群相比,中国玫瑰种群的遗传多样性水平普遍较低(表1),约是欧洲入侵种群和其他亚洲本地种群的1/3到1/2,甚至远低于中国栽培玫瑰品种的基因多样度水平。虽然不同分子标记之间的遗传多样性检测结果不具有充分的可比性,但仍提供了可参考的信息。
2.4种子生物学特性及种子质量
种子繁殖是决定玫瑰种群有性生殖和维持遗传多样性的一个重要环节。国内对玫瑰种子的研究主要集中在种子质量、生活力、存储方法和萌发技术方面。野生玫瑰种子的千粒重通常为8—10g,形状和千粒重因种源不同而略有差异。吉林的玫瑰野生种群,种子为棱三角形,黄白色,千粒重为9.277g[14]。冯立国等[44]研究发现,珲春种群种子形态变异很丰富,扁球形或近球形果实的种子其种皮为淡黄色,颗粒较大而饱满,平均千粒重 9.49g,而卵形和壶形果实种子的种皮呈红色,粒小而狭长,但其千粒重很重,可达到 15.47g。种子解剖发现,珲春野生玫瑰成熟果实中98%的种子种仁不饱满[14];但郭孟瑶等[12]发现珲春野生玫瑰种子空粒率仅为7.67%。种子活力也因种源、贮存方式、测量方式的不同而差异较大。刘毅等[14]将吉林的玫瑰种子用赤霉素处理后低温湿沙层积250d,播种,出苗率可达40%以上;陈建军等[9]发现,珲春野生玫瑰种子低温层积处理246d后发芽率只有8%;郭孟瑶等[12]用20g/L的KNO3处理4h以打破珲春玫瑰种子休眠,2—6℃下低温层积180d,发芽率可达37.74%。目前,尚无对原产地和入侵地玫瑰种群种子产量和质量的系统比较研究,入侵种群种子的萌发率也因层积和萌发方式不同变化很大,但最高可达100%[1],丹麦玫瑰种子的萌发率在55%—80%之间[29,45],高于记录到的中国种群种子的萌发率。
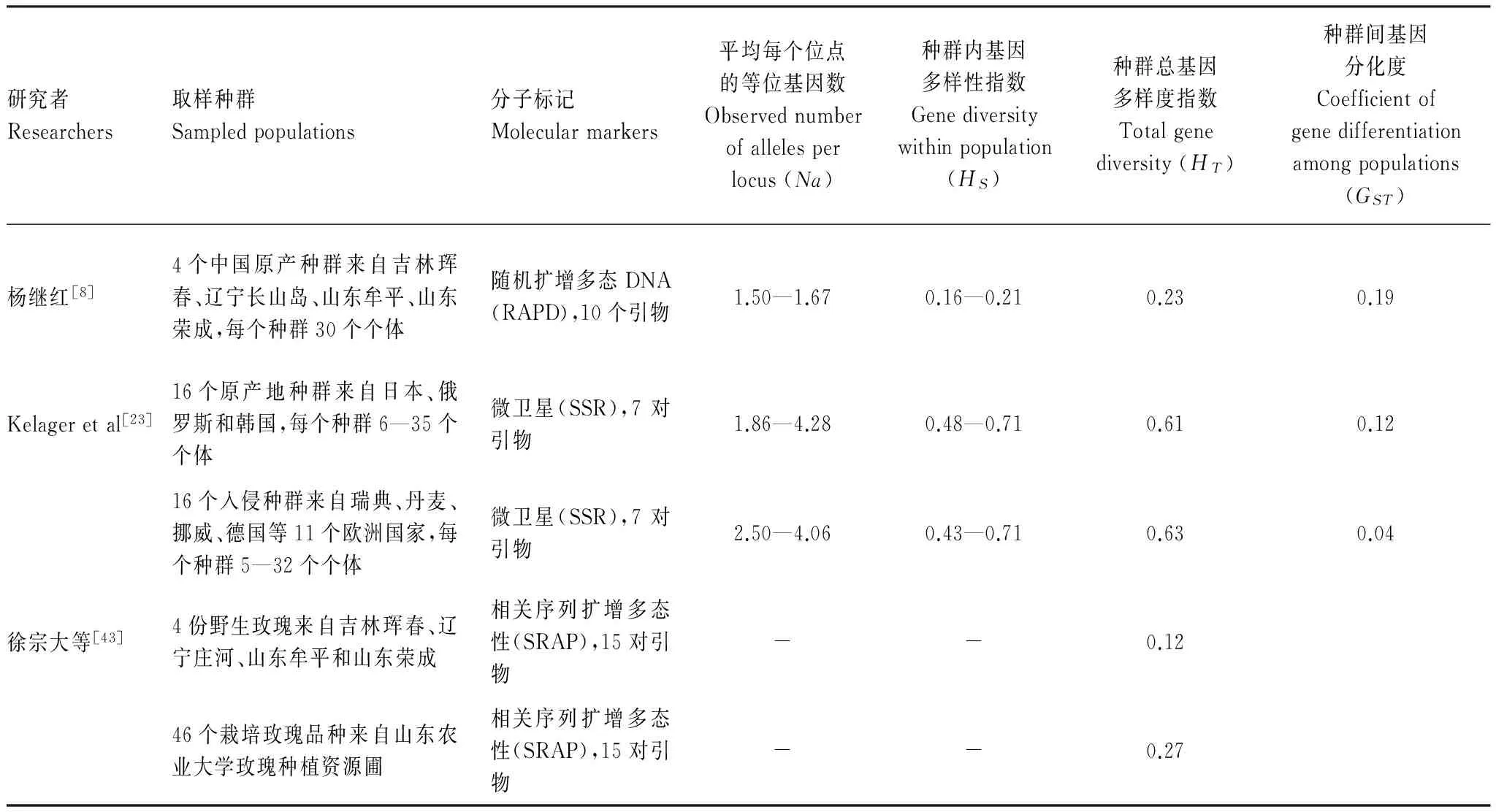
表1 原产地和入侵地玫瑰种群遗传多样性比较
2.5人为干扰
多项研究表明,由于中国滨海地区围海造田、旅游度假以及工业开发等人为活动,导致野生玫瑰的生境急剧恶化,种群面积和数量迅速减少,使该物种逐渐走向濒危[7,9,44]。吉林珲春和烟台牟平种群均位于自然保护区内,受到的人为破坏较小,仍然持续减少。而欧洲入侵种群也多位于海岸保护区或者旅游度假区,受到游客和自然管理策略的影响,却不断扩张。除了种群自身的生长能力和遗传因素,人为干扰方式和程度的差异也是一个重要方面。表2列出了中国濒危种群和欧洲入侵种群的人为干扰方式差异。对比可见,中国玫瑰种群的人为干扰以占用生境、改变土壤、改变植被、收集花果为主;欧洲玫瑰种群的人为干扰以轻度休闲、剪切管理为主。由于玫瑰喜光耐贫瘠,是沙质海岸或沙丘的先锋物种,放牧、旅游等轻度干扰对玫瑰的影响可能非常微妙。在一定范围内,适度的干扰可能保持群落处在适宜玫瑰生长的阶段,防止封育导致其他物种繁茂和群落演替加速,火烧对日本北海道玫瑰种群更新的促进就是一个例证[39]。因此,进一步研究和理解干扰对玫瑰种群动态的影响对我国玫瑰种群的保护具有重要意义。
2.6濒危因素和保护对策
综合分析我国玫瑰种群的数量、遗传多样性和种子特性等内在因素和气候变化、物种竞争、人为干扰等外在因素,并与日本和欧洲玫瑰种群相比较,我国玫瑰种群的濒危可能是外因主导,外因和内因共同作用、交互作用的结果。但目前还不清楚其详细机制。国内以往研究较为侧重外因对种群濒危的影响,在对种群更新和生境破坏研究和评价的基础上,提出了就地保护、迁地保护和利用性保护相结合的框架并得到国内学者的广泛认可[7,9]。以野生玫瑰为主要保护目标的自然保护地、异地种质园和繁育基地建设正在受到重视。吉林珲春种群已经划入珲春国家级自然保护区范围,山东牟平种群已经划入烟台海岸带防护林省级自然保护区。延边大学和山东农业大学分别建立了野生种质的异地保存基地。野生玫瑰的引种驯化、种苗繁育[14,46]和快繁技术[47]也受到林业和园艺部门的重视。这些保护措施对缓解玫瑰的濒危状况起到了积极作用,但就地、迁地保护的效果仍然需要科学评价,气候和环境变化背景下玫瑰种群的生态和遗传响应也需要进一步研究。
表2中国濒危玫瑰种群和欧洲入侵玫瑰种群人为干扰的方式和程度
Table 2The ways and their extents of the anthropogenic disturbances observed in the endangered populations of China and the invasive populations of Northwest Europe

种群Populations干扰方式Disturbances种群后果Populationconsequences参考文献References珲春濒危种群EndangeredpopulationinHunchun环保部门封育江坝改造断水采摘花果根茎及放牧伴生种繁茂生境变化,种群数量急剧消失种子繁殖受阻,自然更新不良[9][9][9,32]烟台濒危种群EndangeredpopulationinYantai林业部门管护和造林修建旅游及工业设施居民收集柴草多数灌丛完好,少数受林木影响消失生境丧失、灌丛消亡地被破坏,土壤干旱,幼苗更新困难[8][7][7,11]日本北海道天然种群ThenativepopulationinHokkaido,Japan火烧促进更新[39]德国北海岛屿入侵种群InvasivepopulationsontheislandsoftheNorthSea,Germany自然生境,旅游步道小径协助扩散[27]丹麦海岸入侵种群Invasivepopulationsonthecoast,Denmark半自然生境,民居,道路,步道;不定期剪切;挖根、填埋协助扩散和种子萌发促进就地扩张促进再萌发和扩张[29][22][26]
3欧洲入侵种群的研究进展
3.1入侵生境与生态影响
玫瑰在1796年首次从日本引入英国,1927年在英国首次记录有野生分布之后迅速逃逸,至今在北纬46°至68°之间的16个欧洲国家记录到野生分布,在波罗的海和北海周边国家的沙质海岸成为影响最为严重的入侵种之一[1],并在加拿大大西洋沿海沙丘入侵成功[19]。欧洲多个国家建立了玫瑰入侵的监控体系,对玫瑰入侵的范围和敏感生境进行动态观测。Kollmann等[22]的研究表明:生长在海岸带中间灰色沙丘上的玫瑰灌丛比靠近海岸线的白色沙丘和靠近内陆的棕色沙丘上的玫瑰灌丛略小,而且发现一些较大的灌丛多靠近村庄。轻微的人为扰动和小径、道路、房屋周围丰富的土壤养分能够提高玫瑰的建群和克隆繁殖。
在欧美的入侵生境中,随着玫瑰的密度和盖度的增加,群落的总盖度增加,物种丰富度和优势种数量则降低,且草本植物比灌木更敏感[27,34]。只有繁缕(Stellariamedia)随玫瑰盖度增加有所增加。而本地物种的丧失将继续降低入侵的阻力,从而加速入侵[48]。另外,玫瑰能够降低草本植物和苔藓、地衣、蕨类植物的盖度,增加土壤腐殖质,降低土壤pH[49]。玫瑰在欧洲入侵生境中常形成密集连续的大灌丛,从而将本地植物排挤出去,降低本地植物多样性,改变海岸植被组成和结构。在中国玫瑰则常形成斑块状镶嵌分布的小灌丛,与其他灌木和高大草本植物共同形成多样化的海岸植被。但种间竞争对玫瑰种群动态的影响还没有研究报道。
3.2遗传变异
Kelager等[23]对16个欧洲入侵玫瑰种群和16个原产地玫瑰种群(来自日本、俄罗斯、韩国等)种群遗传多样性的SSR研究表明,欧洲玫瑰种群遗传多样性水平与原产地种群接近,但遗传组成已发生了显著的变化,在大部分位点上的优势等位基因与原产地不同,3个欧洲种群可能源自日本西北部,但其余13个欧洲种群的来源还无法解释。该研究未对中国种群进行采样,因此欧洲入侵种群与中国种群的亲缘关系尚不确定;欧洲入侵种群中的优势等位基因的来源及其适应性也无相关证据。Kelager等[23]将欧洲入侵玫瑰种群丰富的遗传多样性归因于多次引种、种子传播和反复杂交,并认为这可能是玫瑰得以避免遗传瓶颈效应的原因。同时,Kellner 等[50]报道了玫瑰在波罗的海沿岸与欧洲本地种Rosamollis的天然杂交,并称其在重叠分布的种群中通过遗传删除威胁该本地种的遗传完整性,导致其杂交衰退。Mercure 和Bruneau[24]在加拿大圣劳伦斯河口也确认了逃逸的玫瑰与本地哈德逊湾玫瑰(Rosablanda)杂交产生了新的入侵基因型。由此推测,杂交和种子繁殖对欧洲及北美入侵玫瑰种群的遗传多样性维持和适应性的不断提高可能起到了至关重要的作用。
3.3种子和幼苗更新
虽然成功入侵的玫瑰灌丛主要以无性繁殖方式就地拓展空间,但仍成功产生大量果实和种子。玫瑰果实产量和灌丛高度以及生境无关[1]。低温层积后种子的萌发率可达55%—80%[29,45]。野外播种和实生苗移植实验表明:种子是玫瑰入侵新生境并成功建立种群的重要因素,一旦种子到达并成功萌发,可在各种海岸沙丘和沙滩生境成功建立新种群;开放沙丘、沙滩对种子入侵最为敏感,而旅游、放牧等人为干扰对玫瑰种子和幼苗更新有促进作用。土壤扰动使得种子由土壤表面到达内部,有利于种子的层积和萌发[29]。而我国学者发现中国玫瑰种群种子品质差、人为干扰阻碍幼苗更新。种子品质和人为干扰及其对种群动态的影响在入侵和濒危种群间可能有较大差异,需要进一步研究。另外,欧洲记录到多种传播玫瑰种子的鸟类、啮齿类动物以及海流对玫瑰种子的远距离传播,我国这方面的研究还未见报道。
3.4食草和寄生
与众多入侵植物一样,缺少天敌是玫瑰在欧洲入侵成功的重要因素之一。在原产地攻击玫瑰的昆虫和真菌如锈病明显比入侵地多,而且这些特化的昆虫和真菌主要局限于原产地如日本北海道和俄罗斯远东地区的天然玫瑰种群中[25]。在日本,蚜虫、象鼻虫和瘿蜂较为常见,在俄罗斯远东地区卷叶蛾类则是玫瑰主要的食草者,但这些原产地的玫瑰天敌并未随玫瑰一起引入欧洲。在欧洲,黑斑病和白粉病对玫瑰几乎没有影响,一些小型啮齿类如田鼠取食玫瑰的果肉和种子,反而协助了其种子的传播[29]。在欧洲也有发现一些寄生在果实里的本地的蚜虫(Chaetosiphontetrarhodum)和寄生蛾类(Grapholitatenebrosana),但寄生概率很低。虽然在欧洲也发现了在日本攻击玫瑰的卷叶蜂,但其在欧洲却不以玫瑰为食,有人猜测这可能是由于入侵地和原产地的玫瑰存在遗传差异,导致寄主对宿主的选择变化[1]。中国对玫瑰食草者和寄生昆虫、病原体的研究较少,有少量关于栽培玫瑰品种虫害如瘿蜂属种类的报道[51]。
3.5种群扩张模拟和预测
外来种群的监测需基于长时间、高分辨率的数据收集和分析[21]。Damgaard等[21]提出用不平衡的永久样地数据(unbalanced permanent-plot data)来监测入侵植物的贝叶斯状态空间模型(Bayesian state-space models)。Kollmann等[22]用1986, 1999, 2002, 2004, 2006等年份的一系列卫片对丹麦西北部沿海的植被组成进行了解译,发现2004年丹麦西北部海岸沙滩的玫瑰盖度为0.33%。永久样地监测结果表明,在2004—2007年期间固定沙丘上能发现玫瑰灌丛的平均概率由0.18显著增加到0.28。这一模型可进一步开发以用于对特定位置玫瑰灌丛的年际动态变化进行预测。模型预测表明在保持现存环境、无人为干扰,只考虑克隆繁殖的条件下,到2034年玫瑰在该地区的盖度将达到3.4%,但斑块数量会因合并而大大降低。灌丛扩大和合并是欧洲海岸玫瑰种群就地扩张的常见模式。
3.6入侵原因和控制对策
综合分析入侵玫瑰种群的生境和群落特征、丰富的遗传变异、成功的种子繁殖和幼苗更新、天敌的缺少和持续的灌丛扩张融合,可见玫瑰之所以在欧洲入侵成功,首先得益于该物种自身对新生境的适应性和不断积累的杂交优势,其次是人为扰动对灌丛扩张的促进,再次是海流和鸟类及哺乳类对种子的长距离传播,最后是新生境中竞争植物和天敌的缺少。因此,对入侵种群的管理需要充分考虑其适应性和遗传变异性的差异及其与入侵性的关系。目前,尚无这方面的研究报道。
欧洲学者对入侵种群的控制策略进行了大量研究,针对以根茎繁殖为主的就地扩张,为了保持海岸空间对游客的开放性,深埋、连根拔起、火烧、剪切等多种机械控制方法被结合使用,但很难将玫瑰从已经建立的生境中完全根除[26]。生物控制试图通过整合玫瑰种群研究,以筛选确定在玫瑰最敏感的生命周期阶段潜在天敌物种对玫瑰的影响。在了解其寄主专一性的基础上,筛选最有效最安全的生物防治剂[25]。减少玫瑰种子产量和降低种子在近自然地区的传播率,并降低人类对生境的影响是限制玫瑰种子发芽和建群的重要策略[22]。
4未来研究展望
4.1 入侵种群、濒危种群和正常种群的比较研究
玫瑰在中国的濒危与在欧洲的入侵为研究玫瑰及繁育系统相似灌木物种的濒危和入侵机制、进化生态学提供了良好的系统。入侵种群和原产地种群之间的适合度差异或适应性变异已在锈红蔷薇(Rosarubiginosa)等多个物种中被发现[52-53]。入侵地和原产地种群之间统计特征、适合度相关性状、遗传组成的比较研究已经成为入侵生物学研究的一个新热点和进化生态学研究的新工具。对玫瑰入侵种群和原产地种群之间遗传多样性的比较研究已经证实了高遗传多样性、多次引入和新优势基因在入侵种群中的存在,但还没有入侵种群和原产地种群之间统计特征、适应性状及其与这些遗传变异有直接关系的证据,也没有入侵种群、濒危种群与正常种群之间的系统比较。开展欧洲入侵种群、中国濒危种群、日本正常种群之间的比较研究,不仅有助于了解种群入侵和濒危的过程、结果和原因,而且有助于找到导致物种入侵和濒危的关键因子,并采取正确的管理方法。同时,对入侵地和濒危地玫瑰与其他物种的种间关系(竞争物种、物种多样性等)和群落组成进行比较研究,也有助于从群落水平发现影响种群动态的生物因子如竞争者、天敌等,在群落水平采取相应的种群管理策略。
4.2玫瑰野生分布区的动态监测
目前国内对玫瑰分布面积的变化还缺乏全面准确的信息,也没有关于野生玫瑰现存种群分布区的详细绘图,这在一定程度上限制了其宏观保护策略和合理取样策略的制定。Kollmann等[22]通过卫片解译实现了对丹麦西北部海岸灌丛面积变化的动态监测。德国也通过卫片、航片和实地调查实现了对部分岛屿玫瑰种群的动态监测。由于条件限制,我国还没有实现利用卫片和航片对玫瑰种群和固定灌丛进行动态监测的报道,也缺乏相应的玫瑰种群数量、灌丛数量和大小动态变化的连续数据。如何实现对我国玫瑰种群分布区、灌丛数量和大小的动态监测,并与入侵种群和健康种群动态相比较,模拟和预测濒危过程和入侵过程中的种群轨迹,解析种群濒危和入侵的关键生态因子,也是未来研究的一个重要方向。
4.3濒危和入侵种群功能基因组变异及其适应性的比较研究
已有研究发现欧洲入侵种群的遗传组成已经发生了变化而与原产地种群有了很大差异[23]。但该研究未涉及功能基因和濒危种群,仍然缺乏濒危和入侵种群遗传差异特别是适应性遗传差异的直接证据。种群濒危和入侵过程的遗传基础如何?功能基因和基因组有哪些差异?哪些差异和适应有关?是否存在强入侵性的基因型或表型?这些都是进化生态学和进化基因组学的热点问题,也是未来玫瑰种群生物学研究的一个重要方面。通过生态基因组学方法探索玫瑰濒危和入侵过程中的适应进化及其驱动力,发现是否存在致濒或入侵相关的基因、基因型,有助于了解物种在濒危或入侵过程中对环境变化的遗传响应及其适应机制[54],采取有针对性的种群遗传管理策略。
虽然目前对野生玫瑰种群的基因组研究还未见报道,但对栽培玫瑰及其同属近缘种和品种的基因组测序、功能基因、微小RNA功能的研究正在迅速展开。Guterman等[55]用基因组学方法发现了新的月季芳香相关的基因。Kaufmann 等[56]构建了第一个玫瑰BAC文库并研究了抗黑斑病基因。Debener 和Linde[57]建议将蔷薇属作为研究木本园艺植物基因组和基因功能的模式类群。Koning-Boucoiran等[58]通过RNA测序组装了一个蔷薇属杂交品种的转录组,包含13000多个全长表达基因。Vukosavljev 等[59]则基于多个体转录组中重复序列的多态性设计了一套微卫星标记(Microsatellite markers),这些研究的开展为将来对玫瑰种群进行生态基因组学和功能基因进化研究奠定了技术基础。
4.4基于种群生物学的濒危种群保育和入侵种群控制研究
我国学者在玫瑰濒危种群保护方面做了大量研究和实践,但多为对局地种群数量统计、种子质量、保育措施等某一方面的研究,且由于样本来源或研究方法不同对同一问题多有不同结果。种子品质还是环境恶化影响更新?严格封育还是适度干扰更有利于种群恢复?对这些问题的正确认识是有效保育和恢复中国野生玫瑰种群的前提。因此,濒危种群数量动态、种子品质及幼苗更新、当代和子代种群适合度等自身特性,严格封育、群落演替、种间竞争、花粉和种子传播等生物因素,气候变化、生境扰动等非生物因素对濒危玫瑰种群存续的影响仍然需要给予足够关注,并加强对研究的整体设计和技术、方法的科学化和标准化,综合、深入、客观地揭示玫瑰濒危的主要因素,在此基础上制定针对不同空间尺度和管理层面的策略和措施。
欧洲对玫瑰入侵种群的模拟、预测和控制做了大量研究,基本弄清了其敏感生境和传播途径,但控制措施仍不理想。虽然相关研究已确定干扰会促进种群的扩张和幼苗更新,但对干扰类型、作用方式、强度及其对克隆扩张和种子繁殖的影响效果还没有详细研究,对种群定居、扩张过程及其群落效应缺乏系统了解。大规模的挖掘清除和化学控制成本高昂且效果并不理想,残存的根茎和种子很快就会恢复种群[26]。因此,在已有知识和经验的基础上,进一步明确主要干扰类型及其对种群扩张的影响模式,通过长期定位观测了解种群扩张的生态过程及其影响因素,通过建立国际动态监测网络全面掌握玫瑰入侵的路径、范围和后果,是对入侵种群进行综合评价、科学管理的重要基础。
致谢:感谢瑞典乌普萨拉大学Jon Agren教授对玫瑰未来研究的宝贵建议,感谢德国布莱梅大学生态学系Maike Isermann博士、德国慕尼黑工业大学Johannes Kollmann教授和哥本哈根大学Hans Herik Bruun副教授提供欧洲玫瑰分布信息和相关文献。
参考文献(References):
[1]Bruun H H.RosarugosaThunb. ex Murray. Journal of Ecology, 2005, 93(2): 441- 470.
[2]俞德浚, 陆玲娣, 谷粹芝. 中国植物志(第三十六卷: 蔷薇科). 北京: 科学出版社, 1974.
[3]秦忠时, 胡群, 何兴元, 于兴华. 野生玫瑰分布及其生态群落类型. 生态学杂志, 1994, 13(6): 52- 54.
[4]朱红梅, 丰震, 杨科家, 莫镇华, 尹海燕. 野生玫瑰抗旱性地理变异的初步研究. 中国农学通报, 2009, 25(12): 172- 176.
[5]杨志莹, 赵兰勇, 徐宗大. 野生玫瑰与栽培玫瑰对盐胁迫反应的比较研究. 山东林业科技, 2010, 40(2): 43- 44.
[6]陈向明, 郑国生, 孟丽. 玫瑰、月季、蔷薇等蔷薇属植物RAPD分析. 园艺学报, 2002, 29(1): 78- 80.
[7]张淑萍, 王仁卿, 杨继红, 张强, 魏英华. 胶东海岸野生玫瑰(Rosarugosa)的濒危现状与保护策略. 山东大学学报: 理学版, 2005, 40(1): 112- 118.
[8]杨继红. 中国濒危物种野生玫瑰的遗传多样性及其影响因子研究[D]. 济南: 山东大学, 2009.
[9]陈建军, 刘毅, 吴景才, 章林. 野生玫瑰濒危机理的研究. 吉林林业科技, 2008, 37(2): 1- 6.
[10]冯立国, 邵大伟, 生利霞, 赵兰勇, 何小弟. 野生玫瑰的花粉形态及其起源与演化的探讨. 林业科学, 2007, 43(12): 76- 80.
[11]赵娟娟. 荣成海岸破碎化生境中玫瑰(RosarugosaThunb.)野生种群的遗传多样性与遗传结构的初步研究[D]. 济南: 山东大学, 2005.
[12]郭孟瑶, 全炳武, 刘海峰. 野生玫瑰种子萌发的研究. 甘肃农业, 2006, (8): 157- 158.
[13]姬璐璐. 鲅鱼圈地区野生玫瑰种质资源调查研究. 辽宁林业科技, 2006, (4): 44- 46.
[14]刘毅, 陈建军, 刘永富, 黄清俊, 田雨, 牛纯, 章林, 吴景才, 王龙福, 吴俊遥. 野生玫瑰种子繁殖及保存技术的研究. 吉林林业科技, 2008, 37(4): 1- 3, 15- 15.
[15]田锡存, 姚曾. 野生玫瑰的繁殖. 中国花卉园艺, 2002, (6): 31- 31.
[16]于晓艳, 赵兰勇, 丰震, 齐海鹰, 徐宗大, 朱秀芹. 22份国产玫瑰资源的自交亲和性. 中国农业科学, 2009, 42(9): 3236- 3242.
[17]张一婧, 薛勇彪. 基于S-核酸酶的自交不亲和性的分子机制. 植物学通报, 2007, 24(3): 372- 388.
[18]Ueda Y, Akimoto S. Cross-and self-compatibility in various species of the genusRosa. The Journal of Horticultural Science & Biotechnology, 2001, 76(4): 392- 395.
[19]Hill N, Beveridge L, Flynn A, Garbary D J.Rosarugosaas an invader of coastal sand dunes of Cape Breton Island and mainland of Nova Scotia. The Canadian Field-Naturalist, 2010, 124(2): 151- 158.
[20]Jørgensen R H, Kollmann J. Invasion of coastal dunes by the alien shrubRosarugosais associated with roads, tracks and houses. Flora-Morphology, Distribution, Functional Ecology of Plants, 2009, 204(4): 289- 297.
[21]Damgaard C, Nygaard B, Ejrns R, Kollmann J. State-space modeling indicates rapid invasion of an alien shrub in coastal dunes. Journal of Coastal Research, 2011, 27(3): 595- 599.
[22]Kollmann J, Jørgensen R H, Roelsgaard J, Skov-Petersen H. Establishment and clonal spread of the alien shrubRosarugosain coastal dunes—a method for reconstructing and predicting invasion patterns. Landscape and Urban Planning, 2009, 93(3/4): 194- 200.
[23]Kelager A, Pedersen J S, Bruun H H. Multiple introductions and no loss of genetic diversity: invasion history of Japanese Rose,Rosarugosa, in Europe. Biological Invasions, 2013, 15(5): 1125- 1141.
[24]Mercure M, Bruneau A. Hybridization between the escapedRosarugosa(Rosaceae) and nativeR.blandain eastern North America. American Journal of Botany, 2008, 95(5): 597- 607.
[25]Bruun H H. Prospects for biocontrol of invasiveRosarugosa. BioControl, 2006, 51(2): 141- 181.
[26]Kollmann J, Brink-Jensen K, Frandsen S I, Hansen M K. Uprooting and burial of invasive alien plants: a new tool in coastal restoration? Restoration Ecology, 2011, 19(3): 371- 378.
[27]Maike I. Classification and habitat characteristics of plant communities invaded by the non-NativeRosarugosaThunb. in NW Europe. Phytocoenologia, 2008, 38(1/2): 133- 150.
[28]翟雯. 大连长山岛玫瑰(RosarugosaThunb.)种群的遗传多样性和遗传结构的初步研究[D]. 济南: 山东大学, 2007.
[29]Kollmann J, Frederiksen L, Vestergaard P, Bruun H H. Limiting factors for seedling emergence and establishment of the invasive non-NativeRosarugosain a coastal dune system. Biological Invasions, 2007, 9(1): 31- 42.
[30]崔奎焕. 吉林的野玫瑰花. 植物杂志, 1988, (2):17- 17.
[31]陈建军, 王东升, 李亚东. 吉林珲春地区野生玫瑰资源的开发利用. 资源开发与市场, 1993, (1):74- 74.
[32]郑明焕, 金明植, 全炳武. 珲春野玫瑰的生物学特性. 延边大学农学学报, 2005, 27(1): 61- 64.
[33]Milberg P. Aggressiva invasionsarter. Svensk Botanisk Tidskrift, 1998, 92(6): 313- 321.
[34]Isermann M. Effects ofRosarugosainvasion in different coastal dune vegetation types // Tokarska-Guzik B, ed. Plant Invasions: Human Perception, Ecological Impacts and Management. Leiden: Backhuys Publishers, 2008: 289- 306.
[35]Christenhusz M J M, van Uffelen G A. Verwilderde Japanse planten in Nederland, ingevoerd door Von Siebold. Gorteria, 2001, 27(5): 97- 108.
[36]Pedersen A. Rosaceernes udbredelse i danmark, I. underfamilierne spiraeoideae, dryadoideae og rosoideae eksklusiveRubusfruticosuscoll.,Rubuscaesiuscoll. ogRubuscorylifoliuscoll. Botanisk Tidsskrift, 1965, 61: 145- 270.
[37]Fremstad E. Fremmede planter i Norge. Rynkerose-Rosarugosa. Blyttia, 1997, 55: 115- 121.
[38]傅立国, 金鉴明. 中国植物红皮书: 稀有濒危植物(第一册). 北京: 科学出版社, 1991.
[39]Tsuda S, Fujita H, Nishisaka K. Resprouting behavior ofRosarugosaThunb. after an experimental burning in Koshimizu Nature Reserve, Hokkaido, Japan. Actinia, 1999, 12: 113- 121.
[40]Ohba T, Miyawaki A, Tüxen R. Pflanzengesellschaften der japanischen Dünen-Küsten. Vegetatio, 1973, 26(1/3): 3- 143.
[41]李希国, 谭鼎山, 李传进, 冯丽. 近40年来烟台地区气温与降水量变化的关系研究. 水文, 2008, 28(1): 91- 93.
[42]Klingbjer P, Moberg A. A composite monthly temperature record from Tornedalen in northern Sweden, 1802—2002. International Journal of Climatology, 2003, 23(12): 1465- 1494.
[43]徐宗大, 赵兰勇, 张玲, 杨志莹. 玫瑰SRAP遗传多样性分析与品种指纹图谱构建. 中国农业科学, 2011, 44(8): 1662- 1669.
[44]冯立国, 邵大伟, 生利霞, 赵兰勇, 于晓艳. 中国野生玫瑰种质资源调查及其形态变异研究. 山东农业大学学报: 自然科学版, 2009, 40(4): 484- 488.
[45]Tillberg E. Levels of endogenous abscisic acid in achenes ofRosarugosaduring dormancy release and germination. Physiologia Plantarum, 1983, 58(3): 243- 248.
[46]孙淑芹. 浅谈野生玫瑰种子繁殖及种植技术. 才智, 2010, (26): 71- 71.
[47]黄清俊, 季大方, 高冬菊, 辛亚芬, 王宏伟, 吴晓春. 观果型玫瑰的繁殖技术. 林业实用技术, 2009, (12): 22- 23.
[48]Levine J M. Species diversity and biological invasions: relating local process to community pattern. Science, 2000, 288(5467): 852- 854.
[49]Thiele J, Isermann M, Otte A, Kollmann J. Competitive displacement or biotic resistance? Disentangling relationships between community diversity and invasion success of tall herbs and shrubs. Journal of Vegetation Science, 2010, 21(2): 213- 220.
[50]Kellner A, Ritz C M, Wissemann V. Hybridization with invasiveRosarugosathreatens the genetic integrity of nativeRosamollis. Botanical Journal of the Linnean Society, 2012, 170(3): 472- 484.
[51]刘丹, 张文利, 肖晖. 中国长尾小蜂属(膜翅目, 长尾小蜂科)一新纪录种. 动物分类学报, 2012, 37(4): 907- 911.
[52]Zimmermann H, von Wehrden H, Renison D, Wesche K, Welk E, Damascos M A, Hensen I. Shrub management is the principal driver of differing population sizes between native and invasive populations ofRosarubiginosaL. Biological Invasions, 2012, 14(10): 2141- 2157.
[53]Davidson A M, Jennions M, Nicotra A B. Do invasive species show higher phenotypic plasticity than native species and, if so, is it adaptive? A meta-analysis. Ecology Letters, 2011, 14(4): 419- 431.
[54]Prentis P J, Wilson J R U, Dormontt E E, Richardson D M, Lowe A J. Adaptive evolution in invasive species. Trends in Plant Science, 2008, 13(6): 288- 294.
[55]Guterman I, Shalit M, Menda N, dan Piestun, Dafny-Yelin M, Shalev G, Bar E, Davydov O, Ovadis M, Emanuel M, Wang J H, Adam Z, Pichersky E, Lewinsohn E, Zamir D, Vainstein A, Weiss D. Rose scent genomics approach to discovering novel floral fragrance-related genes. The Plant Cell, 2002, 14(10): 2325- 2338.
[56]Kaufmann H, Mattiesch L, Lörz H, Debener T. Construction of a BAC library ofRosarugosaThunb. and assembly of a contig spanningRdr1, a gene that confers resistance to blackspot. Molecular Genetics and Genomics, 2003, 268(5): 666- 674.
[57]Debener T, Linde M. Exploring complex ornamental genomes: the rose as a model plant. Critical Reviews in Plant Sciences, 2009, 28(4): 267- 280.
[58]Koning-Boucoiran C F S, Esselink G D, Vukosavljev M, van′t Westende W P C, Gitonga V W, Krens F A, Voorrips R E, van de Weg W E, Schulz D, Debener T, Maliepaard C, Arens P, Smulders M J M. Using RNA-Seq to assemble a rose transcriptome with more than 13,000 full-length expressed genes and to develop the WagRhSNP 68k Axiom SNP array for rose (RosaL.). Frontiers in Plant Science, 2015, 6, doi: 10.3389/fpls.2015.00249.
[59]Vukosavljev M, Esselink G D, van′t Westende W P C, Cox P, Visser R G F, Arens P, Smulders M J M. Efficient development of highly polymorphic microsatellite markers based on polymorphic repeats in transcriptome sequences of multiple individuals. Molecular Ecology Resources, 2015, 15(1): 17- 27.
基金项目:山东省2010年科技发展计划项目(2010GSF10618);国家“十二五”农村领域科技计划课题(2013BAJ10B0403);国家自然科学基金项目(31200426)
收稿日期:2015- 06- 23;
修订日期:2015- 09- 28
*通讯作者
Corresponding author.E-mail: spzhang@sdu.edu.cn
DOI:10.5846/stxb201506231269
Advances in population biology ofRosarugosa
JIN Feiyu1, SHU Huajie1, LIU Jian2, GUAN Zhangnan1, ZHANG Shuping1,*
1InstituteofEcologyandBiodiversity,SchoolofLifeScience,ShandongUniversity,Jinan250100,China2InstituteofEnvironmentalResearch,ShandongUniversity,Jinan250100,China
Abstract:Rosa rugosa is a shrub species native to eastern China, Japan, Korea and the Russian Far East. The species is a key component of sand plant communities in its native range and a globally important germplasm resource for ornamental rose breeding. After introduction into Europe as a hardy, resistant garden rose in the 18th century, R. rugosa escaped and invaded many countries around the North Sea and the Baltic Sea as well as sandy coasts of North America. However, wild R. rugosa populations in China have decreased continuously over the past three decades. Consequentially, the species is considered rare and endangered in China, and is listed in the China Plant Red Data Book. A large number of studies have focused on the expanding R. rugosa populations in northwestern Europe and the shrinking populations in China. To identify future research directions, a comprehensive overview of the literature is crucial to gain insight into linkages and gaps among different studies. In this review, we analyze previous studies on the population biology of R. rugosa to clarify the ecological characteristics and changes of its distribution range in China. In addition, we discuss the potential factors driving the decrease of the native populations in China. Overall, R. rugosa populations in China suffer from reduced reproduction, poor seed quality, eroded genetic diversity due to genetic drift, and strong pressures from habitat loss and anthropogenic disturbances. The fenced enclosure of protected areas that has preserved existing shrubs has also stimulated the facilitated succession of plant communities and overgrowth of some tall grass species. External habitat degradation and internal genetic erosion may be contributing to the population decrease in China. According to research on invasive R. rugosa populations in northwestern Europe, the species is disturbance-favored and has expanded very quickly in its invasive range. It frequently forms large, dense and continuous monodominant shrub zones that exclude native species and plant communities from the North Sea and the Baltic Sea dunes and sandy beaches. Most of the invasive populations exhibit increased seed reproduction, mixture of multiple varieties, release from herbivory and parasitism. We infer that the evolved high adaptation of R. rugosa to novel environments, resistance to pathogens in its introduced range, and inappropriate anthropogenic disturbances are the main factors driving its invasion success. After comparing differences between endangered and invasive populations of R. rugosa, we propose that future research should focus on the following aspects: (1) comparative research on quantitative dynamics and genetic structure of endangered and invasive R. rugosa populations; (2) dynamic monitoring of natural R. rugosa populations and individual shrubs in its native and invasive ranges; (3) examining the differences of functional genes and genomics among R. rugosa populations and individual shrubs, therefore to discover specific genes or genotypes related to population invasiveness and/or depression; and (4) designing control or conservation strategies based on population biology of R. rugosa. By focusing on population dynamics, ecological genomics and the driving forces behind the decrease and expansion of R. rugosa, future work may lead to the development of efficient population management approaches and provide new insights into the evolutionary adaptation of species with similar features.
Key Words:Rosa rugosa; biological invasion; invasive species; endangered species; China; Europe
金飞宇,束华杰,刘建,管章楠,张淑萍.玫瑰种群生物学研究进展.生态学报,2016,36(11):3156- 3166.
Jin F Y, Shu H J, Liu J, Guan Z N, Zhang S P.Advances in population biology ofRosarugosa.Acta Ecologica Sinica,2016,36(11):3156- 3166.

