3种丁香叶片的PSⅡ光化学活性及光能利用特点
张钰莹,张会慧,张萌萌,李 阳,张潆心,孙广玉*
(1.东北林业大学 生命科学学院,哈尔滨 150040;2.东北农业大学 资源与环境学院,哈尔滨 150030)
3种丁香叶片的PSⅡ光化学活性及光能利用特点
张钰莹1,张会慧2,张萌萌1,李阳1,张潆心1,孙广玉1*
(1.东北林业大学 生命科学学院,哈尔滨 150040;2.东北农业大学 资源与环境学院,哈尔滨 150030)
摘要:以我国北方地区常见的3种丁香属植物紫丁香(Syringa oblata)、白丁香(S.oblata var.alba)和暴马丁香(Syringa reticulata(Blume)H.Hara)为试验材料,利用快相叶绿素荧光动力学技术研究3种丁香叶片的PSⅡ光化学活性之间的差异。结果表明:3种丁香叶片Fv/Fm之间差异不大,但暴马丁香叶片的Fv/Fo和PIABS却小于紫丁香和白丁香,达到极显著差异水平,说明暴马丁香叶片的PSⅡ光化学活性相对较低。暴马丁香叶片PSⅡ电子受体侧电子由QA向QB传递的速率明显低于紫丁香和白丁香,而且向QB传递速率也明显低于紫丁香和白丁香,但3种丁香叶片Sm无显著差异,即在PQ库容量差异较小情况下,暴马丁香叶片QA向QB传递速率较低的原因与QB接受电子能力较低有关,受QB下游PQ库的影响较小。暴马丁香叶片放氧复合体OEC的功能和类囊体膜结构的稳定性也明显低于紫丁香和白丁香。虽然暴马丁香单位反应中心吸收的光能ABS/RC明显高于紫丁香和白丁香,但是3种丁香叶片的ETo/RC之间却无显著差异,但DIo/RC极显著高于紫丁香和白丁香。因此,暴马丁香叶片PSⅡ反应中心能量分配的不均衡性也是其PSⅡ反应中心光化学活性较低的原因之一。
关键词:丁香;光系统Ⅱ;OJIP曲线
0引言
丁香为木樨科丁香属优良观赏植物[1],丁香具有极强的抗旱、耐寒、耐盐优势以及耐贫瘠等特点[2-3],广泛栽植于庭园或散植于园路两旁、草坪之中,具有色、香、姿的观赏性状。丁香在中国已有一千年多年的栽培历史,是我国裁种的著名花木。丁香主要分布于我国长江以北,在华北地区紫丁香(Syringaoblata)、白丁香(S.oblatavar.alba)和暴马丁香(Syringareticulata(Blume)H.Hara)是最为主要的品种[4]。但是,不同品种丁香的抗逆能力明显不同,例如紫丁香的耐淹能力明显低于暴马丁香[5]。植物的不同品种在长期自然进化中,导致其光合能力存在明显差异[6-7]。植物的光合能力是植物生长发育的基础,特别是PSⅡ反应中心的功能在维持叶片同化物的积累促进其生长方面发挥重要的作用[8-9]。通过分析分布在同一区域内的不同丁香品种叶片的光合能力,可以筛选出适合当地生长、适应性较强的优良品种。目前,在丁香属品种光合作用研究较多[10],但是对于不同丁香品种光合特性,特别是叶片PSⅡ功能差异方面的研究较少,没有通过叶绿素荧光角度分析不同品种丁香具有不同光合能力的内在机理。为此,本试验以我国北方常见的3种丁香为试验材料,利用快相叶绿素荧光动力学技术研究了自然环境下3种丁香叶片PSⅡ反应中心光化学活性及光能利用方面的差异,为深入研究丁香属植物的光合机理,为丁香在我国北方地区的引种栽培提供一些基础数据。
1材料与方法
1.1试验材料
试验于2014年8月在东北林业大学进行,试验材料紫丁香(Syringaoblata)、白丁香(S.oblatavar.alba)和暴马丁香(Syringareticulata(Blume)H.Hara)均为多年生,紫丁香和白丁香株高大约1.5 m,暴马丁香大约3.5 m,3种丁香生境周围均无高大树木遮荫。
1.2测定项目和方法
快速叶绿素荧光动力学曲线(OJIP)的测定:选择不同丁香品种的当年生枝条顶部第2片完全展开叶,进行30 min暗适应后利用Mini调制式掌上叶绿素荧光仪(FluorPen FP 100 max,捷克)测定各暗适应后叶片的OJIP曲线。OJIP曲线由3 000 μmol/m2·s的脉冲红光诱导,相对荧光强度的记录从10 μs开始至1 s结束,利用5次重复的平均值绘制OJIP曲线。其中OJIP曲线上O、J、I和P点分别为0、2、30、1 000 ms对应的时刻,L和K点分别表示0.15、0.3 ms对应的时刻,O、J、I和P点的相对荧光强度分别以Fo、FJ、FI和Fm表示。为特异分析J点和I点相对可变荧光VJ和VI的变化,将O-P曲线标准化,即将O点的相对荧光强度定义为0,而P点相对荧光强度定义为1,按公式(Ft-Fo)/(Fm-Fo)求得各时间点的相对可变荧光,其中Ft表示各时间点的相对荧光强度。为分析不同品种丁香叶片放氧复合体OEC活性和类囊体解离状态的影响,即K点和L点的相对可变荧光VL和VK的变化,分别将O-J和O-K曲线进行标准化,其计算公式分别为:(Ft-Fo)/(FJ-Fo)和(Ft-Fo)/(FK-Fo)。对OJIP曲线按照Strasser等人的方法JIP-test分析[11],得到PSⅡ最大光化学效率(Fv/Fm)、PSⅡ潜在光化学活性(Fv/Fo)、以光吸收为基础的光合性能指数(PIABS)、荧光上升的初始斜率(Mo)、QA完全被还原所需要的能量(Sm)、QA被氧化还原次数(N)、单位反应中心吸收的光能(ABS/RC)、单位反应中心捕获的用于还原QA的能量(TRo/RC)、单位反应中心捕获的用于电子传递的能量(ETo/RC)和单位反应中心耗散掉的能量(DIo/RC)等。
1.3数据处理和统计方法
运用Excel和DPS软件对试验数据进行统计分析,数据结果为5次重复的平均值±标准差(SE),采用单因素方差分析(One-way ANOVA)和最小显著差异法(LSD)比较不同数据组间的差异。
2结果与分析
2.13种丁香叶片的OJIP曲线
由图1可以看出,紫丁香和白丁香叶片的OJIP曲线形态基本相似,二者无明显差异,但是暴马丁香叶片的OJIP曲线各点相对荧光强度明显高于紫丁香和白丁香,并且随着测定时间的延长,差异程度逐渐变大。定量分析结果表明:紫丁香和白丁香O、J、I和P点的相对荧光强度均无显著差异,而暴马丁香则与紫丁香和白丁香均达极显著差异水平。
2.23种丁香叶片的PSⅡ光化学活性
图2结果可以看出,3种丁香叶片的Fv/Fm无显著差异,但是暴马丁香叶片的Fv/Fo分别低于紫丁香和白丁香22.63%(P<0.01)和18.05%(P<0.01),PIABS也分别较紫丁香和白丁香降低57.71%(P<0.01)和52.99%(P<0.01),均达极显著差异水平。紫丁香和白丁香叶片的Fv/Fo和PIABS无显著差异。
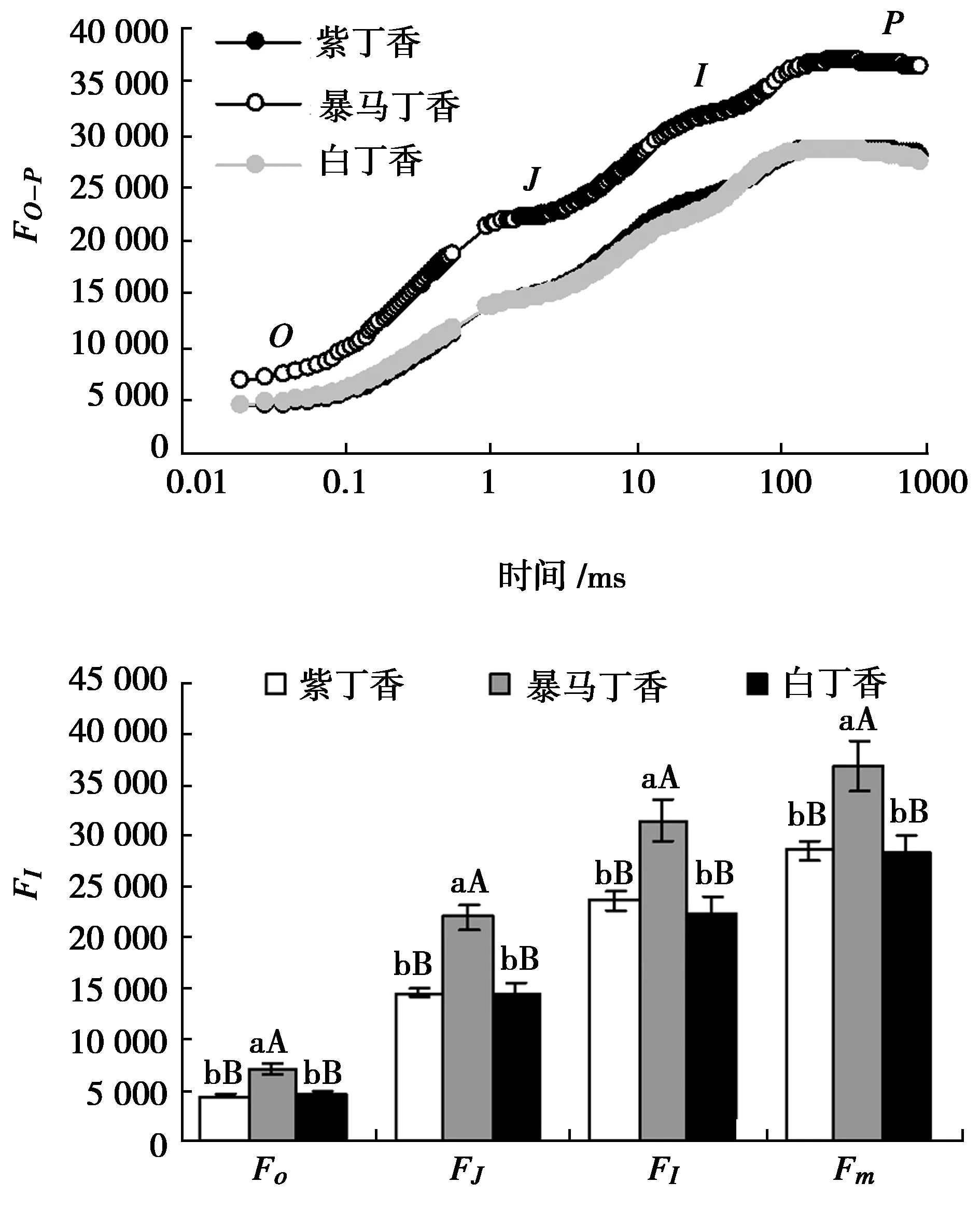
图1 3种丁香叶片OJIP曲线及特征点相对荧光强度Fig.1 OJIP tramsient and feature points relative fluorescence intensity in leaves of three clove varieties
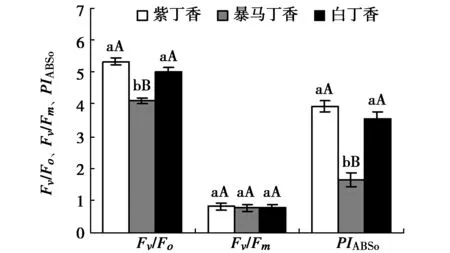
图2 3种丁香叶片Fv/Fm、Fv/Fo和PIABSFig.2 Fv/Fm ,Fv/Fo and PIABS in leaves of three clove varieties
2.33种丁香叶片的标准化O-P曲线
将OJIP曲线标准化后可以看出,3种丁香标准化OJIP曲线以2 ms时(J点)的相对可变荧光差异最为明显,I点相对可变荧光也表现出明显的差异,并且均以暴马丁香J点和I点的相对可变荧光最大。定量分析结果表明,暴马丁香叶片的VJ和VI分别高于紫丁香20.96%(P<0.01)和3.12%(P<0.01),分别高于白丁香23.08%(P<0.05)和9.34%(P<0.01)。另外,由于暴马丁香叶片J点相对可变荧光的增加,还导致暴马丁香叶片荧光曲线的初始上升斜率Mo分别较紫丁香和白丁香增加了55.07%(P<0.05)和47.14%(P<0.05)。

图3 3种丁香叶片VO-P、VJ、VI和MoFig.3 VO-P,VJ,VI and Mo in leaves of three clove varieties
2.43种丁香叶片的Sm和N
由图4可以看出,紫丁香和暴马丁香叶片的Sm分别高于白丁香叶片23.73%(P>0.05)和26.44%(P>0.05),但是3者均未达显著差异水平,3种丁香叶片的N表现为暴马丁香>紫丁香>白丁香,其中暴马丁香叶片的N分别高于紫丁香和白丁香31.12%(P<0.05)和51.23%(P>0.05),但仅暴马丁香和白丁香之间差异显著。
2.53种丁香叶片标准化O-J和O-K曲线
为特异分析OJIP曲线上K点和L点的相对可变荧光变化,分别将O-J和O-K曲线标准化(图5(a)和图5(b)),图中结果可以看出,3种丁香叶片标准化O-J曲线上出现明显的差异点K(0.3 ms),标准化O-K曲线上出现明显差异点L(0.15 ms)。图5(c)定量分析结果表明,紫丁香和白丁香叶片的K点和L点的相对可变荧光VK和VL均无显著差异,而暴马丁香叶片的VK分别高于紫丁香和白丁香28.28%(P<0.01)和18.05%(P<0.01),VL分别高于紫丁香和白丁香12.40%(P<0.01)和7.81%(P<0.01)。

图4 3种丁香叶片的Sm和NFig.4 Sm and N in leaves of three clove varieties
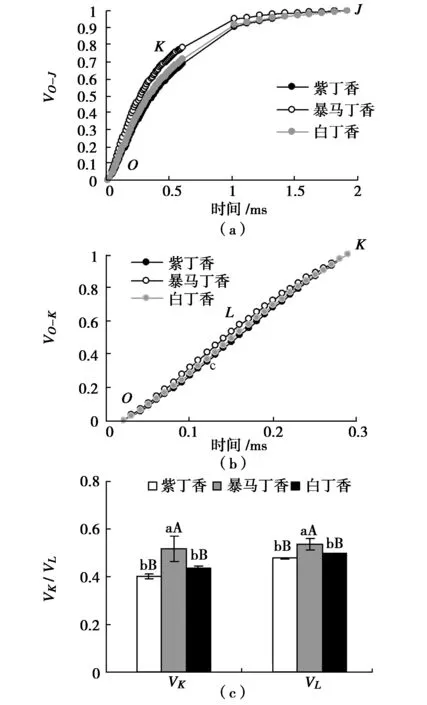
图5 3种丁香叶片VO-J、VO-K、VK和VLFig.5 VO-J,VO-K,VK and VL in leaves of three clove varieties
2.63种丁香叶片能量分配参数
3种丁香叶片单位反应中心的光能吸收和利用情况明显不同,其中,暴马丁香和白丁香叶片的ABS/RC分别高于紫丁香34.45%(P<0.01)和24.23%(P<0.05),与ABS/RC相似,TRo/RC也分别高于紫丁香28.10%(P<0.01)和19.48%(P<0.01)。但是3种丁香叶片的ETo/RC之间却无显著差异,虽然暴马丁香叶片的DIo/RC极显著高于紫丁香和白丁香,但紫丁香和白丁香之间却无显著差异。
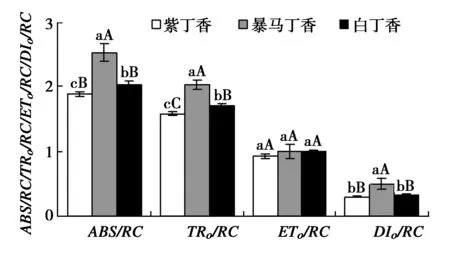
图6 3种丁香叶片能量分配参数Fig.6 ABS/RC,TRo/RC,ETo/RC and DIo/RC in leaves of three clove varieties
3讨论
同属不同品种植物叶片之间的光合能力明显不同[12],严俊鑫等人研究了我国北方地区主要栽培丁香品种的光合能力,结果发现,在生长季中暴马丁香叶片的平均净光合速率明显低于紫丁香和白丁香,而紫丁香稍高于白丁香[13]。本试验得到了相似的结果,正常生长条件下,暴马丁香叶片的PSⅡ光化学活性明显低于紫丁香和白丁香,表现出极低的Fv/Fo和PIABS,但是3种丁香叶片的Fv/Fm无显著差异,均维持在0.8以上,不存在种间差异,说明在正常生长条件下,虽暴马丁香叶片的PSⅡ光化学活性较低,但并没有发生明显的光抑制现象。

将将OJIP曲线按O-J和O-K标准化后可以看出,标准化O-J和O-K曲线上分别在0.3 ms和0.15 ms时3种丁香表出明显的差异点,暴马丁香叶片的VK和VL均明显高于紫丁香和白丁香,而紫丁香和白丁香之间无显著差异。VK和VL的上升分别是放氧复合体OEC受到伤害和类囊体解离的特异性标志[17-18]。因此,本试验结果可以说明,暴马丁香叶片光合能力较低的原因还与放氧复合体OEC的水裂解能力相对较低有关,导致光合电子传递链上的电子供应不足,从而限制了同化力的产生。另外,光合电子传递体均随着在类囊体膜上发挥电子传递的功能[19-20],当类囊体解离或其结构不足以附着电子传递体时,就会使电子传递体QA或QB等丧失电子传递功能,因此暴马丁香叶片叶绿体内类囊体膜结构的稳定性低于紫丁香和白丁香也可能是导致其PSⅡ受体侧电子传递能力较低的重要原因之一。通过单位反应中心能量分配参数的结果可以看出,虽然暴马丁香单位反应中心吸收的光能ABS/RC明显高于紫丁香和白丁香,但是3种丁香叶片的ETo/RC之间却无显著差异,即暴马丁香叶片吸收的光能用于电子传递的能量比例相对较低,而是将能量更多地以无效热能的形式耗散(DIo/RC极显著高于紫丁香和白丁香),因此,暴马丁香叶片PSⅡ反应中心能量分配的不均衡性也是其PSⅡ反应中心光化学活性较低的原因之一。
4结论
紫丁香和白丁香叶片的光合性能明显优于暴马丁香,其原因不但与暴马丁香叶片PSⅡ受体侧电子传递能力较低有关,而且放氧复合体OEC的水裂解能力较低以及类囊体膜结构的稳定性也是导致其PSⅡ反应中心活性较低的重要原因。虽然3种丁香叶片的ETo/RC无明显差异,但暴马丁香ETo/RC占总能量的比例明显低于紫丁香和白丁香,即暴马丁香用于电子传递的能量比例相对较低,而无效热能耗散的比例DIo/RC明显高于紫丁香和白丁香。
【参考文献】
[1]张会慧,张秀丽,李鑫,等.花色素苷在丁香新生叶光合机构中的作用[J].中南林业科技大学学报,2012,32(7):93-99.
[2]安玉艳,梁宗锁,韩蕊莲.黄土高原3种乡土灌木的水分利用与抗旱适应性[J].林业科学,2011,47(10):8-15.
[3]郭二果,王成,彭镇华,等.半干旱地区城市单位附属绿地绿化树种的选择-以神东矿区为例[J].林业科学,2007,43(7):35-43.
[4]张会慧,张秀丽,王娟,等.利用快相叶绿素荧光参数综合评价3种丁香的耐盐性[J].南京林业大学学报:自然科学版,2013,37(5):13-19.
[5]李娟娟,许小妍,朱文旭,等.淹水对3种丁香生理特性的影响[J].林业科技,2011,22(1):21-23.
[6]盛宝龙,常有宏,姜卫兵,等.不同类型梨品种光合特性的比较[J].果树学报,2007,24(6):742-746.
[7]闫小红,尹建华,段世华,等.四种水稻品种的光合光响应曲线及其模型拟合[J]生态学杂志,2013,32(3):604-610.
[8]Jiang C D,Jiang G M,Wang X Z,et al.Increased photosynthetic activities and thermostability of photosystem II with leaf development of elm seedlings(Ulmuspumila)probed by the fast fluorescence rise OJIP[J].Environmental and Experimental Botany,2006,58:261-268.
[9]Chen H X,Li W J,An S Z,et al.Characterization of PSII photochemistry and thermostability in salttreated Rumex leaves[J].Journal of Plant Physiology,2004,161:257-264.
[10]李海梅,何兴元,陈玮.沈阳城市森林主要绿化树种-丁香的光合特性研究[J].应用生态学报,2004,15(12):2245-2249.
[11]Strasser R J,Srivastava A,Govindjee G.Polyphasic chlorophyll a fluorescence transient in plants and cyanobacteria[J].Photochemistry and Photobiology,1995,61(1):32-42.
[12]邱念伟,周峰,顾祝军,等.5种松属树种光合功能及叶绿素快相荧光动力学特征比较[J].应用生态学报,2012,23(5):1181-1187.
[13]严俊鑫,刘晓东,张晓娇,等.6种丁香的光合特性[J].东北林业大学学报,2008,36(7):23-24,41.
[14]齐飞,张会慧,田野,等.绣线菊叶片中花色素苷对光合PSⅡ功能的影响[J].经济林研究,2012,30(4):19-26.
[15]Strasser R J,Srivastava A,Govindjee G.Polyphasic chlorophyll a fluorescence transient in plants and cyanobacteria[J].Photochem Photobiology,1995,61(1):32-42.
[16]李鹏民,高辉远,Strasser R J.快速叶绿素荧光诱导动力学分析在光合作用研究中的应用[J].植物生理与分子生物学学报,2005,31(6): 559-566.
[17]叶露幻,沈唯军,郑宝刚,等.两优培九剑叶衰老过程中光合膜功能及蛋白复合物的变化[J].作物学报,2013,39(11):2030-2038.
[18]Strasser R J.Donor side capacity of photosystem Ⅱ probed by chlorophyll a fluorescence transients[J].Photosynthesis Research,1997,52(2):147-155.
[19]索郎拉措,杨小林,尼珍,等.川滇高山栎的光合作用特征[J].林业科技,2014,39(3):28-30.
[20]李庆亮,谭伟,薛明.B型烟粉虱危害对烟草叶片光系统II的影响[J].中国农业科学,2012,45(19): 3988-3995.
收稿日期:2016-01-28
基金项目:国家自然科学基金(31500508);“十二五”国家科技支撑计划项目(2011BAD08B02-03);黑龙江省科技攻关项目(GZ13B004)
第一作者简介:张钰莹,硕士研究生。研究方向:植物营养生理学方面研究。 *通信作者:孙广玉,博士,教授。研究方向:植物生理生态学研究。E-mail:sungy@vip.sina.com
中图分类号:S 685.26
文献标识码:A
文章编号:1001-005X(2016)04-0013-05
PSⅡ Photochemical Activity and Light Energy Utilizationin Leaves of Three Clove Varieties
Zhang Yuying1,Zhang Huihui2,Zhang Mengmeng1,Li Yang1,Zhang Yingxin1,Sun Guangyu1*
(1.College of Life Science,Northeast Forestry University,Harbin 150040;2.College of Resources and Environment,Northeast Agricultural University,Harbin 150030)
Abstract:In this paper,the difference of PS Ⅱ photochemical activity in the three kinds of leaves of Syringa oblata,S.oblata var.alba and Syringa reticulata(Blume)H.Hara from Northeast China was investigated by using chlorophyll fast fluorescence technique.The results showed that there was no significant difference among the Fv/Fm in three kinds of leaves.However,the Fv/Fo and PIABSin Syringa reticulata(Blume)H.Hara were significantly lower than that in Syringa oblate and S.oblata var.alba.PSⅡ photochemical activity in Syringa reticulata(Blume)H.Hara was relatively low.The transfer rate from QA to QB in PS II electron acceptor side in Syringa reticulata(Blume)H.Hara was obviously lower than that in Syringa oblate and S.oblata var.alba,and the transfer rate from to QB was the same as QA to QB,but Sm was not significantly different among the three kinds of varieties.It was suggested that the low transfer rate from QA to QB in Syringa reticulata(Blume)H.Hara was related to the low capability of QB accepting electron under less difference of the PQ library capability,and that was less affected by PQ library at QB downstream.The function of oxygen evolving complex(OEC)and the stability of thylakoid aggregation structure in the Syringa reticulata(Blume)H.Hara was significantly lower than that in Syringa oblate and S.oblata var.alba,and light absorption by unit reaction centre ABS/RC was apparently higher than that in Syringa oblate and S.oblata var.alba.However,there was no significant difference between the ETo/RC in the three kinds of leaves,but DIo/RC in Syringa reticulata(Blume)H.Hara was greater significantly than that in Syringa oblate and S.oblata var.alba oppositely.Therefore,the imbalance of energy distribution of PSⅡ reaction centre was one of the reasons that led to the decrease of the photochemical activity of PSⅡ reaction centre.
Keywords:Syringa L;photosystemⅡ;OJIP curve
引文格式:张钰莹,张会慧,张萌萌,等.3种丁香叶片的PSⅡ光化学活性及光能利用特点[J].森林工程,2016,32(4):13-17.

