猪圆环病毒2型合并感染脑心肌炎病毒对仔猪的致病性分析
常洪涛,刘慧敏,李永涛,贺秀媛,赵 军,陈 陆,王新卫,杨 霞,王川庆*
(1.河南农业大学牧医工程学院,郑州 450002;2.河南农业大学生命科学学院,郑州 450002)
猪圆环病毒2型合并感染脑心肌炎病毒对仔猪的致病性分析
常洪涛1#,刘慧敏2#,李永涛1,贺秀媛1,赵军1,陈陆1,王新卫1,杨霞1,王川庆1*
(1.河南农业大学牧医工程学院,郑州 450002;2.河南农业大学生命科学学院,郑州 450002)
摘要:旨在研究猪圆环病毒2型(PCV-2)感染仔猪后造成免疫抑制条件下,探索合并感染脑心肌炎病毒(EMCV)对仔猪的生长性能影响和致病性分析。选取16头健康仔猪设计了EMCV攻毒组、PCV-2攻毒组、PCV-2/EMCV联合攻毒组和对照组,通过临床表现、组织病理学检测、生长性能、免疫指标以及排毒情况等多方面评价,对二者合并感染仔猪的影响进行了研究。结果显示,2种病毒单独感染后,均表现出各自的典型临床特征,危害均不严重。但合并感染后死亡率迅速上升,平均日增重显著降低,体重负增长率升高,心肌和脑组织变性、坏死更为严重,血液中淋巴细胞比率始终较低,EMCV中和抗体较长时间维持在低水平。EMCV排毒期可持续至感染后第12 天,略长于EMCV单独攻毒组的第9天。研究结果证实,PCV-2先期感染可使EMCV对仔猪表现出更为严重的致病性和致死性,免疫功能降低,并可能使得EMCV在猪体内的复制、排毒能力增强。
关键词:猪圆环病毒2型;脑心肌炎病毒;合并感染;仔猪;致病性
脑心肌炎(encephalomyocarditis,EMC)是由脑心肌炎病毒(encephalomyocarditis virus,EMCV)引起的一种以脑炎、心肌炎和繁殖障碍为主要临床特征的人畜共患传染病,目前呈世界性分布,也是危害养猪业健康发展的重要疫病之一[1]。国内自2005年成功分离到首株病毒以来[2],截止2013年已分离到20多株不同动物源EMCV[3-5],并证实猪群中感染较为普遍,但抗体阳性率差异显著[6-9],尽管尚未发生严重疫情,但其威胁日趋严重。EMCV属微RNA病毒科、心病毒属,为单股正链RNA病毒,基因组全长约7.8 kb,基本结构含有2个非翻译区(5′-UTR:800~1 200 bp;3′-UTR:120 bp左右)[10],二者之间为1个较大的ORF,长约6 879 bp,编码一个由2 292个氨基酸组成的“多聚蛋白”,经蛋白酶切割和进一步水解为VP1~VP4、2A~2C、3A~3D以及L蛋白等12个成熟的单体蛋白。
猪圆环病毒(porcine circovirus,PCV)是一种无囊膜的单股环状DNA病毒,可分为PCV-1和PCV-2两型。PCV-1无致病性,PCV-2可造成断奶仔猪多系统衰竭综合征(PMWS)、猪皮炎与肾病综合征(PDNS)、先天性震颤(CNS)和繁殖障碍等疾病,其中以PMWS危害最为严重和普遍[11]。自1991年于加拿大首次报道以来,包括我国在内的许多国家和地区都有该病的发生和流行[12]。2010年后随着商品化疫苗的大面积应用推广,危害明显有所降低。但PCV-2的靶细胞是单核-巨噬细胞[13],可造成机体的严重免疫抑制,干扰和破坏免疫抗体的产生和维持,致使抵抗力下降,易继发或并发其他病原体,使病情进一步加剧和复杂化。国内外已大量开展了关于PCV-2与猪繁殖与呼吸综合征病毒[14]、猪细小病毒[15-16]等猪重要致病性病原合并感染或继发感染的试验,但系统研究PCV-2所致免疫抑制条件下,合并感染EMCV后对仔猪的生长性能影响和致病性分析,国内外迄今未见报道,因此进行了本试验。
1材料与方法
1.1毒株和试验动物
PCV-2 HNYY株由本实验室分离、鉴定并保存,经SYBR Green Ⅰ实时荧光定量PCR 方法[17]测定病毒拷贝数为3.351×106copies·μL-1。
猪源EMCV YM13株由本实验室分离、鉴定并保存,测定其TCID50为10-8.51·0.1 mL-1。
5周龄健康仔猪由洛阳市宜阳县鹅宿种猪场提供,应用RT-PCR[18]和PCR分别检测EMCV和PCV-2抗原均为阴性,应用ELISA法分别检测EMCV和PCV-2血清抗体均为阴性。
1.2主要试剂
组织病理学检测所用的常规试剂由河南农业大学动物病理学实验室配制;PCV-2 ELISA抗体检测试剂盒购自武汉科前动物生物制品有限责任公司;PCR和RT-PCR方法的相关试剂均由河南农业大学动物传染病学实验室提供。
1.3仔猪攻毒试验
将16头仔猪随机分为4组,每组4头,隔离饲养,分别命名为EMCV攻毒组、PCV-2攻毒组、PCV-2/EMCV联合攻毒组和对照组。试验前对圈舍进行彻底消毒,观察5 d,无任何异常情况进行攻毒试验,具体操作见表1。各组攻毒后置于相同条件下饲养,每日定时测量直肠体温至14 d。同时详细观察、记录各组猪临床反应情况,至5周时试验结束,随机选择2头扑杀,采集病料用于相关指标的检测。各组于试验前称量平均初始重,整个试验期间每日仔细记录试验猪的采食量、日增重及饲料报酬,试验结束后计算平均日增重,以测定对仔猪生长性能的影响。
1.4组织病理学检测
采集各组试验猪的新鲜心和脑组织,迅速固定,经脱水透明、浸蜡和包埋,制作组织切片,用苏木素-伊红法(HE)染色后,置于显微镜下观察。
1.5淋巴细胞比率测定
各组于试验开始后第1、3、7、14和35 天分别于前腔静脉采血2 mL,置入含EDTA的抗凝管中,应用全自动血细胞分析仪测定血液内的淋巴细胞比率。
1.6EMCV中和抗体测定
各组试验猪于试验开始后第1、3、7、14和35 天分别于前腔静脉采血2 mL,测定EMCV中和抗体。
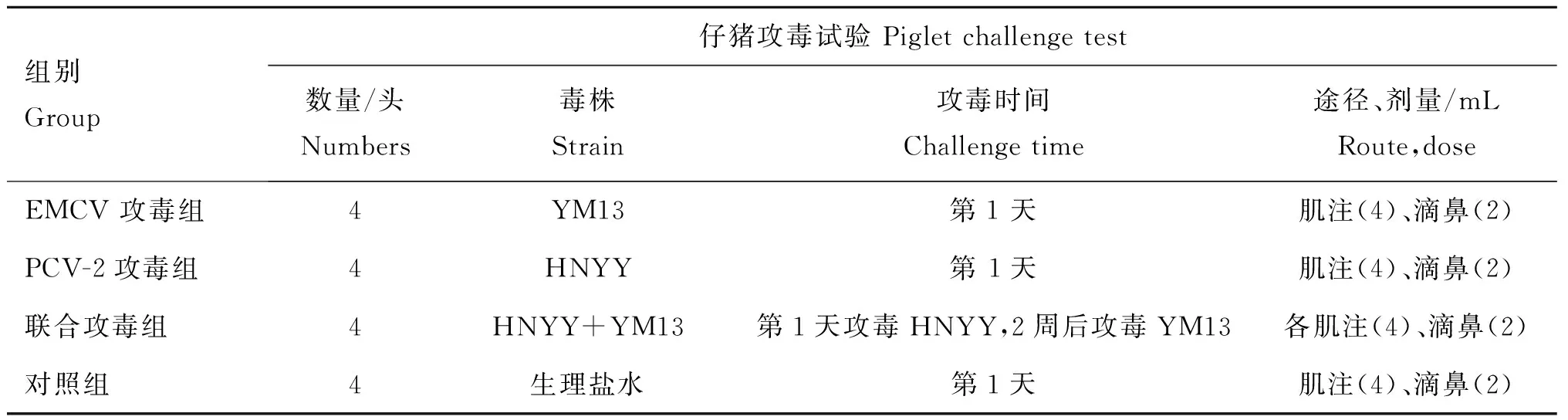
表1 仔猪攻毒试验情况
1.7EMCV排毒情况测定
EMCV攻毒组于试验开始后第1、7、9、10和14 天时,PCV-2/EMCV联合攻毒组和对照组于试验开始后第1、7、9、10、11、12、13、14和21 天时,分别采集肛门拭子,接种BHK-21细胞后收毒,应用RT-PCR方法检测EMCVVP1基因[18],以掌握排毒情况。
2结果
2.1体温和日增重变化
2.1.1体温变化各组动物试验前测量体温均在正常范围。EMCV攻毒组感染后第1天体温升至39.8 ℃,第3天达到峰值(40.5 ℃),随后逐步下降,第7天后一直在39.6~39.8 ℃之间波动;PCV-2攻毒组感染后第3~6天体温略有升高(39.6~39.9 ℃),随后始终保持正常范围;PCV-2/EMCV联合攻毒组在感染EMCV后第1天体温迅速升至40.5 ℃,至第3天达到峰值(41.2 ℃),随后逐步下降,第8 天后趋于稳定,维持在39.7~39.9 ℃之间;对照组在整个试验期内的体温均在正常范围值(图1A)。2.1.2日增重变化各组平均日增重结果显示(图1B),EMCV攻毒组(0.34 kg)、PCV-2攻毒组(0.30 kg)和PCV-2/EMCV联合攻毒组(0.18 kg)的平均日增重均明显低于正常对照组(0.45 kg)(P<0.05)。EMCV攻毒组和PCV-2攻毒组差异不显著(P>0.05),联合攻毒组显著低于2个单感染组和对照组(P<0.05)。分析相对增重率显示(图1C),EMCV攻毒组(-24.4%)、PCV-2攻毒组(-33.3%)和联合攻毒组(-60.0%)均为负值,且差异较为明显,与对照组比较,提示生长速度均受到较大影响。

图1 各试验组的体温和日增重变化Fig.1 Temperature and clinical symptoms and pathological daily gain changes in experimental groups
2.2病理变化
2.2.1EMCV攻毒组感染1~5 d时,出现精神不佳(图2A)、食欲减退、呼吸困难、震颤等症状,至试验结束无死亡,剖检可发现心包积液(图2B),心肌柔软、变性,胸腔积水,脑部轻度充血(图2C)。
2.2.2PCV-2攻毒组感染14 d内的临床表现和对照组基本一致,无明显症状,仅见腹股沟淋巴结轻微肿大。22 d时逐步出现渐进性消瘦、被毛粗乱、贫血(图3A)、黄疸和腹泻,至试验结束无死亡。剖检可见全身淋巴结水肿、变性,心变形、质地柔软、心包积液、心冠脂肪有胶冻样渗出(图3B),脑部无明显病变(图3C)。2.2.3PCV-2/EMCV联合攻毒组感染PCV-2 14 d时,临床表现和对照组基本一致。继发感染EMCV 1~3 d时,出现精神沉郁、食欲废绝,5 d时出现步态蹒跚、呼吸困难和进行性麻痹,死亡2头,其余存活至试验结束,但濒临死亡(图4A)。剖检均可发现心包积液,并有纤维素性渗出,心肌严重变性(图4B),脑部充血明显(图4C),脾肿大变形,肾肿胀、颜色变淡、时有灰白色坏死,胃、肠黏膜出血、坏死,有胸水、腹水。
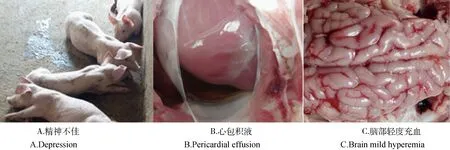
图2 EMCV感染猪的临床症状和病理变化Fig.2 Clinical symptoms and pathological changes of EMCV infected piglets
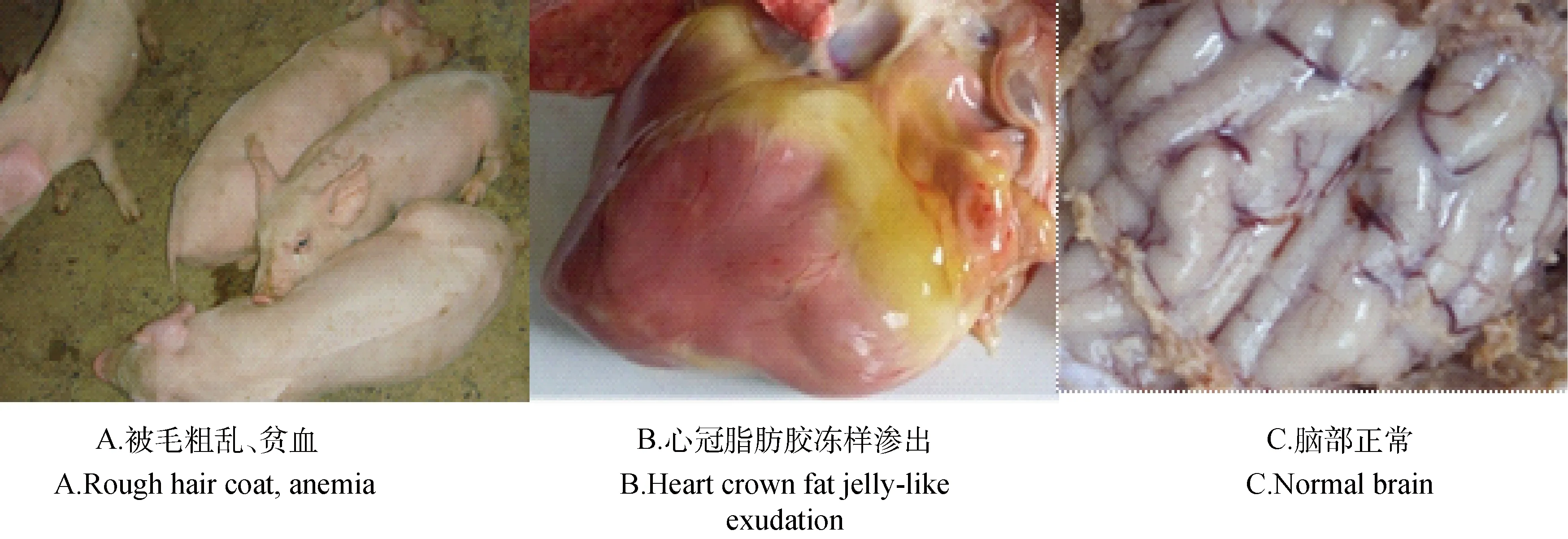
图3 PCV-2感染猪的临床症状和病理变化Fig.3 Clinical symptoms and pathological changes of PCV-2 infected piglets
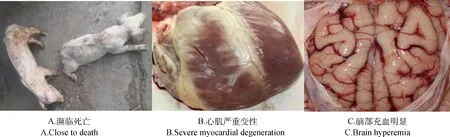
图4 PCV-2/EMCV联合感染猪的临床症状和病理变化Fig.4 Clinical symptoms and pathological changes of PCV-2/EMCV concurrent infected piglets
2.2.4对照组至试验结束时,对照组均未出现异常情况,无任何临床症状和病理变化。
2.3组织病理学检测
2.3.1EMCV攻毒组组织病理学检查可发现心肌炎,心肌横纹消失、心肌毛细血管充血(图5A),炎性细胞浸润和心肌细胞变性坏死(图5B),组织显微结构异常;神经细胞变性、坏死(图5C)。
2.3.2PCV-2攻毒组组织病理学检查可发现心肌细胞充血,细胞质溶解(图6A),神经细胞充血,有小胶质细胞包围,呈现卫星现象(图6B),脑细胞轻微坏死等。
2.3.3PCV-2/EMCV联合攻毒组组织病理学检查可发现心外膜充血,炎性细胞浸润,横纹消失,心肌细胞变性(图7A);神经细胞严重变性、坏死,毛细血管扩张(图7B)。
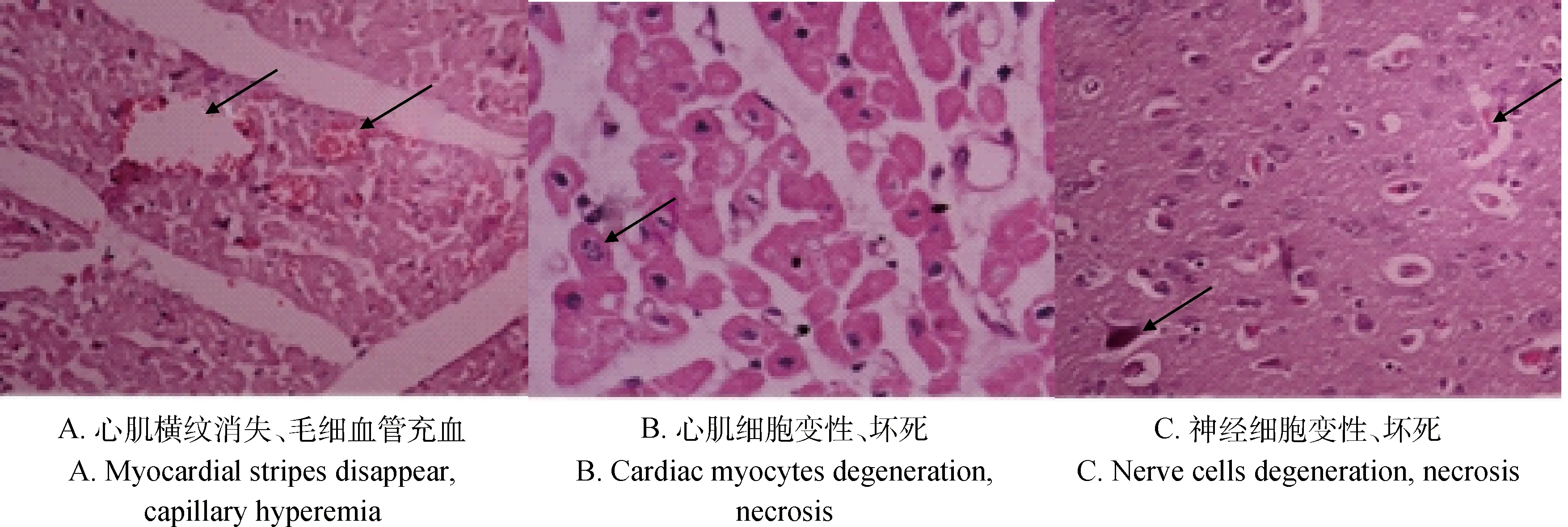
图5 EMCV感染猪的组织病理学变化(40×)HEFig.5 Histopathological changes of EMCV infected piglets
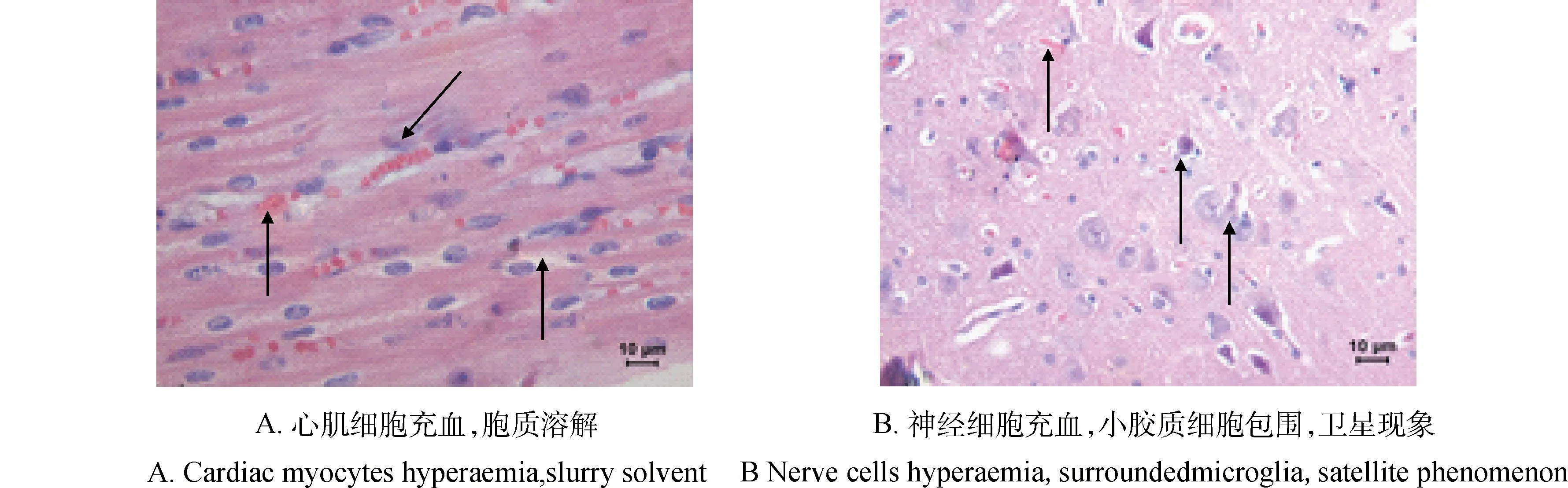
图6 PCV-2感染猪的组织病理学变化(40×)HEFig.6 Histopathological changes of PCV-2 infective piglets
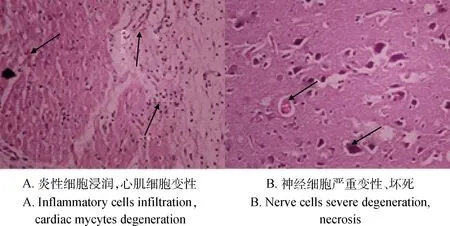
图7 PCV-2/EMCV联合感染猪的组织病理学变化(40×)HEFig.7 Histopathological changes of PCV-2/EMCV concurrent infective piglets
2.3.4对照组组织病理学检查未发现心肌和神经细胞有明显病理变化,心肌横纹完整,神经细胞正常。
2.4淋巴细胞比率测定
各组试验猪的淋巴细胞比率测定结果显示,攻毒EMCV 1 d时的淋巴细胞比率快速上升,至7 d达到峰值,随后逐步下降,21 d后趋于稳定;攻毒PCV-2 1 d时的淋巴细胞比率上升较慢,但至试验结束一直呈逐步上升趋势;PCV-2/EMCV联合攻毒组的淋巴细胞比率缓慢上升,在整个试验期内始终较低,且低于2个单独攻毒组(表2)。正常对照组在整个试验期内均在21.7%~26.4%之间波动,为正常范围值。
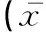
表2 各试验组的淋巴细胞比率测定±s)
2.5EMCV中和抗体测定
EMCV攻毒组和PCV-2/EMCV联合攻毒组在感染EMCV的第1天,均可检测到EMCV中和抗体,随时间而逐步升高,14 d时达到峰值,EMCV攻毒组为29.5,PCV-2/EMCV联合攻毒组仅为25.5,随后缓慢下降。整个试验期内,联合攻毒组的中和抗体明显低于EMCV攻毒组。PCV-2攻毒组和正常对照组的EMCV中和抗体在整个试验期内均为0。
2.6EMCV排毒情况测定
排毒情况测定结果显示,EMCV攻毒组和PCV-2/EMCV联合攻毒组试验猪所采集的肛门拭子,在攻毒后第1天均可检测、分离到病毒;EMCV攻毒组最迟于第9天、PCV-2/EMCV联合攻毒组最迟于第12天仍可检测、分离到病毒(图8)。
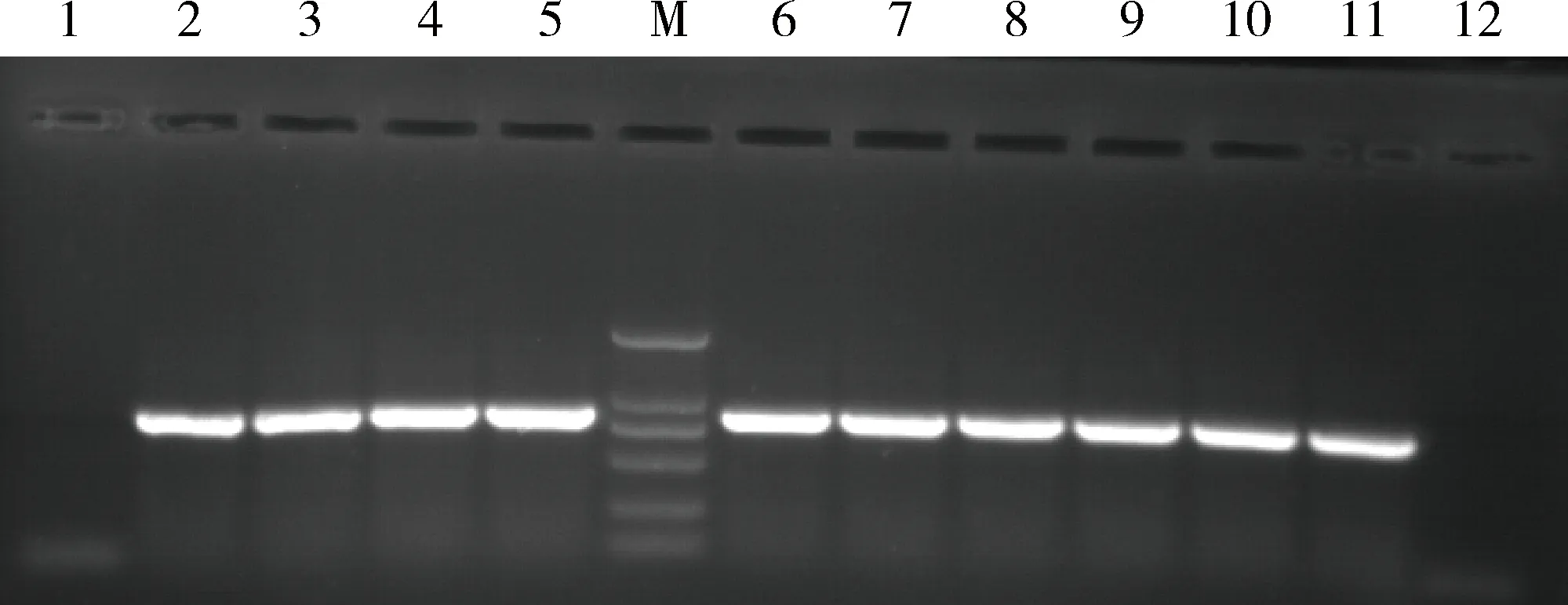
M.DL2000相对分子质量标准;1.阴性对照;2.阳性对照;3~5.EMCV攻毒组第1、7和9天;6~11.联合攻毒组第1、7、9、10、11和12天;12.EMCV攻毒组第10、14天和联合攻毒组第13、14和21天M.DL2000 DNA marker;1.Negative control;2.Positive control;3-5.1,7 and 9 d after EMCV challenge;6-11.1,7,9,10,11 and 12 d after concurrent challenge;12.10,14 d of after EMCV challenge and 13,14,21 d after concurrent challenge图8 EMCV排毒情况测定Fig.8 Detection of EMCV detoxification
3讨论
先前对EMCV的致病性研究均集中于单纯感染[19-20],而在生产实践中多种病原体的共感染现象极为普遍,尤其是猪群中感染率极高的PCV-2所致的严重免疫抑制条件下,并发或继发EMCV应引起高度关注。本研究所有试验设计均在同一环境下完成,最大程度减少因环境差异而造成的误差,从临床表现、组织病理学检测、免疫指标和排毒情况等多方面进行评价,以期为研究二者合并感染后在体内的相互作用及致病机制奠定基础。
PCV-2感染所导致的PCVD为慢性、消耗性疾病,发病率和死亡率一般为10%~20%[21]。EMCV感染断奶猪时多呈亚临床感染,死亡率极低,易感性也随日龄增长进一步降低。本试验中,2种病毒单独感染后,均表现出各自的典型临床特征,危害均不严重,与现有研究结论相一致,而继发感染5 d时死亡率已上升至50%,其余试验猪也濒于死亡,平均日增重也显著低于2个单独感染组和正常对照组,体重负增长率最高(60%),病理学检查可发现心肌和脑组织变性、坏死更为严重。由此推断,PCV-2的先期感染可致使机体防御系统严重损害,抵抗力下降,为EMCV的感染创造了机会。而EMCV感染后又进一步降低了PCV-2感染猪的抵抗力,加快了PCV-2的致病进程。因此,两种病毒对机体的损伤起协同作用,从而表现出更为严重的致病性和致死性。
血液中淋巴细胞比率和中和抗体动态变化均能反映出机体免疫的状态。正常生理情况下,淋巴细胞比率一般为20%~40%,比率上升通常提示发生病毒性感染。本试验中,EMCV攻毒1 d时的淋巴细胞比率快速上升,至7 d达到峰值,而攻毒PCV-2 1 d时上升较慢,随后呈逐步上升趋势,提示大剂量的EMCV感染为急性疾病,PCV-2感染为慢性、消耗性疾病。继发感染组的淋巴细胞比率始终较低,且明显低于2个单独攻毒组,这主要是由于PCV-2感染所造成的严重免疫抑制和免疫缺陷致使外周血液中的B淋巴细胞明显减少。由于中和抗体是由B淋巴细胞产生,因此也使得继发感染组的EMCV中和抗体较长时间维持在低水平。
现有研究证实EMCV在粪便中带毒时间最长为9 d,明显长于病毒血症期[22]。本试验中EMCV攻毒组最迟于攻毒后第9天可检测、分离到病毒,与现有研究结论相一致。联合感染组最迟于攻毒EMCV后第12天仍可检测、分离到EMCV,排毒时间有所延长,提示先期感染PCV-2后,EMCV在猪体内的复制、排毒能力可能得以加强,但由于本试验并未测定PCV-2感染后的排毒情况,这一结论有待今后进一步验证和研究。本试验结论提示,诸如EMCV等某些具有潜在威胁的人兽共患病病原在免疫抑制条件下的生物学特性、致病力和免疫特性等均可能发生较大改变,应引起医学界和兽医学界的高度关注。
参考文献(References):
[1]施开创,陈宏备,覃芳芸,等.猪脑心肌炎病毒TaqMan荧光定量RT-PCR检测方法的建立及应用[J].中国兽医科学,2011,41(9):928-932.
SHI K C,CHEN H B,QIN F Y,et al.Development and application of a TaqMan real-time RT-PCR assay for the detection of porcine encephalomyocarditis virus[J].ChineseVeterinaryScience,2011,41(9):928-932.(in Chinese)
[2]盖新娜,杨汉春,郭鑫,等.猪脑心肌炎病毒的分离与鉴定[J].畜牧兽医学报,2007,38(1):59-65.
GE X N,YANG H C,GUO X,et al.Isolation and characterization of porcine encephalomyocarditis virus[J].ActaVeterinariaetZootechnicaSinica,2007,38(1):59-65.(in Chinese)
[3]YUAN W Z,SONG Q Y,ZHANG X Y,et al.Isolation and molecular analysis of porcine encephalomyocarditis virus strain BD2 from northern China[J].InfectGenetEvol,2014,21:303-307.
[4]LIU H M,YAN Q,ZHAO B,et al.Isolation,molecular characterization,and phylogenetic analysis of encephalomyocarditis virus from South China tigers in China[J].InfectGenetEvol,2013,19:240-243.
[5]常洪涛,刘慧敏,陈陆,等.不同动物源脑心肌炎病毒的分离、鉴定和全基因组序列分析[J].中国兽医学报,2014,34(9):1442-1447.
CHANG H T,LIU H M,CHEN L,et al.Isolation,identification and full length genome sequence analysis of EMCV from different animal source[J].ChineseJournalofVeterinaryScience,2014,34(9):1442-1447.(in Chinese)
[6]陆文俊,施开创,屈素洁,等.猪脑心肌炎病毒抗体间接ELISA检测方法的建立及应用[J].动物医学进展,2011,32(12):6-10.
LU W J,SHI K C,QU S J,et al.Development and application of an indirect ELISA for detection of antibody against porcine encephalomyocarditis virus[J].ProgressinVeterinaryMedicine,2011,32(12):6-10.(in Chinese)
[7]樊得英,冯若飞,李向茸,等.脑心肌炎病毒抗体双抗原夹心ELISA检测方法的建立与初步应用[J].中国生物制品学杂志,2012,25(1):104-107.
FAN D Y,FENG R F,LI X R,et al.Development and preliminary application of double antigen sandwich ELISA method for encephalomyocarditis virus[J].ChineseJournalofBiologicals,2012,25(1):104-107.(in Chinese)
[8]冯若飞.脑心肌炎病毒双抗原夹心ELISA建立、血清学调查、毒株分离及RNA干扰研究[D].北京:中国农业科学院,2014.
FENG R F.DS-ELISA established,serosurvey,strains isolation and RNAi for EMCV[D].Beijing:Chinese Academy of Agricultural Sciences,2014.(in Chinese)
[9]张家龙,盖新娜,马良,等.规模化猪场脑心肌炎病毒感染的血清学调查[J].中国兽医杂志,2007,43(1):7-9.
ZHANG J L,GE X N,MA L,et al.Serological survey of EMCV infection in pigs on large-scale pig farms in China 2005-2006[J].ChineseJournalofVeterinaryMedicine,2007,43(1):7-9.(in Chinese)
[10]PALMENBERG A C,KIRDY E M,JANDA M R,et al.The nucleotide and deduced amino acid sequences of the encephalomyocarditis viral polyprotein coding region[J].NucleicAcidsRes,1984,12(6):2969-2985.
[11]SEGALÉS J,DOMINGO M,CHIANINI F,et al.Immunosuppression in postweaning multisystemic wasting syndrome affected pigs[J].VetMicrobiol,2004,98(2):151-158.
[12]刘捷,陆琪,王先炜,等.猪圆环病毒2型、猪巨细胞病毒和TTV-2混合感染的流行病学调查[J].中国兽医学报,2011,31(8):1095-1098.
LIU J,LU Q,WANG X W,et al.Epidemiological investigation of porcine circovirus type2,porcine cytomegalovirus and Torque Teno virus 2 infection[J].ChineseJournalofVeterinaryScience,2011,31(8):1095-1098.(in Chinese)
[13]MCNEILLY F,KENNEDY S,MOFFETT D,et al.A comparison of in situ hybridization and immunohistochemistry for the detection of a new porcine circovirus formalin-fixed tissues from pigs with post-weaning multisystemic wasting syndrome(PMWS)[J].JVirolMethods,1999,80(2):123-128.
[14]施开创,杨汉春,郭鑫,等.猪繁殖与呼吸综合征病毒和猪圆环病毒2型共感染对猪体内病毒动态及免疫反应的影响[J].畜牧兽医学报,2009,40(2):228-234.SHI K C,YANG H C,GUO X,et al.Effects of porcine reproductive and respiratory syndrome virus and porcine circovirus type 2 co-infection on virological kinetics and immunological responses in piglets[J].ActaVeterinariaetZootechnicaSinica,2009,40(2):228-234.(in Chinese)
[15]KIM J,HA Y,CHAE C.Potentiation of porcine circovirus 2-induced postweaning multisystemic wasting syndrome by porcine parvovirus is associated with excessive production of tumor necrosis factor-α[J].VetPathol,2006,43(5):718-725.
[16]刘祥义,陈立功,宋勤叶,等.猪圆环病毒2型与猪细小病毒共感染对猪肺泡巨噬细胞吞噬功能及其干扰素表达水平的影响[J].微生物学报,2011,51(1):105-114.LIU X Y,CHEN L G,SONG Q Y,et al.Coinfection effects of porcine circovirus type 2 and porcine parvovirusinvivoon phagocytosis and interferon mRNA expression of porcine alveolar macrophages[J].ActaMicrobiologicaSinica,2011,51(1):105-114.(in Chinese)[17]高金良,杨霞,陈陆,等.猪圆环病毒2型灭活疫苗种毒株的筛选[J].中国畜牧兽医,2013,40(4):221-224.
GAO J L,YANG X,CHEN L,et al.Screening of porcine circovirus type 2 inactivated vaccine candidate strain[J].ChinaAnimalHusbandry&VeterinaryMedicine,2013,40(4):221-224.(in Chinese)
[18]常洪涛.脑心肌炎病毒河南流行株病原学、诊断方法和疫苗的研究[D].郑州:河南农业大学,2015.
CHANG H T.Etiology,detection methods and vaccine development for porcine and encephalomyocarditis virus wild isolate from Henan[D].Zhengzhou:Henan Agricultural University,2015.(in Chinese)
[19]施开创,胡丽萍,郑敏,等.猪源脑心肌炎病毒GXLC株对仔猪的致病性试验[J].中国兽医科学,2011,42(2):138-143.
SHI K C,HU L P,ZHENG M,et al.Pathogenic experiment of porcine encephalomyocarditis virus GXLC strain to piglets[J].ChineseVeterinaryScience,2011,42(2):138-143.(in Chinese)
[20]LARUE R,MYERS S,BREWER L,et al.A wild-type porcine encephalomyocarditis virus containing a short poly(C)tract is pathogenic to mice,pigs,and cynomolgus macaques[J].JVirol,2003,77(17):9136-9146.
[21]顾金燕,邢刚,雷静,等.猪圆环病毒2型与猪圆环病毒相关性系统疾病的回顾及展望[J].生物工程学报,2015,31(6):880-891.
GU J Y,XING G,LEI J,et al.Porcine circovirus type 2 and PCV2-systemic disease-a review[J].ChineseJournalofBiotechnology,2015,31(6):880-891.(in Chinese)
[22]CRAIGHEAD J E,PERALTA P H,MURNANE T G,et al.Oral infection of swine with the encephalomyocarditis virus[J].JInfecDis,1963,112:205-212.
`(编辑白永平)
doi:10.11843/j.issn.0366-6964.2016.07.017
收稿日期:2015-07-25
基金项目:河南省高校科技创新团队支持计划(14IRTSTHN015);国家自然科学基金(31272567)
作者简介:常洪涛(1978-),男,河南虞城人,副教授,博士,主要从事动物传染病免疫防治研究,E-mail:ndcht@163.com。常洪涛和刘慧敏并列第一作者 *通信作者:王川庆,博士,教授,E-mail:wchuanq@163.com
中图分类号:S858.285.3
文献标志码:A
文章编号:0366-6964(2016)07-1435-08
Analysis of Pathogenicity in Piglets Concurrent Infection with Encepholomyocarditis Virus under Immunosuppression Caused by Porcine Circovirus Type 2
CHANG Hong-tao1#,LIU Hui-min2#,LI Yong-tao1,HE Xiu-yuan1,ZHAO Jun1,CHEN Lu1,WANG Xin-wei1,YANG Xia1,WANG Chuan-qing1*
(1.CollegeofAnimalHusbandryandVeterinary,HenanAgriculturalUniversity,Zhengzhou450002,China;2.CollegeofLifeScience,HenanAgriculturalUniversity,Zhengzhou450002,China)
Abstract:The objective of our research was to evaluate the growth performance and pathogenicity of piglets concurrent infection with porcine encepholomyocarditis virus (EMCV) under immunosuppression condition caused by porcine circovirus type 2 (PCV-2).Sixteen piglets were chosen for three challenge groups including EMCV,PCV-2 and concurrent infection with PCV-2 and EMCV,and control group.The effect of concurrent infection on piglets was conducted by the relevant indexes including clinical symptoms,pathological examinations,growth performances,immune index,detoxification and so on.The results indicated that the groups infection only with EMCV or PCV-2 showed their own classical clinical characteristic and minimal injury.However,the mortality rate of concurrent infection increased rapidly,the average daily weight gain decreased significantly,degeneration and necrosis in myocardium and brain tissues was more severe,the lymphocyte ratio in the blood still remained low and the neutraliz-ation antibody of EMCV maintained at a low level in a long time.The piglets shed virus lasted 12 days after infection,longer than the group infected only with EMCV for 9 days.The results showed that PCV-2 early infection can promote more severe pathogenicity and lethality,and lower immunity in piglets induced by EMCV,and the ability of virus replication and detoxification in piglets enhanced.
Key words:PCV-2;EMCV;concurrent infection;piglets;pathogenicity

