公山羊Protamine 1 mRNA表达特性及与精液品质相关性的研究
张春香,赵 辉,郭丽娜,郑亚琳,张彩霞,刘文忠,乔利英,任有蛇
(山西农业大学动物科技学院,太谷 030801)
公山羊Protamine 1 mRNA表达特性及与精液品质相关性的研究
张春香,赵辉,郭丽娜,郑亚琳,张彩霞,刘文忠,乔利英,任有蛇*
(山西农业大学动物科技学院,太谷 030801)
摘要:旨在研究雄性山羊主要繁殖器官中PRM1 mRNA表达特性,分析精子PRM1 mRNA表达与精液品质参数的相关性。本研究通过荧光定量PCR技术分析PRM1 mRNA表达规律,利用免疫组化技术对睾丸中PRM1蛋白进行定位,并应用GraphPad Prism 5软件分析精子PRM1 mRNA表达量与精液品质指标的相关性。结果显示,PRM1 mRNA在睾丸中高度表达,其次是附睾,睾丸中PRM1 mRNA表达量是附睾头的247倍,附睾头显著高于附睾体和尾(P<0.05),在剩余其他组织中微量表达。在周岁之前,睾丸中PRM1 mRNA表达量随着月龄增加而增加,12月龄的表达量显著高于9月龄的表达量(P<0.05),9月龄表达量显著高于其他低月龄的表达量(P<0.05)。精子PRM1 mRNA的表达量与精子活力(R2=0.586 0,P=0.000 5)、精子密度(R2=0.442 2,P=0.004 9)呈显著正相关。山羊PRM1在长形精子细胞和精子细胞中表达,睾丸其他生精细胞及间质细胞中无表达。山羊PRM1 mRNA表达具有时空表达特性,PRM1 mRNA表达量可以作为评价公羊繁殖力的指标。
关键词:Protamine 1;表达特性;精液品质参数;相关性;公山羊
Protamine 1(PRM1)是成熟精子中主要的核蛋白,其富含精氨酸。PRM1在精子发生过程中长精子形成阶段,替代约85%组蛋白与DNA结合[1-4],使精子DNA凝聚[5]和染色质重塑[6],改变精子细胞核的形状和数量;也可沉默一些父本基因,使精子基因印迹模式重编程[7]。PRM1表达过高或过低均可引起男性或雄鼠的繁殖障碍[8-10]。因此,PRM1在雄性精子发生及正常生殖维持中发挥重要作用。
PRM1最早是在科学家利用精子研究核蛋白过程中发现的[11],直到不育男性PRM1表达异常研究结果报道后,才广泛引起繁殖领域内学者的关注[8],因此,在男性或模型动物鼠的PRM1表达、功能及其PRM1与DNA结合机制方面的报道很多[12-15]。目前也有一些关于畜禽PRM1表达与雄性繁殖相关性的研究。有研究发现公牛附睾尾中精子PRM1含量显著高于睾丸和附睾头中精子PRM1含量,精子PRM1含量与其DNA损伤程度呈负相关[16],有免疫细胞化学结果显示非正常精子中没有PRM1表达或仅有零星分布[17],而且品质好的精液PRM1 mRNA表达量高[18]。J.L.Courtens等[19]发现公猪PRM1分布在长形精子细胞质中,在精子延长过程中进入细胞核,也有研究发现公猪附睾体精子核PRM1浓度最高,推测DNA与PRM1相互作用的关键位置在附睾体[20],这与人或鼠上PRM1表达特点不一致。早在20世纪80年代就从绵羊精子头部分离出富含精氨酸的PRM1。J.Gosálvez等[21]研究发现山羊和绵羊精子冷冻后,其DNA损伤显著增加,从精子PRM1蛋白结构分析,绵、山羊PRM1中胱氨酸残基的数量7个,而猪的PRM1中有10个,然而并未对绵、山羊PRM1 mRNA情况进行分析。因此,本试验以晋岚绒山羊为试验对象,采用荧光定量PCR研究不同组织以及不同发育阶段主要生殖器官中PRM1规律,利用免疫组化技术对睾丸中PRM1进行定位,并分析精子PRM1 mRNA与精液品质指标的相关性,为进一步研究山羊精子PRM1作用机制及在羊生产实践中的应用提供依据。
1材料与方法
1.1样品采集
1.1.1组织样品的采集2和3月龄(精子初现时)、5和6月龄(性成熟)、9月龄(初次配种)晋岚绒山羊各3只,手术去势,取睾丸、附睾头、附睾体和附睾尾4种组织。12月龄(周岁)晋岚绒山羊3只,颈静脉放血致死,取肝、心、脾、肾、肺、腹肌、背最长肌、小肠、大肠、睾丸、附睾头、附睾体和附睾尾13种组织,迅速放入RNA固相清除剂处理过的2.0 mL 冻存管,置于液氮中,于-80 ℃冰箱保存。试验动物由山西农业大学动物科技试验站羊场提供。另取相同部位的睾丸,切成0.5 cm×0.5 cm×0.5 cm大小,在4%(重量/体积)的多聚甲醛固定24 h后转移至75%乙醇溶液中保存。
1.1.2精液样品的采集12月龄晋岚绒山羊8只,单独饲喂,饲养条件一致,试验羊每隔7 d使用电刺激法采精一次,电压0.6 V,根据反应调高电压0.1~0.2 V,刺激时间为3~5 s,间歇5~8 s,用集精杯收集精液。精液转移至离心管后,以37 ℃水浴保存,送至实验室进行相关指标测定,精液品质检测后,放入-80 ℃冰箱保存,供提取总RNA使用。
1.2主要试剂
PrimeScriptTMRT Master Mix试剂盒、Trizol Reagent试剂盒、SYBR Premix Ex TaqTM试剂盒购自TaKaRa公司,黄色DAB染料和即用型SABC免疫组化试剂盒购自博士德公司,Rabbit Anti-Protamine 1多克隆一抗购自Bioworld公司,其他常用试剂为国产分析纯。
1.3试验方法
1.3.1精液品质检查精液量由离心管刻度读出;在37 ℃下用稀释液(Tris 27.1 g·L-1,柠檬酸14.0 g·L-1,果糖10 g·L-1)进行10倍稀释,在400倍显微镜下,取5个不同视野观察精子运动状态,对直线前进运动精子进行计数,取其平均值为该样品的精子活力;精子密度采用血细胞计数板进行测定,取5个不同视野求其平均值。1.3.2总RNA提取参照Trizol Reagent试剂盒操作说明进行。用ND-1000核酸蛋白测定仪检测总RNA浓度和纯度,琼脂糖凝胶电泳检测RNA完整性,然后将浓度调整为1 000 ng·μL-1,-80 ℃保存。1.3.3cDNA合成总RNA反转录参照PrimeScriptTMRT Master Mix试剂盒操作说明,10 μL反应体系:5×PrimeScriptTMRT Master Mix 2.0 μL,总RNA 0.5 μL,Rnase-free水7.5 μL;反应条件:37 ℃ 15 min,85 ℃ 5 s;产物-20 ℃保存。
1.3.4引物设计与合成参照山羊PRM1序列和18S rRNA序列,引物序列见表1。合成由北京六合华大基因科技股份有限公司完成。

表1 PRM1和18S rRNA引物序列
1.3.5常规RT-PCR检测参照李振等[22]方法。15 μL反应体系:TaqDNA聚合酶(125 U) 0.5 μL,10×PCR Buffer 1.5 μL,dNTP Mixture(10 mmol·L-1) 2 μL,上下游引物(10 pmol·L-1)各0.6 μL,cDNA模板1.0 μL,ddH2O 8.8 μL。反应条件:95 ℃ 3 min;94 ℃ 30 s,57 ℃ 30 s,72 ℃ 20 s,30个循环;72 ℃ 延伸5 min。用3.0%琼脂糖凝胶电泳检测PCR产物,检测合格后,送北京六合华大基因科技股份有限公司测序。
1.3.6相对定量标准曲线的绘制参照李振等[22]和任有蛇等[23-24]方法进行。反转录所得的PRM1和18S rRNA cDNA按照2×稀释5个梯度,使各PCR反应体系中起始模板数分别是25、24、23、22、2,阴性对照为不添加模板的空白,20 μL反应体系:cDNA模板2.0 μL,Rox Reference Dye Ⅱ 0.4 μL,引物1.6 μL,ddH2O 6.0 μL和SYBR Premix Ex TaqTM10 μL。扩增条件:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 35 s,45个循环;熔解曲线阶段,95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s。在每个退火或延伸步骤结束时检测荧光值,结果由ABI7500型实时PCR系统v2.0.6软件导出。
1.3.7荧光定量PCR反应体系同1.3.6,每个样本重复3次,以18S rRNA为内参校正,结果由2-ΔΔCT方法计算。
1.3.8免疫组化分析参照张春香等[25]和任有蛇等[26]方法进行,组织经常规脱水、浸蜡后制作石蜡切片,切片厚度5 μm。每一步更换液体先用PBS洗3次,每次5 min。切片二甲苯脱蜡,梯度酒精脱水;3% H2O2消除内源性过氧化物酶的活性,室温孵育10 min;pH 7.5的柠檬酸缓冲液中95 ℃热修复15 min,自然冷却;5% BSA 37 ℃封闭15 min,甩去多余液体;1∶100稀释的多克隆Rabbit Anti-PRM 1一抗4 ℃过夜孵育;生物素标记的单克隆Goat Anti-Rabbit二抗37 ℃孵育20 min;ABC复合物37 ℃20 min;黄色DAB显色5 min;苏木精复染30 s后冲洗,然后盐酸乙醇分化;最后把切片脱水、透明、封片。同时用PBS代替一抗做阴性对照。在Olympus生物显微镜下观察,用Image-pro plus 7.0拍照并分析平均光密度值。
1.4图像分析与数据处理
以12月龄附睾尾为对照,用-△△CT法计算PRM1相对表达量。用SPSS 19.0统计软件分析数据,单因素方差分析(ANOVA)对生殖器官PRM1 mRNA和蛋白表达量进行差异显著性检验。精子PRM1 mRNA表达量与精液品质的相关性分析用GraphPad Prism 5软件中Correlation程序。作图用GraphPad Prism 5软件。
2结果
2.1总RNA提取及常规RT-PCR检测
各组织总RNA浓度和纯度的检测结果显示,A260 nm/A280 nm均为1.8~2.0。1.5%琼脂糖凝胶电泳结果(图1A)显示28S rRNA、18S rRNA条带完整、清晰,说明所提取RNA符合反转录要求。总RNA经反转录后,以睾丸组织cDNA为模板进行目的基因扩增,经3%琼脂糖凝胶电泳检测(图1B),条带单一、清晰,说明扩增产物特异性强,可进行后续试验。PCR产物回收后测序,其测序结果与已登录的山羊PRM1的序列(GenBank,No.HM773246)相似性达100%,说明该序列即为山羊PRM1 mRNA部分序列,可进行下一步试验。
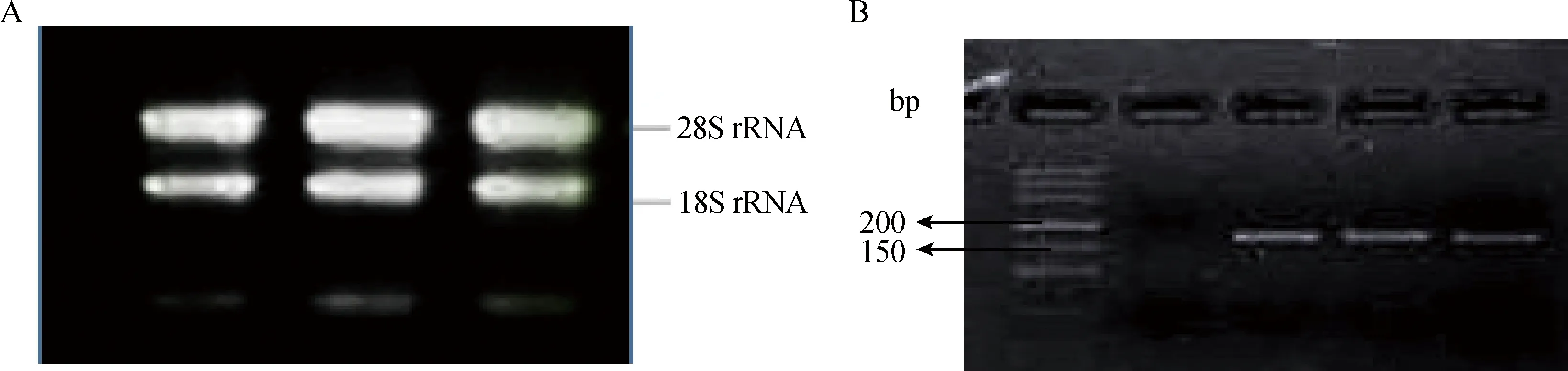
A.总RNA检测;B.PCR扩增产物检测A.Agarose gel electrophoresis pattern of total RNA;B.Agarose gel electrophoresis pattern of PCR production图1 总RNA及PRM1 PCR扩增产物琼脂糖胶电泳Fig.1 Agarose gel electrophoresis pattern of total RNA and PRM1 PCR production
2.2不同组织中PRM1 mRNA表达量
PRM1和18S rRNA标准曲线见图2。图2A显示在5个数量级梯度上PRM1和18S rRNA呈良好的线性关系,回归系数分别为0.999和0.992,扩增效率在95%~110%,说明该相对定量检测方法有效。扩增曲线(图2B)基线平稳,拐点清楚;熔解曲线(图2C)起峰单一,无非特异性产物和引物二聚体,保证试验的可靠性。

A.标准曲线;B.扩增曲线;C.熔解曲线A.Standard curves;B.PCR amplification plots;C.Dissociation curves图2 PRM1与18S rRNA标准曲线Fig.2 Standard curves for PRM1 and 18S gene
13种组织中PRM1 mRNA表达见图3。图3显示PRM1在山羊各组织间表达差异变化明显:睾丸>>附睾头>附睾体、附睾尾>肝、肺>小肠、腹肌、脾、大肠、心、背最长肌和肾。PRM1在睾丸的表达水平是附睾头、体和尾表达量的247、6 511和10 157倍。附睾头中表达显著高于附睾体和尾(P<0.05),其表达量是附睾体26倍,附睾尾41倍。附睾体和尾PRM1表达水平显著高于肝和肺(P<0.05);在小肠、腹肌、脾、大肠、心、背最长肌和肾中有微量表达。
2.3不同月龄公山羊主要生殖器官PRM1 mRNA表达量
不同月龄公山羊主要生殖器官PRM1 mRNA表达量分析结果见图4。从图4可以看出,不同月龄公山羊睾丸中PRM1 mRNA表达量随月龄的增加而显著增加,12月龄PRM1 mRNA表达量显著高于9月龄的表达量(P<0.05),9月龄的表达量显著高于其他低月龄的表达量(P<0.05),9月龄和12月龄的睾丸中PRM1 mRNA表达量分别是2月龄的315倍和453倍。附睾头中PRM1 mRNA表达量6月龄的显著高于9和12月龄的(P<0.05),极显著高于2和3月龄的(P<0.01)。附睾体和尾中PRM1 mRNA表达量随月龄的增加而增加,9和12月龄附睾体PRM1 mRNA表达量显著高于6月龄的表达量(P<0.05),极显著高于2、3和5月龄的(P<0.01);6、9和12月龄附睾尾PRM1 mRNA表达量显著高于3和5月龄的表达量(P<0.05),极显著高于2月龄的表达量(P<0.01)。同一月龄睾丸中PRM1 mRNA表达量均显著高于附睾头的(P<0.05),极显著高于附睾体和尾(P<0.01)。附睾头PRM1 mRNA表达量均显著高于附睾体和尾的(P<0.05)。
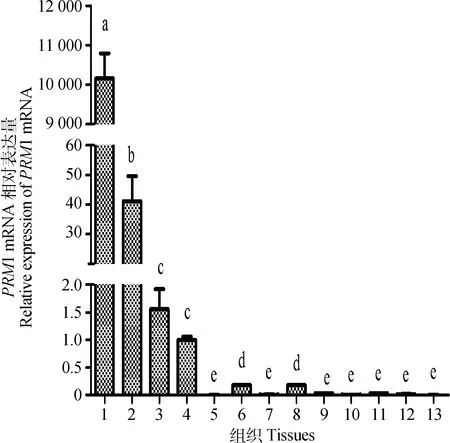
1.睾丸;2.附睾头;3.附睾体;4.附睾尾;5.心;6.肝;7.脾;8.肺;9.肾;10.大肠;11.小肠;12.腹肌;13.背最长肌;相隔和相邻字母分别表示差异极显著(P<0.01);显著(P<0.05),同行相同字母表示差异不显著(P>0.05)。下同1.Testes;2.Caput;3.Corpus;4.Cauda;5.Heart;6.Liver;7.Spleen;8.Lung;9.Kidney;10.Intestinum crassum;11.Small intestine;12.Abdominal muscle;13. Longissimus dorsi muscle.The alternative letters in the same line are very significantly different (P<0.01),The adjacent letters in the same line are significantly different (P<0.05);Values with the same letters are no significantly different (P>0.05).The same as below图3 公山羊组织PRM1 mRNA表达量Fig.3 Relative expression of PRM 1 mRNA in different tissues of bucks
2.4精子PRM1 mRNA表达量与精液品质参数相关性分析
精子PRM1 mRNA表达量与精液品质参数的相关性分析见图5。从图5A可以看出精子PRM1 mRNA表达量与射精量相关性接近显著(P=0.063 2)。图5B和5C结果显示精子PRM1 mRNA表达量与精子活力和精子密度呈显著正相关性(P=0.000 5和P=0.004 9),R2分别为0.586 0和0.442 2。
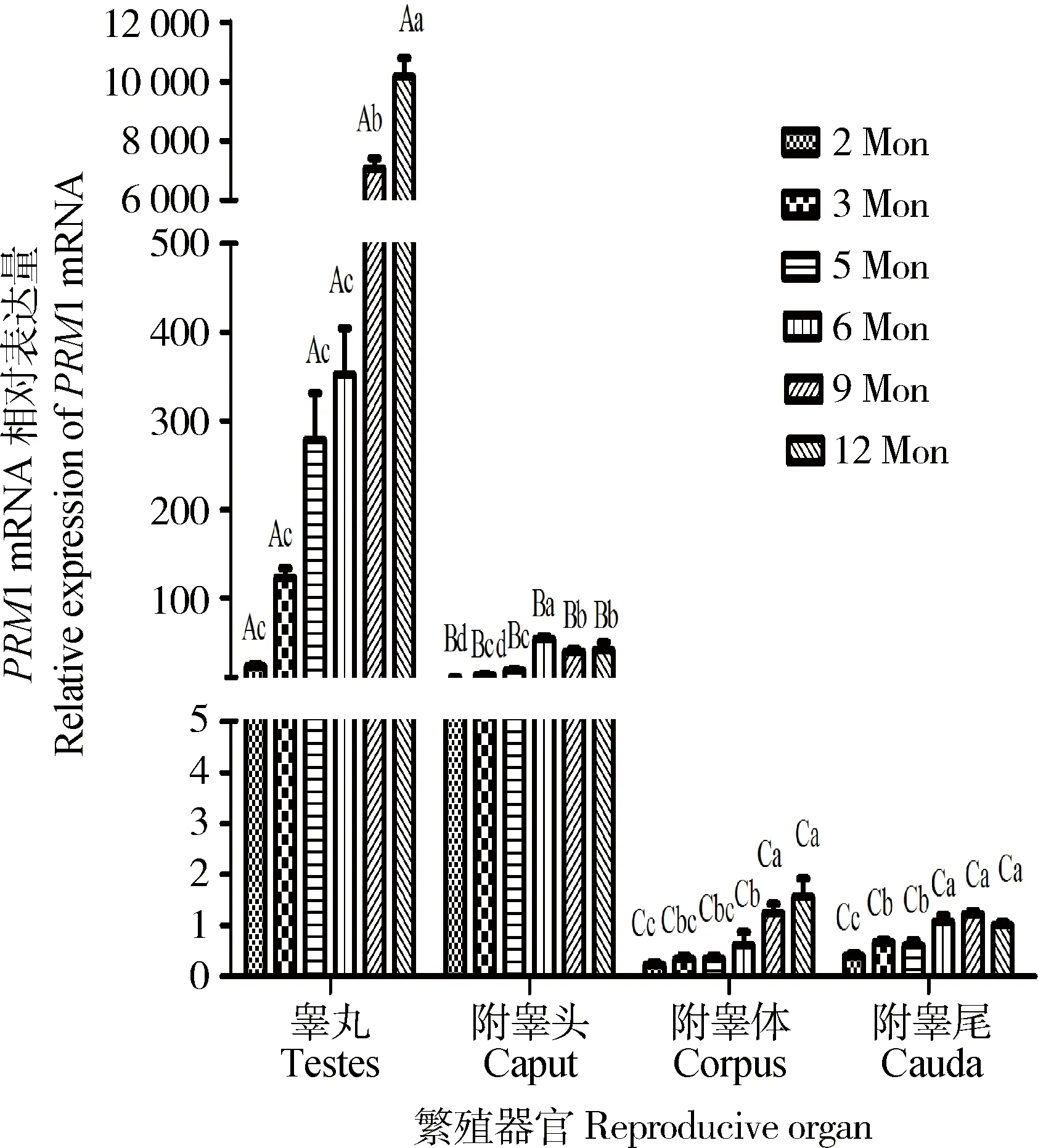
不同大写字母表示同一月龄不同器官的差异显著性,不同小写字母表示不同月龄同一器官的差异显著性Values with the different capital letters are significant difference in different reproductive organs at same age(P<0.05);Values with the different small letters are significant difference in same reproductive organs at different age(P<0.05)图4 不同月龄山羊主要繁殖器官PRM1 mRNA相对表达量Fig.4 Relative expression of PRM1 mRNA in reproductive organ at different age
2.5PRM1蛋白在睾丸中的定位
免疫组化技术对3、6和12月龄睾丸PRM 1蛋白定位结果如图6,根据生精波的规律和核的形状,初步将PRM 1蛋白定位在长形精子细胞和精子中,而在其他生精细胞及间质细胞中没有检测到阳性信号。睾丸免疫组化结果光密度值分析见图7,6和12月龄光密度值显著高于3月龄的(P<0.05)6和12月龄光密度值分别是3月龄的14.6和17.0倍。
3讨论
3.1PRM1 mRNA表达特性
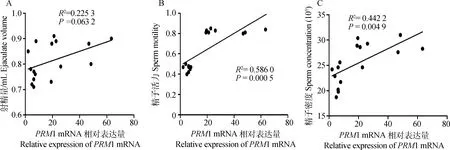
图5 PRM1 mRNA相对表达量与精液品质参数的相关性分析Fig.5 Correlative analyse between relative expression of PRM1 mRNA and index of semen quality
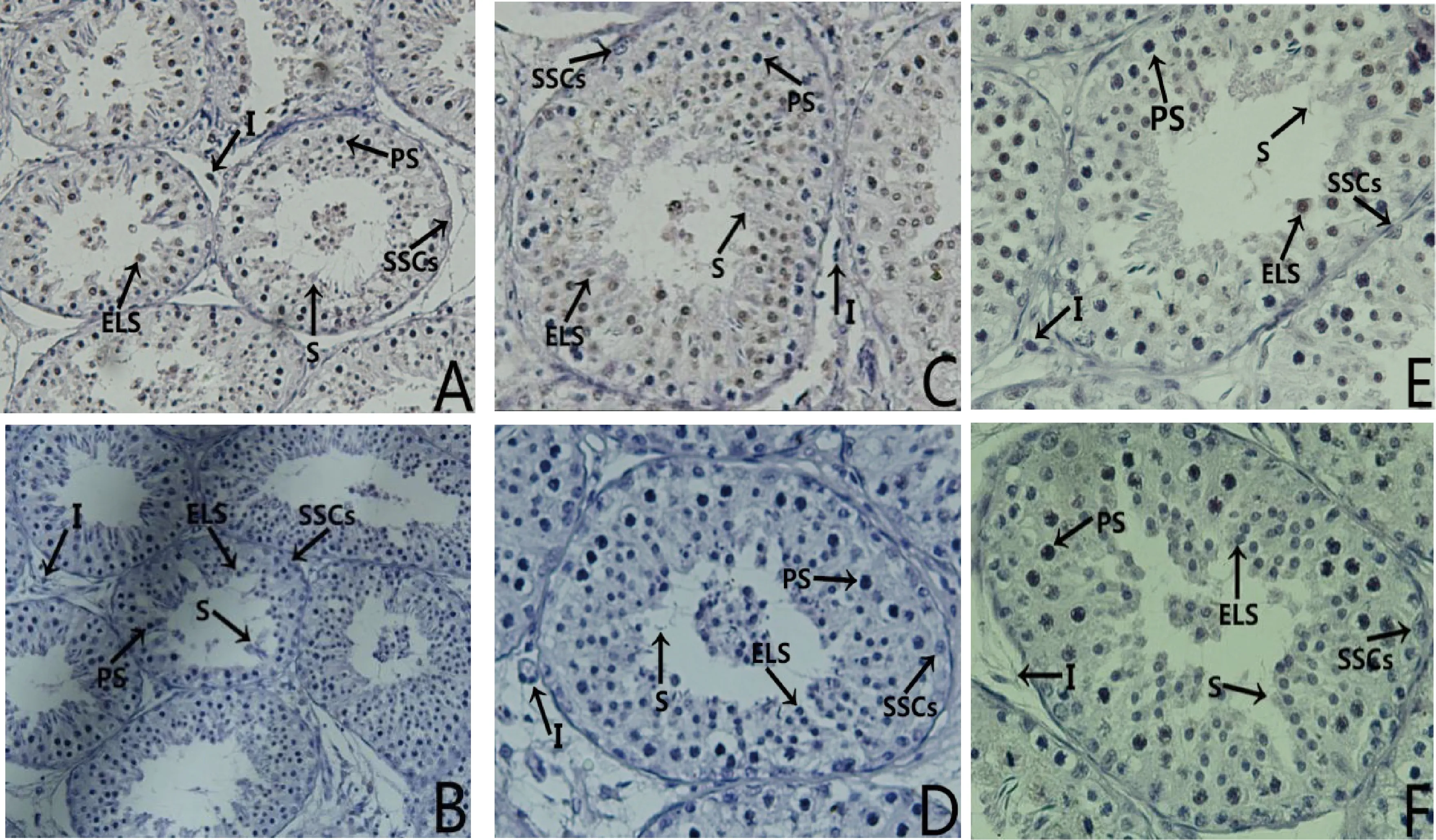
A、C和E.PRM1在3、6和12月龄睾丸检测到阳性产物;B、D和F.3、6和12月龄睾丸阴性对照;SSCs.精原干细胞;PS.初级精母细胞;ELS.长形精子细胞;S.精子;I.睾丸间质细胞A,C and E.PRM1 in 3-month-old,6-month-old and 12-month-old testis showed a positive signal;B,D and F.The negative control of 3-,6- and 12-month-old testis;SSCs.Spermatogonial stem cells;PS.Primary spermatocyte;ELS.Elongating spermatids;S.Spermatozoon;I.Interstitial cell图6 睾丸组织PRM1免疫组化 400×Fig.6 Immunohistochemistry of PRM1 protein in caprine testis 400×

图7 平均光密度值分析Fig.7 Analysis of the mean optical density
3.1.1不同组织PRM1 mRNA表达特性最初PRM1是从精子的头部分离得到的[11]。利用Northern blot技术发现在人类和鼠类只在睾丸中PRM1特异表达[27-28],而脑组织和肝中无表达;滕小梅等利用RT-PCR技术琼脂糖电泳检测了15种人类组织(不包括附睾)PRM1表达情况,发现除睾丸和结肠癌组织外其余组织无PRM1表达[29],随后侯文佳等[30]发现在人类正常结肠组织中也有微量的PRM1 mRNA。本研究检测山羊13种组织中均存在不同程度表达,PRM1在睾丸表达量最高,其次是附睾头,主要繁殖器官以外的组织都是微量表达,其相对表达量为0.002~0.200,这与人和鼠上的结果有差异,造成这种差异原因主要是检测PRM1 mRNA的技术手段不同,随着技术手段的改进,检测的精确度越来越高,因此,还需要在其他动物上进一步验证。3.1.2年龄对动物睾丸和附睾PRM1 mRNA表达的影响有研究发现小鼠在出生后7~8 日龄无PRM1 mRNA表达,在24~26日龄时PRM1 mRNA被检测到,且随着日龄的增加PRM1表达量持续增加[28]。本研究结果显示在2~3月龄精子初现时已经有PRM1的表达,到性成熟时5~6月龄时增加,9~12月龄时显著增加,与前人研究结果基本一致。目前有关年龄对附睾PRM1 mRNA表达影响的研究较少,基本趋势是与睾丸一致,附睾头中的表达量显著高于附睾体和尾,这可能是附睾头处PRM1仍与DNA发生作用。公猪附睾体精子核PRM1浓度最高,推测DNA与PRM1作用关键位置在附睾体[20]。本研究用的是从mRNA水平上定量附睾的组织PRM1表达量,而在公猪研究上用免疫组织化学方法研究附睾中精子核中PRM1蛋白浓度,本研究中6月龄附睾头PRM1 mRNA最高,有可能是山羊6月龄达到性成熟大量精子出现在附睾头中的原因,另外还需进一步研究其PRM1蛋白是否也表达最高呢?因此,下一步将对山羊附睾及其中的精子PRM1蛋白进行定量分析,探讨PRM1作用的规律。
3.2PRM1 mRNA含量与精液品质参数的相关性
现已有研究报道精子PRM1 mRNA表达量可作为评价雄性生殖力的指标,在人上,有生殖障碍男性精子PRM1 mRNA含量较低,DNA损伤较为严重[31-32]。公牛和种马精子质量和精子受精能力参数均与PRM1 mRNA表达量正相关[17,33],含PRM1高的精子其DNA损伤较低[16],正常精子PRM1 mRNA表达量显著高于有运动障碍的精子的表达量[18]。还有研究显示PRM1能影响精子头部大小,使精子流动性发生变化[34],导致活力改变[35]。本研究结果显示PRM1 mRNA表达量与精子密度和精子活力显著正相关。高活力山羊精液(>0.8)精子PRM1 mRNA含量显著高于低活力精液(<0.5)PRM1 mRNA含量,说明在山羊上,PRM1 mRNA表达量也可以作为评价公羊繁殖力的指标,但仍需进一步研究睾丸和精子PRM1 mRNA含量与精子DNA损失的关系。
3.3睾丸中PRM 1蛋白定位
在圆形精子细胞向长形精子细胞分化时,PRM1代替组蛋白与DNA结合形成Protamine-DNA复合体[12-13],促进染色体的凝聚和浓缩[14-15]。利用免疫电镜技术发现人类和大鼠精子发生过程中PRM1首先出现在长形精子细胞中[36-38];费仁仁等[39]利用速度沉降法和超声法发现,睾丸圆形精子细胞核内全部为组蛋白,长形精子细胞核内主要为PRM1,也存在少量过渡型蛋白和组蛋白,附睾精子核中绝大部分为PRM1,同时该研究还利用免疫组织化学和同位素标记方法进一步证明,只有在长形精子细胞核内检测到PRM1。本研究免疫组化结果初步将山羊PRM1蛋白定位于长形精子细胞和精子中,睾丸其他生精细胞及间质细胞中无表达,与人和鼠睾丸中PRM1表达规律基本一致,仍需进一步分离睾丸中不同发育阶段的精细胞,通过不同生物技术手段进行精确定位。相对光密度值显示PRM1蛋白与mRNA的表达趋势一致。目前,首先需要合成抗山羊PRM1单克隆抗体,进一步利用先进生物技术研究山羊睾丸和附睾PRM1表达模式。
4结论
山羊PRM1 mRNA表达具有组织特异性,其在睾丸中高度表达,其次是附睾;山羊主要繁殖器官中PRM1 mRNA具有时间依赖性,在周岁之前随着月龄增加表达量增加;精子PRM1 mRNA的表达量与精子活力、精子密度呈显著正相关;山羊睾丸中PRM1在长形精子细胞与精子中表达。PRM1 mRNA表达量也可以作为评价公羊生育力的指标,但仍需进一步利用先进生物技术研究山羊睾丸和附睾PRM1表达模式,探讨PRM1作用的规律。
参考文献(References):
[1]HECHT N B.Regulation of ‘haploid expressed genes’ in male germ cells[J].JReprodFertil,1990,88(2):679-693.
[2]OLIVA R,DIXON G H.Vertebrate protamine gene evolution I.Sequence alignments and gene structure[J].JMolEvol,1990,30(4):333-346.
[3]DADOUNE J P.The nuclear status of human sperm cells[J].Micron,1995,26(4):323-345.
[4]STEGER K.Transcriptional and translational regulation of gene expression in haploid spermatids[J].AnatEmbryol,1999,199(6):471-487.
[5]DEROUCHEY J E,RAU D C.Role of amino acid insertions on intermolecular forces between arginine peptide condensed DNA helices:implications for protamine-DNA packaging in sperm[J].JBiolChem,2011,286(49):41985-41992.
[6]DOYEN C M,MOSHKIN Y M,CHALKLEY G E,et al.Subunits of the histone chaperone CAF1 also mediate assembly of protamine-based chromatin[J].CellRep,2013,4(1):59-65.
[7]AOKI V W,CARRELL D T.Human protamines and the developing spermatid:their structure,function,expression and relationship with male infertility[J].AsianJAndrol,2003,5(4):315-324.
[8]STEGER K,FINK L,FAILING K,et al.Decreased protamine-1 transcript levels in testes from infertile men[J].MolHumReprod,2003,9(6):331-336.
[9]ALEEM M,PADWAL V,CHOUDHARI J,et al.Sperm protamine levels as indicators of fertilising potential in sexually mature male rats[J].Andrologia,2008,40(1):29-37.
[10]AOKI V W,LIU L,CARRELL D T.Identification and evaluation of a novel sperm protamine abnormality in a population of infertile males[J].HumReprod,2005,20(5):1298-1306.
[11]POLLISTER A W,MIRSKY A E.The nucleoprotamine of trout sperm[J].JGenPhysiol,1946,30(2):101-116.
[12]BREWER L R,CORZETT M,LAU E Y,et al.Dynamics of protamine 1 binding to single DNA molecules[J].JBiolChem,2003,278(43):42403-42408.
[13]CREE L H,BALHORN R,BREWER L R.Single molecule studies of DNA-protamine interactions[J].ProteinPeptLett,2011,18(8):802-810.
[14]BREWER L R,CORZETT M,BALHORN R.Protamine-induced condensation and decondensation of the same DNA molecule[J].Science,1999,286(5437):120-123.
[15]BALHORN R,BREWER L,CORZETT M.DNA condensation by protamine and arginine-rich peptides:analysis of toroid stability using single DNA molecules[J].MolReprodDev,2000,56(2 Suppl):230-234.
[16]FORTES M R,SATAKE N,CORBET D H,et al.Sperm protamine deficiency correlates with sperm DNA damage in Bos indicus bulls[J].Andrology,2014,2(3):370-378.
[17]DOGAN S,VARGOVIC P,OLIVEIRA R,et al.Sperm protamine-status correlates to the fertility of breeding bulls[J].BiolReprod,2015,92(4):92.
[18]GANGULY I,GAUR G K,KUMAR S,et al.Differential expression of protamine 1 and 2 genes in mature spermatozoa of normal and motility impaired semen producing crossbred Frieswal (HF× Sahiwal) bulls[J].ResVetSci,2013,94(2):256-262.
[19]COURTENS J L,PLÖEN L,LOIR M.Immunocytochemical localization of protamine in the boar testis[J].JReprodFertil,1988,82(2):635-643.
[20]RODRIGUEZ-MARTINEZ H,COURTENS J L,KVIST U,et al.Immunocytochemical localization of nuclear protamine in boar spermatozoa during epididymal transit[J].JReprodFertil,1990,89(2):591-595.
[22]李振,任有蛇,焦光月,等.雄激素受体基因在绵羊公羔不同组织中的表达特性及性腺中的定位[J].畜牧兽医学报,2013,43(8):1251-1257.
LI Z,REN Y S,JIAO G Y,et al.The expression of androgen receptor gene in different tissues and cellular localization in gonad of male sheep lambs[J].ActaVeterinariaetZootechnicaSinica,2013,43(8):1251-1257.(in Chinese)
[23]任有蛇,张国林,郭丽娜,等.公山羊β防御素104a生物信息学分析及表达特性研究[J].畜牧兽医学报,2015,46(2):219-227.
REN Y S,ZHANG G L,GUO L N,et al.Bioinformatics analysis and expression characteristics of goat beta-defensin 104a gene in adult bucks[J].ActaVeterinariaetZootechnicaSinica,2015,46(2):219-227.(in Chinese)
[24]任有蛇,秦小伟,郭丽娜,等.日粮纳米锌水平对公羊睾丸和附睾Cu-ZnSOD表达的影响[J].畜牧兽医学报,2014,45(10):1622-1630.
REN Y S,QIN X W,GUO L N,et al.Effect of the supplementation of different nano-zinc levels on expression of copper zinc superoxide in testis and epididymis of ram lambs[J].ActaVeterinariaetZootechnicaSinica,2014,45(10):1622-1630.(in Chinese)
[25]张春香,秦小伟,郭丽娜,等.纳米锌水平对公羊精液品质、抗氧化酶活性及附睾Cu-ZnSOD表达的影响[J].中国农业科学,2015,48(1):154-164.
ZHANG C X,QIN X W,GUO L N,et al.Effect of different Nano-zinc levels in dietary on semen quality,activities of antioxidant enzyme and expression of copper zinc superoxide in epididymis of ram lambs[J].ScientiaAgriculturaSinica,2015,48(1):154-164.(in Chinese)
[26]任有蛇,郭丽娜,张春香,等.山羊Lcn 5的表达特点及其在繁殖器官中定位[J].畜牧兽医学报,2015,46(5):711-718.
REN Y S,GUO L N,ZHANG C X,et al.Expression characteristics of Lcn 5 and its localization in reproduction organ of bucks[J].ActaVeterinariaetZootechnicaSinica,2015,46(5):711-718.(in Chinese)
[27]DOMENJOUD L,KREMLING H,BURFEIND P,et al.On the expression of protamine genes in the testis of man and other mammals[J].Andrologia,1991,23(5):333-337.
[28]FEI R R,JI L,WU X F,et al.Studies on expression of P1 protamine gene in rat and mouse testis[J].Reproduction&Contraception,1999,10(4):195-202.
[29]滕小梅,韩泽广,黄健.PRM1,一个新的候选结肠癌相关CT抗原基因的识别及其在结肠癌组织中的表达分析[J].现代检验医学杂志,2008,23(3):1-4.
TENG X M,HAN Z G,HUANG J.Identification and expression analysis of PRM1 as a novel candidate cancer/testis gene in human colorectal cancer[J].JournalofModernLaboratoryMedicine,2008,23(3):1-4.(in Chinese)
[30]侯文佳,陈芳芳,任平,等.鱼精蛋白 1 在结肠腺癌组织中的表达及其临床意义[J].中国生物制品学杂志,2013,26(5):698-700,709.
HOU W J,CHEN F F,REN P,et al.Expression and significance of protamine 1 in human colon adenocarcinoma tissue[J].ChineseJournalofBiologicals,2013,26(5):698-700,709.(in Chinese)
[31]NILI H A,MOZDARANI H,ALEYASIN A.Correlation of sperm DNA damage with protamine deficiency in Iranian subfertile men[J].ReprodBiomedOnline,2009,18(4):479-485.
[32]STEGER K,WILHELM J,KONRAD L,et al.Both protamine-1 to protamine-2 mRNA ratio and Bcl2 mRNA content in testicular spermatids and ejaculated spermatozoa discriminate between fertile and infertile men[J].HumReprod,2008,23(1):11-16.
[33]PARADOWSKA-DOGAN A,FERNANDEZ A,BERGMANN M,et al.Protamine mRNA ratio in stallion spermatozoa correlates with mare fecundity[J].Andrology,2014,2(4):521-530.
[34]LÜKE L,CAMPBELL P,VAREA SNCHEZ M,et al.Sexual selection on protamine and transition nuclear protein expression in mouse species[J].ProcBiolSci,2014,281(1783):76-80.
[35]RETTIE E C,DORUS S.Drosophila sperm proteome evolution:Insights from comparative genomic approaches[J].Spermatogenesis,2012,2(3):213-223.
[36]MEISTRICH M L,TROSTLE-WEIGE P K,VAN BEEK M E.Separation of specific stages of spermatids from vitamin A-synchronized rat testes for assessment of nucleoprotein changes during spermiogenesis[J].BiolReprod,1994,51(2):334-344.
[37]LESCOAT D,BLANCHARD Y,LAVAULT M T,et al.Ultrastructural and immunocytochemical study of P1 protamine localization in human testis[J].Andrologia,1993,25(2):93-99.
[38]LE LANNIC G,ARKHIS A,VENDRELY E,et al.Production,characterization,and immunocytochemical applications of monoclonal antibodies to human sperm protamines[J].MolReprodDev,1993,36(1):106-112.
[39]费仁仁,邓锦松,纪林,等.大鼠精子细胞变态期核蛋白转换的研究[J].解剖学报,1997,28(4):388-392.
FEI R R,DENG J S,JI L,et al.Studies on rat spermatid nuclear protein transition[J].ActaAnatomicaSinica,1997,28(4):388-392.(in Chinese)
(编辑程金华)
doi:10.11843/j.issn.0366-6964.2016.07.007
收稿日期:2016-01-22
基金项目:山西省科技攻关计划项目(20130311025-2;20110311029)
作者简介:张春香(1972-),女,山西侯马人,副教授,主要从事动物遗传育种与繁殖研究,Tel:0354-6285990,E-mail:zhchx66@126.com *通信作者:任有蛇,教授,主要从事动物繁殖调控研究,E-mail:rys925@126.com
中图分类号:S827.2
文献标志码:A
文章编号:0366-6964(2016)07-1354-09
Expression Profiles of Protamine 1 mRNA and Correlation with Index of Semen Quality in Bucks
ZHANG Chun-xiang,ZHAO Hui,GUO Li-na,ZHENG Ya-lin,ZHANG Cai-xia,LIU Wen-zhong,QIAO Li-ying,REN You-she*
(CollegeofAnimalScienceandVeterinaryMedicine,ShanxiAgriculturalUniversity,Taigu030801,China)
Abstract:The aims of this study were to evaluate the expression profiles of Protamine 1(PRM1) mRNA in reproductive organs of bucks and to analyze the correlation between expression of PRM1 mRNA in spermatozoa and semen quality index.In this experiment,mRNA expression was detected by real-time fluorescent quantitative PCR.Cellular localization of PRM1 in testis was examined by immunohistochemistry.The correlation was analyzed by GraphPad Prism 5 software.The results showed that:the expression of PRM1 mRNA in testis was the highest in all tissue detected,which was 247 times higher than that in the epididymal caput(P<0.05).The expression of PRM1 mRNA in epididymal caput was significantly higher than that in epididymal corpus and cauda(P<0.05).The expression of PRM1 mRNA in other tissues was very few.The expression of PRM1 mRNA in testis was gradually increased with the increase of ages in one year old.The PRM1 mRNA expression in testis at 12 months old were significantly higher than that at 9 months old(P<0.05).The PRM1 mRNA expression in testis at 9 months old was significantly higher than that in other ages.Concentration of PRM1 mRNA in sperm was positively correlated with the sperm motility (R2=0.586 0,P=0.000 5) and sperm concentration (R2=0.442 2,P=0.004 9).PRM1 was located in elongating spermatids and spermatozoa in testis of bucks.There was no positive signal in other cells of testis.This study indicated that the expression of PRM1 mRNA was spatial and temporal-specific pattern.The sperm PRM1 mRNA content could be index of fertility of bucks.
Key words:Protamine 1;expression profiles;index of semen quality;correlation;bucks

