多粘菌素B研究及治疗策略进展*
颜可 综述 袁喆 审校
(重庆医科大学附属第一医院感染科·重庆市传染病寄生虫病学重点实验室,重庆 400016)
多粘菌素B研究及治疗策略进展*
颜可 综述袁喆 审校
(重庆医科大学附属第一医院感染科·重庆市传染病寄生虫病学重点实验室,重庆 400016)
【摘要】随着全球耐药革兰阴性菌感染率日益增加,多粘菌素B再次广泛应用于临床。多粘菌素B作为早期抗菌药物,对于常见多重耐药革兰阴性菌体现了较好的抗菌活性,如铜绿假单胞菌、鲍曼不动杆菌、肺炎克雷伯杆菌等。然而多粘菌素B的临床研究数据样本量小,其药效学及药代动力学相关研究仍然相对缺乏,本文通过对十年来多粘菌素B相关研究的复习,从化学构造、作用机制、耐药机制、抗菌活性、临床使用、联合应用以及毒副作用等方面对多粘菌素B进行综述,以期对临床应用提供参考。
【关键词】多粘菌素B;多重耐药革兰阴性菌;治疗策略
多粘菌素作为一种早期的非核糖体类抗菌药物,曾广泛应用于临床抗革兰阴性菌治疗,后因其抗菌谱窄,毒副作用明显而逐渐被替代,目前随着全球范围内多重耐药革兰阴性菌感染率不断增长,多粘菌素作为治疗革兰阴性菌的最后一道防线而再次被重视。本文通过对十年来多粘菌素相关研究的复习,从化学构造、作用机制、耐药机制、抗菌活性、临床使用以及联合应用等方面对多粘菌素B进行综述,以期对临床应用提供参考。
1多粘菌素的发展史及基本化学结构
多粘菌素是一组碱性多肽类抗菌药物的总称,最早于1947年在多粘芽孢杆菌的二次代谢产物中提取得到,并于1959年开始应用于临床抗革兰阴性菌的治疗[1]。后随着其毒副反应的不断报道,而逐渐被新晋抗菌药物取代。Pubmed的数据研究表明,从1970年开始至2000年多粘菌素的临床应用处于低峰[2]。根据不同菌株产生化学结构不全相同,多粘菌素总共有30多种类型,又主要分为A、B、C、D、E五种亚型,其基本结构均为类环状十肽序列,包括一个七肽环,一个三环侧链,三环侧链各带有一个含氨基酸残基端的脂肪酸尾链,残基端的不同氨基酸组成导致其化学结构不全相同,其为多粘菌素分型的主要依据。而最终仅多粘菌素B及E因其良好的疗效和相对较高的安全性而应用于临床,其区别在于多粘菌素B的氨基酸成分为苯丙氨酸,而多粘菌素E则为亮氨酸[2-3]。临床上常用多粘菌素B、E均为混合物,多粘菌素B为由30多种多肽形成的硫酸盐制剂,B1、B2为其主要部分,多以非肠道形式给药,用于治疗眼、耳部疾病。多粘菌素E则多为甲磺酸盐制剂,需在体内水解为粘菌素而发挥其效应[4-5,30]。
2多粘菌素B的杀菌机制及耐药机制
多粘菌素B作为一种快速杀菌药物,通过与细菌细胞膜的接触,其分子中聚阳离子环与革兰氏阴性菌细胞膜上的脂蛋白游离带负电荷的磷酸基通过电作用结合,形成较强的链-链结合,破坏细胞原有的完整性,导致其通透性增加,细胞内小分子成分尤其是嘌呤、嘧啶等重要物质外漏而致杀菌作用[6-7]。
另外多粘菌素也可通过囊泡接触途径,使得细胞内外膜之间的成分交叉,丧失原有的特异性,致渗透不平衡,导致细菌膨胀、溶解[3]。羟基自由基的累积损害是最新提出的多粘菌素破坏细菌的机制,考虑与氧化应激反应导致羟基自由基的积累破坏细菌的DNA相关[3]。
除此之外多粘菌素还具有中和内毒素作用,其阳离子环形肽通过电作用与内毒素活性中心的硫酸根离子结合,使内毒素失去活性,从而达到消除内毒素、抑制内毒素的释放及其活力,进一步达到抑制炎症因子释放、减轻炎性反应的效果[9-10]。
3多粘菌素B的抗菌谱及其抗菌活性
多粘菌素B为窄谱抗菌药物,对绝大多数革兰氏阴性菌有较好的活性[7]。而所有革兰阳性菌、真菌、厌氧菌以及部分革兰阴性球菌(淋病奈瑟菌、脑膜炎奈瑟菌)、寄生虫等对其固有耐药。多粘菌素对铜绿假单胞菌和不动杆菌属天然易感,也可有效地抵抗流感嗜血杆菌、大肠杆菌、沙门氏菌属、志贺菌属、肺炎克雷伯菌、嗜肺军团菌、铜绿假单胞菌、枸橼酸杆菌属和百日咳杆菌,而对变形杆菌、沙雷氏菌属药物活性欠佳[2,6-7]。对于多粘菌素的敏感折点,各个组织之间存在不同的界定值,见表1[2,12]。
表1不同国家多粘菌素B对不同细菌种类的敏感折点的界定值
Table 1The sensitive break point values of polymyxin B of the different bacterial species in different countries

S(mg/L)R(mg/L)菌种法国微生物学会<2>2肠杆菌科英国抗菌药物协会<4>8肠杆菌科美国临床和实验室标准协会(CLSI)<2>4不动杆菌属<2>8铜绿假单胞菌欧洲药敏试验委员会(EUCAST)<2>2不动杆菌属<2>4铜绿假单胞菌
目前国际上多粘菌素的形式多种多样,Wertheim等通过对来自56个国家的284名受访者的调查问卷结果显示,主要形式为多粘菌素甲磺酸盐形式-多粘菌素E(使用率为48.6%)和硫酸盐制剂-多粘菌素B(使用率为14.1%)。而给药方式的选择也是不同的,在284名受访者中,84.2%使用多粘菌素静脉滴注,44.4%使用雾化吸入,12.7%使用口服给药方案。而给药方案的选择多取决于其适用指针。静脉给药多适用于耐药革兰氏阴性菌所介导的呼吸机相关性肺炎、败血症和导管相关性感染者,而雾化给药则常用于囊肿性纤维化的患者[1-2,29]。
虽然目前静脉注射多粘菌素B已被广泛应用于严重铜绿假单胞菌、鲍曼不动杆菌、肺炎克雷伯菌所致的肺炎、尿路感染及败血症等各种类型的感染[19,31],但其大多数相关研究均在体外基础上进行,且相关临床研究数据量本均较小,其临床经验指导实则相对有限[13,27]。
目前几乎所有的药代动力学研究就是着重于多粘菌素E,多粘菌素B的相关研究甚少。最近的药代动力学研究强调,多粘菌素E在体内转换为多粘菌素是十分缓慢的、不完全,因此,多粘菌素E的药代学结果是不能应用于多粘菌素B[17]。既往药代动力学相关结果表明,多粘菌素B在4~5个半衰期后达到稳定血药浓度,故首日的负荷剂量有利于迅速达到控制感染的治疗浓度,尤其是应用于危重症患者[1,13,40].目前国际上对于肾小球率过滤正常的患者推荐使用多粘菌素B剂量为1.5~2.5mg/kg/d,若存在GFR下降,多粘菌素B的推荐剂量见表2[12,24]。
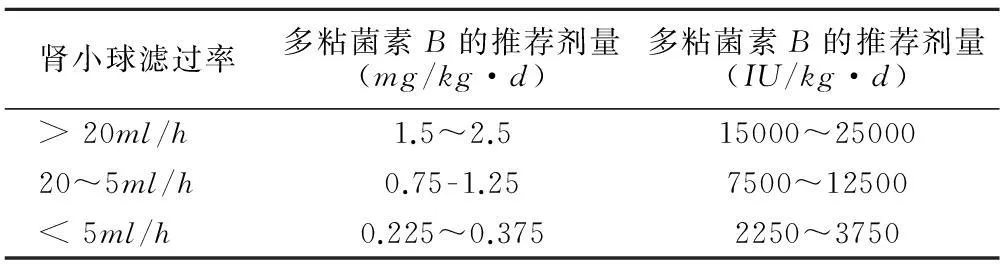
表2 PMB的推荐使用剂量
Sandri等通对24例不同年龄(21~87岁)、不同肾功能(其中两例为连续性血液透析患者,余22例患者肌酐清除率波动于为10~143ml/L)患者静脉使用多粘菌素B研究发现多粘菌素B的体内清除速度与肾功能(r2=0.008)、APACHE II评分以及年龄无统计学差异,建议多粘菌素B的静脉使用量最好根据患者体重,而非肾功能情况[13]。但Pai等却对这一结论提出质疑,其认为根据体重计算多粘菌素B的静脉剂量,可能导致肥胖患者的剂量过大及消瘦患者的剂量不足[14,25]。
4多粘菌素B与其他抗菌药物的联合应用
上世纪末由于新晋抗生素的缺乏,多粘菌素B重新用于抗革兰阴性菌感染,尤其是应用于多重耐药革兰阴性菌的感染,然因缺乏充分的药效学及药代学的循证医学依据,不合理的用药导致多粘菌素耐药菌株的出现,对于耐药菌株的出现,多粘菌素B联合其他抗菌药物的使用成为当下研究的重点[15]。
Urban等分离出20株对碳青霉烯类药物耐药的菌株,包括不同耐药机制的铜绿假单胞菌、肺炎克雷伯杆菌、鲍曼不动杆菌、大肠杆菌各5株,分别给予多粘菌素B、多尼培南、利福平的二联或三联组合干预,在以上三种药物的1/4MIC值的联合应用下,其杀菌率分别为85%(多粘菌素B-多尼培南-利福平组)、30%(多粘菌素B-多尼培南组)、25%(多粘菌素B-利福平组)、30%(多尼培南-利福平组),而以上三种药物单独在其1/4MIC值时是没有杀菌效果的[16,33]。结果表明,对于多粘菌素B与其他药物以其1/4MIC值联用可达到85% 的抗菌效果。虽然体外研究不能完全用于评估体内疗效,但对于多重耐药革兰氏阴性菌的治疗策略仍有一定的指导意义。
Nathalie等通过2例重症感染患者的详细病例分析报道,其痰培养或血培养病原学结果提示为产KPC酶的肺炎克雷伯菌,在多粘菌素B及适当高剂量的2种碳青霉烯类药物的联合应用下, PCT、CPR、WBC等相关感染指标均下降明显[17,32]。该病例报道结果对于目前多粘菌素B的联合用药有一定的帮助。
Kim等采用微量肉汤稀释法测定在96孔板中对多粘菌素B敏感的耐药大肠埃希菌以及鲍曼不动杆菌的生长以及测定药物的分数抑菌浓度指数(FICI,FICI<0.5,提示有协同作用;FICI在0.5~1.0之间提示部分协同;FICI>1.0,表示无协同作用)以证实多粘菌素B与环吡酮胺联合应用的协同作用,结果显示环吡酮胺浓度在3.12~12.5μg/ml范围内波动时(其MIC为25ug/ml),多粘菌素B的MIC值下降至原来的1/6-1/4,,FICI值分别波动于0.25~0.5(大肠埃希菌)、0.375~0.5(鲍曼不动杆菌),而环吡酮胺对于以上两种细菌并无杀菌效果[18,26]。以上研究结果显示,环吡酮胺有利于增强多粘菌素B的抗菌活性。
目前相关研究认为多粘菌素B与其他抗菌药物联合应用时应考虑如下方面:多粘菌素B与其他抗菌药物之间互为敏化剂增加对方的抗菌活性,或可以抑制生物膜的形成,使得部分疏水性抗菌药物更加容易进入细胞,或与部分药物联用可产生或协同增强其抗真菌效果[11,18]。
5多粘菌素B的耐药机制
多粘菌素B的主要作用部位为细菌的细胞膜,故革兰阴性菌常通过其细胞外膜及其组成部分的一系列变化,如LPS或电阻阵列的改变,通过激活或外排泵,最后达到异质性,从而导致耐药的发生[3]。其中最常见的是脂多糖修饰,细菌细胞膜通过脂质A的变化、粘多糖结构变化从而达到脂多糖修饰,导致负电荷减少,对Ca2+、Mg2+的定向转运减少,导致细菌胞体对多粘菌素B的亲和力下降而产生耐药[6-7]。Moffatt等指出,完全丧失脂多糖结构的鲍曼不动杆菌可对多粘菌素耐药,考虑与多粘菌素对完全丧失的脂多糖的细胞定向能力减弱,从而导致耐药的发生[9]。另外目前有研究指出铜绿假单胞菌对于多粘菌素B的耐药机制尚与产生抗生素修饰酶、水解酶相关。肺炎克雷伯杆菌还可通过产生荚膜导致耐药;沙门氏菌、霍乱弧菌等也可通过对外排基因、mig-14基因、mgrB基因的表达从而产生耐药[21,36,37]。
6多粘菌素B的毒副作用
多粘菌素B作为一种古老的抗菌药物,早在1970年就有相关文献对其毒副作用做了相关报道[22],其常见不良反应为剂量依赖的肾毒性及神经毒性,其他罕见副作用包括:过敏反应,皮肤瘙痒,以及使用吸入制剂时轻度刺激性呛咳等[15,35]。
多粘菌素B的肾毒性最为常见,主要表现为急性肾损伤(AKI),其中又以急性肾小管坏死多见[22]。目前相关研究认为多粘菌素B通过肾小球滤过后在近曲小管上皮细胞重吸收,量的不断累积逐渐损伤上皮细胞,使通透性增加,导致细胞肿胀、溶解,进而引起急性肾损伤。临床上以蛋白尿、血尿和管型尿,血肌酐和尿素氮增高,肌酐清除率下降为主要表现[2,22,28]。Nelson等对151例静脉使用多粘菌素B(超过48小时)的败血症患者做了回顾性分析,结果显示AKI的发生率为35.8%,而高剂量的多粘菌素B(大于等于250mg/d)的AKI的发生率(P1)明显高于使用低剂量多粘菌素B的患者(P2)(P1=66.7%,P2=32%;P=0.03)[23]。Abdelraouf等通过对小鼠模型研究表明,频繁多次给药相较于每日给予适当剂量导致肾毒性发生率明显升高。以上研究结果证实AKI的发生率与多粘菌素B的给药剂量相关[20]。
多粘菌素B的神经毒性为第二常见副反应,主要表现为感觉异常,有极个别个案曾报道更严重的神经毒性(如窒息、呼吸窘迫等)。其发病机制考虑与其导致神经肌肉接头阻滞相关,可能是由于突触前膜乙酰胆碱释放受到抑制,竞争性抑制乙酰胆碱,或长时间去极化和钙耗竭所致[24,38]。多粘菌素B的神经毒性相较于其肾毒性而言更为罕见,其发生率为0~7%,通常较轻,停药后可以快速恢复[22,39]。
Nigam等对一例使用多粘菌素B后出现以上神经及精神症状的患者进行了报道,并且在停用后以上症状能快速恢复[10,15]。同时因多粘菌素B通过肾脏代谢,故对肾功能不全患者,亦为神经毒性发生的危险因素[7,34]。与肾毒性一样,神经毒性仍然与多粘菌素B使用剂量及使用疗程密切相关,因其发生率相对较少,相关研究偏少。
7小结与展望
目前随着越来越多的耐药革兰阴性细菌出现,能有效用于治疗的抗菌药物不断枯竭,而多粘菌素B表现出良好的抗菌活性,因此多黏菌素B的治疗策略的优化势在必行。目前对于多粘菌素B的药效学及药代学的相关研究非常有限的,甚至往往是矛盾的,对于如何优化多粘菌素B的长期治疗策略,以达到多粘菌素B最大效价的同时,又能真正减少其毒副作用和避免耐药的发生,尚需大量的临床研究。对于多粘菌素B的不规范使用导致部分耐药菌的出现,与其他类型抗菌药物的联合应用,为该类型或减少该类型病菌出现提供了较好的治疗策略,但尚需大量的药理学、毒理学以及相互作用机制及其协同率的相关研究来进行临床指导[37,41]。
【参考文献】
[1]Wertheim H,Van N K,Hara G L,et al.Global survey of polymyxin use:A call for international guidelines[J].Journal of Global Antimicrobial Resistance,2013,1(3):131-134.
[2]Silpak B,Jean-Michel B,Jean-Christophe D,et al.Colistin:an update on the antibiotic of the 21st century[J].Expert review of anti-infective therapy,2012,10(8):917-934.
[3]Yu Z,Qin W,Lin J,et al.Antibacterial Mechanisms of Polymyxin and Bacterial Resistance[J].Biomed Research International,2015,2015:1-11.
[4]Kassamali Z,Rotschafer J C,Jones R N,et al.Polymyxins:wisdom does not always come with age[J].Clinical Infectious Diseases,2013,57(6):877-883.
[5]Kim K S,Kim T,Pan J G.In vitro evaluation of ciclopirox as an adjuvant for polymyxin B against gram-negative bacteria[J].Journal of Antibiotics,2015.
[6]Quei Yen L,Yi-Lin T,Ming-Che L,et al.Serratia marcescens arn,aPhoP-regulated locus necessary for polymyxin B resistance[J].Antimicrobial Agents & Chemotherapy,2014,58(9):5181-5190.
[7]Neiva L B D M,Fernanda Teixeira B,Mirian W,et al.Nephrotoxicity Of Polymyxin B:Experimental Study In Cells And Implications For Nursing Practice[J].Revista Da Escola De Enfermagem Da U S P,2014,48(2):272-277.
[8]Pogue J M,Cohen D A,Marchaim D.Polymyxin-Resistant Acinetobacter baumannii:Urgent Action Needed[J].Clinical Infectious Diseases,2015,60.
[9]Moffatt J H,Marina H,Ben A,et al.Insertion sequence ISAba11 is involved in colistin resistance and loss of lipopolysaccharide in Acinetobacter baumannii[J].Antimicrobial Agents & Chemotherapy,2011,55(6):3022-3024.
[10] Nigam A,Batra S.Colistin neurotoxicity:revisited[J].Case Reports,2015,2015.
[11] Kadar B,Kocsis B,Nagy K,et al.The Renaissance of Polymyxins.[J].Current Medicinal Chemistry,2013,20(30):3759-3773.
[12] José M,Elisa C,Jerónimo P.New information about the polymyxin/colistin class of antibiotics[J].Expert Opinion on Pharmacotherapy,2009,10(17):2811-2828.
[13] Sandri A M,Landersdorfer C B,Jacob J,et al.Population pharmacokinetics of intravenous polymyxin B in critically ill patients:implications for selection of dosage regimens[J].Clinical Infectious Diseases An Official Publication of the Infectious Diseases Society of America,2013,57(4):524-531.
[14] Pai M P.Polymyxin B Dosing in Obese and Underweight Adults[J].Clinical Infectious Diseases,2013,57(12):1785-1785.
[15] Molina J,Cordero E,Pachon J.New Information about the polymyxin/colistin class of antibiotics[J].Expert Opin Pharmacother,2009,10:2811-2828.
[16] Carl U,Noriel M,Rahal J J.In vitro double and triple bactericidal activities of doripenem,polymyxin B,and rifampin against multidrug-resistant Acinetobacter baumannii,Pseudomonas aeruginosa,Klebsiella pneumoniae,and Escherichia coli[J].Antimicrobial Agents & Chemotherapy,2010,54(6):2732-2734.
[17] Nathalie Grace C,Yvonne Peijun Z,Thuan Tong T,et al.Polymyxin B with dual carbapenem combination therapy against carbapenemase-producing Klebsiella pneumoniae[J].Journal of Infection,2014,70(3):309-311.
[18] Kim K S,Kim T,Pan J G.In vitro evaluation of ciclopirox as an adjuvant for polymyxin B against gram-negative bacteria [J].Journal of Antibiotics,2015.68,395-398.
[19] Walkty A,Decorby M,Nichol K,et al.In vitro activity of colistin (polymyxin E) against 3,480 isolates of gram-negative bacilli obtained from patients in Canadian hospitals in the CANWARD study,2007-2008[J].Antimicrobial Agents & Chemotherapy,2009,53(11):4924-4926.
[20] Abdelraouf K,Luan D T,Braggs K H,et al.Characterization of polymyxin B-induced nephrotoxicity:implications for dosing regimen design[J].Antimicrobial Agents & Chemotherapy,2012,56(9):4625-4629.
[21] Olaitan A O,Morand S,Rolain J M.Mechanisms of polymyxin resistance:acquired and intrinsic resistance in bacteria[J].Frontiers in Microbiology,2014,5:643-643.
[22] Julie Ann J,Bosso J A.Adverse Reactions Associated with Systemic Polymyxin Therapy[J].Pharmacotherapy the Journal of Human Pharmacology & Drug Therapy,2015,35(1):28-33.
[23] Nelson B C,Eiras D P,Gomez-Simmonds A,et al.Clinical Outcomes Associated with Polymyxin B Dose in Patients with Bloodstream Infections Due to Carbapenem-Resistant Gram-Negative Rods[J].Antimicrobial Agents & Chemotherapy,2015.
[24] Valencia R,Arroyo LA,Conde M,et al.Nosocomial outbreak of infection with pan-drug-resistant Acinetobacter baumannii in a tertiary care university hospital [J].Infect Control Hosp Epidemiol, 2009,30:257-263.
[25] Elias LS,Konzen D,Krebs JM,Zavascki AP.The impact of polymyxin B dosage on inhospital mortality of patients treated with this antibiotic [J].J Antimicrob Chemother, 2010, 65:2231-2237.
[26] Subissi A,Monti D,Togni G,et al.Ciclopirox:recent nonclinical and clinical data relevant to its use as a topical antimycotic agent[J].Drugs,2010,70,2133-2152.
[27] Michalopoulos AS,Karatza DC,Gregorakos L.Pharmacokinetic evaluation of colistin sodium[J].Expert Opinion on Drug Metabolism & Toxicology,2011,7:245-255.
[28] Loutet SA,Valvano MA.Extreme antimicrobial peptide and polymyxin B resistance in the genus Burkholderia [J] Front Microbiol,2011,2:159.
[29] He J,Ledesma KR,Lam W,et al.Variability of polymyxin B major components in commercial formulations[J].Int J Antimicrob Agents,2010,35:308-310.
[30] Tam VH,Cau H,Ledesma KR,Hu M.In vitro potency of various polymyxin B components [J].Antimicrob Agents Chemother,2011,55:4490-4491.
[31] Arnold TM,Forrest GN,Messmer KJ.Polymyxin antibiotics for gram-negative infections [J].Am J Health Syst Pharm,2007,64 (8):819-826.
[32] Hong JH,Clancy CJ,Cheng S,et al.Characterization of porin expression in Klebsiella pneumoniae carbapenemase (KPC)-producing K.pneumoniae identifies isolates most susceptible to the combination of colistin and carbapenems [J].Antimicrob Agents Chemother,2013,57:2147e53.
[33] Petrosillo N,E Ioannidou,E Falagas.Colistin monotherapy vs.combination therapy:evidence from microbiological,animal and clinical studies[J].Clin.Microbiol.Infect,2008,14:816-827.
[34] Kubin CJ,Ellman TM,Phadke V,et al.Incidence and predictors of acute kidney injury associated with intravenous polymyxin B therapy [J].J Infect,2012,65:80-87.
[35] Souli M,Rekatsina PD,Chryssouli Z,et al.Does the activity of the combination of imipenem and colistin in vitro exceed the problem of resistance in metallo-beta-lactamase-producing klebsiella pneumoniae isolates [J] Antimicrob Agents Chemother,2009,53:2133-2135.
[36] Falagas ME,Rafailidis PI,Matthaiou DK.Resistance to polymyxins:Mechanisms,frequency and treatment options [J].Drug Resist.Updat,2013,132-138.doi:10.1016.
[37] Poirel L,Jayol A,Bontron S,et al.The mgrB gene as a key target for acquired resistance to colistin in Klebsiella pneumoniae [J].J Antimicrob Chemother,2015,70(1):75-80.10.1093/jac/dku323.Epub 2014,3.
[38] Molina J,Cordero E,Pachon J.New Information about the polymyxin/colistin class of antibiotics [J].Expert Opin Pharmacother,2009,10:2811-2828.
[39] Spapen H,Jacobs R,VanGorp V,et al.Renal and neurological side effects of colistin in critically ill patients [J].Ann Intensive Care,2011,1:14.
[40] Giamarellou H,Poulakou G.Multidrug-resistant Gram-negative infections:what are the treatment options [J] Drugs,2009,69 (14):1879-901.
[41] Yuan Z,Tam VH.Polymyxin B:a new strategy for multidrug-resistant Gram-negative organisms [J].Expert Opin Investig Drugs,2008,17(5):661-8.doi:10.1517/13543784.17.5.661 .
基金项目:人事部科研基金(09958013),重庆市自然科学基金(CSTC2009BB5061)
通讯作者:袁喆,教授,本刊审稿专家,E-mail:yuanzhe-1030@163.com
【中图分类号】R 978.1
【文献标志码】A
doi:10.3969/j.issn.1672-3511.2016.07.035
(收稿日期:2015-11-10;编辑:陈舟贵)
Progress of polymyxin B research and treatment strategies
YAN Ke reviewingYUAN Zhe checking
(Key Laboratory of Infectious and Parasitic Diseases in Chongqing,Department of Infectious Diseases,The First Affiliated Hospital of Chongqing Medical University,Chongqing 400016,China)
【Abstract】The increasing prevalence of multidrug-resistant Gram-negative bacteria worldwide has led to a re-evaluation of the previously discarded antibiotic-polymyxin B.In vitro,polymyxin B has demonstrated excellent activity against various Gram-negative rod-shaped bacteria,including multidrug-resistant Pseudomonas aeruginosa,Acinetobacter baumannii and Klebsiella pneumoniae.However,data samples on clinic researches of Polymyxin B are lack,so studies on its pharmacodynamics and pharmacokinetics are deficient.Based on review of ten years’ related studies on Polymyxin B,this article summarizes Polymyxin B from various aspects,like chemical structure,action mechanism,drug-resistance mechanism,antimicrobial activity,clinical use,combination with other antibiotics and toxic effects,to provide reference for clinical application.
【Key words】Polymyxin B; Multidrug-resistant Gram-negative bacteria; Treatment strategies

