miR-126在乳腺癌中与VEGF表达关系及其抗肿瘤效果①
米旭光 李首庆 刘 多 魏海峰 江显卓 方艳秋
(吉林省人民医院肿瘤综合治疗科,长春130021)
miR-126在乳腺癌中与VEGF表达关系及其抗肿瘤效果①
米旭光李首庆刘多魏海峰江显卓方艳秋
(吉林省人民医院肿瘤综合治疗科,长春130021)
[摘要]目的:探讨miR-126与VEGF在乳腺癌中的表达情况,及miR-126发挥的抗肿瘤效果。 方法:以qRT-PCR检测和Western blot分析miR-126与VEGF在乳腺癌组织和细胞中的表达情况;以miR-126 mimics转染乳腺癌细胞株MDA-MB-231,检测miR-126对VEGF的表达影响,MTT法和细胞划痕实验验证miR-126对肿瘤细胞的增殖和迁移能力的影响。 结果:miR-126在乳腺癌组织和细胞中呈低表达,VEGF表达与其呈负相关,上调miR-126可以降低VEGF的表达,抑制乳腺癌细胞的增殖和迁移能力。 结论:miR-126可以通过下调VEGF表达来实现降低乳腺癌细胞的增殖和迁移能力,从而发挥抗肿瘤效果。
[关键词]miR-126;VEGF;乳腺癌
乳腺癌是中国女性最常见的癌症,是第六大中国女性癌症的死亡原因。寻找特异性的治疗靶点和有效的治疗方法一直是克服乳腺癌的研究方向。microRNA是长约22个核苷酸的非编码RNA,可以使靶基因mRNA降解或抑制其翻译来影响靶基因的表达,参与肿瘤细胞的分化、增殖和凋亡,与肿瘤的发生、发展、转移、侵袭、复发和预后都有着重要的关系[1]。血管内皮生长因子(Vascular endothelial growth factor,VEGF)可以促进肿瘤血管生成,增强乳腺癌细胞的增殖、转移和复发[2]。VEGF受到多种microRNA的直接或间接调控,调节某些特异性的microRNA的表达可能成为抗VEGF治疗肿瘤的新手段。抑癌基因miR-126被证实与乳腺癌肿瘤血管形成密切相关,本研究将探讨miR-126在乳腺癌细胞中对VEGF基因表达的影响及由此发挥的抗肿瘤效果。
1材料与方法
1.1细胞株与试剂人乳腺癌细胞株MDA-MB-231、MCF-7、HCC1806、CAL-120、JIMT-1为本实验室冻存;胎牛血清、RPMI medium 1640、DMEM培养基(Gibco,美国);Trizol 、LipofectamineTM2000(Life Technologies,美国);Has-miR-126 mimics及阴性对照Cel-miR-67 mimics(上海百奥迈科,中国);miR-126、U6、VEGF和GAPDH引物(上海生工,中国);RT-PCR试剂盒(Promega,美国);SYBR Green Master(Roche,瑞士);鼠抗人VEGFA抗体(Abcam,美国);马抗鼠IgG(CST,美国);GAPDH抗体(Santa,美国);其他常规试剂产自北京化工。
1.2标本采集留取2013年3月至2014年3月吉林省人民医院乳腺癌手术标本5例,包括癌组织5例和正常组织块2例(距离癌灶>3 cm且病理证实无癌细胞残留)。组织样本取出后剪碎尽快放入液氮速冻,之后放入-80℃冰箱冻存。
1.3实验方法
1.3.1细胞培养和脂质体转染乳腺癌细胞株MDA-MB-231使用含10% FBS,100 μg/ml链霉素及100 U/ml青霉素的DMEM(高糖)培养基培养;CAL-120细胞使用含20%FBS的双抗DMEM培养基;MCF-7、HCC1806、JIMT-1细胞株使用含双抗的RPMI medium 1640培养基。细胞培养条件为37℃,5% CO2和100%饱和湿度的细胞培养箱。用于转染的细胞,在转染前1 d细胞生长丰度达到70%~80%时,胰酶消化转至细胞培养板中,以2×105个/孔接种细胞(以MDA-MB-231细胞,6孔细胞培养板为例)。转染当天细胞丰度可达60%~70%。每孔转染miR-126 mimics 5 μl(终浓度为50 nmol/L),具体操作步骤如LipofectamineTM2000说明书。转染后48 h,提取RNA或蛋白用于后续实验。
1.3.2总RNA提取和qRT-PCR检测用Trizol法提取乳腺癌组织、癌旁正常组织和乳腺癌细胞株总RNA。紫外分光光度计测量纯度和浓度。按逆转录说明书将1 μg RNA逆转录为cDNA。得到的cDNA 5倍稀释用于荧光定量反应。使用2×SYBR Green Master在ABI7500荧光定量PCR仪上测定。miR-126表达以U6作为内参,VEGF表达以GAPDH为内参。结果以2-△△Ct表示mRNA拷贝数比值。
Hsa-miR-126:颈环引物5′-GTCGTA TCCAG TGCAG GGTCC GAGGT ATTCG CACTG GATAC GACCG CATT-3′;miR-126-3p forward primer:5′-GTCTC GTACC GTGAG TAAT-3′;miRNA Universal reverse primer:5′-GTGCA GGGTC CGAGGT-3′;U6 forward primer:5′-CTCGC TTCGG CAGCA CA-3′,reverse primer:5′-AACGC TTCAC GAATT TGCGT-3′;VEGF forward primer:5′-CGAAG TGGTG AAGTT CATGG-3′,reverse primer:5′-GTACT CGATC TCATC AGGGT-3′;GAPDH forward primer:5′-CAATG ACCCC TTCAT TGACC-3′,reverse primer:5′-GACAA GCTTC CCGTT CTCAG-3′。
1.3.3蛋白样本制备和免疫印迹分析取100 mg组织标本加入500 μl组织蛋白裂解液匀浆后,4℃,12 000 r/min离心10 min,取上清。乳腺癌细胞每孔加入80 μl细胞裂解液重悬细胞,4℃,12 000 r/min离心10 min,取上清。核酸蛋白分析仪测定蛋白浓度后,加入5×上样缓冲液混匀,煮沸10 min,离心取上清。聚丙烯酰胺凝胶电泳后,转膜,封闭液中封闭2 h,VEGF和GAPDH一抗4℃过夜,酶标二抗室温2 h,显色,拍照。
1.3.4细胞增殖实验(MTT法)将处于生长对数期的乳腺癌细胞株MDA-MB-231以7.5×103个/孔的密度接种于96孔细胞培养板中。次日,板中待转染细胞丰度达50%~60%,转染miR-126 mimics 及阴性对照(NC),每孔0.25 μl(终浓度为50 nmol/L),设5复孔。转染5 h后换完全培养液,分别于转染换液后0、24、48、72 h每孔加入20 μl MTT溶液(MTT浓度为5 μg/ml的PBS溶液),37℃避光培养4 h后,移除培养液,每孔加入100 μl DMSO,水平振荡10 min,放入酶标仪中检测转染组与对照组波长490nm处的光吸收值。
1.3.5细胞划痕实验6孔板培养MDA-MB-231细胞,次日细胞丰度达60%~70%时转染miR-126 mimics 及阴性对照(NC),每孔5 μl(终浓度为50 nmol/L),转染5 h后细胞培养孔以细枪头十字划痕,轻晃培养板,换液后拍摄转染0 h细胞划痕图像,24 h、48 h后同样拍摄。
2结果
2.1miR-126在乳腺癌组织和细胞中的表达2例正常乳腺组织和5例乳腺癌组织提取RNA,逆转录后qRT-PCR检测miR-126在正常乳腺组织和乳腺癌组织中的表达情况(U6作为内参)。如图1A,与正常乳腺组织相比,乳腺癌组织miR-126表达明显降低(P<0.05)。
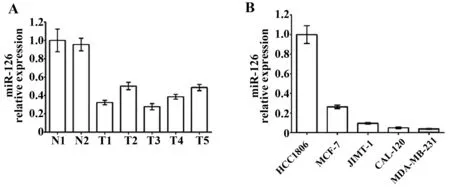
图1 miR-126在乳腺癌组织和细胞中的表达差异Fig.1 Expression of miR-126 in breast cancer tissues and cellsNote: A.qRT-PCR analysis of miR-126 expression in five human breast cancer tissues(T1-T5) vs.the distant non-tumor tissues(N1-N2);B.qRT-PCR analysis of miR-126 expression in five human breast cancer cell lines.
乳腺癌细胞株MDA-MB-231、MCF-7、HCC1806、CAL-120、JIMT-1分别提取RNA,逆转录后qRT-PCR检测miR-126在乳腺癌细胞中的表达情况。以表达miR-126最高的HCC1806细胞株为参照,各细胞株miR-126的相对表达情况如图1B。
2.2乳腺癌细胞中VEGF的表达乳腺癌细胞株MDA-MB-231、MCF-7、HCC1806、CAL-120、JIMT-1分别提取RNA,逆转录后qRT-PCR检测VEGF在乳腺癌细胞中的mRNA表达水平。以表达VEGF最高的MDA-MB-231细胞株为参照,各细胞株VEGF表达情况如图2。
结果显示,在几种乳腺癌细胞株中, VEGF mRNA 的表达与miR-126呈负相关。其中,miR-126表达最高的HCC1806细胞株,VEGF mRNA 表达水平最低;而miR-126表达最低的高侵袭性的MDA-MB-231细胞株,VEGF mRNA 表达水平最高。
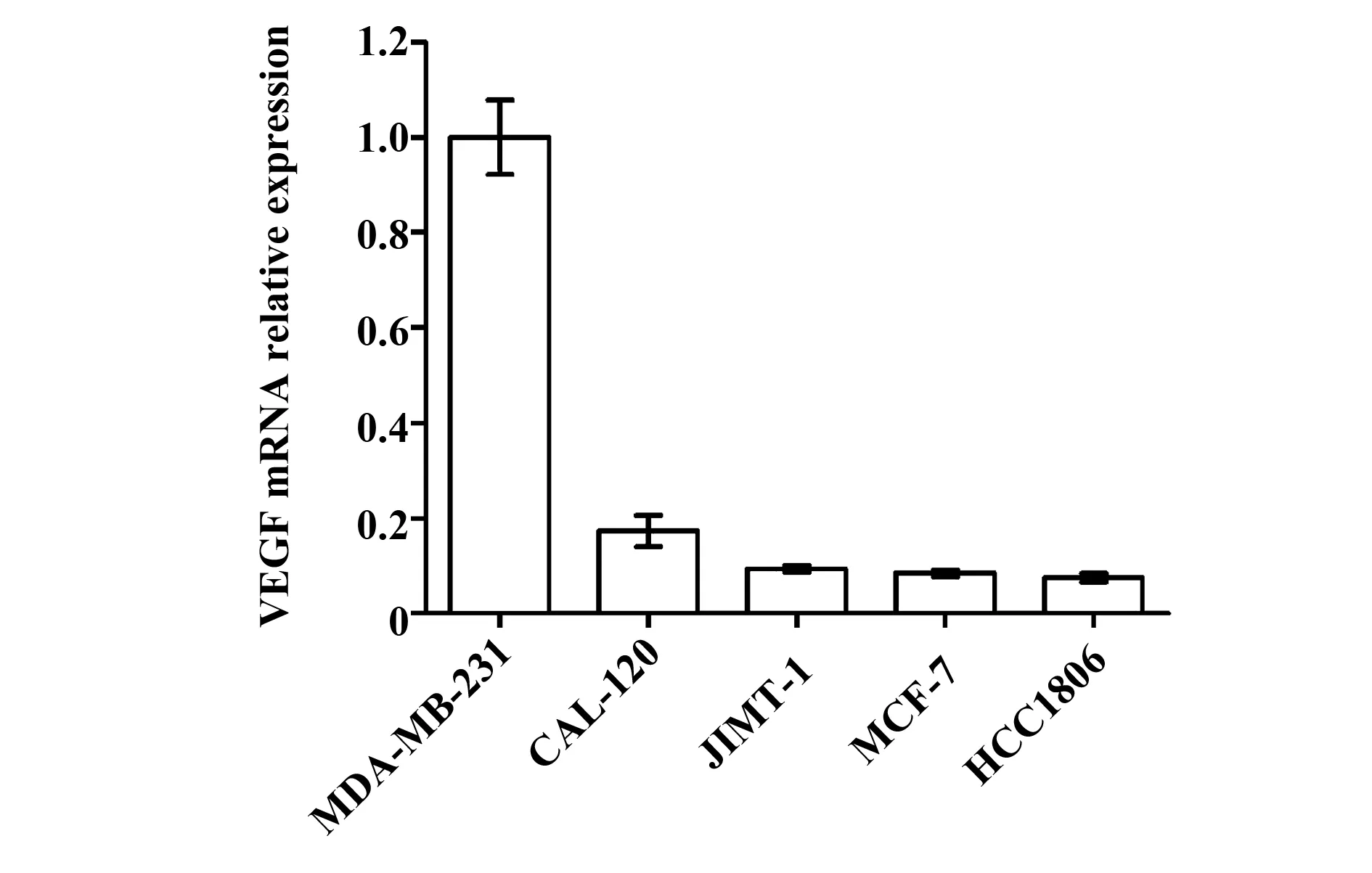
图2 VEGF在乳腺癌细胞中的表达差异Fig.2 Expression of VEGF in breast cancer cells
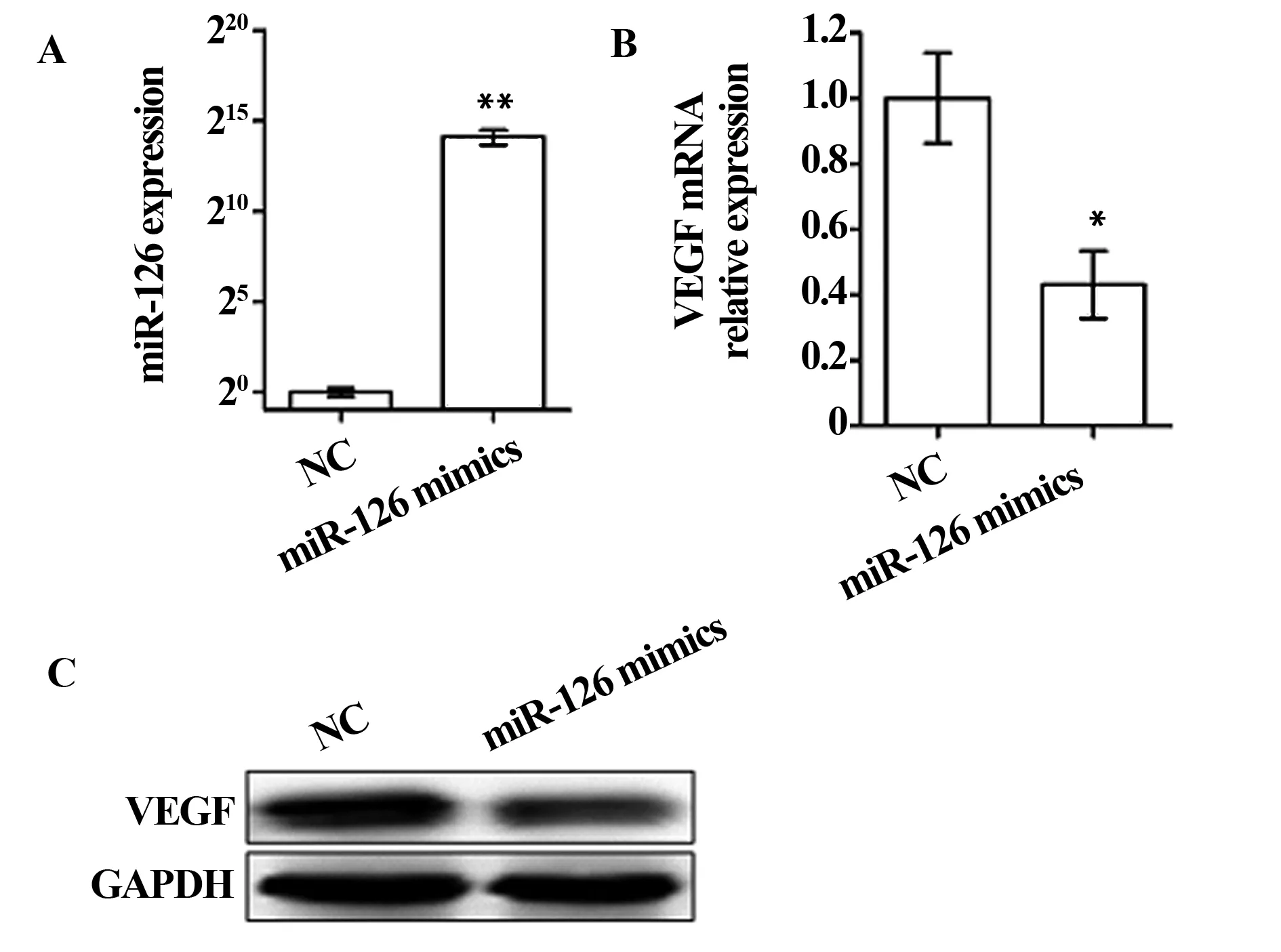
图3 miR-126对MDA-MB-231细胞株中VEGF表达影响Fig.3 Effect of miR-126 on VEGF in MDA-MB-231 cellsNote: A.miR-126 expression after miR-126 mimics transfected;B.VEGF mRNA expression after miR-126 mimics transfected;C.VEGF protein expression after miR-126 mimics transfected.
2.3miR-126对VEGF表达的影响miR-126 mimics 50nm转染MDA-MB-231细胞株48 h后,提取细胞RNA和细胞蛋白,进行qRT-PCR检测和Western blot分析。结果显示,miR-126 mimics转染后,miR-126表达显著升高(P<0.01)(图3A),而VEGF mRNA表达水平明显降低(P<0.05)(图3B)。蛋白印迹分析显示,miR-126表达升高的情况下,VEGF蛋白表达明显下降(图3C)。
2.4miR-126对乳腺癌细胞增殖能力的影响MTT增殖实验结果显示,MDA-MB-231细胞转染miR-126 mimics 50nm 48 h后,细胞增殖能力明显低于对照(NC)组(P<0.05),转染72 h差别显著(P<0.01)(图4)。VEGF可以促进肿瘤细胞的增殖,miR-126表达增高时VEGF表达下调,细胞增殖能力下降。
2.5miR-126对乳腺癌细胞迁移能力的影响划痕实验结果显示,MDA-MB-231细胞转染miR-126 mimics 50nm 24 h后,细胞迁移能力明显低于对照(NC)组(P<0.05),转染48 h差别显著(P<0.01)(图5)。VEGF可以增强肿瘤细胞的转移能力,miR-126表达增高时VEGF表达下调,细胞迁移能力下降。
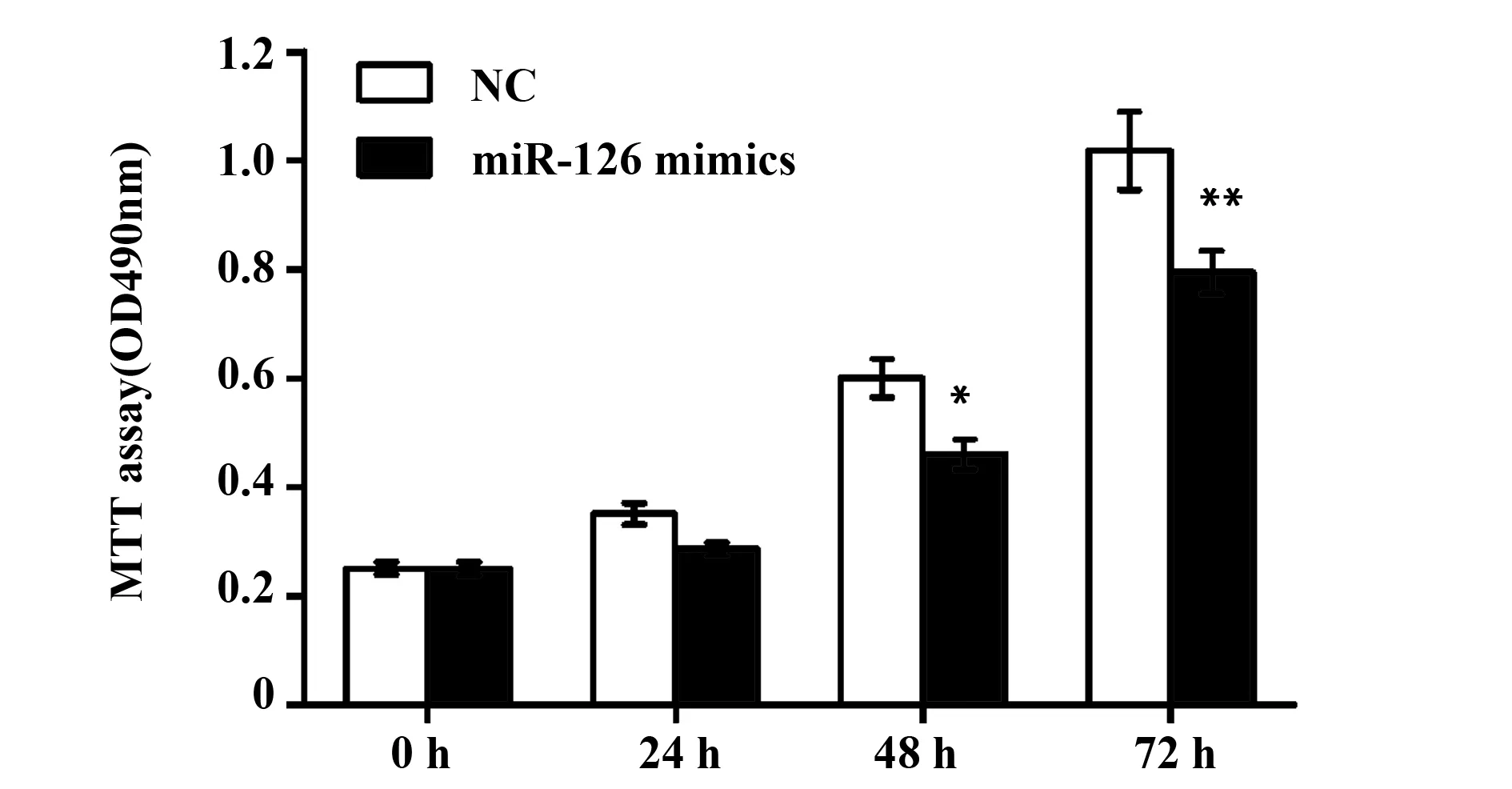
图4 miR-126对MDA-MB-231细胞增殖影响Fig.4 Effect of miR-126 on MDA-MB-231 cell proliferation
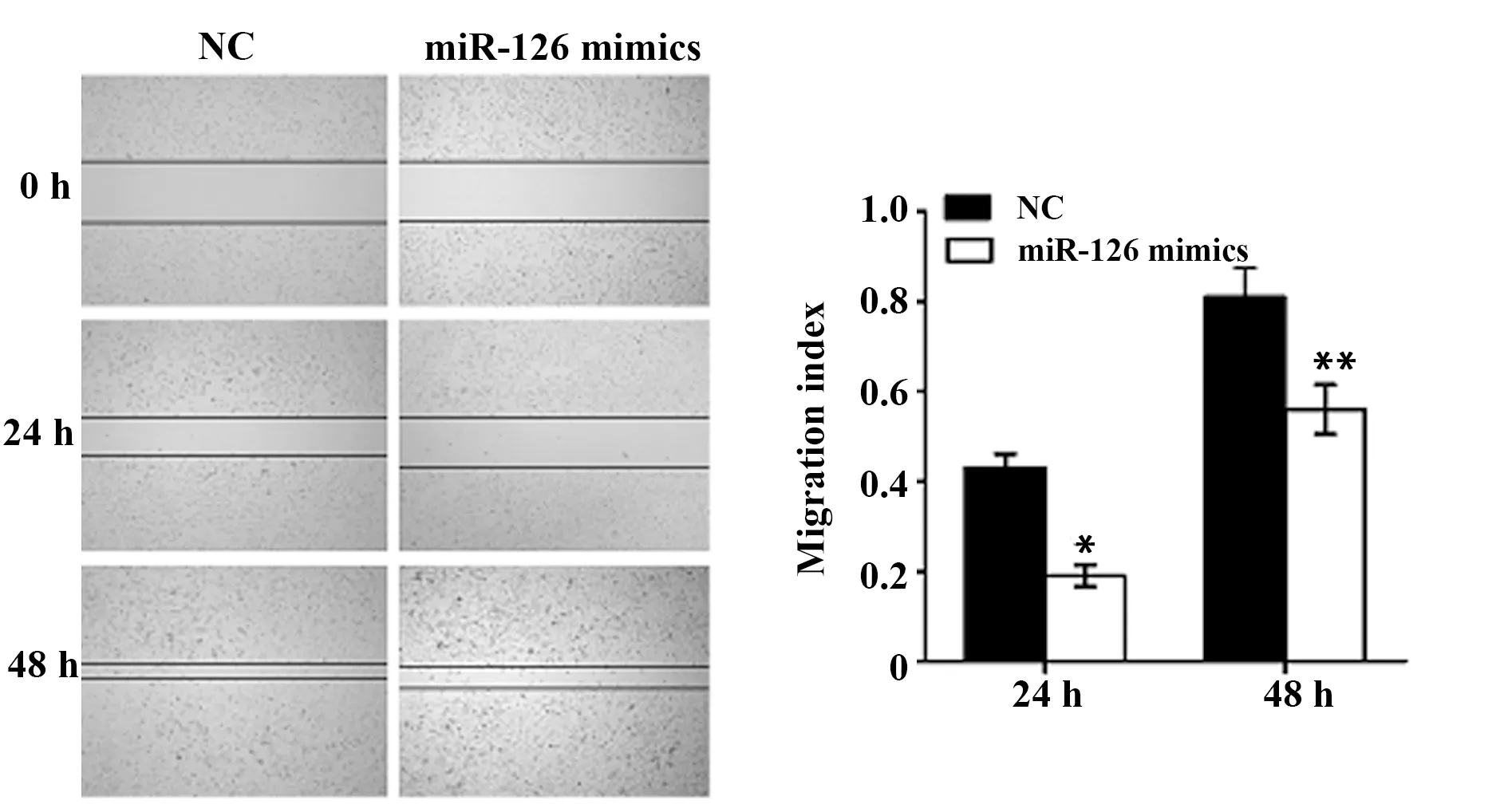
图5 miR-126对MDA-MB-231细胞迁移能力影响Fig.5 Effect of miR-126 on MDA-MB-231 cell migration
3讨论
miRNA在肿瘤的发生发展中起到癌基因或抑癌基因的作用[3,4]。有抑癌基因作用的miR-126在大部分肿瘤组织中呈低表达,肿瘤的发生、发展与其表达的降低和缺失相关,其在肿瘤的诊断、治疗及预后判断等方面均具有潜在价值。研究发现[5-13],miR-126 可抑制结肠癌细胞生长;抑制非小细胞肺癌细胞的增殖;抑制胃癌细胞的增殖、侵袭和转移;且其表达水平与肝癌复发后生存率呈正相关; miR-126 是乳腺癌转移的抑制因子,可抑制乳腺癌细胞的细胞周期进程,其缺失易导致预后不良和肿瘤复发。由此说明,miR-126在多种肿瘤中发挥着抑癌作用,miR-126表达增高可以抑制肿瘤细胞的增殖、侵袭和转移,降低复发率和提高生存率。
本研究中显示,乳腺癌组织中miR-126的表达明显低于正常乳腺组织的表达(P<0.05),与同类研究结果相同。在本研究中不同侵袭力的乳腺癌细胞株miR-126的表达也显示出差异,即侵袭力强的乳腺癌细胞株miR-126表达明显降低,如MDA-MB-231细胞株。侵袭和转移能力是衡量肿瘤恶性程度的一个重要标准,所以与乳腺癌转移相关的miRNA也得到重视。本文研究的miR-126可以抑制肿瘤细胞生长和侵袭,但其作用的靶点和机制在现有研究基础上仍需要深入研究。
肿瘤血管的形成是肿瘤可以生长、侵袭和转移的必备条件之一,VEGF是肿瘤血管生成过程中作用最强、特异性最高的促血管生长因子,在肺癌、宫颈癌等多种人类恶性肿瘤中都有较高水平的表达。Liu等[14]发现编码VEGF-A mRNA3′的非编码区有miR-126 的结合位点,本研究显示,miR-126表达最高的HCC1806细胞株,其VEGF mRNA的表达也是最低的。且在人为的调高MDA-MB-231细胞株中miR-126表达后,VEGF mRNA和蛋白水平上的表达均降低,且乳腺癌细胞的增殖和侵袭水平也明显降低。我们由此推论,转染miR-126模拟物使乳腺癌细胞中miR-126表达上调,使得VEGF表达水平明显降低,miR-126抑制乳腺癌细胞增殖和侵袭的作用可能是通过下调VEGF表达来实现的。
综上所述,miR-126可作为乳腺癌的一个重要抑癌基因,其表达上调可使增强肿瘤微血管形成相关的VEGF基因表达降低,进而发挥抑制乳腺癌发展和转移的功能,即miR-126可成为乳腺癌诊断、治疗及复发预后等的重要参考指标。
参考文献:
[1]Bartel DP.MicroRNAs:target recognition and regulatory functions [J].Cell,2009,136(2):215-233.
[2]Luo HQ,Xu M,Zhong WT,etal.EGCG decreases the expression of HIF-1α and VEGF and cell growth in MCF-7 breast cancer cells[J].J BUON,2014,19(2):435-439.
[3]Li H,Yang BB.MicroRNA-regulated stress response in cancer and its clinical implications[J].Cell Cycle,2013,12(13):1983-1984.
[4]Vrba L,Jensen TJ,Garbe JC,etal.Role for DNA methylation in the regulation of miR-200c and miR-141 expression in normal and cancer cells[J].PLoS One,2010,5(1):e8697.
[5]Ahmed FE,Jeffries CD,Vos PW,etal.Diagnostic microRNA markers for screening sporadic human colon cancer and active ulcerative colitis in stool and tissue[J].Cancer Genomics Proteomics,2009,6(5):281-295.
[6]Guo C,Sah JF,Beard L,etal.The noncoding RNA,miR-126,suppresses the growth of neoplastic cells by targeting phosphatidylinositol 3-kinase signaling and is frequently lost in colon cancers [J].Genes Chromosomes Cancer,2008,47(11):939-946.
[7]Sun Y,Bai Y,Zhang F,etal.miR-126 inhibits non-small cell lung cancer cells proliferation by targeting EGFL7[J].Biochem Biophys Res Commun,2010,391(3):1483-1489.
[8]Hansen TF,Srensen FB,Lindebjerg J,etal.The predictive valuer of microRNA-126 in relation to first line treatment with capecitabine and oxaliplatin in patients with metastatic colorectal cancer[J].BMC Cancer,2012,12:83.
[9]Yang Z,Wang R,Zhang T,etal.MicroRNA-126 regulates migration and invasion of gastric cancer by targeting CADM1[J].Int J Clin Exp Pathol,2015 ,8(8):8869-8880.
[10]Han ZB,Zhong L,Teng MJ,etal.Identification of recurrence-related microRNAs in hepatocellular carcinoma following liver transplantation[J].Mol Oncol,2012,6(4):445-457.
[11]Yin J,Bai Z,Song J,etal.Differential expression of serum miR-126,miR-141 and miR-21 as novel biomarkers for early detection of liver metastasis in colorectal cancer[J].Chin J Cancer Res,2014,26(1):95-103.
[12]Tavazoie SF,Alarcón C,Oskarsson T,etal.Endogenous human microRNAs that suppress breast cancer metastasis[J].Nature,2008,451(7175):147-152.
[13]Wang CZ,Yuan P,Li Y.MiR-126 regulated breast cancer cell invasion by targeting ADAM9.[J].Int J Clin Exp Pathol,2015,8(6):6547-6553.
[14]Liu B,Peng XC,Zheng XL,etal.MiR-126 restoration down-regulate VEGF and inhibit the growth of lung cancer cell lines in vitro and in vivo[J].Lung Cancer,2009,66(2):169-175.
[收稿2015-11-09修回2015-11-30]
(编辑倪鹏)
doi:10.3969/j.issn.1000-484X.2016.07.015
作者简介:米旭光(1983年-),男,博士,助理研究员,主要从事肿瘤靶向治疗研究,E-mail:mixg699@163.com。 通讯作者及指导教师:方艳秋(1968年-),女,教授,硕士生导师,主要从事肿瘤综合治疗的科研及临床工作,E-mail:yq.fang@163.com。
中图分类号R735.7
文献标志码A
文章编号1000-484X(2016)07-1000-04
MiR-126 expression relationship with VEGF in breast cancer and its anti-tumor effect
MI Xu-Guang,LI Shou-Qing,LIU Duo,WEI Hai-Feng,JIANG Xian-Zhuo,FANG Yan-Qiu.
Tumor Comprehensive Treatment Department,Jilin Province People′s Hospital,Changchun 130021,China
[Abstract]Objective:To probe the expression of miR-126 and VEGF in breast cancer,and the anti-tumor effect of miR-126.Methods: The expression of miR-126 and VEGF in breast cancer tissues and cells were detected by qRT-PCR and Western blot;after transfection with miR-126 mimics into MDA-MB-231,expression of VEGF was detected again,MTT assay and cell scratch test were used to verify the influence of miR-126 on proliferation and migration of tumor cells.Results: The expression of miR-126 was lower in the breast cancer tissues and cells,the expression of VEGF was negative correlation with it,increasing the expression of miR-126 may decrease the expression of VEGF and inhibit the proliferation and migration of breast cancer cells.Conclusion: miR-126 can reduce the proliferation and migration of breast cancer cells by inhibiting the expression of VEGF,which play an anti-tumor effect.
[Key words]miR-126; VEGF;Breast cancer
①本文由吉林省卫生厅科技计划项目(No.2012Z080;2014Z012)、长春市社会发展科技计划项目(No.2012129-12SF57)和吉林省科技发展计划项目(No.20140519018JH;20122113)资助。

