饥饿对菲律宾蛤仔消化酶活力与抗氧化能力的影响
李林明,王灿华,何亮华
(福建农林大学动物科学学院 350002)
饥饿对菲律宾蛤仔消化酶活力与抗氧化能力的影响
李林明,王灿华,何亮华
(福建农林大学动物科学学院350002)
摘要:以淀粉酶活力、纤维素酶活力和总抗氧化能力为指标,研究饥饿与再投喂期间菲律宾蛤仔消化能力和抗氧化能力的变化,结果表明:饥饿与再投喂对菲律宾蛤仔抗氧化能力无显著影响,但可提高其消化能力;蛤仔淀粉酶、纤维素酶活力呈现随饥饿时间延长而下降的趋势,饥饿阶段各组消化酶活力在第3 d开始迅速大幅下降;恢复投喂后各组纤维素酶和淀粉酶活力均有不同程度的升高,并在3 d内分别恢复到饥饿第1 d和第2 d的水平;试验期间各组蛤仔总抗氧化能力无显著变化(P<0.05)。
关键词:菲律宾蛤仔;饥饿;再投喂;消化酶活力;总抗氧化能力
菲律宾蛤仔营养丰富、味道鲜美,是一种适宜高密度养殖的优良贝类。菲律宾蛤仔繁殖和人工育苗始于20世纪70年代,2004年福建省的菲律宾蛤仔规模化人工育苗关键技术取得突破性成果,为蛤仔的养殖提供了技术支撑[1]。学者们把动物在饥饿后恢复正常摄食后表现出超过正常摄食时的生长速率的现象定义为补偿性生长现象[2]。目前许多学者已对畜禽类动物中的补偿生长现象进行了广泛研究,并通过投饲方式的改变而获得额外的经济效益。研究水生动物补偿生长的现象和机制不仅能为渔业资源合理利用提供指导,也可为水产动物生理学提供理论依据[3]。
在受到饥饿胁迫时,鱼类为了维持生命,由神经内分泌系统调节体内各种代谢酶的活性,从而有效利用体内贮存的营养物质[4]。国内学者研究发现,鱼类的补偿生长与许多代谢酶的活性有着密切的关系。饥饿对鲤、虎鲨和施氏鲟幼鱼的不同消化酶有不同的影响[5-7]。目前,国内通过饥饿再投喂对水产动物补偿生长现象的研究主要集中在鱼类和甲壳类上,贝类方面的相关研究尚不多见,闫喜武等[8]研究了冬季饥饿对菲律宾蛤仔生存和生化组成的影响,何毛贤等[9]研究了珠母贝饥饿补偿生长的现象,章承军等[10]研究了饥饿对缢蛏消化酶活力和抗氧化作用的影响。本研究通过分析饥饿与再投喂状态下菲律宾蛤仔体内各种消化酶的活力和抗氧化能力的变化,研究其补偿生长现象及其机制, 揭示其适应胁迫的生理状态,为改善蛤仔养殖技术提供理论依据。
1材料与方法
1.1试验动物
菲律宾蛤仔取自福建省莆田市太湖胜利垦区养殖场;用海水清洗后暂养于水族箱,投喂硅藻;暂养5 d后选择正常生活、湿重(8.24±0.38)g、壳长(31.49±1.07)mm的蛤仔100粒,放置在控温水族箱中,每箱水量30 L,水温(22±1)℃,比重1.020。
1.2样品采集和处理
试验开始后停止喂食5 d,后继续投喂3 d。每天上午10:00从水族箱中随机取出8个蛤仔。撬开贝壳解剖蛤仔,将内脏团置于离心管内,并冰浴,将与内脏团等体积、预冷的生理盐水加入离心管,在冰浴条件下研碎成组织匀浆液,用SIGMA2-16型台式冷冻离心机离心15 min(8000 r/min、-14℃),上清液即为粗酶液。
1.3测定方法
1.3.1总蛋白测定总蛋白测定采用考马斯亮蓝法[11]。配置牛血清白蛋白0.1 mg/mL标准溶液,加入5 mL考马斯亮蓝染液,反应3 min,检测OD595,绘制标准曲线。取0.1 mL酶液,用生理盐水稀释至1 mL,加入5 mL染液,3 min后检测OD595。计算蛋白质含量。
1.3.2淀粉酶活性测定淀粉酶活性的定义:组织中每毫克蛋白在37℃下与底物作用30 min,水解10 mg淀粉定义为1个淀粉酶活力单位。淀粉酶活性采用南京建成生产的试剂盒测定。
1.3.3纤维素酶活性测定纤维素酶活性的定义:在上述条件下,每分钟催化纤维素水解生成1 μg葡萄糖所需的酶量为1个单位。纤维素酶活性测定使用章承军改良的CMC法[10,12],分别取5%底物羧甲基纤维素钠2 mL和上述粗酶液1 mL在40℃水浴预热3 min,并混匀;继续进行40℃水浴10 min,使其糖化;立即加入显色剂DNS 2 mL, 摇匀后置于沸水浴5 min,使酶失活;冷却后加入蒸馏水15 mL,使用上海光谱722型分光光度计520 nm测量吸光度。
1.3.4 总抗氧化能力测定总抗氧化能力定义:37℃ 时,每分钟每毫克组织蛋白使反应体系的吸光度值每增加0.01为1个总抗氧化能力单位。总抗氧化能力测定使用南京建成生产的试剂盒测定。
1.4数据分析
试验数据采用SPSS13.0系统进行方差分析。
2结果与分析
2.1饥饿过程中菲律宾蛤仔消化酶活力及抗氧化能力的变化
从表1可见,淀粉酶和纤维素酶活力呈现随饥饿时间延长而下降的趋势。饥饿初期(1~2 d)蛤仔淀粉酶活力稍有下降,变化较小;第3 d蛤仔淀粉酶活力明显下降,其中淀粉酶活力单位为0.25±0.03,与第1 d、第2 d差异达显著水平;第4 d淀粉酶活力继续下降,第5 d稍有下降。第1~5 d纤维素酶活力呈逐渐降低的趋势,第4~5 d下降幅度较大。饥饿1~5 d菲律宾蛤仔的抗氧化能力稍有下降,但下降趋势不明显,各处理总抗氧化能力变化差异不显著 (P>0.05)。
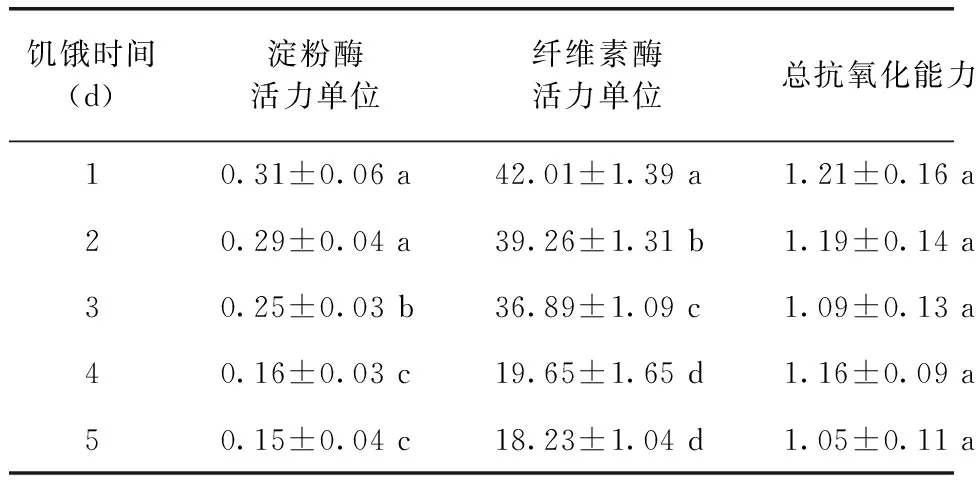
表1 饥饿对菲律宾蛤仔消化酶活力及抗氧化能力的影响
2.2再投喂过程中菲律宾蛤仔消化酶活力及抗氧化能力的变化
从表2可见,恢复投喂后蛤仔淀粉酶活力迅速升高,投喂第1 d淀粉酶活力明显提高,投喂3 d达到饥饿1 d时的淀粉酶活力水平。恢复投喂后纤维素酶活力也呈上升趋势,投喂3 d后纤维素酶活力恢复到饥饿2 d的水平。此外,恢复投喂后,菲律宾蛤仔总抗氧化能力变化不显著。

表2 饥饿后再投喂对菲律宾蛤仔消化酶活力及抗氧化能力的影响
3小结与讨论
本试验研究了饥饿与再投喂期间菲律宾蛤仔消化能力和抗氧化能力的变化过程,结果表明:饥饿对菲律宾蛤仔的淀粉酶、纤维素酶活性均产生影响,淀粉酶、纤维素酶活力随饥饿时间延长而下降。恢复投喂后消化酶迅速提高,两种消化酶分别恢复到饥饿1~2 d时的活力水平。此外,饥饿和恢复投喂后蛤仔总抗氧化能力无显著变化(P<0.05)。说明饥饿与再投喂对菲律宾蛤仔抗氧化能力无显著影响。
饥饿对菲律宾蛤仔的淀粉酶、纤维素酶活性均产生影响。饥饿初期消化酶活力均大幅下降,下降到一定程度后,继续饥饿消化酶活力变化趋于平缓。说明蛤仔对饥饿胁迫较为敏感,缺乏饵料会在短时间内显著降低消化酶活力。樊启学等[13]研究了饥饿与再投喂期间翘嘴鲌幼鱼肠道的不同部位和肝胰脏消化酶活性,发现饥饿会导致消化酶活性显著下降,而如果继续保持饥饿,酶活性下降不显著。钱云霞等[14]对鲈鱼研究发现,食物缺乏会导致消化道各部位蛋白酶活性不同程度的下降。区又君等[4]对千年笛鲷幼鱼的研究结果表明,在饥饿过程中,蛋白酶和脂肪酶活性下降明显,淀粉酶起伏较大。此外,也有学者的研究结果不尽相同,王燕妮等[5]发现,鲤鱼的淀粉酶活性在饥饿胁迫后会大幅上升;郑曙明等[6]研究发现,在饥饿初期虎鲨淀粉酶活性显著下降,持续饥饿后,其活性又迅速上升;高露姣等[7]研究发现,饥饿7 d后,施氏鲟消化道和肝胰脏的消化酶活性均显著下降,持续饥饿,部分酶活性出现不同程度的上升。出现以上这些不同变化的原因可能是由于水生动物在饥饿时机体发生适应性变化,通过神经内分泌系统改变身体各种酶的活性,调节代谢速率,并积极利用体内的贮存物质适应饥饿应激以维持生命。
前人的研究发现,饥饿后恢复投喂能显著提高水生动物的消化酶活力,但不同物种恢复的程度不同。章承军等[10]对缢蛏消化酶活力的研究表明,恢复投喂后各组消化酶活力在1~4 d升至显著高于饥饿前水平;李代金等[15]对黑尾近红鲌幼鱼体消化酶的研究表明,饥饿时间过长后再投喂黑尾近红鲌幼鱼的消化酶活力很难恢复到饥饿前水平[16]。本试验结果表明,虽然在恢复投喂的3 d内菲律宾蛤仔的2种消化酶活力都显著上升,但纤维素酶没有恢复到饥饿1 d的水平,这说明短期(3 d)恢复投喂只能使消化活力得到部分恢复。
饥饿可通过诱导基因表达影响神经内分泌系统进而影响生物的免疫、抗氧化能力与生殖等各方面机能。饥饿过度会引起机体免疫机能的下降。随着饥饿时间延长,肝脏、胰脏和消化道的营养物质和抗氧化物质消耗殆尽,使总抗氧化能力降低[16]。本试验中菲律宾蛤仔饥饿后再投喂机体抗氧化能力均未出现明显下降,说明试验中的饥饿程度对机体的抗氧化水平未产生显著影响。
参考文献:
[1]翁国新.菲律宾蛤仔大水面人工育苗技术[J].福建水产,2006,12(4):85.
[2]谢小军,邓利,张波.饥饿对鱼类生理生态学影响的研究进展[J].水生生物学报,1998,22(2):181-188.
[3]吴立新,董双休.水产动物继饥饿或营养不足后的补偿生长研究进展[J].应用生态学报,2000,11(6):943-946.
[4]区又君,刘泽伟.饥饿和再投喂对千年笛鲷幼鱼消化酶活性的影响[J].海洋学报,2007,29(1):86-90.
[5]王燕妮,张志蓉,郑曙明,等.鲤鱼的补偿性生长及饥饿对淀粉酶的影响[J].水利渔业,2001,21(5):6-7.
[6]郑曙明,王燕妮,聂迎霞,等.虎鳖饥饿后的补偿生长及淀粉酶活性研究[J].华中农业大学学报,2003,22(5):483-487.
[7]高露姣,陈立侨,赵晓勤,等.施氏鲟幼鱼的饥饿和补偿生长研究——对消化器官结构和酶活性的影响[J].中国水产科学,2004,11(5):413-419.
[8]闫喜武,姚托,张跃环,等.冬季饥饿再投喂对菲律宾蛤仔生长、存活和生化组成的影响[J].应用生态学报,2009,20(12):3063-3069.
[9]何毛贤,袁涛,黄良民.马氏珠母贝饥饿补偿生长的初步研究[J].热带海洋学报,2010,29(6):143-146.
[10]章承军,刘健,陈锦辉,等.饥饿再投喂对缢蛏消化酶活力和抗氧化能力的影响[J].水产学报,2010(7):1106-1112.
[11]周顺伍.动物生物化学实验指导[M].北京:中国农业出版社,2002.
[12]王琳.DNS法测定纤维素酶活力最适条件研究[J].河南师范大学学报:自然科学版,1998,26(3):66-69.
[13]樊启学,程鹏,刘文奎.饥饿和再投喂对翘嘴鲌幼鱼消化酶活性的影响[J].中国水产科学,2008,15(3):439-444.
[14]钱云霞.饥饿对养殖鲈蛋白酶活力的影响[J].水产科学,2002,21(3):6-7.
[15]李代金,黄辉,谭德清,等.饥饿和再投喂对黑尾近红鲌幼鱼体成分、消化酶活性和RNA/DNA比值的影响[J].淡水渔业,2010,40(6):27-32.
[16]刘波,何庆国,唐永凯,等.饥饿胁迫对吉富罗非鱼生长及生理生化指标的影响[J].中国水产科学,2009,16(2):230-237.
(责任编辑:林玲娜)
收稿日期:2015-11-13
作者简介:李林明,男,1985年生,助理实验师。
DOI:10.13651/j.cnki.fjnykj.2016.01.007
Effect of starvation on digestive enzyme activity and antioxidant capacity ofRuditapesphilippinarum
LI Lin-ming, WANG Can-hua, HE Liang-hua
(CollegeofAnimalScience,FujianAgricultureandForestryUniversity,FujianProvince350002)
Abstract:In this paper, dynamic changes of digestive enzyme activity and total antioxidant capacity of Ruditapes philippinarum in starvation and re-feeding durations were studied with amylase activity, cellulose activity and total antioxidant capacity as indices. The results showed that no significant effect on antioxidant capacity of Ruditapes philippinarum between the treatments of starvation and re-feeding but digestive ability was improved. Amylase and cellulase activities showed downward trends with the increase of starvation time. Digestive enzyme activity decreased sharply until the third day of starvation. Amylase and cellulase activities improved in different degree after re-feeding and the activities reached the levels at the first and second day respectively within three days. There was no significant change of total antioxidant capacity during the experiment.
Key words:Ruditapes philippinarum; starvation; re-feeding; digestive enzyme activity; total antioxidant capacity

