短链氯化石蜡C10 (50.2% Cl)对斑马鱼胚胎的发育毒性
刘丽华,马万里,刘丽艳,李一凡
(哈尔滨工业大学 市政环境工程学院 城市水资源与水环境国家重点实验室 国际持久性有毒物质联合研究中心,哈尔滨 150090)
短链氯化石蜡C10(50.2% Cl)对斑马鱼胚胎的发育毒性
刘丽华,马万里,刘丽艳,李一凡
(哈尔滨工业大学 市政环境工程学院 城市水资源与水环境国家重点实验室 国际持久性有毒物质联合研究中心,哈尔滨 150090)
摘要:为评价短链氯化石蜡对斑马鱼胚胎的发育毒性,以斑马鱼为模式生物,观察不同质量浓度的短链氯化石蜡C10(50.2% Cl)暴露24,48,72和96 h后斑马鱼胚胎/幼鱼的死亡率、孵化率、畸形率和体长.结果表明,C10(50.2% Cl)在斑马鱼的早期发育阶段可引起一系列非致死效应和致死效应.高质量浓度(1 000和10 000 μg/L)短链氯化石蜡可导致96 h斑马鱼胚胎死亡率显著升高(达100%),48 h抑制胚胎的孵化,并诱发一系列的发育畸形.C10(50.2% Cl)在斑马鱼幼鱼中引起的畸形表型主要包括脊柱弯曲,卵黄畸形,心包囊肿,尾部畸形和鱼鳔发育缺陷.低质量浓度组和高质量浓度组C10(50.2% Cl)均能够抑制斑马鱼幼鱼的生长速度,目前的环境质量浓度已具有一定程度的水生生态风险.
关键词:短链氯化石蜡;斑马鱼;胚胎;发育毒性
Study on developmental toxicity of short-chain chlorinated paraffins
短链氯化石蜡(short chain chlorinated paraffins,SCCPs)是氯化石蜡中的一类,碳链长度为10~13个碳原子,常见含氯质量分数为30%~75%[1-2].短链氯化石蜡比中链和长链氯化石蜡更容易从各类终端产品中释放进入环境,并且对水生态环境和哺乳动物显现出更强的毒性[3],具有潜在的致癌性[4],因而备受关注.短链氯化石蜡被广泛用作金属加工润滑剂、密封剂、橡胶和纺织品阻燃剂、皮革加工助剂、油漆涂料添加剂和塑化剂[2,5].伴随着氯化石蜡的大量生产和使用,环境中短链氯化石蜡的污染问题也随之而来,短链氯化石蜡在各类环境介质如空气、水体、土壤、沉积物、污水污泥、室内灰尘、野生动物甚至母乳中均被检出[6-13].目前,短链氯化石蜡在中国自然水体中的监测数据很少.2011年,北京高碑店湖水体中短链氯化石蜡总质量浓度范围为162~176 ng/L[7],质量浓度水平高于2005年日本某河流(7.6~31 ng/L)[14]和2004年加拿大圣劳伦斯河 (15.74~59.57 ng/L)[6],低于2004年西班牙某河流(300~1 100 ng/L)[14].有研究表明,氯化石蜡对哺乳动物的肝脏、甲状腺和肾脏有毒性作用[15-17].美国国家毒理学规划处早期的研究显示,氯化石蜡工业品C500C(58% Cl)可导致小鼠和大鼠肝肿瘤、肾小球腺瘤或腺癌、滤泡细胞腺瘤或甲状腺癌的发生率显著增加,具有致癌性[18].非洲爪蟾胚胎暴露于氯化石蜡工业品CP 56-12 (C12, 56% Cl)后出现发育畸形,表明其具有胚胎毒性和致畸性[1].另有研究显示,短链氯化石蜡对北美鳉和日本青鳉的胚胎发育产生毒性作用,其中短链氯化石蜡工业品(C10-13, 58% Cl)的最小可观察效应质量浓度(lowest observed effect concentration,LOEC)和最大无观察效应质量浓度(no observed effect concentration,NOEC)为620.5和280 μg/L.[19-20],实验室合成品C10H15.3Cl6.7的LOEC和NOEC为370和50 μg/L[21].另外,短链氯化石蜡具有内分泌干扰毒性.有研究表明,短链氯化石蜡可降低小鼠和大鼠体内甲状腺素总T4的浓度,并引起促甲状腺素TSH和尿苷二磷酸葡醛酸转移酶(UDPGT)水平升高,导致甲状腺功能紊乱[22-23].
由于短链氯化石蜡中同系物和异构体组成复杂,受试物化学品难以获得,目前关于短链氯化石蜡不同组分的毒性数据,尤其是发育毒性数据非常少.本实验以斑马鱼胚胎和幼鱼作为敏感动物模型,研究了短链氯化石蜡中的C10组分C10(50.2% Cl)对斑马鱼胚胎的发育毒性.
1实验
1.1实验试剂
本实验受试物为一种短链氯化石蜡合成品C10-SCCP(C10H18Cl4),碳链长度为10个碳,氯质量分数为50.2%,由德国慕尼黑工业大学Mehmet Coelhan教授提供.DMSO购自Sigma-Aldrich 公司.
1.2实验动物
成年斑马鱼饲养在循环养殖系统中,饲养用水充分曝气,并经过生物过滤器和UV光照处理,水温28.5 ℃,光/暗周期为14/10 h,每日喂食2次,控制培养1个月后开始采集胚胎.胚胎采集前1天晚上将雌鱼和雄鱼按2∶1的比例放入配鱼箱中,中间用挡板隔开.采集当天早上8:00取出挡板开始配鱼,大约1 h后收集胚胎.不同配鱼箱中的胚胎用吸管取出清洗后收集到同一个培养皿中混匀,待胚胎发育至2 hpf (受精后小时数)时在显微镜下挑选发育正常的胚胎进行染毒.
1.3染毒与测定
选取产卵后2 h发育进入囊胚期的健康胚胎,用吸管吸至培养皿中,每个培养皿放入20枚胚胎,分别加入25 mL新鲜的染毒液,染毒质量浓度梯度设置为0, 0.01, 0.1, 0.5, 1, 10, 100, 1 000和10 000 μg/L(含体积分数0.1‰ DMSO),每个质量浓度组设置3个平行样.将培养皿置于28.5 ℃的培养箱中,每24 h 更换新鲜的染毒液,及时清除死亡的胚胎,同时记录死亡胚胎数目.胚胎发育至96 hpf 时每个培养皿采集10条幼鱼照片,用Image J软件测量斑马鱼幼鱼的体长,记录和计算斑马鱼胚胎的存活率、畸形率和孵化率.
1.4统计分析方法
将所有数据求出平均值和标准差(Mean±SE),使用 SigmaPlot 12.0 软件对实验数据进行统计分析,采用单因素方差分析(one-way ANOVA)和双因素方差分析(two-way ANOVA)检验处理组和对照组之间的差异显著性.P<0.05为差异显著,用*表示;P<0.01和P<0.001为差异极显著,用**和***表示.
2结果与讨论
2.1短链氯化石蜡C10(50.2% Cl)对斑马鱼胚胎/幼鱼存活率的影响
在斑马鱼胚胎暴露于短链氯化石蜡C10(50.2% Cl)的过程中,胚胎/幼鱼在4个观察时间点(24,48,72,96 hpf)的死亡率统计见图1.可以看出,胚胎死亡率随着SCCPs质量浓度的升高和暴露时间的延长而升高.10 mg/L暴露组72 h时胚胎的死亡率显著高于24 h(P=0.022)和48 h (P=0.022),96 hpf时与对照组相比出现显著死亡(P<0.001),死亡率急剧升高达100%.对照组在全部观察时间点均没有出现胚胎死亡,其他处理组也均未观察到显著死亡情况.
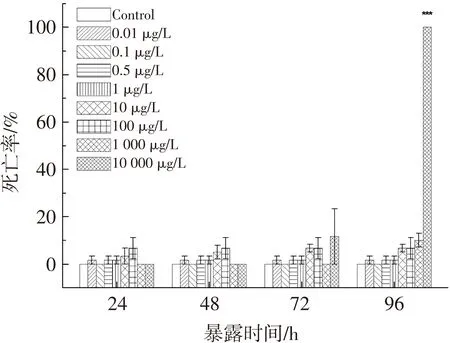
图1短链氯化石蜡C10(50.2% Cl)对斑马鱼胚胎/幼鱼死亡率的影响
Fig.1Effects of C10(50.2% Cl)on the death rates in zebrafish embryo/ larvae
2.2短链氯化石蜡C10(50.2% Cl)对斑马鱼胚胎孵化率的影响
统计胚胎在24,48,72和96 hpf时的孵化率,用以评估短链氯化石蜡C10(50.2% Cl) 对胚胎孵化过程的影响.如图2所示,斑马鱼胚胎在24 hpf后开始孵化,到48 hpf时对照组的胚胎孵化率达75%,此时1 000和10 000 μg/L暴露组的孵化率显著低于对照组(P<0.001),分别为43.3%和47.7%.72 hpf时,对照组和0.01 μg/L暴露组中孵化率达100%,而其他处理组中的胚胎均未完全孵化,孵化率为91.7%~98.3%.
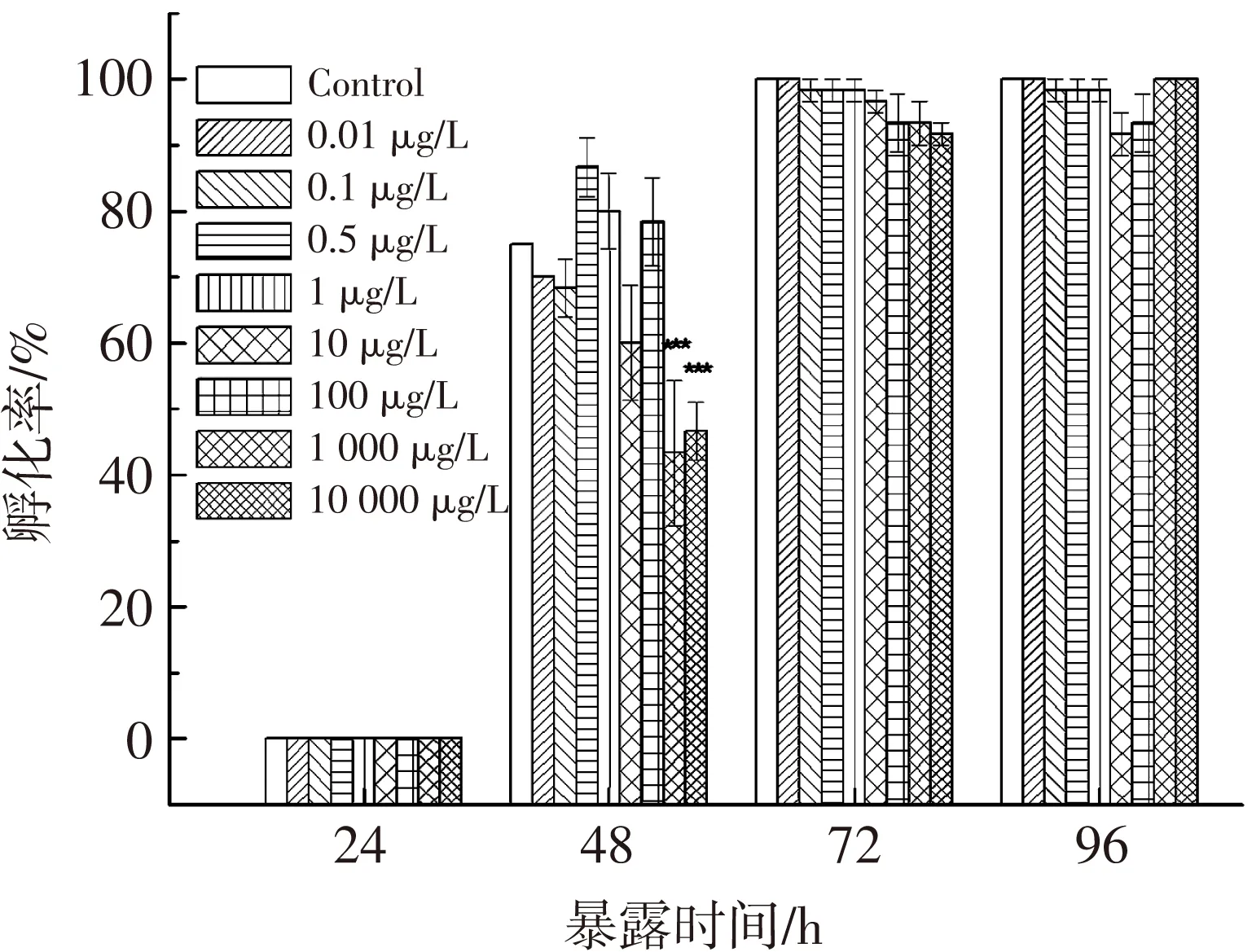
图2 短链氯化石蜡C10(50.2% Cl)对斑马鱼胚胎孵化率的影响
Fig.2Effects of C10(50.2% Cl)on the hatching rates in zebrafish embryo
2.3短链氯化石蜡C10(50.2% Cl)对斑马鱼胚胎/幼鱼畸形率的影响
如图3所示,短链氯化石蜡C10(50.2% Cl)的暴露导致斑马鱼胚胎和幼鱼出现一系列的发育畸形,其中出现比例较高且表型最明显的几种畸形类型为脊柱弯曲(SC)、卵黄囊肿(YD)、心包囊肿(PE)、尾部畸形(MT)和鱼鳔发育缺陷(USB).从图4可以看出,在24 hpf时,并未观察到畸形胚胎.48 hpf时,1 000和10 000 μg/L暴露组幼鱼最早出现SC、YD和MT,与对照组相比畸形率也显著升高,分别为18.3%和46.7%.随着暴露时间的延长,1 000和10 000 μg/L暴露组畸形表型和畸形率也随之增加,到72 hpf时所有畸形表型均出现,畸形率也达最大值,分别为56.7%和100%.
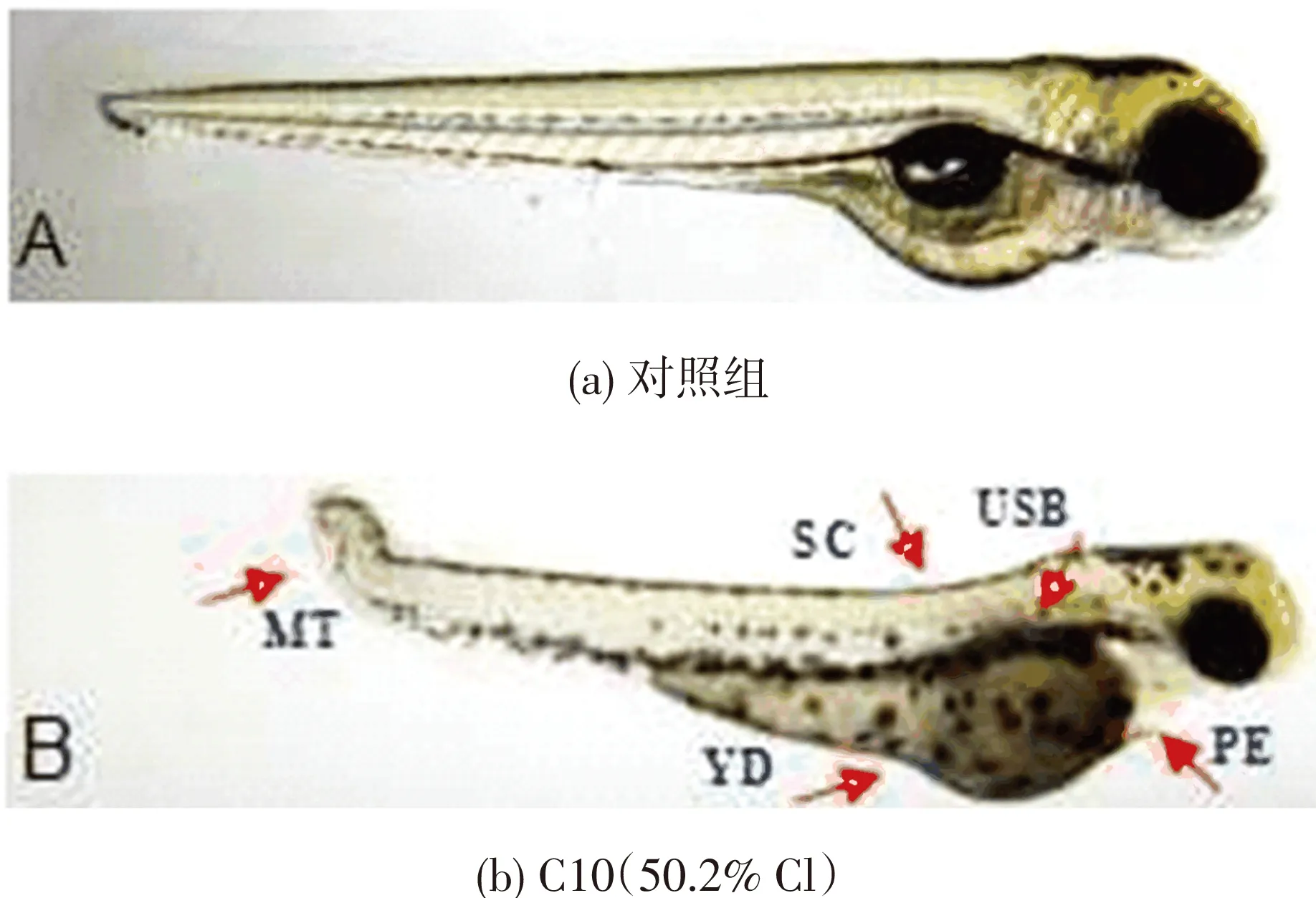
图3 短链氯化石蜡C10(50.2% Cl)导致的畸形表型
Fig.3Typical malformation types in zebrafish larvae exposed to C10(50.2% Cl)

图4短链氯化石蜡C10(50.2% Cl)对斑马鱼胚胎/幼鱼畸形率的影响
Fig.4Effects of C10(50.2% Cl)on the malformation rates in zebrafish embryo/ larvae
2.4短链氯化石蜡C10(50.2% Cl)对斑马鱼幼鱼体长的影响
以96 hpf斑马鱼幼鱼体长为观察终点,评估短链氯化石蜡C10(50.2% Cl)对斑马鱼幼鱼生长速度的影响.如图5所示,短链氯化石蜡C10(50.2% Cl)的暴露抑制了斑马鱼幼鱼的生长速度.96 hpf时,0.5、1 000和10 000 μg/L暴露组的幼鱼平均体长分别为(3.62±0.00)、(3.60±0.01)和(3.08±0.01) cm,显著低于对照组体长(3.72±0.00) cm.
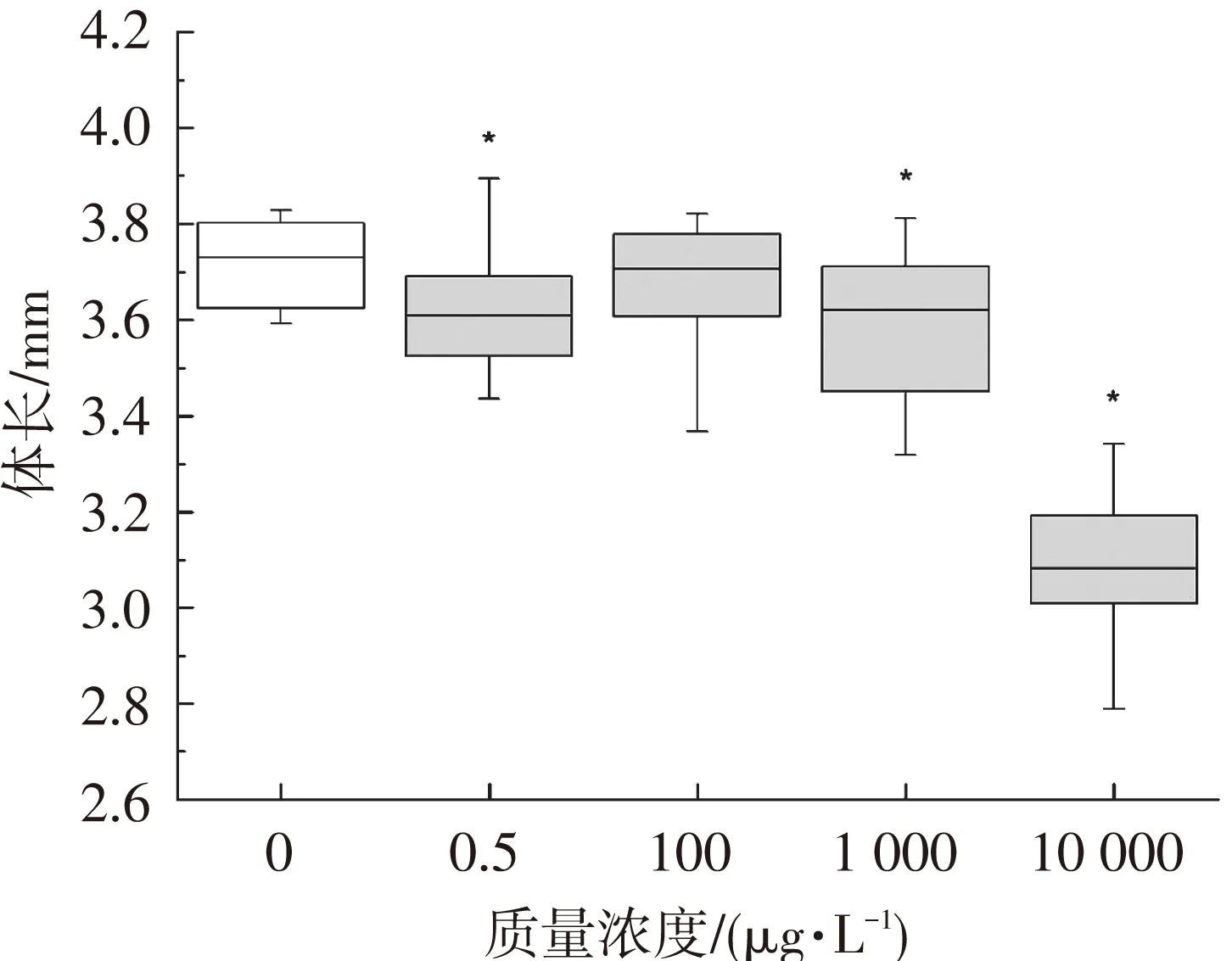
图5短链氯化石蜡C10(50.2% Cl)对斑马鱼体长的影响
Fig.5Effects of C10(50.2% Cl)on the body length in zebrafish larvae
3讨论
本实验的目的是研究短链氯化石蜡C10(50.2% Cl)对斑马鱼胚胎/幼鱼的早期发育毒性.根据国内外的监测数据,自然水体中短链氯化石蜡的质量浓度范围在0.01~1.10 μg/L.因此,本研究染毒质量浓度涵盖了环境质量浓度相似水平,同时设置了高剂量染毒组,以利于观察染毒物的毒理学终点效应.研究结果表明,短链氯化石蜡C10(50.2% Cl)可引起胚胎/幼鱼的死亡,抑制胚胎的孵化和幼鱼生长,并导致一系列的发育畸形.
斑马鱼胚胎对于C10(50.2% Cl)的敏感性导致胚胎出现显著死亡,且呈现剂量效应关系.C10(50.2% Cl)对斑马鱼胚胎96 h的LC50为1~10 mg/L,这与Fisk在日本青鳉鱼胚胎中得到的C10H15.5Cl6.5的LC50值2.7~9.6 mg/L相似[21],但远高于SCCPs目前在环境中的质量浓度.本研究结果表明,短链氯化石蜡C10(50.2% Cl)具有一定的致死毒性,但在目前的环境质量浓度下不会直接导致鱼类的显著死亡.
短链氯化石蜡C10(50.2% Cl)的暴露可引起胚胎孵化时间推迟,从而降低孵化率.暴露于1 000和10 000 μg/L高质量浓度中的胚胎48 hpf时孵化率显著低于对照组,表明高质量浓度的C10(50.2% Cl)会推迟胚胎的孵化过程.Fisk在日本青鳉鱼胚胎实验中也发现SCCPs有类似的作用,但并不显著[21].孵化时间是水生生物幼体发育过程中的重要指标.外源性污染物可能会改变胚胎发育过程中的信号,而这些信号是胚胎从绒膜中解脱出来所必须的[24].本研究结果表明,短链氯化石蜡C10(50.2% Cl)对斑马鱼胚胎的孵化过程产生一定的影响,且影响程度取决于C10(50.2% Cl)的质量浓度,但在目前的环境质量浓度下尚不会直接影响鱼类的胚胎孵化过程.
胚胎暴露于外源性污染物时可以观察到发育过程中的各种畸形现象[25-26],胚胎的发育毒性比急性毒性更加敏感.本研究中,短链氯化石蜡C10(50.2% Cl)的暴露导致斑马鱼胚胎出现多种畸形表型,暴露于1 000和10 000 μg/L高质量浓度中的胚胎从48 hpf开始畸形率显著高于对照组和其他处理组,高质量浓度的C10(50.2% Cl)显示出较强的致畸毒性.此外, C10(50.2% Cl)的发育毒性还表现为对斑马鱼幼鱼的生长速度的影响.本研究显示,该影响不仅出现在高质量浓度暴露组中,在较低质量浓度(0.5 μg/L)暴露时也有发生.另有研究显示,非洲爪蟾胚胎暴露于氯化石蜡工业品CP 56-12 (C12, 56% Cl) 后也产生了生长抑制效应[1].本研究结果表明,短链氯化石蜡C10(50.2% Cl)对斑马鱼早期发育具有显著的发育毒性,目前的环境质量浓度可能已具有一定程度的水生生态风险.
4结论
1)10 000 μg/L的短链氯化石蜡C10(50.2% Cl)可导致斑马鱼胚胎96 hpf死亡率显著升高.
2)1 000和10 000 μg/L的短链氯化石蜡C10(50.2% Cl)可显著抑制胚胎48 hpf的孵化过程.
3)1 000和10 000 μg/L的短链氯化石蜡C10(50.2% Cl)可显著诱发斑马鱼幼鱼48、72和96 hpf的一系列发育畸形,主要包括脊柱弯曲、卵黄囊肿、心包囊肿、尾部畸形和鱼鳔发育缺陷.
4)0.5、1 000和10 000 μg/L的短链氯化石蜡C10(50.2% Cl)均可显著降低斑马鱼幼鱼96 hpf的体长,抑制斑马鱼幼鱼的生长,目前的环境质量浓度已具有一定程度的水生生态风险.
参考文献
[2] United National Environment Program. Updated supporting document for the risk profile on short-chained chlorinated paraffins (UNEP/POPS/PROPRC.5/INF/18) [R]. Geneva: UNEP, 2009. http://chm.pops.int/Convention/POPsReviewCommittee/Chemicals/tabid/243/Default.aspx.
[3] Environment Canada. Environment Canada Priority substances program: CEPA assessment report, chlorinated paraffins [R]. Hull Quebec: Commercial Chemicals Branch, 1993. https://www.ec.gc.ca/toxiques-toxics/Default.asp?lang=En&n=148DE7B6-1.
[4] International Agency for Research on Cancer. Some flame retardants and textile chemicals, and exposures in the textile manufacturing industry [R]. Lyon: IARC, 1990. http://monographs.iarc.fr/ENG/Monographs/vol48/index.php.
[5] DE BOER J. Chlorinatedparaffins, in the handbook of environmental chemistry [M]. Berlin Heidelberg: Springer, 2010.
http://link.springer.com/book/10.1007/978-3-642-10761-0.
[6] MOORE S, VROMET L, RONDEAU B.Comparison of metastable atom bombardment and electron capture negative ionization for the analysis of polychloroalkanes [J]. Chemosphere, 2004, 54 (4): 453-459.[7] ZENG Lixi, WANG Thanh, WANG Pu, et al. Distribution and trophic transfer of short-chain chlorinated paraffins in an aquatic ecosystem receiving effluents from a sewage treatment plant [J]. Environ Sci Technol, 2011, 45 (13): 5529-5535.
[8] MARVIN C H, PAINTER S, TOMY G T, et al.Spatial and temporal trends in short-chain chlorinated paraffins in Lake Ontario sediment [J]. Environ Sci Technol, 2003, 37 (20): 4561-4568.
[9] WANG Thanh, HAN Shanlong, YUAN Bo, et al. Summer-winter concentration and gas-particle partitioning of short chain chlorinated paraffins in the atmosphere of an urban setting [J]. Environmental Pollution, 2012, 171: 38-45.
[10]HOUDE M, MUIR D C M, TOMY G T, et al.Bioaccumulation and trophic magnification of short-and medium-chain chlorinated paraffins in food webs from Lake Ontario and Lake Michigan [J]. Environ Sci Technol, 2008, 42 (10): 3893-3899.
[11]YUAN Bo, WANG Thanh, ZHU Nali, et al. Short chain chlorinated paraffins in mollusks from coastal waters in Chinese Bohai Sea [J]. Envion Sci Technol, 2012, 46 (12): 6489-6496.
[12]TOMY G T. The mass spectrometric characterization of polychlorinated n-alkanes and the methodology for their analysis in the environment [D]. Winnipeg, Manitoba: University of Manitoba, 1997.
[13]THOMAS G O, FARRAR D, BRAEKEVELT E, et al. Short and medium chain length chlorinated paraffins in UK human milk fat [J]. Environment International, 2006, 32 (1): 34-40.
[14]FEO M L, ELJARRAT E, BARCELO D. Occurrence, fate and analysis of polychlorinated n-alkanes in the environment [J]. Trends in Analytical Chemistry, 2009, 28 (6): 778-791.
[15]BUCHER J R, ALISON R H, MONTGOMERY C A, et al.Comparative toxicity and carcinogenicity of two chlorinated paraffins in F344/N rats and B6C3F1 mice [J]. Fund Appl Toxicol, 1987, 9 (3): 454-468.
[16]SERRONE D M, BIRTLEY R D N, WEIGAND W, et al.Toxicology of chlorinated paraffins [J]. Food Chem Toxicol, 1987, 25 (7): 553-562.
[17]ELCOMBE C R, WATSON S C, WYATT I, et al.Chlorinated paraffins (CP): mechanisms of carcinogenesis [J]. Toxicologist, 1994, 14: 276.
[18]National Toxicology Program.Toxicology and carcinogenesis studies of chlorianted paraffins (C12, 60% Chlorine) (CAS No. 63449-39-8) in F344/N rats and B6C3F1mice (gavage studies) (Technical Report Series No. 308) [R]. North Carolina: NTP, 1986.
[19]HILL R W, MADDOCK B G.Effect of a chlorinated paraffin on embryos and larvae of the sheephead minnow (Cyprinodon variegatus)-(Study one) (Brixham Report BL/B/2326) [R]. Devon: Imperial Chemical Industries PLS, 1983.
[20]HILL R W, MADDOCK B G. Effect of a chlorinated paraffin on embryos and larvae of the sheephead minnow (Cyprinodon variegatus)-(Study two) (Brixham Report BL/B/2327) [R]. Devon: Imperial Chemical Industries PLS, 1983.
[21]FIRSK AA T, TOMY G T, MUIR D G C. Toxicity of C10-, C11-, C12-, and C14- polychlorinated n-alkanes to Japanese Medaka embryos [J]. Environmental Toxicology and Chemistry, 1999, 18 (12): 2894-2902.
[22]European Commission. European union risk assessment report, 1st priority list vol 4: alkanes, C10-13, chloro-[R]. Luxembourg: European Chemicals Bureau, 2000.
[23]WYATT I, COUTTS C T, ELCOMBE C R.The effect of chlorinated paraffins on hepatic enzymes and thyroid hormones [J]. Toxicology, 1993, 77 (1/2): 81-90.
[24]SANO K, INOHAYA K, KAWAGUCHI M, et al.Purification and characterization of zebrafish of hatching enzyme-an evolutionary aspect of the mechanism of egg envelope digestion [J]. Febs J, 2008, 275 (23): 5934-5946.
[25]HILL A J, TERAOKA H, HEIDEMAN W, et al.Zebrafish as a model vertebrate for investigating chemical toxicity [J]. Toxicol Sci, 2005, 86 (1): 6-19.
[26]CARNEY S A, PRASCH A L, HEIDEMAN W, et al.Understanding dioxin developmental toxicity using the zebrafish model [J]. Birth Defects Res A, 2006, 76 (1): 7-18.
(编辑刘彤)
doi:10.11918/j.issn.0367-6234.2016.08.021
收稿日期:2015-12-16
基金项目:城市水资源与水环境重点实验室(哈尔滨工业大学)自主课题(2013DX15)
作者简介:刘丽华(1984—),女,博士研究生; 李一凡(1949—),男,教授,博士生导师
通信作者:李一凡,ijrc_pts_paper@ yahoo.com
中图分类号:X171.5
文献标志码:A
文章编号:0367-6234(2016)08-0127-04
C10(50.2% Cl) in zebrafish embryos
LIU Lihua, MA Wanli, LIU Liyan, LI Yifan
(International Joint Research Center for Persistent Toxic Pollutants (IJRC-PTS), State Key Laboratory of Urban Water Resource and Environment, School of Municipal and Environmental Engineering, Harbin Institute of Technology, Harbin 150090, China)
Abstract:A zebrafish (Danio rerio) model was applied to evaluate the developmental toxicity of short-chain chlorinated paraffins (SCCPs). Death rates, hatching rates, malformation rates and body length were observed after the zebrafish embryos were exposed to different concentrations of C10(50.2% Cl) separately for 24, 48, 72 and 96 h. The results indicated that C10(50.2% Cl) could exert lethal and sub-lethal effects on the early life stage of zebrafish. Higher concentrations of C10(50.2% Cl) ( 1 000 and 10 000 μg/L) could not only cause significant death rates increase to 100% after 96 h exposure and hating delay after 48 h exposure, but also induce a series of malformations, including spinal curvature, yolk deformity, pericardial edema, malformation of tail and uninflated swim bladder. Since the growth inhibition of juvenile zebrafish caused by C10(50.2% Cl) on the exposure concentrations no matter high or low, SCCPs might be a risk to the aquatic ecology and fish development.
Keywords:SCCPs; zebrafish; embryo; developmental toxicity

