溶解氧对输水管道生物膜微生物群落结构及出水水质影响
雒江菡,贾瑞宝,于瑞洪,阎力君,李圭白,梁 恒
(1. 城市水资源与水环境国家重点实验室(哈尔滨工业大学),哈尔滨 150090;2. 济南市供排水监测中心,济南 250000;3. 黑龙江生物科技职业学院,哈尔滨 150025; 4. 哈尔滨商业大学 细胞与分子生物学研究所,哈尔滨 150076)
溶解氧对输水管道生物膜微生物群落结构及出水水质影响
雒江菡1,贾瑞宝2,于瑞洪3,阎力君4,李圭白1,梁恒1
(1. 城市水资源与水环境国家重点实验室(哈尔滨工业大学),哈尔滨 150090;2. 济南市供排水监测中心,济南 250000;3. 黑龙江生物科技职业学院,哈尔滨 150025; 4. 哈尔滨商业大学 细胞与分子生物学研究所,哈尔滨 150076)
摘要:为提高微污染原水输水安全性,采用生物膜环状反应器(biofilm annular reactor,BAR)模拟原水输水管网,研究溶解氧(DO)对出水水质及生物膜微生物的影响,运用454-高通量测序技术对生物膜的微生物多样性和丰度进行分析.结果表明:随着溶解氧浓度的提高,反应器出水浊度、总铁、氨氮大幅度下降,该过程对总氮和CODMn去除的影响并不明显;生物膜中的铁细菌、硫酸盐还原菌的量均随溶解氧浓度的提高而降低,而微生物多样性和丰度(如硝化细菌)随溶解氧质量浓度的提高而升高.提高溶解氧能够缓解管道腐蚀,提高管壁生物膜的净水作用.
关键词:原水;溶解氧;生物膜;454-高通量测序技术;微生物群落结构
原水通过长距离输送,历经数百千米,历时四五小时乃至数天,密闭管道溶解氧下降,管道腐蚀加剧,消毒剂用量增加,出水浊度升高,水质恶化,增加了水厂处理难度[1-2];另外,原水中的微生物及微污染物易附着于管壁形成生物膜,溶解氧也将会影响生物膜中某些微生物(如铁细菌、硫酸盐还原菌及硝化细菌等)的生长及作用,从而导致生物膜微生物群落结构的改变[3].因此,溶解氧是评价和改善水质的重要参数.
近年来,国内外关于管网水质以及生物膜的研究主要集中在给水管网水利条件、消毒剂及管材等因素对其的影响,关于溶解氧对生物膜及水质的影响研究甚少.Rochex等[4]运用Rotating annular reactors研究了剪切力对生物膜微生物群落结构的影响,证实剪切力使老化生物膜不断脱落,管壁生物膜一直处于旺盛生长状态;Gagnon等[5]的研究表明给水管网消毒剂氯和氧化氯能控制生物膜的生长;Markku等[1]研究了流速对给水管网生物膜的影响,证实增加水流速度能够促进生物膜的生长;王磊等[6]通过生物膜生物反应器研究了低溶解氧条件下生物膜的特性,证实溶解氧对生物膜外观、微生物群落组成及除污(COD、SS)能力均有影响;Luo等[7]在输水管网生物膜研究中发现,生物膜中的微生物在高溶解氧条件下对原水中的氨氮有较高的去除率.近几年发展起来的454 高通量测序技术被广泛应用到环境微生物多样性分析中,Hong等[8]采用高通量测序方法对给水管网生物膜的微生物群落结构进行分析,发现在同一输水管网内不同取样点生物膜微生物多样性差异较大.本文拟用BAR模拟原水输水管网,研究溶解氧对出水水质及生物膜微生物的影响,运用454-高通量测序技术对生物膜的微生物多样性和丰度进行分析,以期为发挥管壁生物膜净水作用和降低管道腐蚀提供参考.
1实验
1.1实验装置与运行
为真实地模拟实际管网,采用美国BioSurface Technology公司生产的BAR 1320 LJ在水厂取水泵站搭建了小型模拟输水管网(见图1).管道材料为铸铁.管网进水为某江水,水质参数见表1.水通过蠕动泵提升进入模拟管网,依靠蠕动泵控制进水速度,从而控制原水在管网内的停留时间(4 h).调节BAR反应器转速(50 r/min)调整水流与管壁的剪切力(0.25 N/m2).通过曝气泵调节水箱内的溶解氧(0.8,1.9,2.9,4.1,4.9,5.9和7.1 mg/L).每个工况运行6个月,管网生物膜趋于成熟,对应的生物膜编号为B1—B7.为保证实验条件一致,7台反应器并联操作.
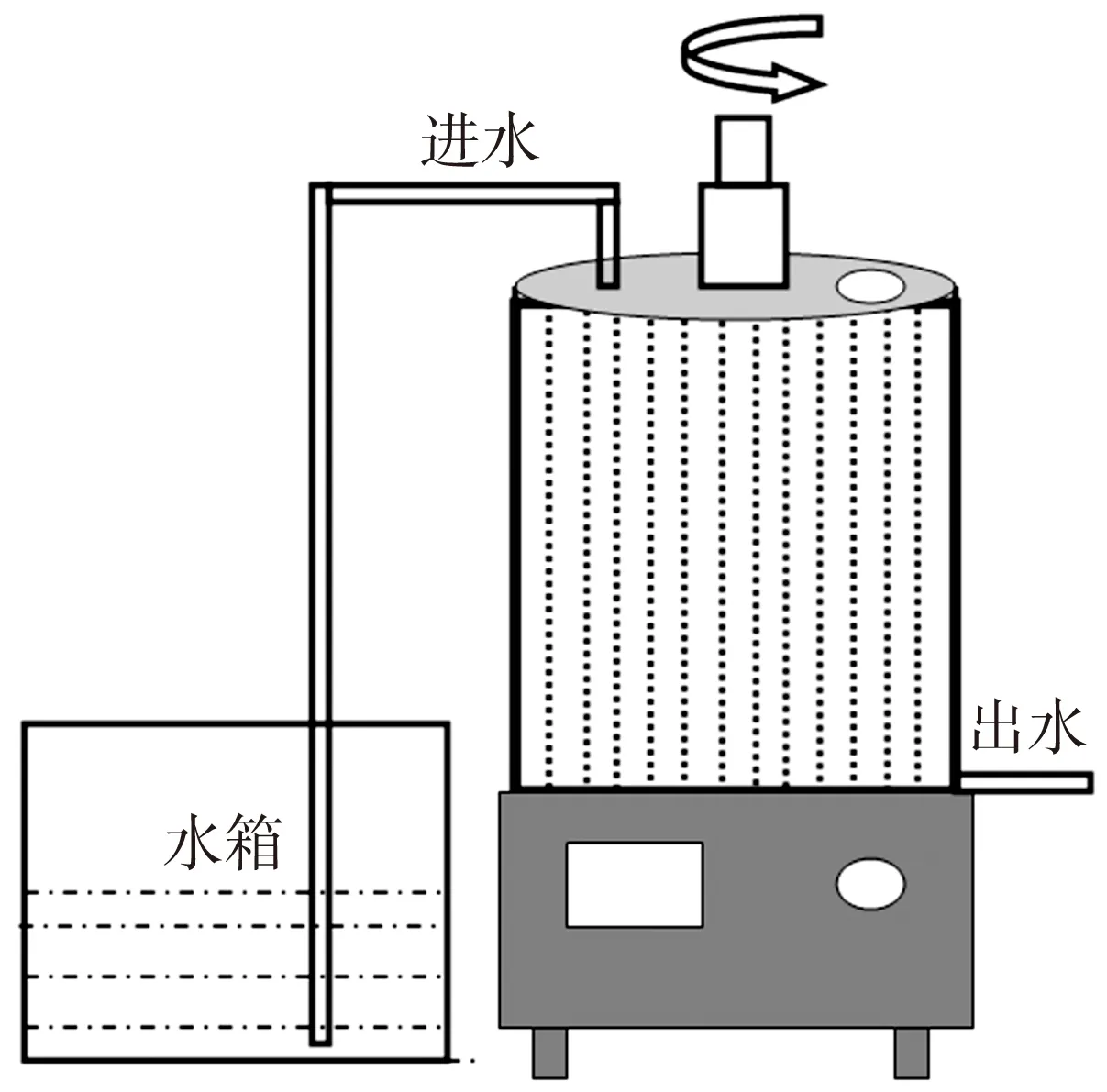
图1 模拟管网流程
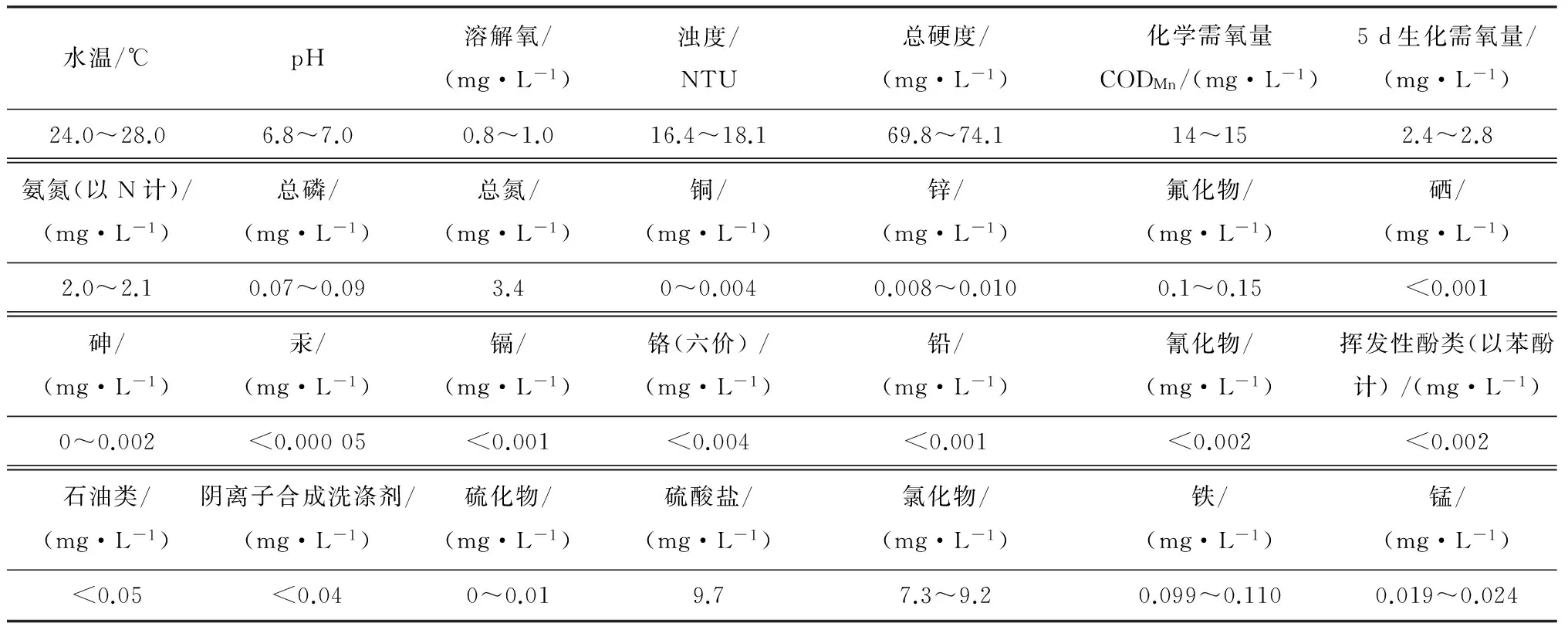
水温/℃pH溶解氧/(mg·L-1)浊度/NTU总硬度/(mg·L-1)化学需氧量CODMn/(mg·L-1)5d生化需氧量/(mg·L-1)24.0~28.06.8~7.00.8~1.016.4~18.169.8~74.114~152.4~2.8氨氮(以N计)/(mg·L-1)总磷/(mg·L-1)总氮/(mg·L-1)铜/(mg·L-1)锌/(mg·L-1)氟化物/(mg·L-1)硒/(mg·L-1)2.0~2.10.07~0.093.40~0.0040.008~0.0100.1~0.15<0.001砷/(mg·L-1)汞/(mg·L-1)镉/(mg·L-1)铬(六价)/(mg·L-1)铅/(mg·L-1)氰化物/(mg·L-1)挥发性酚类(以苯酚计)/(mg·L-1)0~0.002<0.00005<0.001<0.004<0.001<0.002<0.002石油类/(mg·L-1)阴离子合成洗涤剂/(mg·L-1)硫化物/(mg·L-1)硫酸盐/(mg·L-1)氯化物/(mg·L-1)铁/(mg·L-1)锰/(mg·L-1)<0.05<0.040~0.019.77.3~9.20.099~0.1100.019~0.024
1.2分析方法
1.2.1水质的测定
参照文献[9]对pH、浊度、溶解氧(DO)、CODMn、“三氮”、总氮以及总铁等指标进行检测.
1.2.2生物膜微生物数量的测定
铁细菌和硫酸盐还原菌的检测采用文献[10]方法;氨氧化菌采用MPN-Griess法(最大可能数法-Griess试剂检测法)[11].
1.2.3微生物多样性
采用454-高通量测序的方法解析微生物种群结构.通过OMEGA E.Z.N.A DNA试剂盒抽提生物膜微生物基因组,采用细菌16S rRNA常用引物(8F: 5’-AGAGTTTGATCCTGGCTCAG-3’;533R:5’-TTACCGCGGCTGCTGGCAC-3’)通过PCR反应进行扩增实验(反应参数为:95 ℃ 2 min; 25 循环: 95 ℃ 30 s, 55 ℃ 30 s,72 ℃ 30 s; 72 ℃ 5 min;10 ℃保温).使用1%琼脂糖电泳检测PCR产物并定量,取适量PCR产物进一步油包水PCR(EmPCR)扩增,用 Roche Genome Sequencer FLX 系统测序.为后续测序分析区分样品,需连接特定标签序列,所得原始序列进一步优化和聚类,通过mothur软件分析样品的多样性和群落结构.
2结果与分析
2.1水质变化
2.1.1溶解氧对出水浊度的影响
管网水浊度的改变主要是由微污染物的降解、生物膜脱落、管道腐蚀和铁释放引起的.溶解氧影响生物膜的交联度、生物膜与管壁的结合能力、管壁的腐蚀速率及铁的溶出,从而影响出水浊度.不同溶解氧质量浓度下,出水浊度的变化如图2 所示.可以看出,随着溶解氧质量浓度的提高,出水浊度呈现先上升后下降再上升的趋势.溶解氧为1.9 mg/L时,浊度最高,为27.7 NTU,溶解氧为5.9 mg/L时,浊度最低,为18.4 NTU.这或许是因为高溶解氧条件下,生物膜交联度高,阻碍了铁管进一步腐蚀和铁的释放,出水浊度降低;而低溶解氧条件下,生物膜松动,管壁腐蚀加剧,铁释放量大,导致出水浊度升高.另外,随着溶解氧质量浓度的提高,微生物数量增加,代谢能力增强,水中的微污染物被生物膜中微生物的生长所消耗,出水的浊度降低;溶解氧达5.9 mg/L以上时,出水浊度呈现上升趋势,这或许是因为随着溶解氧的升高,外部微生物生长繁殖较快,生物膜厚度增加,内部营养物质较少,生物膜会无规则地出现老化现象,易脱落到水中而影响出水浊度.因此,即使溶解氧质量浓度较高时,出水浊度也会突然升高.
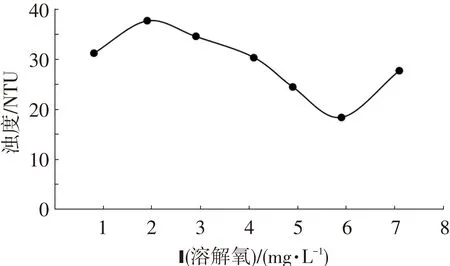
图2 溶解氧对BAR出水浊度的影响
2.1.2溶解氧对管道腐蚀的影响
目前以铸铁和钢管为主的铁质管材在给水管网中仍普遍存在,这类管材与水接触不可避免地会发生腐蚀现象,大多数输水管网都会在管壁表面形成铁腐蚀产物,腐蚀管垢的存在会限制输水能力,还会导致铁的溶出,恶化水质,溶解氧作为氧化剂参与管道腐蚀,并对铁的溶出有重要影响.图3反映了溶解氧对铁溶出的影响.可以看出,随着溶解氧质量浓度的升高,出水总铁质量浓度下降,由1.28 mg/L下降到0.37 mg/L,由此推断,水体中的溶解氧对管道腐蚀、铁释放均有较大影响.水体中溶解氧质量浓度较高时,氧分子作为电子受体参与管道腐蚀反应,其将Fe(II)氧化为Fe(III)、Fe(OH)3等三价铁的化合物并附着沉积在管壁,新生成的三价铁的化合物会进一步与水体及管垢反应,生成更为稳定的 Fe3O4、FeOOH 等物质,从而形成稳定致密的氧化膜,防止管道的进一步腐蚀,管垢内表层的腐蚀产物不易释放[12].管网内释放的铁主要是由金属铁的腐蚀产物中亚铁离子( Fe2+) 和亚铁组分的溶解造成的,当水体中溶解氧质量浓度较低时,FeOOH 会代替氧气作为电子受体,与管道中的铁发生反应,生成易溶的亚铁物质[13],增加出水总铁质量浓度.另外,生物膜的存在也能减少传递到管壁的氧,从而抑制管壁的腐蚀.鲁智礼等[14]通过管网中试模拟系统研究了溶解氧对管网铁释放的影响,发现进水溶解氧质量浓度由8 mg /L 增加到15 mg /L 时,实验系统的铁释放均有明显的降低.
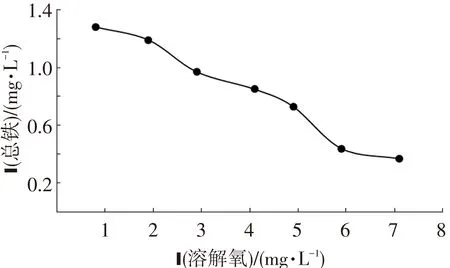
图3 溶解氧对反应器出水总铁的影响
Fig.3Effect of dissolved oxygen on BAR effluent total iron concentration
2.1.3溶解氧对出水CODMn的影响
溶解氧能够氧化有机物而影响出水的CODMn.不同溶解氧条件下,出水CODMn的变化见图4所示.

图4 溶解氧对反应器出水CODMn的影响
由图4可以看出,随着溶解氧质量浓度的增加,出水CODMn变化较小,基本保持在10.1~13.8 mg/L.这是因为出水CODMn的变化受生物膜中微生物的降解以及老化生物膜脱落的影响,一方面增加溶解氧质量浓度,挂片生物膜的微生物代谢能力增强,CODMn不断被降解消耗导致质量浓度降低;另一方面管壁生物膜是一个复杂的、动态变化的微生物生存环境,它的形成包括“营养物质及微生物的吸附—生物膜的形成—生物膜的生长—生物膜的老化—生物膜的脱落”这样周而复始的循环[15],当生物膜生长到一定程度,膜深处的微生物由于营养物质及溶解氧缺乏而死亡,生物膜交联度降低而引起脱落,导致出水的CODMn略有增加,总体上看,当进水CODMn较低时,溶解氧对CODMn的去除率影响较小.
2.1.4溶解氧对出水氮素的影响
传统的生物脱氮主要是通过氨化/硝化反应和反硝化反应实现.硝化反应是在好氧条件下,以氧作为电子受体将氨氮转化为硝酸盐氮的过程,反硝化反应是在厌氧条件下硝酸氮转化为氮气而去除.因此,溶解氧是生物脱氮较受关注的指标之一.溶解氧对出水氮素质量浓度的影响见图5.可以看出,当溶解氧在0.8 mg/L以下时,氨氮去除率较低,出水氨氮质量浓度在1.9 mg/L左右,去除率仅为7%,亚硝酸盐氮质量浓度最高,硝酸盐氮和总氮质量浓度略有下降.说明有反硝化作用产生,但不彻底,存在一定量亚硝酸盐氮的积累,同时,较低的溶解氧抑制了管道内的硝化作用;随着溶解氧质量浓度的升高,氨氮去除率逐渐升高,当溶解氧超过4.1 mg/L时,氨氮去除率达27%以上,亚硝酸盐氮低于进水质量浓度,为0.16 mg/L,硝酸盐氮质量浓度逐渐升高,硝化作用占较大优势,而总氮质量浓度忽高忽低.这或许是由于微生物在溶解氧充足的条件下,为满足自身的生长需要消耗一定量的氮源,导致出水总氮质量浓度降低,而当微生物生长进入衰亡期,老化生物膜脱落,反而增加了水中有机氮质量浓度,造成出水总氮质量浓度升高.Helmer 等[16]的研究也证实,以氨氮为唯一氮源,反应器厌氧时,氨氮几乎不会发生转化;溶解氧超过5 mg/L时,氨氮易转化为亚硝态氮和硝态氮.另外,参与硝化作用的亚硝化菌与硝化菌属于专性好氧自养菌,依靠氨氮和亚硝氮的氧化获得能量才能生长,也需要氧分子作为呼吸链的最终电子受体.李绍峰等[17]在研究溶解氧对膜生物反应器同步硝化反硝化影响时获得了同样的规律,可以通过提高溶解氧加快硝化效率.

图5 溶解氧对反应器出水氮的影响
2.2生物膜微生物数量变化
2.2.1生物膜铁细菌数量的变化
铁细菌能将溶解于微污染原水中的氢氧化亚铁、碳酸铁氧化成高铁沉淀附着到管壁,形成锈层或锈瘤.有研究表明[18],在溶解氧质量浓度较低(0.1~0.2 mg/L)时,铁细菌生长良好,当质量浓度较高(大于2.75 mg/L)时,铁细菌的生长受到抑制,从而抑制了管道的腐蚀.文献[19]指出,铁细菌是好氧型自养菌,依靠铁和氧生长繁殖,溶解氧的存在能够为铁细菌的生长提供有利的条件.本实验考察了密闭生物反应器内溶解氧对生物膜铁细菌数量的影响,结果见图6.可以看出,随着溶解氧质量浓度的升高,生物膜中的铁细菌数量呈下降趋势,当溶解氧超过2.9 mg/L时,铁细菌的数量低于200 MPN/mL.本研究结果证实,溶解氧对铁细菌的生长有一定的抑制作用:一方面是高溶解氧降低了管壁铁的溶出,铁细菌缺少营养基质,从而抑制了铁细菌的增殖;另一方面是由于铁细菌分布在挂片表面,随着溶解氧质量浓度的升高,生物膜厚度增加,阻碍了溶解氧的传递,从而抑制了铁细菌的生长.

图6 溶解氧对生物膜中铁细菌的影响
2.2.2生物膜硫酸盐还原菌(SRB)的变化
硫酸盐还原菌是一种生长在管壁锈垢和沉淀物内部,能够利用有机物为碳源,利用生物膜内产生的氢,将硫酸盐还原成硫化氢的厌氧菌[20].在输水管网微污染原水输送过程中,管道内溶解氧降低,水中的微污染物及微生物也会在管壁形成粘泥及污垢,为硫酸盐还原菌的生长繁殖创造有利条件.生物膜硫酸盐还原菌随溶解氧的变化见图7.可以看出,随着溶解氧质量浓度的升高,生物膜中SRB的数量呈下降趋势.特别是当溶解氧高于2.9 mg/L以后,硫酸盐还原菌的数量低于20 MPN/mL.硫酸盐还原菌是一类生长在在锈垢和沉淀物内部厌氧环境下,以有机物作为电子供给体,以硫酸盐作为末端电子接受体,将硫酸根还原成硫离子的细菌,当溶液中的溶解氧质量浓度低于2.5 mg/L 时,SRB 就能快速繁殖[21].由此推断,当溶解氧质量浓度超过3 mg/L时,溶解氧成了挂片SRB生长的限制性因素,抑制硫酸还原菌的生长,同时减缓管道腐蚀.

图7 溶解氧对生物膜中硫酸盐还原菌的影响
2.2.3生物膜硝化细菌的变化
硝化细菌是一类能降解氨和亚硝酸盐的自养型细菌,氨氮和亚硝酸盐是其生长的物质基础,它们通过硝化作用将氨氮转化为亚硝酸盐,再进一步转化为硝酸盐,每毫克氮素经过整个硝化作用途径后,最大需要4.5 mg溶解氧来“清除”含氮物质释放的电子;另外,硝化细菌均为专性好氧菌,其正常生长代谢都需要氧的参与,O2是最终的电子受体.生物膜硝化细菌随溶解氧的变化见图8.可以看出,随着溶解氧质量浓度的升高,生物膜中硝化细菌的数量呈上升趋势.当溶解氧超过4.1 mg/L时,生物膜中硝化细菌数量大幅度增加.有研究表明,为确保硝化作用进行彻底,反应体系溶解氧尽量控制在2.0 mg/L以上,低于 0.5 mg/L硝化作用明显减弱[22].因此,可以通过提高管道内的溶解氧质量浓度,发挥管壁生物膜硝化细菌硝化作用,降低密闭管道水质恶化风险.

图8 溶解氧对生物膜中硝化细菌的影响
2.3生物膜微生物群落结构变化
微生物在生物膜法处理污染物中起决定性作用,其种群的多样性及丰度很大程度上影响处理效果.同时,微生物群落结构分析能够揭示环境因素对微生物生态分布的作用,从机制上分析生物膜对出水水质的影响.
生物膜454测序收获62 904个有效序列,优化后得到 48 016 个序列.将这些序列进行聚类分析,得到2 240 OTUs(operational taxonomic units).在门和科的水平上,对所有序列进行OTU划分,结果见图9.由图9(a)可以看出,不同溶解氧条件下BAR挂片生物膜中微生物多样性较为丰富,各样品微生物的多样性及丰度存在较大差异.在门的水平,变形菌门 (Proteobacteria)是除样品B1,B2之外,其他生物膜的优势菌群,厚壁菌门(Firmicutes)是B1,B2的优势菌群;变形菌门 (Proteobacteria)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)和拟杆菌门(Bacteroidetes)以不同的丰度分散在各个样品中,硝化螺旋菌门(Nitrospirae)的丰度增加.变形菌门 (Proteobacteria)是细菌中最大的一门,其丰度在各个样品中相对较高;厚壁菌门(Firmicutes)多数为革兰氏阳性菌,可以产生内生孢子,具有极强的抵抗极端环境能力,营厌氧、兼性或好氧生活,因此,在较低溶解氧条件具有较高丰度;硝化螺旋菌门(Nitrospirae)为好氧菌,随着溶解氧质量浓度的提高,其丰度相对增加,而其他门类均是水中普遍存在的微生物, 丰度较高.如图9(b),在科的水平上,所有样品的优势菌群均为假单胞菌科(Pseudomonadaceae),随着溶解氧质量浓度的提高,肠杆菌科(Enterobacteriaceae)的丰度降低,硝化螺旋菌科(Nitrospiraceae)和亚硝化单胞菌科(Nitrosomonadaceae) 的丰度增加.这主要是因为肠杆菌为兼性厌氧菌,在营养物质一定的条件下,低溶解氧有利于其生长;硝化螺旋菌科(Nitrospiraceae)和亚硝化单胞菌科(Nitrosomonadaceae)是好氧菌[21],溶解氧成为其生长及进行硝化作用的动力.由此可以推断,溶解氧对输水管壁生物膜的微生物群落结构有重要影响.

图9 溶解氧对生物膜中微生物丰度和多样性的影响
3结论
1)溶解氧的改变,对出水浊度、总铁的溶出以及氨氮去除均产生较大影响,对总氮和CODMn有一定的去除效果,但随着溶解氧质量浓度升高,去除效果并没大幅度升高;而溶解氧对NH4+-N去除效果有很大影响,溶解氧在3.0 mg/L 以下时,出水的去除率低于20%,随着溶解氧的提高,最高可达43%.溶解氧极大影响出水总铁的质量浓度及生物膜微生物数量,随着溶解氧的提高,出水总铁质量浓度降低;挂片生物膜的铁细菌、硫酸盐还原菌数量减少,硝化细菌数量增加.
2)454-高通量测序对挂片生物膜微生物多样性及丰度分析表明:在门的水平上,变形菌门菌群所占比重最大,其次是厚壁菌门,随着溶解氧的提高,硝化螺旋菌门丰度升高;在科的水平上,优势菌群均为假单胞菌科(Pseudomonadaceae),随着溶解氧质量浓度的提高,肠杆菌门(Enterobacteriaceae)的丰度降低,硝化螺旋菌科(Nitrospiraceae)和亚硝化单胞菌科(Nitrosomonadaceae) 的丰度增加,这与反应器较好的硝化作用相一致.
3)改变管道溶解氧能够提高管壁生物膜的净水作用,同时减缓管道管壁腐蚀,大大提高了输水安全性.
参考文献
[1] LEHTOLA M J, NISSINEN T K, MIETTINEN I T, et al. Removal of soft deposits from the distribution system improves the drinking water quality [J]. Water Research, 2004, 38:601-610.
[2] United states environmental protection agency. health risks from microbial growth and biofilms in drinking water distribution systems [Z]. Distribution System White Paper, 2002.
[3] 李爽, 张晓健. 给水管壁生物膜的生长发育及其影响因素[J].中国给水排水, 2003, 19 (13):49-52.
LI Shuang, ZHANG Xiaojian. Study of the influential factors on the growth of biofilm on distribution water pipe wall [J]. China Water & Wastewater, 2003, 19 (13):49-52.
[4] ROCHEX A, GODON J J, BERNET N, et al. Role of shear stress on composition, diversity and dynamics of biolm bacterial communities [J]. Water Research, 2008 (42):4915-4922.
[5] GAGNON G A, RAND J L, O’LEARY K C, et al. Disinfectant efcacy of chlorite and chlorine dioxide in drinking water biolms [J]. Water Research, 2005 (39):1809-1817.
[6] 王磊, 李海英, 李雪娟,等. 低溶解氧对生物膜特性的影响研究[J]. 中国给水排水, 2003, 24 (15):15-19.
WANG Lei, LI Haiying, LI Xuejuan. The study of low dissolved oxygen concentration on the biofilm characteristics [J]. China Water & Wastewater, 2003, 24 (15):15-19.
[7] LUO Jianghan, LIANG Heng, YAN Lijun, et al. Microbial community structures in a closed raw water distribution system biolm as revealed by 454-pyrosequencing analysis and the effect of microbial biolm communities on raw water quality [J]. Bioresource Technology, 2013 (148):189-195.
[8] HONG P Y, HWANG C, LING F, et al. Pyrosequencing analysis of bacterial biofilm communities in water meters of a drinking water distribution system [J]. Applied and Environmental Microbiology, 2010, 76 (16): 5631-5635.
[9] 中国国家标准化管理委员会.生活饮用水标准检验方法:GB/T5750.1-5750.13[S]. 北京:中国标准出版社, 2006.
Standardization Administration of the People′s Republic of China. Standard examination methods for drinking water: GB/T5750.1-5750.13[S]. Beijing: Standards Press of China, 2006.
[10]中国国家标准化管理委员会. 生活饮用水标准检验方法:GB/T14643.5-14643.6[S]. 北京:中国标准出版社, 2009.
Standardization Administration of the People's Republic of China. Standard examination methods for drinking water: GB/T14643.5-14643.6[S]. Beijing: Standards Press of China, 2006.
[11]俞毓馨, 吴国庆, 孟宪庭, 等.环境工程微生物检验手册[M]. 北京: 中国环境科学出版社, 1990:136-144.
YU Yuxin, WU Guoqing, MENG Xianting. Environmental engineering microbiology test handbook [M]. Beijing: China Environmental Sciences Press, 1990:136-144.
[12]BENJAMI N. Internal corrosion of water distribution systems [M]. 2nd ed. Michigan, USA: American Water Works Association Research Foundation, 1996.
[13]KUCH A. Investigations of the reduction and re-oxidation kinetics of iron (III) oxide scales formed in waters [J]. Corrosion Science, 1988, 28 (3):221-231.
[14]鲁智礼, 王刚亮, 石宝友, 等.消毒剂和溶解氧对管网铁释放影响的中试研究[J]. 环境工程学报, 2014,8(4): 1410-1416.
LU Zhili, WANG Gangliang, SHI Baoyou. Pilot study on effects of disinfectant and dissolved oxygen on iron release in distribution system [J]. Chinese Journal of Environmental Engineering, 2014, 8(4): 1410-1416.
[15]曲久辉. 饮用水安全保障技术原理[M]. 北京: 科学出版社, 2007.
QU Jiuhui. Drinking water security technology principle [M]. Beijing: Science Press, 2007.
[16]HELMER C, TROMM C, HIPPEN A, et al. Single stage biological nitrogen removal by nitrification and anaerobic ammonium oxiadation in biofilm systems [J]. Water Science Technology, 2001, 43 (1): 311-320.
[17]李绍峰, 崔崇威, 黄君礼, 等.溶解氧和HRT对MBR 同步硝化反硝化影响研究[J]. 哈尔滨工业大学学报, 2007, 39(6):887-890.
LI Shaofeng, CUI Chongwei, HUANG Junli,et al. Influence of DO and HRT on simultaneous nitrification and denitrification in MBR[J]. Journal of Harbin institute of Technology, 2007, 39(6):887-890.
[18]BUSALMEN J P, VAZQUEZ M, DESANCHEZ S R, et al. New evidences on the catalase mechanism of mirobial corrosion [J]. Electrochimica Acta, 2002, 47:1857-1865.
[19]武素茹, 段继周. 硫酸盐还原细菌和铁还原细菌混合生物膜对碳钢腐蚀的影响[J]. 材料开发与应用, 2008, 3(23):53-56.
WU Suru, DUAN Jizhou. Effect of sulfate-reducing bacteria and iron-reducing bacteria mixed biofilm on carbon steel corrosion [J]. Development and Application Materials, 2008, 3(23):53-56.
[20]陈野, 刘贵昌. 硫酸盐还原菌腐蚀的防治方法及其研究进展[J]. 腐蚀与防护, 2004, 25(3): 211-217.
CHEN Ye, LIU Guichang. Progress in control of corrosion caused by sulfate-reducing bacteria [J]. Corrosion & Protection, 2004, 25(3): 211-217.
[21]HAO O J, CHEN J M, HUANG L, et al. Sulfate-reducing bacteria [J]. Crit Rev Environ Sci Technol, 1996 (26): 155-187.
[22]BAE H S, RASH B A, RAINEY F A, et al. Description of azospira restricta sp nov., a nitrogen-fixing bacterium isolated from groundwater [J]. International Journal of Systematic and Evolutionary Microbiology, 2007,57 (7):1521-1526.
(编辑刘彤)
doi:10.11918/j.issn.0367-6234.2016.08.004
收稿日期:2015-06-11
基金项目:国家自然科学基金(21301041);科技部科技惠民项目(2013GS370202-003);“十二五”水专项(2012ZX07404-003-004);哈尔滨市科技局优秀学科带头人项目(2013RFXXJ054)
作者简介:雒江菡(1980—),女,博士研究生; 李圭白(1931—),男,博士生导师,中国工程院院士;
通信作者:梁恒,hitliangheng@163.com
中图分类号:X703
文献标志码:A
文章编号:0367-6234(2016)08-0024-07
Effect of dissolved oxygen concentration on pipeline biofilm microbial community structure and effluent water quality
LUO Jianghan1, JIA Ruibao2,YU Ruihong3, YAN Lijun4, LI Guibai1,LIANG Heng1
(1.State Key Laboratory of Urban Water Resource and Environment(Harbin Institute of Technology), Harbin 150090, China;2. Jinan Water Supply and Drainage Monitoring Center, Jinan 250000, China;3. Heilongjiang Vocational College of Biology Science and Technology, Harbin 150025, China; 4. Institute of Cell and Molecular Biology, Harbin University of Commerce, Harbin 150076, China)
Abstract:To improve the safety of distributing raw water, a BAR(Biofilm Annular Reactor)was constructed to simulate the distribution system and the effect of dissolved oxygen (DO) concentration on the effluent water quality and biofilm was studied. The 454-pyrosequencing technology was employed to analyze the diversity of biofilm in the reactor. Experimental results showed that the turbidity and the concentration of total iron, ammonia nitrogen decreased obviously with DO concentration increasing, while the concentrations of total nitrogen and CODMnchanged slightly. The numbers of iron bacteria and sulfate-reducing bacteria reduced significantly, while the richness and diversity of the biofilm related bacteria (such as nitrifying bacteria) improved. So, increasing DO concentration can alleviate the pipeline corrosion and develop biofilm purifying water role.
Keywords:raw water; dissolved oxygen; biofilm; 454-pyrosequencing; microbial community structure
梁恒(1979—),男,教授,博士生导师

