化学改性强化活性炭纤维吸附重金属离子
师 杰,赵志伟,崔福义,梁志杰,孙天一,聂亚林
(1.解放军后勤工程学院 国防建筑规划与环境工程系,重庆 401311;2.哈尔滨工业大学 市政环境工程学院,哈尔滨 150090;3.中国人民解放军69330部队,新疆 哈密 839200)
化学改性强化活性炭纤维吸附重金属离子
师杰1,赵志伟1,崔福义2,梁志杰2,孙天一2,聂亚林3
(1.解放军后勤工程学院 国防建筑规划与环境工程系,重庆 401311;2.哈尔滨工业大学 市政环境工程学院,哈尔滨 150090;3.中国人民解放军69330部队,新疆 哈密 839200)
摘要:为提高活性炭纤维(ACF)对水中重金属离子的吸附性能,采用两种不同改性方法对ACF进行改性处理,比较其对水中Pb(II)、Cu(II)和Co(II)的竞争吸附效能,并对改性前后ACF表面的物理化学特征变化进行分析.结果表明:改性ACF均具有较大的比表面积和孔容积;HNO3及Fe改性后ACF结晶程度较未改性ACF有所降低,且Fe改性ACF具有明显的Fe衍射峰.ACF对重金属离子吸附速率较快,60 min吸附基本达到平衡,HNO3及Fe改性ACF的吸附平衡时间有所增加.初始pH变化直接影响ACF对Pb(II)、Cu(II)和Co(II)的去除效果.3种ACF对重金属离子的亲和力顺序均为Pb(II)>Cu(II)>Co(II),随着平衡质量浓度的增加,其对Pb(II)和Cu(II)的吸附量增大,而对Co(II)的吸附量呈先增加再下降趋势.Langmuir和Freundlich模型均能较好地描述竞争吸附中Pb(II)和Cu(II)离子的吸附过程,但不能有效模拟Co(II)离子的吸附过程.
关键词:活性炭纤维;重金属;竞争吸附;改性;pH;等温线模型
水环境中重金属污染物具有持续性、剧毒性和难降解性等特点,已经引起广泛关注.重金属污染源主要包含人工源和自然源两类,其中人工源是造成水源水中重金属污染的主要原因[1],主要来自矿山、冶金、电子、电镀、石油和化肥生产等工业排水[2].重金属离子Pb(II)、Cu(II)和Co(II)等可以富集在微生物、水生植物和动物等生物体内[3-4],并通过食物链进入人体,导致重金属离子在不同器官内富集,进而影响人体健康[5].因此,重金属污染已经成为水环境中重要问题之一,国家《生活饮用水卫生标准》(GB5749—2006)规定Pb(II)和Cu(II)离子的限值分别为0.01和1.0 mg/L.
目前,常用的重金属离子去除方法有化学沉淀、吸附、电解、离子交换和膜分离等[6-8],其中,吸附技术由于具有快速、高效、操作方便及价格便宜等优点广泛应用于重金属污染物的去除[9].活性炭纤维(ACF)作为一种新型活性炭,具有很大的比表面积以及大量的微孔和丰富的官能团,吸附性能良好.同时,吸附层不会因为碎屑沉积和沉积不均匀而造成阻力增加或流体分布不均,也不会造成二次污染[10],逐步应用于水处理领域.然而,ACF对重金属离子的吸附去除能力有限,限制其在重金属废水处理中的应用.本实验采用浓HNO3及Fe溶液对ACF进行浸渍改性以提高其对重金属离子的吸附能力,在分析ACF表面物理化学特性的基础上,通过吸附动力学、初始pH影响和等温线的研究,评价不同改性方法处理的ACF对Pb(II)、Cu(II)和Co(II)的竞争吸附效能.
1实验
1.1实验配水
根据不同实验需求,采用去离子水添加一定量的Pb(II)、Cu(II)和Co(II)等储备液配制所需质量浓度水源水,其中Pb(II)、Cu(II)和Co(II)储备液采用相应的硝酸盐进行配置,储备液质量浓度均为1 000 mg/L,Pb(II)、Cu(II)和Co(II)储备液的pH均调节为5.5.
1.2实验材料
ACF购于江苏苏通碳纤维有限公司.将ACF剪为10 cm×10 cm的正方形后,放入1 000 mL的大烧杯中,先用蒸馏水冲洗杂物,然后进行加热处理,待煮沸后继续加热半小时,至ACF表明无明显气泡,以去除其中的水溶性和挥发性物质,然后烘干待用,记为ACF-0.
将一定量预处理后的ACF剪为2 cm×2 cm的小块,然后浸渍于质量分数为65%~68%浓硝酸中,在20 ℃水浴条件下氧化2 h,然后用蒸馏水反复冲洗,至滤液呈中性,105 ℃烘干至恒质量,记为ACF-1;将该ACF小块浸渍在体积比为4∶1的0.15 mol·L-1FeCl3·6H2O和FeSO4·7H2O混合溶液200 mL,逐滴加入5 mol·L-1的NaOH溶液50 mL,在80 ℃磁力搅拌下反应4 h,用蒸馏水反复冲洗至中性,105 ℃烘干至恒质量,记为ACF-2.
1.3实验方法
吸附动力学实验中,对于初始质量浓度均为10 mg/L的Pb(II)、Cu(II)和Co(II)重金属离子溶液,加入500 mg/L ACF,并置于摇床中25 ℃恒温震荡,分别于5,10,20,30,60,120,180,240,300 min后取滤液,过滤后测定残余重金属离子质量浓度.
吸附等温线实验中,配制初始质量浓度分别为5,10,15,20,25,30 mg/L的Pb(II)、Cu(II)和Co(II)溶液100 mL于碘量瓶中,并加入500 mg/L ACF于25 ℃摇床中反应6 h,过滤后测定残余重金属离子质量浓度.
初始pH影响因素实验中,500 mg/L ACF加入初始质量浓度均为10 mg/L的Pb(II)、Cu(II)和Co(II)溶液中,利用0.1 mol/L HCl 和 0.1 mol/L NaOH调节初始pH在2.83~9.54变化,置于摇床中25 ℃恒温震荡6 h,过滤后测定pH和残余重金属离子质量浓度,其余实验中pH调节为6.0.
1.4分析方法
重金属离子质量浓度通过ICP-OES电感耦合等离子体发射光谱仪确定,样品测量前通过0.45 μm无机滤膜过滤;SEM通过FEI-Quanta200环境扫描电子显微镜测定,并利用自带能谱仪EDAX Genesis 2000 XMS Image 60S进行样品元素的定性分析;利用ASAP2020M全自动比表面积及孔隙度分析仪在77 K氮气实验条件下分析ACF表面的吸附量和脱附量.XRD采用日本岛津6100型X射线衍射仪测定.
2结果与讨论
2.1ACF表面特性
2.1.1BET结果分析
图1为ACF的孔径分布等温线,3种ACF的孔径主要分布在1~20 nm,有利于ACF对重金属离子的吸附去除.同时,3种ACF的氮气吸附脱附曲线均属于国际纯粹与应用化学联合会(IUPAC)分类的Ⅰ型吸附等温线(插图),表明3种ACF的孔结构均以微孔为主,呈现较强的吸附作用.

图1 ACF的孔径分布曲线
由表1可知,ACF存在发达的内部孔隙,具有较大的比表面积和孔容积,ACF-0比表面积可达1 281.57 m2/g,经HNO3及Fe改性后ACF的BET表面积、BJH平均孔径和孔容均有不同程度的变化.在常温条件作用下,浓HNO3可以溶解ACF表面部分灰分,有利于孔道结构的进一步拓展,但浓HNO3还可以腐蚀ACF结构,导致内部孔道结构产生部分塌陷,进而使改性后ACF的比表面积减少;而Fe改性ACF由于表面负载一层Fe物质,导致部分孔道堵塞[11-12],比表面面积、平均孔径和孔容均相应减少.2.1.2SEM结果分析
由图2(a)可以看出,ACF-0本身存在少量的裂缝和细微的斑点,表面基本呈凹槽状,纤维表面整体上是平滑的.经过HNO3及Fe改性后ACF本身结构没有发生破坏,但其表面形貌发生了变化,表面本身的粗糙度增大,特别是Fe改性ACF-2,其表面包裹着直径约几百nm的白色絮状物,这与Xu等[13]观察到的吸附材料的表面负载现象一致,在载Fe活性炭去除高氯酸盐的实验中,通过SEM观察到活性炭表面存在一层尺寸保持在20~80 nm的纳米铁颗粒.

图2 ACF的SEM图及ACF-2的EDAX图谱
2.1.3XRD结果分析
图3为不同ACF的XRD图谱.3种ACF均出现了石墨化特征的衍射峰C(002),ACF经过HNO3及Fe改性后,衍射峰C(002)的强度减弱,表现为宽而矮的特征,由此可知,ACF-1和ACF-2结晶程度较ACF-0有所降低,并呈现向右移动的趋势;同时,在2θ=44.8°处,三者均检测出一个较小的石墨平面峰C(101),经过HNO3及Fe改性的衍射峰C(101)也有所下降,这两个衍射峰特性表明ACF是由部分石墨微晶构成的无定性区材料[14-16],改性过程本质上是孔的刻蚀过程.此外,Fe改性的ACF-2出现衍射峰Fe(311),该衍射峰为Fe3O4特征峰[16].

图3 ACF的XRD分析
2.2吸附动力学
图4为3种ACF对Pb(II)、Cu(II)和Co(II)离子吸附量随时间变化规律.可以看出,吸附量随时间的增大而增大.对ACF-0,Pb(II)、Cu(II)和Co(II)离子在60 min时吸附基本达到平衡,吸附量可分别达11.48、5.07和2.24 mg/g,在随后吸附时间内基本保持恒定;相比ACF-0吸附过程,HNO3及Fe改性ACF的吸附平衡时间增长,吸附量增大,这主要是因为HNO3及Fe改性可以增加ACF表面羧基和酚羟基等酸性含氧官能团的数量,进而强化ACF与阳离子之间的离子交换反应,而ACF-2制备过程中NaOH溶液的加入可以中和部分羧基和酚羟基,使其与阳离子之间相互作用弱于ACF-1,吸附量相应降低.
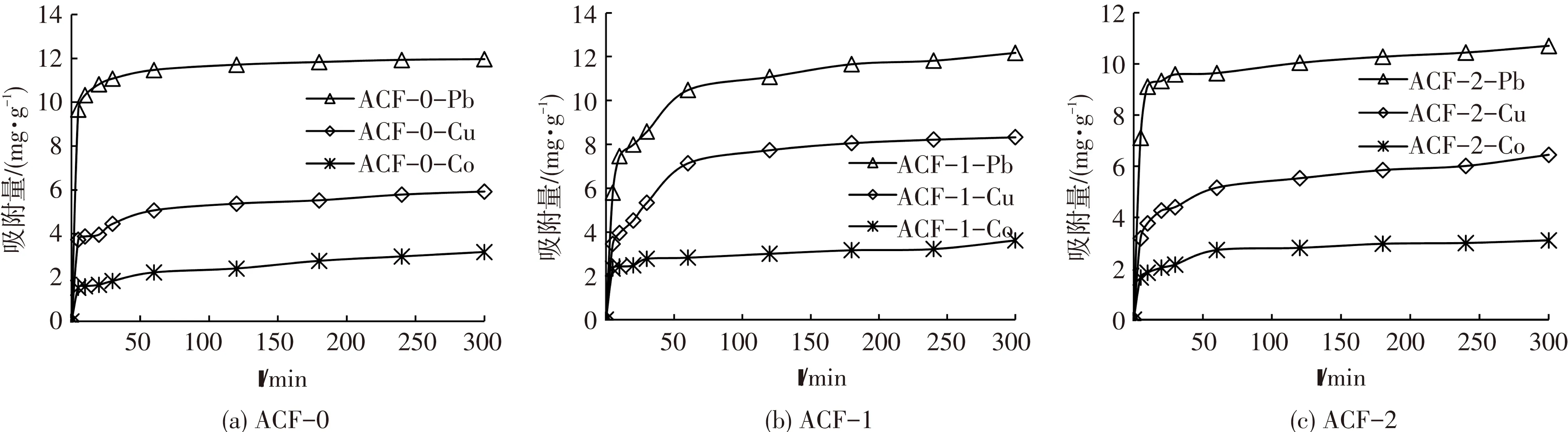
图4 ACF对Pb(II)、Cu(II)和Co(II)离子的竞争吸附动力学
2.3pH影响
pH会通过影响重金属离子形态以及氢氧根与重金属离子之间的配位作用而改变重金属离子和吸附剂之间的相互作用[17].图5为重金属离子吸附过程中pH的变化.可以看出,ACF-0和ACF-2的pHPZC保持在3.66~5.5,而ACF-1的pHPZC保持在2.83~3.66.图6为不同初始pH条件下,不同活性炭纤维对Pb(II)、Cu(II)和Co(II)去除效果的变化.可以看出,随着初始pH的增大,去除率均呈上升趋势.当初始pH≥6.94时,Pb(II)和Cu(II)离子去除效果趋于稳定,去除率保持在95%左右.3种吸附剂ACF-0、ACF-1和ACF-2对Co(II)的去除率分别由7.34%增加为83.43%、7.43%增加为76.25%和6.53%增加为83.61%.这主要是由于pH会影响Pb(II)、Cu(II)和Co(II)在水环境中的存在形态,当pH小于6时,3种重金属主要以离子形式存在,随着pH的增大,PbOH+、CuOH+和CoOH+形式会产生,然后重金属离子将以沉淀形式存在[18-20].

图5 ACF吸附过程中pH的变化

图6 ACF对Pb(II)、Cu(II)和Co(II)去除效果随初始pH的变化
2.4吸附等温线
在重金属离子Pb(II)、Cu(II)、Co(II)初始质量浓度均在5~30 mg/L的条件下,开展多种污染物在ACF-0、ACF-1和ACF-2 3种类型活性炭纤维上的竞争吸附实验,结果见图7.ACF-0、ACF-1和ACF-2均能够同时吸附Pb(II)、Cu(II)和Co(II),其中,ACF-0、ACF-1和ACF-2的亲和力顺序均为Pb(II)>Cu(II)>Co(II),这与离子电负性大小相一致(Pb(2.33)>Cu(1.90)>Co(1.88))[21].同时,随着平衡质量浓度的增加,Pb(II)和Cu(II)两者的吸附量随之增大,而Co(II)由于与ACF亲和力最低,吸附位点被Pb(II)和Cu(II)离子占据,致使其吸附量增幅缓慢,甚至出现吸附量下降的现象(图7(a)、(b)).其他竞争吸附实验中也观察到类似现象[22],在CNTs竞争吸附Pb(II)、Cu(II)和Cd(II)实验中,Cd(II)亲和力最小,其在平衡质量浓度为2.9 mg/L时,吸附量最大,为7.1 mg/g,然后随着平衡质量浓度的增大,吸附量下降.

图7 ACF对Pb(II)、Cu(II)和Co(II)离子的竞争吸附等温线
利用Langmuir和Freundlich吸附等温线模型对实验数据进行拟合,相关参数比较见表2.ACF-0、ACF-1和ACF-2 3种吸附剂对Pb(II)和Cu(II)的吸附过程能够利用等温线模型进行模拟,其中Langmuir相关性R2(>0.98)值略大于Freundlich相关性R2(>0.95),其拟合结果与实验数据相吻合,而Co(II)在Langmuir和Freundlich吸附等温线模型中的相关性分别为0.173 3和0.049 8,相关性较差,由此可知,在竞争吸附过程中,由于Co(II)与ACF亲和力差,吸附过程受Pb(II)和Cu(II)影响较大,无法利用Langmuir和Freundlich模型拟合.由表2 Langmuir数据分析可知,HNO3及Fe改性能够有效提高ACF对重金属离子的去除效果,3种吸附剂对Pb(II)和Co(II)去除效果大小为ACF-1>ACF-2>ACF-0,而对Cu(II)去除效果大小为ACF-2>ACF-0>ACF-1.总体来讲,HNO3改性ACF对重金属离子去除效果最好,其对Pb(II)、Cu(II)和Co(II)的吸附量分别可达38.61、11.29和4.88 mg/g.
此外,利用0.1 mol/L HCl对3种ACF进行解吸处理,通过对比5次重复吸附实验效果考察3种吸附剂重复使用效率,结果表明3种ACF均具有较好的重复使用性.以Pb(II)为例,其吸附量分别由第1次的19.61、38.61和28.17 mg/g下降到第5次的16.76、34.21和21.13 mg/g,仍保持较高去除效能.

表2 Langmuir 及 Freundlich模型拟合参数
3结论
1)ACF均具有较大的比表面积和孔容积,HNO3改性ACF由于能够腐蚀活性炭纤维内部孔道使比表面有所减少,而Fe改性ACF由于孔道堵塞使比表面有所下降;ACF是由部分石墨微晶构成的无定性区材料,HNO3及Fe改性使ACF结晶程度降低.
2)ACF对Pb(II)、Cu(II)和Co(II)的吸附在60 min基本达到平衡,HNO3及Fe改性ACF的吸附平衡时间有所增长;随着初始pH的增大,3种ACF对Pb(II)、Cu(II)和Co(II)的去除效率增加.
3)ACF均能够同时吸附Pb(II)、Cu(II)和Co(II),随着平衡质量浓度的增加,Pb(II)和Cu(II)两者的吸附量随之增大;而Co(II)由于与ACF亲和力最低,吸附位点被Pb(II)和Cu(II)占据,致使其吸附量增幅缓慢,甚至出现吸附量下降的现象.
4) HNO3及Fe改性能够强化ACF对Pb(II)、Cu(II)和Co(II)的吸附效果,除Co(II)外,Langmuir和Freundlich模型的相关性R2>0.95,其拟合结果与实验数据相吻合.
参考文献
[1] 王海东, 方凤满, 谢宏芳. 中国水体重金属污染研究现状与展望 [J]. 广东微量元素科学, 2010, 17(1): 14-18.
WANG H, FANG F, XIE H. Research situation and outlook on heavy metal pollution in water environment of China [J].Guangdong Trace Elements Science, 2010, 17(1): 14-18.
[2] GUZE F, YAKUT H, TOPAL G. Determination of kinetic and equilibrium parameters of the batch adsorption of Mn (II), Co (II), Ni (II) and Cu (II) from aqueous solution by black carrot (Daucus carota L.) residues [J]. Journal of Hazardous Materials, 2008, 153(3): 1275-1287.
[3] VAROL M. Assessment of heavy metal contamination in sediments of the Tigris River (Turkey) using pollution indices and multivariate statistical techniques [J]. Journal of Hazardous Materials, 2011, 195: 355-364.
[4] VAROL M, SEN B. Assessment of nutrient and heavy metal contamination in surface water and sediments of the upper Tigris River, Turkey[J]. Catena, 2012, 92: 1-10.
[5] WANG X, SATO T, XING B, et al. Health risks of heavy metals to the general public in Tianjin, China via consumption of vegetables and fish [J]. Science of the Total Environment, 2005, 350(1): 28-37.
[6] KONG Z, LI X, TIAN J, et al. Comparative study on the adsorption capacity of raw and modified litchi pericarp for removing Cu (II) from solutions [J]. Journal of Environmental Management, 2014, 134: 109-116.
[7] FU F, WANG Q. Removal of heavy metal ions from wastewaters: a review [J]. Journal of Environmental Management, 2011, 92(3): 407-418.
[8] YU Y, ZHAO C, WANG Y, et al. Effects of ion concentration and natural organic matter on arsenic (V) removal by nanofiltration under different transmembrane pressures [J]. Journal of Environmental Sciences, 2013, 25(2): 302-307.
[9] MEITEI M D, PRASAD M N V. Adsorption of Cu (II), Mn (II) and Zn (II) by Spirodela polyrhiza (L.) Schleiden: equilibrium, kinetic and thermodynamic studies [J]. Ecological Engineering, 2014, 71: 308-317.
[10]SUN Z, YU Y, PANG S, et al. Manganese-modified activated carbon fiber (Mn-ACF): novel efficient adsorbent for Arsenic [J]. Applied Surface Science, 2013, 284: 100-106.
[11]REY A. Catalytic wet peroxide oxidation of phenol over Fe/AC catalysts: influence of iron precursor and activated carbon surface [J]. Applied Catalysis B: Environmental, 2009, 86(1/2): 69-77.
[12]SIGRIST M E, BRUSA L, BELDOMENICO H R, et al. Influence of the iron content on the arsenic adsorption capacity of Fe/GAC adsorbents [J]. Journal of Environmental Chemical Engineering, 2014, 2(2): 927-934.
[13]XU J, GAO N, DENG Y, et al. Nanoscale iron hydroxide-doped granular activated carbon (Fe-GAC) as a sorbent for perchlorate in water [J]. Chemical Engineering Journal, 2013, 222: 520-526.
[14]侯方, 陈明, 佟明友. 硝酸处理对活性炭性质的影响 [J]. 化学与生物工程, 2011, 28(5): 70-73.
HOU F, CHEN M, TONG M. Influence of nitric acid modification on properties of active carbon [J]. Chemistry & Bioengineering, 2011, 28(5): 70-73.
[15]PENG L, CHEN Y, DONG H, et al. Removal of trace As (V) from water with the titanium dioxide/ACF composite electrode [J]. Water, Air, & Soil Pollution, 2015, 226(7): 1-11.
[16]陈龙. 载铁活性炭纤维的制备及其用于Fenton体系降解罗丹明B和除氟的研究 [D]. 武汉:武汉理工大学, 2014.
CHEN L. Preparation of Fe-modified activated carbon fiber and its applications for Fenton degradation of Rhodamine B and adsorption of fluoride [D]. Wuhan: Wuhan University of Technology, 2014.
[17]CAO F, YIN P, ZHANG J, et al. Nanoplates of cobalt phosphonate with two-dimensional structure and its competitive adsorption of Pb (II) and Hg (II) ions from aqueous solutions [J]. Journal of Industrial and Engineering Chemistry, 2014, 20(4): 2568-2573.
[18]DEPCI T, KUL A R, ONAL Y. Competitive adsorption of lead and zinc from aqueous solution on activated carbon prepared from Van apple pulp: study in single-and multi-solute systems [J]. Chemical Engineering Journal, 2012, 200: 224-236.
[19]SUN W L, XIA J, SHAN Y C. Comparison kinetics studies of Cu (II) adsorption by multi-walled carbon nanotubes in homo and heterogeneous systems: effect of nano-SiO2[J]. Chemical Engineering Journal, 2014, 250: 119-127.
[20]HE M, ZHU Y, YANG Y, et al. Adsorption of cobalt (II) ions from aqueous solutions by palygorskite [J]. Applied Clay Science, 2011, 54(3): 292-296.
[21]ZHANG M. Adsorption study of Pb(II), Cu(II) and Zn(II) from simulated acid mine drainage using dairy manure compost [J]. Chemical Engineering Journal, 2011, 172 (1): 119-127.
[22]LI Y H, DING J, LUAN Z, et al. Competitive adsorption of Pb2+, Cu2+and Cd2+ions from aqueous solutions by multiwalled carbon nanotubes [J]. Carbon, 2003, 41(14): 2787-2792.
(编辑刘彤)
doi:10.11918/j.issn.0367-6234.2016.08.017
收稿日期:2015-12-17
基金项目:国家自然科学基金(51508564);重庆市前沿与应用基础研究计划(cstc2015jcyjA20024)
作者简介:师杰(1988—),男,博士研究生; 赵志伟(1976—),男,教授,博士生导师; 崔福义(1958—),男,教授,博士生导师
通信作者:赵志伟,hit_zzw@163.com
中图分类号:TU991
文献标志码:A
文章编号:0367-6234(2016)08-0102-06
Enhancement of heavy metals adsorption on activated carbon fibers by chemically modification
SHI Jie1, ZHAO Zhiwei1, CUI Fuyi2, LIANG Zhijie2, SUN Tianyi2, NIE Yalin3
(1.Department of National Defense Architecture Planning and Environmental Engineering, Logistical Engineering University,Chongqing 401311, China;2.School of Municipal and Environmental Engineering, Harbin Institute of Technology,Harbin 150090,China; 3.Troops 69330 PLA,Hami 839200, Xinjiang, China)
Abstract:To enhance the adsorption capacity of activated carbon fibers (ACF) towards heavy metals, the surface modification of ACF was conducted and the physical and chemical characteristics were analyzed. Additionally, the competitive adsorption of Pb(II), Cu(II) and Co(II) from liquid solution on the modified ACF were evaluated. It was found that both the modified and unmodified ACF had large specific surface areas and pore volumes. Compared with the unmodified ACF, the crystallinity of Fe and HNO3 modified ACF showed a trend of decrease, and the Fe modified ACF appeared on obvious Fe characteristic diffraction peak. The rate of heavy metal ions adsorption onto ACF were so fast that the adsorption equilibrium achieved at about 60 minutes, and the adsorption equilibrium time increased after the Fe and HNO3 modification. The removal of Pb(II), Cu(II) and Co(II) were influenced significantly by the initial pH. The adsorption af�nity to the three heavy metals was in the order of Pb > Cu > Co for all types of ACF. With the increase of initial concentration, the adsorption amount of Pb(II) and Cu(II) increased, while the adsorption amount of Co (II) increased firstly and then decreased. The Langmuir and Freundlich models could well describe the competitive adsorption process of Pb (II) and Cu (II), but not effectively simulate the adsorption process of Co (II).
Keywords:ACF; heavy metals; competitive adsorption; modification; pH; isotherm model

