系统素多肽激素适配体功能化磁性纳米量子点的构建及特性研究
秦 群, 郭 琳, 郑 弦, 孙 林, 阮贵华, 杜甫佑
(桂林理工大学 a.化学与生物工程学院;b.岩溶地区水污染控制与用水安全保障协同创新中心, 广西 桂林 541004)
系统素多肽激素适配体功能化磁性纳米量子点的构建及特性研究
秦群a, 郭琳a, 郑弦a, 孙林a, 阮贵华, 杜甫佑
(桂林理工大学 a.化学与生物工程学院;b.岩溶地区水污染控制与用水安全保障协同创新中心, 广西 桂林541004)
摘要:以碳二亚胺法合成了对目标植物多肽激素具有高特异性、强亲和作用的适配体功能化磁性纳米量子点荧光探针(Fe3O4@mSiO2-QDs-Apt), 研究了其选择性和荧光特性。首先在Fe3O4磁性纳米粒子上包裹一层二氧化硅以克服Fe3O4磁性纳米粒子自身表现出的不稳定性、易团聚以及被缓慢化学腐蚀等缺点。通过自组装、静电作用、共价作用实现Fe3O4@mSiO2表面修饰氨基, 再以碳二亚胺法偶联上量子点和系统素适配体。通过对体系中缓冲液及其pH值等条件的优化, Fe3O4@mSiO2-QDs-Apt在pH 8.6的Tris-HCl缓冲液体系中荧光最强, 并能与目标系统素多肽特异性结合, 使探针的荧光发生猝灭, 猝灭程度随加入目标多肽浓度的增大而增强, 且Fe3O4@mSiO2-QDs-Apt探针对不同多肽的识别能力不同。与适配体功能化量子点荧光探针(QDs-Apt)相比较, Fe3O4@mSiO2-QDs-Apt的荧光强度有所降低, 但适配体的特异性识别能力不变, 由此拓展了QDs-Apt在生物样品分析中的应用研究。
关键词:适配体;量子点;系统素;多肽激素;磁性纳米粒子;荧光探针
磁性纳米粒子一般是指尺寸在1~100 nm的磁性颗粒, 是20世纪70年代后逐步产生并发展起来的一种具有广阔应用前景的新型功能性材料[1-2]。磁性纳米粒子不仅具有量子尺寸效应、宏观量子隧道效应、表面效应和协同效应等特性, 而且还具有特有的超顺磁性、高矫顽力、低居里温度和高磁化率等新型特性[3-6]。磁性纳米粒子的制备工艺简单、 无毒无污染以及表面可联接生化活性功能基团等特性[7], 使其在核酸分析、靶向药物和酶固定化等领域得到广泛应用[8-9]。
量子点(quantum dots, QDs)又称为半导体纳米微晶体, 是一种由Ⅱ—Ⅵ族或Ⅲ—Ⅴ族元素组成的纳米颗粒。 由于粒径小(约1~100 nm), 电子和空穴被量子限域, 连续能带变成具有分子特性的分立能级结构, 因此量子点的光学行为与一些荧光分子相似, 受到激发后可发射出荧光[10]。QDs具有许多有机荧光分子不具备的优点, 如有可调谐的激发波、抗漂白性、狭窄的激发波长和远离激发峰激发等优良的光学性质[11]。 因此, QDs成为比有机荧光分子更好的荧光能量共振转移(FRET)的供体或受体[12-14]。利用适配体特异性强、亲和力高、稳定性高、易合成、易修饰等特性, 将其与量子点偶合可制备各种高灵敏、高选择、高亲和的纳米量子点荧光探针, 已广泛应用于环境、食品、医学检测与成像等诸多领域[15-17]。
植物多肽激素主要有系统素(Systemin)、 植物硫肽素(Phytosulfokine)、 SCRPSP11 和CLV3等[18],其与生长素、 细胞分裂素、赤霉素、脱落酸以及油菜素内酯等小分子激素一样, 参与植物生长、发育及抗逆等许多生命过程, 特别是作为信号分子在细胞与细胞之间短距离的信息交流中起着关键作用[19-20]。为研究植物多肽激素的作用机理, 构建超灵敏准确分析多肽激素的方法尤为迫切。但由于植物多肽激素的含量很低, 准确分离分析植物样品中多肽激素仍面临诸多的挑战[21-23]。
笔者将磁性纳米粒子与量子点相结合,用高亲和力、能与各类靶分子特异性地结合的适配体修饰,得到一种新型的适配体功能化磁性纳米量子点荧光探针,以期实现样品中目标多肽激素的准确检测。
1实验部分
1.1主要仪器
上海雷磁PHS-3C型精密pH计(上海精密科学仪器有限公司); UPS-II-20L型生化分析型超纯水机(上海楚柏实验室设备有限公司); FD-1系列真空冷冻干燥机(北京博医康实验仪器有限公司); 傅里叶红外光谱仪; 恒温振荡器(常州国华有限公司); DF-101S集热式恒温加热磁力搅拌器(巩义市予华仪器有限公司); RF-5301(PC)S荧光分光光度计(日本岛津)。
1.2主要试剂
Fe3O4磁性纳米粒子(上海阿拉丁公司); 正硅酸乙酯(TEOS)(国药集团化学试剂有限公司); 氨水(汕头市西陇化工厂有限公司); 硅烷偶联剂(KH-550)(上海耀华化工厂); 三(羟甲基)氨基甲烷(Tris)(国药集团化学试剂有限公司); 硼酸(西陇化工厂有限公司); 四硼酸钠(西陇化工厂有限公司); 无水乙醇(西陇化工厂有限公司); 氢氧化钠(天津市化学试剂工厂); 浓盐酸(汕头市西陇化工厂有限公司); 羧基的水溶性CdSe/ZnS量子点(珈源量子点技术开发有限公司, Q2605, 5 nmol/L); 碳二亚胺盐酸盐(EDCHCl)(阿拉丁); N-羟基琥珀酰亚胺(上海阿拉丁公司); 适配体(Oligo DNA)[25](5′/5AMINO/-GCA CTA ACG GGG TTT CGG GGG GGT AGG GAG GTT AGT GC-3′, 赛百盛公司); 多肽(蕃茄系统素Ⅰ、 烟草系统素Ⅰ、 烟草系统素Ⅱ)(上海强耀生物科技有限公司); 其他化学试剂均为分析纯或更高级别, 试验用水全部为去离子水。
1.3Fe3O4磁性纳米粒子的表面修饰
称取1.000 g Fe3O4磁性纳米粒子超声分散于40 mL乙醇、10 mL二次水及3 mL氨水(33.3%)混合液中,逐滴加入5 mL正硅酸乙酯(TEOS),在磁性搅拌器中磁性搅拌反应24 h取出后进行磁场分离,用乙醇洗脱洗净,获得复合Fe3O4@mSiO2磁性纳米粒子。然后加入35 mL乙醇、1 mL超纯水,将3 mLγ-氨丙基三乙氧基硅烷(APTES, KH550)逐滴加入溶液中,0.5 h滴完。在室温下磁性搅拌反应7 h后取出,磁场分离,用乙醇洗涤数次后置于冰箱中冷冻结冰,一般冷冻2~4 h,然后取出置于真空冷冻干燥机中进行冷冻干燥,得到氨基修饰的Fe3O4@mSiO2-NH2磁性纳米粒子,密封保存待用。
1.4适配体功能化磁性纳米量子点粒子的合成
取10 μL羧基的水溶性CdSe/ZnS量子点(8.0 μmol/L)加入到190 μL含20 mmol/L的PBS缓冲溶液(室温, pH=7.4)和10 μL 0.1 g/mL的N-羟基琥珀酰亚胺溶液(NHS)中, 加入10 μL 0.1 g/mL的1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐溶液(EDC·HCl), 在磁力搅拌器中磁力搅拌0.5 h后, 加入0.001 1 g Fe3O4@mSiO2-NH2磁性纳米粒子, 继续室温磁力搅拌反应2 h。 Fe3O4@mSiO2-NH2磁性纳米粒子与量子点偶合后, 加入10 μL 0.1 g/mL的N-羟基琥珀酰亚胺溶液和10 μL 0.1 g/mL的1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐溶液, 在磁力搅拌器中磁力搅拌0.5 h后, 加入28 nmol氨基修饰的适配体(NH2-Aptamer), 继续室温磁力搅拌反应2 h。完成后得到Fe3O4@mSiO2-QDs-Apt, 放置于4 ℃的冰箱待用。此外, 适配体功能化纳米量子点荧光探针(QDs-Apt)作为对照样品按照相似方法合成。 先取10 μL羧基的水溶性CdSe/ZnS量子点(8.0 μmol/L)加入到190 μL 20 mmol/L PBS溶液(室温, pH 7.4)和10 μL的0.1 g/mL的N-羟基丁二酰亚胺溶液, 再加入10 μL的0.1 g/mL的碳二亚胺盐酸盐溶液, 磁力搅拌反应30 min后, 再加入28 nmol氨基修饰的适配体(NH2-Aptamer, NH2-Apt), 继续室温磁力搅拌反应2 h, 得到QDs-Apt, 放置在4 ℃的冰箱待用。
1.5荧光检测
荧光激发波长为380 nm,考察不同缓冲液、同一种缓冲液不同pH值、不同时间段、番茄系统素系列浓度、不同多肽对量子点荧光强度的影响, 所有荧光数据均进行平行3次测定。
2结果与讨论
2.1Fe3O4@mSiO2-NH2红外表征
图1曲线a为纯Fe3O4磁性纳米粒子的红外谱图, 3 436 cm-1附近出现的谱带应为OH—的伸缩振动所产生, 其弯曲振动所对应的谱带在1 631 cm-1附近, 557 cm-1则对应于Fe—O—Fe的伸缩振动。
图1曲线b对应的是氨基修饰的Fe3O4磁性纳米粒子的红外谱图。经硅烷修饰后的Fe3O4磁性纳米粒子, 其Fe—O—Si键的特征吸收峰无法从红外谱图中直接看出, 原因是Fe—O—Si键的特征吸收峰在584 cm-1左右, 与Fe3O4磁性纳米粒子Fe—O键的吸收峰发生重叠, 在564 cm-1处形成了新的吸收峰。 1 401、 1 384、 1 079 cm-1处的谱带为Si—O—CH2CH3基团的特征峰。 3 412 cm-1附近出现的谱带为N—H伸缩振动, 3 150 cm-1的谱带对应—CH2—C—H伸缩振动, 1 384 cm-1的谱带对应于C—H的面内弯曲振动, 1 092 cm-1的谱带则为Si—O伸缩振动。 可见,经偶联剂修饰过后的磁性纳米粒子带有—OH、 —NH、 —NH2、 —C—O、 —C—OH等多种功能基团,表明γ-氨丙基三乙氧基硅烷已修饰在Fe3O4磁性纳米粒子表面。
2.2合成Fe3O4@mSiO2-QDs-Apt
先以SiO2包裹Fe3O4合成Fe3O4@mSiO2磁性微球, 从而克服Fe3O4磁性纳米粒子自身表现出来的不稳定性、 易团聚以及被缓慢化学腐蚀等缺点。通过γ-氨丙基三乙氧基硅烷在Fe3O4@mSiO2表面修饰氨基, 以N-羟基琥珀酰亚胺(NHS)和1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(EDC·HCl)对量子点表面裸露的羧基进行活化, 通过表面活化的量子点和氨基化的磁性纳米粒子Fe3O4@mSiO2偶合, 再通过碳二亚胺法得到Fe3O4@mSiO2-QDs-Apt(图2)。 显微电镜图(图3)表明, 合成所得的Fe3O4@mSiO2-QDs-Apt比羧基化CdSe/ZnS量子点的粒径大, 表面较规整, 其平均粒径约为25 nm, 能均匀分散于溶液中。
2.3Fe3O4@mSiO2-QDs-Apt特性
2.3.1缓冲体系对Fe3O4@mSiO2-QDs-Apt荧光的影响不同缓冲体系对量子点荧光性质的影响不同, 尤其修饰上其他基团后, 各基团可能在不同缓冲体系中使荧光加强或减弱, 同时也影响量子点的稳定性。图4结果表明, 在pH值相同的Tris-HCl、硼酸、PBS这3种缓冲液体系中, 相同浓度Fe3O4@mSiO2-QDs-Apt时体系的荧光强度不同, 其中在Tris-HCl缓冲液中的荧光最强, PBS缓冲液中荧光最弱;未修饰磁性纳米粒子的QDs-Apt在Tris-HCl缓冲液荧光最强, 硼酸缓冲液最弱。因此, 选用Tris-HCl缓冲液作为实验的缓冲体系。此外, 修饰后磁性纳米粒子量子点的荧光有所减弱, 其原因可能是合成过程中部分量子点未被磁性纳米粒子功能化, 从而被分离出Fe3O4@mSiO2-QDs-Apt体系, 使对应的荧光强度略有减弱。

图2 合成Fe3O4@mSiO2-QDs-Apt示意图Fig.2 Synthesis of Fe3O4@mSiO2-QDs-Apt

图3 羧基化CdSe/ZnS量子点(A, 武汉珈源量子点技术开发有限公司提供) 和适配体功能化磁性纳米量子点Fe3O4@mSiO2-QDs-Apt(B)的扫描电镜图Fig.3 SEM microphotographs of carboxylic CdSe/ZnS (A) and Fe3O4@mSiO2-QDs-Apt (B)
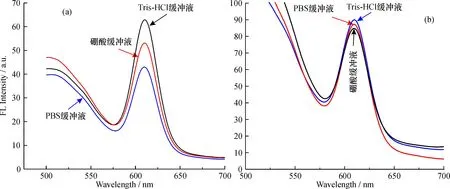
图4 Fe3O4@mSiO2-QDs-Apt(a)和QDs-Apt (b)在不同缓冲液的光谱图Fig.4 Fluorescence spectra of QDs-Apt (a)and Fe3O4@mSiO2-QDs-Apt (b)in different buffer
2.3.2缓冲体系pH值对Fe3O4@mSiO2-QDs-Apt荧光的影响缓冲液的pH 值不仅影响量子点的荧光强度, 更重要的是影响其稳定性。由图5可知, 在Tris-HCl缓冲液中, Fe3O4@mSiO2-QDs-Apt和QDs-Apt在pH值等于或小于8.0的缓冲液中其荧光随着pH值变小而减弱; 在pH值大于8.6的缓冲液中荧光急剧变弱; pH值为8.0~8.6时是Fe3O4@mSiO2-QDs-Apt和QDs-Apt缓冲液的最适范围; 在pH值为8.6时荧光最强。QDs-Apt修饰上磁性纳米粒子后虽然在不同缓冲液中的荧光整体下降, 但是缓冲液最佳范围不变。因此, Fe3O4@mSiO2-QDs-Apt缓冲体系的最佳pH值选为8.6。
2.3.3与多肽的反应时间对Fe3O4@mSiO2-QDs-Apt荧光的影响适配体能特异性识别多肽, 可与多肽特异性结合, 识别目标分子, 但其识别过程需要一定的时间。图6表明, Fe3O4@mSiO2-QDs-Apt和QDs-Apt与番茄系统素识别后的荧光强度随着时间增长而增强, 到3 h时荧光最强, 之后体系的荧光强度降低。因此, 加入植物多肽反应3 h后测定体系的荧光强度。
2.3.4多肽对Fe3O4@mSiO2-QDs-Apt荧光的影响适配体上含特定的碱基序列, 对多肽有选择性识别, 能特异性结合多肽。图7的实验结果表明, Fe3O4@mSiO2-QDs-Apt和QDs-Apt的荧光强度随着溶液中的蕃茄系统素浓度的增加而减小, 荧光的猝灭度随着蕃茄系统的浓度增加而增大。对比两种物质的荧光光谱图可知, QDs-Apt修饰在磁性纳米粒子上, 磁性纳米粒子只是让量子点的荧光强度有所下降, 并不影响适配体对多肽物质的特异性识别, 也没有改变量子点的性质。

图5 Fe3O4@mSiO2-QDs-Apt(Ⅰ)和QDs-Apt(Ⅱ)在不同pH缓冲液中的荧光光谱Fig.5 Fluorescence spectra of Fe3O4@mSiO2-QDs-Apt(Ⅰ) and QDs-Apt(Ⅱ)in different pH

图6 Fe3O4@mSiO2-QDs-Apt(Ⅰ)和QDs-Apt(Ⅱ)与多肽反应不同时间的荧光光谱Fig.6 Fluorescence spectra of Fe3O4@mSiO2-QDs-Apt (Ⅰ)and QDs-Apt (Ⅱ)reaction with plant peptide hormones at different times
2.3.5Fe3O4@mSiO2-QDs-Apt荧光探针对不同多肽的选择性识别多肽的种类很多, 不同的多肽分子量不同, 所含肽片段、基团也不同, 对量子点荧光的猝灭程度也有差异。本实验考察了3种不同多肽对Fe3O4@mSiO2-QDs-Apt和QDs-Apt荧光的影响, 在Fe3O4@mSiO2-QDs-Apt和QDs-Apt各4份溶液中分别加入等量不同种类的多肽, 反应3 h后测定荧光。由结果图8可知,不同多肽对偶联物量子点的荧光猝灭程度是不同的: 番茄系统素对偶联物的荧光猝灭的程度最大, 烟草系统素Ⅰ和烟草系统素Ⅱ的猝灭程度较小, 表明所制备的适配体功能化探针对相似的多肽激素有识别作用, 其中Fe3O4@mSiO2-QDs-Apt对番茄系统素的识别能力最强, QDs-Apt对多肽激素的识别结果相似。为了能增加特异性识别能力, 后期将筛选更高特异性适配体, 从而实现高选择性识别。
3结论
采用碳二亚胺法制备出对目标多肽激素具有一定识别能力的适配体功能化磁性纳米粒子量子点Fe3O4@mSiO2-QDs-Apt。在优化的实验条件下, 该荧光探针具有荧光强度大、稳定性好、识别能力较好等特点。在pH值为8.6的Tris-HCl缓冲液中能特异性结合多肽激素, 使探针的荧光发生明显猝灭, 其荧光猝灭程度随着多肽浓度的增加而增强, 且Fe3O4@mSiO2-QDs-Apt对不同植物多肽的猝灭程度不同, 在一定范围内可选择性识别系统素多肽。该探针可用于实际样品中目标多肽激素的分离富集和荧光检测, 实现植物体中系统素多肽激素的高灵敏检测, 并将为植物多肽激素的分子作用机理研究提供新的检测平台。
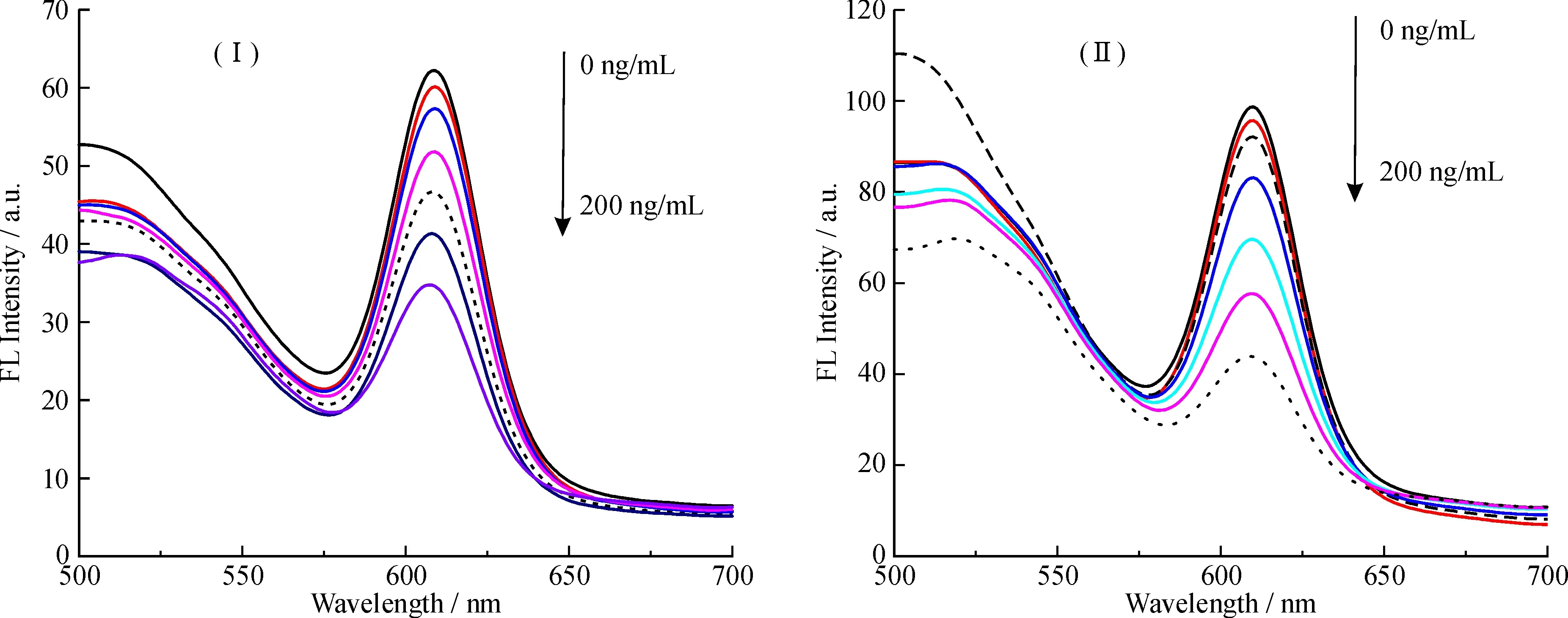
图7 Fe3O4@mSiO2-QDs-Apt(Ⅰ)和 QDs-Apt(Ⅱ)与系列多肽浓度反应荧光光谱 (由箭头方向浓度依次为0、 10、 20、 50、 100、 150、 200 ng/mL)Fig.7 Fluorescence spectra of Fe3O4@mSiO2-QDs-Apt(Ⅰ)and QDs-Apt(Ⅱ)reaction in the series of peptide concentration
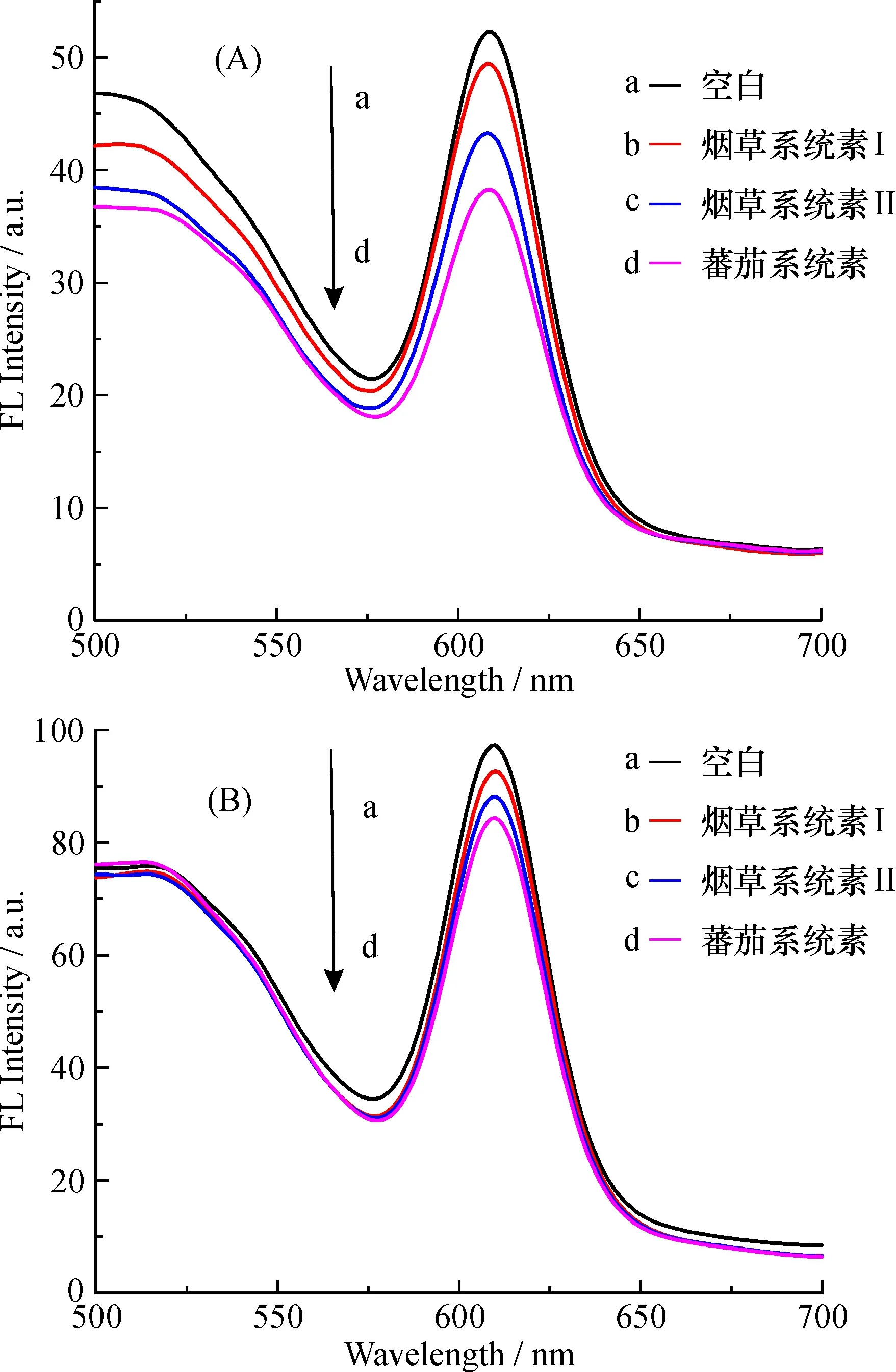
图8 不同多肽Fe3O4@mSiO2-QDs-Apt(A)和 QDs-Apt(B)的荧光光谱Fig.8 Fluorescence spectra of Fe3O4@mSiO2-QDs-Apt (A) and QDs-Apt(B)reaction with different polypeptides
参考文献:
[1]Yuan J Y, Xu Y Y, Müller A H E. One-dimensional magnetic inorganic-organic hybrid nanomaterials[J]. Chem. Soc. Rev., 2011, 40: 640-655.
[2]熊雷, 姜宏伟, 王迪珍. Fe3O4磁性纳米粒子表面修饰研究进展[J]. 材料导报, 2008, 22 (5):31-34.
[3]Chen M, Liu J P, Sun S H. One-step synthesis of FePt nanoparticles with tunable size[J]. J. Am. Chem. Soc., 2004, 126 (27): 8394-8395.
[4]赵永纲, 沈昊宇, 李勍, 等. 氨基功能化纳米Fe3O4磁性高分子吸附剂对废水中Cr(VI)的吸附研究[J]. 化学学报, 2009, 6 (13): 1509-1514.
[5]Krötz F, de Wit C, Sohn H Y, et al. Magnetofection—A highly efficient tool for antisense oligonucleotide delivery in vitro and in vivo[J]. Molecular Therapy: The Journal of the American Society of Gene Therapy, 2003, 7(5 Pt 1): 700-710.
[6]Scherer F, Anton M, Schillinger U, et al. Magnetofection: Enhancing and targeting gene delivery by magnetic force in vitro and in vivo[J]. Gene Therapy, 2002, 9(2): 102-109.
[7]Cheng F Y, Su C H, Yang Y S, et al. Characterization of aqueous dispersions of Fe3O4nanoparticles and their biomedical applications[J]. Biomaterials, 2005, 26(7): 729-738.
[8]Xie X, Zhang X, Zhang H, et al. Preparation and application of surface-coated superparamagnetic nanobeads in the isolation of genomic DNA[J]. Journal Magnetism and Magnetic Materials, 2004, 277 (1-2): 16-23.
[9]Stoeva S I, Huo F W, Lee J S, et al. Three-layer composite magnetic nanoparticle probes for DNA[J]. Journal of the American Chemical Society, 2005, 127 (44): 15362-15363.
[10]Kairdolf B A, Smith A M, Stokes T H, et al. Semiconductor quantum dots for bioimaging and biodiagnostic applications[J]. Annual Review of Analytical Chemistry, 2013, 6(1): 143-162.
[11]邹明强, 杨蕊, 李锦丰, 等. 量子点的光学特征及其在生命科学中的应用[J]. 分析测试学报, 2005, 24 (6): 133-137.
[12]王宗花, 高艳丽, 张菲菲, 等. 量子点在分析检测中的应用进展[J]. 分析科学学报, 2012, 28 (1):119-125.
[13]秦大明, 柏亚铎, 赖平安, 等. 量子点在生命科学中的应用及发展趋势[J]. 动物医学进展, 2007, 28 (6): 76-82.
[14]Mattoussi H, Palui G, Na H B. Luminescent quantum dots as platforms for probing in vitro and in vivo biological processes[J]. Advanced Drug Delivery Reviews, 2012, 64(2): 138-166.
[15]Algar W R, Susumu K, Delehanty J B, et al. Semiconductor quantum dots in bioanalysis: Crossing the valley of death[J]. Analytical Chemistry, 2011, 83(23): 8826-8837.
[16]Xing H, Wong N Y, Xiang Y, et al. DNA aptamer functionalized nanomaterials for intracellular analysis, cancer cell imaging and drug delivery[J]. Current Opinion in Chemical Biology, 2012, 16(3-4): 429-435.
[17]Zhang C L, Ji X H, Zhang Y, et al. One-pot synthesized aptamer-functionalized CdTe: Zn2+quantum dots for tumor-targeted fluorescence imaging in vitro and in vivo[J]. Analytical Chemistry, 2013, 85(12): 5843-5849.
[18]Lease K A, Walker J C. The arabidopsis unannotated secreted peptide database, a resource for plant peptidomics[J]. Plant Physiology, 2006, 142(3): 831-838.
[19]Bahyrycz A, Konopińska D. Plant signalling peptides: Some recent developments[J]. Journal of Peptide Science, 2007, 13(12): 787-797.
[20]Katsir L, Davies K A, Bergmann D C, et al. Peptide signaling in plant development[J]. Current Biology, 2011, 21(9): R356-R364.
[21]Du F Y, Bai Y, Bai Y, et al. Quantitative detection of trace systemins inSolanaceousplants by immunoaffinity purification combined with liquid chromatography/electrospray quadrupole time-of-flight mass spectrometry[J]. Analytical Chemistry, 2010, 82(22): 9374-9383.
[22]Du F Y, Ruan G H, Liu H W. Analytical methods for tracing plant hormones[J]. Analytical and Bioanalytical Chemistry, 2012, 403 (1): 55-74.
[23]Bai Y, Du F Y, Yang Y Y, et al. In-capillary non-covalent labeling and determination of tomato systemin with quantum dots in capillary electrophoresis with laser-induced fluorescence detection[J]. Journal of Separation Science, 2011, 34(20): 2893-2900.
[24]Bai Y, Chang C L, Du F Y, et al. Combination of dynamic pH junction with capillary electrophoresis-mass spectrometry for the determination of systemins in plant samples[J]. Electrophoresis, 2014, 35 (14): 1984-1988.
[25]Bing T, Chang T J, Yang X J, et al. G-quadruplex DNA aptamers generated for systemin[J]. Bioorganic & Medicinal Chemistry, 2011, 19(14): 4211-4219.
文章编号:1674-9057(2016)02-0326-07
doi:10.3969/j.issn.1674-9057.2016.02.022
收稿日期:2014-12-01
基金项目:国家自然科学基金项目(21265004;21465008);广西自然科学基金项目(2014GXNSFAA118063);广西教育厅科研项目(201203YB086)
作者简介:秦群(1989—),男,硕士,分析化学专业,453292725@qq.com。
通讯作者:杜甫佑, 博士,教授,dufu2005@126.com。
中图分类号:O657.3
文献标志码:A
Development and properties of systemin aptamer-functionalized magnetic quantum dots
QIN Quna, GUO Lina, ZHENG Xiana, SUN Lina, RUAN Gui-hua, DU Fu-you
(a.College of Chemistry and Bioengineering; b.Collaborative Innovation Center for Water Pollution Control and Water Safety in Karst Area, Guilin University of Technology, Guilin 541004,China)
Abstract:Aptamer-functionalized magnetic quantum dots (Fe3O4@mSiO2-QDs-Apt) with high specificity and affinity for the recognition of target systemin polypeptide hormones were prepared through carbodiimide coupling method, and its recognition and fluorescence properties were investigated in this work. First, magnetic iron oxide nanoparticles were packed by silicon dioxide in order to overcome their disadvantage of Fe3O4 magnetic nanoparticles, then systemin aptamer-functionalized quantum dots were bound on the carboxyl modification Fe3O4@mSiO2 surface by carbodiimide coupling method. The fluorescence properties of the prepared Fe3O4@mSiO2-QDs-Apt were investigated by optimizing experimental conditions, including buffer, pH value and recognition time. The results show that the fluorescence intensity of Fe3O4@mSiO2-QDs-Apt was strongest in the Tris-HCl buffer system at pH 8.6, at the same time they were stable in the selected buffer system. The fluorescence intensity of Fe3O4@mSiO2-QDs-Apt was lower than that of QDs-Apt, but the recognition ability was similar between them, which may help the applications of aptamer-functionalized quantum dots in bioanalysis.
Key words:aptamer; quantum dots; systemin; polypeptide hormones; magnetic nanoparticles; fluorescence probe
引文格式:秦群, 郭琳, 郑弦, 等.系统素多肽激素适配体功能化磁性纳米量子点的构建及特性研究[J].桂林理工大学学报,2016,36(2):326-332.

