长白山榛子抗氧化肽制备及其活性研究
李京京,孙文佳,闵伟红,*(1.吉林农业大学食品科学与工程学院,吉林长春130118;2.小麦和玉米深加工国家工程实验室,吉林长春130118)
基础研究
长白山榛子抗氧化肽制备及其活性研究
李京京1,2,孙文佳1,2,闵伟红1,2,*
(1.吉林农业大学食品科学与工程学院,吉林长春130118;2.小麦和玉米深加工国家工程实验室,吉林长春130118)
以长白山榛子分离蛋白为原料,采用碱性蛋白酶制备抗氧化肽,通过Box-Behnken中心组合试验确定最佳水解工艺条件为:酶解温度50℃、加酶量8 000 U/g、底物浓度5.0%、pH9.5。对该条件制备的抗氧化肽进行活性研究,结果显示随着浓度的升高,榛子抗氧化肽在4mg/mL时对ABTS自由基和DPPH清除率均达到100%,8mg/mL时对·OH清除率和总还原能力分别达到85.46%和0.859,12mg/mL时,对Fe2+螯合率达到99.3%。
榛子分离蛋白;抗氧化肽;酶解工艺优化;抗氧化活性
人体过量积累自由基会导致细胞死亡、组织受损、糖尿病和冠状动脉硬化等许多慢性疾病[1-2]。与人工合成的抗氧化剂相比,植物蛋白酶解得到的抗氧化肽,因其易于人体吸收和安全无副作用更受人们的青睐[3-5]。其抗氧化机理包括:为抗氧化酶提供氢、缓冲生理pH、螯合金属离子和捕捉自由基等[6]。
榛子(corylus heterophylla fisch.ex trantv),与扁桃、核桃、腰果并称“四大坚果”,在中国东北地区分布尤为广泛。榛子仁不仅口味佳而且营养价值高,富含蛋白质、脂肪、碳水化合物以及维生素和多种矿物质。其中脂肪57.1%~62.1%,蛋白质16.2%~21.12%,碳水化合物6.5%~9.3%。榛子仁除可直接食用或添加到食品中外,还可以榨油。目前国内对榛子的研究主要集中在榛子油,榛子果奶以及榛子蛋白等方面[7]。国外对榛子的研究则集中在过敏原方面[8-10],对蛋白和多肽的研究普遍较少。本试验采用响应面分析法对酶解制备榛子抗氧化肽进行工艺优化,并在此基础上研究其抗氧化活性,为榛子蛋白的充分利用和榛子多肽功能性产品的开发提供参考。
1 材料与方法
1.1材料与试剂
榛子分离蛋白:实验室自制。DPPH、ABTS、菲洛嗪:购于sigma公司;Alcalase 2.4L,碱性蛋白酶:购于丹麦诺维信公司;其他均为国产分析纯。
1.2仪器与设备
UV-1700型紫外可见分光光度计:日本岛津;SPECTRA-MAX190型酶标仪:美国Molecular Devices公司;ZD-2型自动电位滴定计:上海仪电科学仪器股份有限公司;BSA224S型分析天平:赛多利斯科学仪器(北京)仪器有限公司;XMTD-8222型水浴锅:精宏仪器公司;FD-1B-50型冷冻干燥机:北京博医康实验仪器有限公司;Z36HK型高速冷冻离心机:德国HERMLE公司。
1.3试验方法
1.3.1榛子抗氧化肽制备
取榛仁分离蛋白粉,加入蒸馏水配成一定底物浓度的溶液,90℃水浴10 min。冷却后调节pH,加入碱性蛋白酶,电位滴定计滴加碱液维持溶液pH恒定。酶解一定时间后,溶液90℃灭酶20 min,冷却至室温,调节pH至7.0,5 000 r/min离心10 min取上清液,冷冻干燥后得到榛仁抗氧化肽。
1.3.2羟基自由基(·OH)清除能力测定
利用Fenton反应,参照Amarowicz的试验方法。
1.3.3响应面法优化榛子抗氧化肽的酶解制备工艺
试验运用Design-Expert 8.0.6.1软件,采用响应曲面法的中心组合设计,以羟基自由基清除能力为指标对酶解条件进行优化。根据单因素试验结果,选出影响较大的4个因素,根据Box-Behnken中心组合试验设计原理,开展四因素三水平的响应面试验,试验因素及水平表见表1。

表1 响应面分析因素水平表Table 1 Factors and their coded levels teasted in response surface analysis
1.3.4还原能力测定
参照Lin[12]的试验方法。
1.3.5ABTS清除作用的测定
参照Memarpoor-Yazdi[13]的试验方法。
1.3.6DPPH自由基清除能力测定
参照Wang[14]的试验方法。
1.3.7Fe2+螯合能力测定
参照Yu-Ling Lee[15]的试验方法。
2 结果与分析
2.1响应面试验
2.1.1响应面试验结果及分析
选取底物浓度、酶解温度、pH、加酶量四因素,酶解时间为300 min。酶解制备榛子抗氧化肽工艺的响应面分析试验根据Box-Behnken设计进行了29组试验,其中5组中心点重复试验,结果见表2,回归模型方差分析见表3。
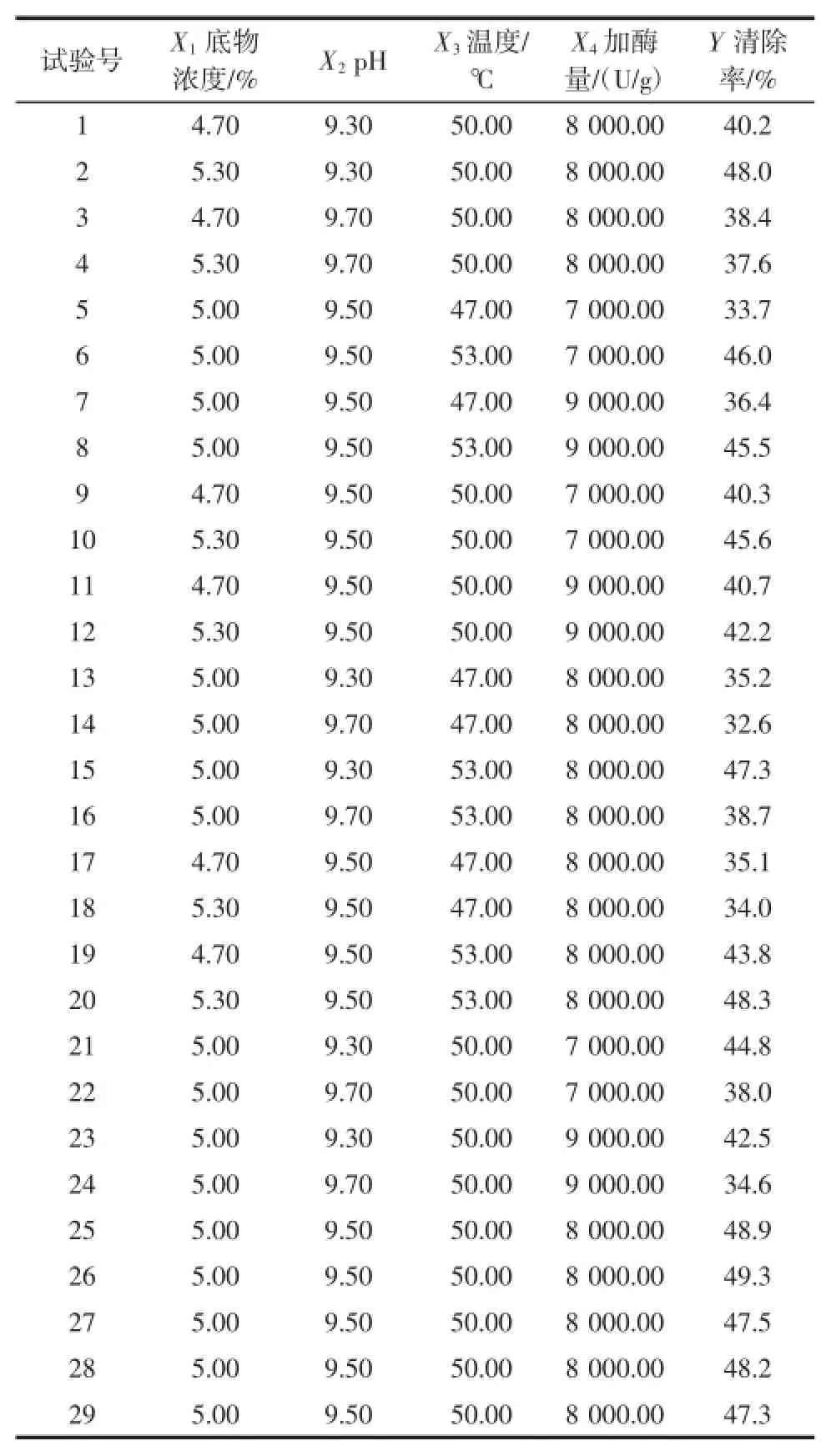
表2 响应面试验设计及结果Table 2 Box-Behnken design and results for response surface analysis
以·OH清除率为响应值回归拟合所得各因素函数表达如下:
清除率/%=48.24+1.43X1-3.18X2+5.22X3-0.54X4-2.15X1X2+1.40X1X3-0.95X1X4-1.50X2X3-0.28X2X4-0.80X3X4-2.74X12-4.78X22-4.94X32-3.23X42
由表3方差分析得出P值,模型极显著,模型的失拟性不显著,回归决定系数R2=0.976 7修正决定系数R2Adj=0.953 3,说明方程拟合性较好,可以应用于对酶解条件的分析预测。根据结果进行分析:一次项X1、X2、X3极显著,二次项X12、X22、X32、X42极显著。说明该模型拟合程度良好,用该模型对酶解制备榛子抗氧化肽的工艺进行优化是合适的。
各因素交互作用影响·OH清除率的响应面图见图1。
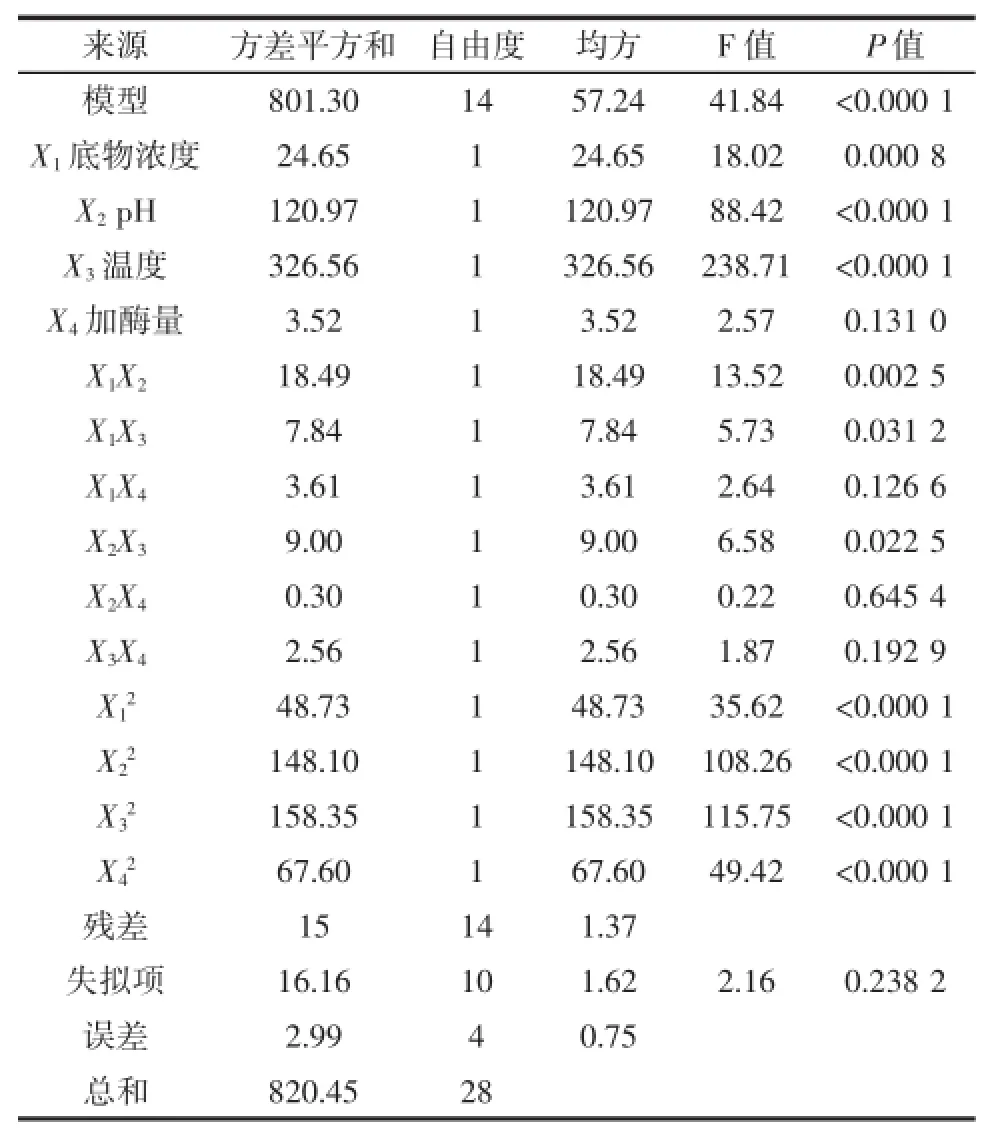
表3 回归模型方差分析Table 3 Regression and the Analysis of Variance


图1 各因素交互作用影响·OH清除率的响应面图Fig.1 Response surface of mutual influence on scavenging capacities of hydroxyl radical
从图中可以直观地反映各因素对响应值的影响,找出最佳工艺参数以及各参数之间的相互作用。
2.1.2酶解制备榛子抗氧化肽工艺条件的确定及验证
数据分析表明回归模型存在最大值,酶解制备榛子抗氧化肽的最佳工艺条件为:酶解温度52.24℃、加酶量7 741.14 U/g、底物浓度5.22%、pH 9.38。此条件下羟基自由基清除率理论预测最大值为51.74%。采用优化后的最佳工艺条件进行验证试验,同时考虑到实际操作的情况,将条件修正为:pH9.5,温度50℃,加酶量8 000 U/g,底物浓度5.0%,在此条件下做验证试验,得到清除率为50.98%,与模型预测值较为吻合。采用响应面法优化得到的酶解榛子分离蛋白工艺条件比较可靠,具有一定的实用价值。
2.2榛子抗氧化肽粗提物抗氧化活性测定
2.2.1ABTS自由基清除能力测定结果
榛子抗氧化肽对ABTS自由基的清除作用见图2。

图2 榛子抗氧化肽对ABTS自由基的清除作用Fig.2 Scavenging effect of hazelnut antioxidant peptide with ABTS radical
由图2可知,酶解产物浓度达到3 mg/mL时,对ABTS自由基的清除率就已经达到96.43%。试验浓度范围内,酶解产物对ABTS自由基清除率在3 mg/mL以后保持在98%~100%,此时酶解产物和VC对ABTS自由基的清除率基本相同,即酶解产物对ABTS自由基的清除率为VC的100%。说明酶解产物对ABTS自由基有较强的清除作用,具有较强的抗氧化活性。
2.2.2DPPH自由基清除能力测定结果
榛子抗氧化肽对DPPH自由基清除能力如图3所示。

图3榛子抗氧化肽对DPPH自由基的清除作用Fig.3 Scavenging effect of hazelnut antioxidant peptide with DPPH radical
榛子抗氧化肽对DPPH自由基的清除率随浓度的增大而升高,并在2 mg/mL后逐渐稳定,8 mg/mL时达到100%,此时酶解产物和VC对DPPH自由基的清除率一致,即酶解产物对DPPH自由基的清除率为VC的100%。说明酶解产物对DPPH自由基有较强的清除作用,具有较强的抗氧化活性。
2.2.3·OH清除能力测定结果
试验结果如图4所示。

图4 榛子抗氧化肽对羟基自由基的清除作用Fig.4 Scavenging effect of hazelnut antioxidant peptide with hydroxyl radical
榛子抗氧化肽对羟基自由基的清除作用随浓度的增加而显著提高,当浓度为8 mg/mL时,清除率到达85%以上,并在24 mg/mL时达到100%。
2.2.4总还原能力能力测定结果
试验过程中,有还原能力的样品能使铁氰化钾中的Fe3+还原成Fe2+(亚铁氰化钾),产物与FeCl3进一步反应生成在700 nm处有最大吸光峰的普鲁士蓝(Fe4[Fe(CN)6]3),因此测定700 nm处吸光值的高低可以反映样品还原能力的大小,吸光值越大,则还原能力越强。试验结果如5图所示。

图5 榛子抗氧化肽的还原能力作用Fig.5 Reducing power of hazelnut antioxidant peptide
随着浓度的升高,榛子抗氧化肽的还原能力逐渐增强,100 mg/mL时,A700值为1.055,能够达到同浓度下EDTA的38.55%
2.2.5Fe2+螯合能力测定结果
试验结果如图6所示。浓度为10mg/mL时抗氧化肽的螯合率为90.25%,12 mg/mL时达到99.30%。可见榛子抗氧化肽对Fe2+有较好的螯合能力。
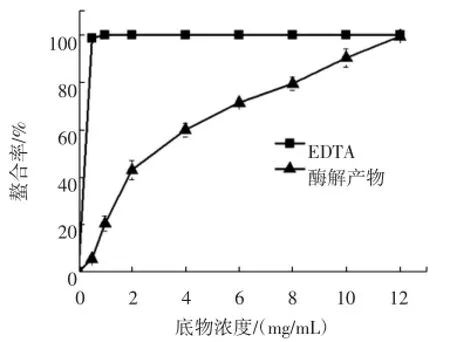
图6 榛子抗氧化肽对亚铁离子的螯合作用Fig.6 Ferrous ions chelating capacity of hazelnut antioxidant peptide
3 结论
本试验以长白山榛子分离蛋白为原料,用碱性蛋白酶酶解,响应面分析法确定最佳水解工艺条件为:酶解温度50℃、加酶量8 000 U/g、底物浓度5.0%、pH 9.5。在此条件下进行酶解,所得得到羟基自由基清除率为50.98%。
对酶解制备的抗氧化肽进行活性研究,考察了·OH、DPPH以及ABTS自由基清除率、Fe2+螯合能力和总还原能力5个指标。结果表明,榛子抗氧化肽随着浓度的升高,对Fe2+螯合率最高能够达到99.3%,对·OH、ABTS的清除率及DPPH的清除率能够达到100%。由此可见榛子抗氧化肽对几种自由基有显著的清除作用,具有较强的抗氧化活性,是一种良好的天然抗氧化剂,拥有广阔的研究价值和市场前景。
[1]Tanzadehpanah H,Asoodeh A,Chamani J.An antioxidant peptide derived from Ostrich(Struthio camelus)egg white protein hydrolysates[J].Food Research International,2012,49(1):105-111
[2]He R,Ju X,Yuan J,et al.Antioxidant activities of rapeseed peptides produced by solid state fermentation[J].Food Research International,2012,49(1):432-438
[3]Kudo K,Onodera S,Takeda Y,et al.Antioxidative activities of some peptides isolated from hydrolyzed potato protein extract[J].Journal of functional foods,2009,1(2):170-176
[4]Jamdar S,Rajalakshmi V,Pednekar M,et al.Influence of degree of hydrolysis on functional properties,antioxidant activity and ACE inhibitory activity of peanut protein hydrolysate[J].Food Chemistry,2010,121(1):178-184
[5]Zhang T,Li Y,Miao M,et al.Purification and characterisation of a new antioxidant peptide from chickpea(Cicer arietium L.)protein hydrolysates[J].Food Chemistry,2011,128(1):28-33
[6]Kou X,Gao J,Xue Z,et al.Purification and identification of antioxidant peptides from chickpea(Cicer arietinum L.)albumin hydrolysates[J].LWT-Food Scienceand Technology,2013,50(2):591-598
[7]李杨,江连洲,王胜男,等.水酶法提取榛子蛋白工艺优化[J].食品科学,2012,33(2):143-148
[8]Nitride C,Mamone G,Picariello G,et al.Proteomic and immunological characterization of a new food allergen from hazelnut(Corylus avellana)[J].Journal of proteomics,2013,86(12):16-26
[9]Costa J,Ansari P,Mafra I,et al.Development of a sandwich ELISA-type system for the detection and quantification of hazelnut in model chocolates[J].Food chemistry,2015,173:257-265
[10]Beyer K,Grishina G,Bardina L,et al.Identification of an 11S globulin as a major hazelnut food allergen in hazelnut-induced systemic reactions[J].Journal of Allergy and Clinical Immunology,2002,110 (3):517-523
[11]Amarowicz R,Naczk M,Shahidi F.Antioxidant activity of various fractions of non-tannin phenolics of canola hulls[J].Journal of Agricultural and Food Chemistry,2000,48(7):2755-2759
[12]Lin S,Jin Y,Liu M,et al.Research on the preparation of antioxidant peptides derived from egg white with assisting of high-intensity pulsed electric field[J].Food chemistry,2013,139(1/4):300-306
[13]Memarpoor-Yazdi M,Mahaki H,Zare-Zardini H.Antioxidant activity of protein hydrolysates and purified peptides from Zizyphus jujuba fruits[J].Journal of Functional Foods,2013,5(1):62-70
[14]Wang Q,Li W,He Y,et al.Novel antioxidative peptides from the protein hydrolysate of oysters(Crassostrea talienwhanensis)[J].Food chemistry,2014,145(7):991-996
[15]Lee Y-L,Yen M-T,Mau J-L.Antioxidant properties of various extracts from Hypsizigus marmoreus[J].Food Chemistry,2007,104(1):1-9
Preparation and Activity of Antioxidant Peptide from Hazelnut in Changbai Mountain
LI Jing-jing1,2,SUN Wen-jia1,2,MIN Wei-hong1,2,*
(1.College of Food Science and Engineering,Jilin Agricultural University,Changchun 130118,Jilin,China;2.National Engineering Laboratory on Wheat and Corn Further Processing,Changchun 130118,Jilin,China)
In this experiment,hazelnut nut protein isolated was used as raw material,hydrolyzed by Alcalase to prepare antioxidant peptide.Through Box-Behnken method,the optimal hydrolysis conditions were determined as hydrolysis temperature of 50℃,Alcalase concentration of 8 000 U/g,substrate concentration of 5.0%,hydrolysis pH of 9.5.Assess the antioxidant potential,with the increasing of the peptide solution concentration,scavenging capacities against ABTS and DPPH were 100%at 4 mg/mL,scavenging capacities against hydroxyl radical and reducing power were 85.46%and 0.859 at 8 mg/mL,Ferrous ions chelating capacity of hazelnut antioxidant peptide was 99.3%at 12 mg/mL.
hazelnut protein isolated;antioxidant peptide;enzymatic hydrolysis optimization;antioxidant activity
10.3969/j.issn.1005-6521.2016.10.001
国家“863”计划项目(2013AA102206)
李京京(1991—),女(汉),硕士研究生,研究方向:食品科学。
*
闵伟红(1971—),女,教授,博士生导师,主要从事发酵工程、粮油科学与深加工技术研究。
2015-01-22

