降烟碱解淀粉芽孢杆菌和边缘假单胞菌原生质体融合选育高效降烟碱菌株
邓高毅,彭 宇,王远亮(.湖南农业大学食品科技学院/食品科学与生物技术湖南省重点实验室,湖南 长沙 408;.湖南中烟技术中心,湖南 长沙 4004)
降烟碱解淀粉芽孢杆菌和边缘假单胞菌原生质体融合选育高效降烟碱菌株
邓高毅1,彭 宇2,王远亮1
(1.湖南农业大学食品科技学院/食品科学与生物技术湖南省重点实验室,湖南 长沙 410128;2.湖南中烟技术中心,湖南 长沙 410014)
获取1株高效降解烟碱的融合子,以解淀粉芽孢杆菌T11和边缘假单胞菌作为亲本菌株,使用溶菌酶破除亲株细胞壁后以40%PEG-6000诱导解淀粉芽孢杆菌T11原生质体和已热力灭活的边缘假单胞菌原生质体进行融合,并检测了融合子的降烟碱能力。对融合子利用青霉素抗性初筛获得了176株再生融合子,利用烟碱降解率为指标进行降烟碱复筛实验后获得5株烟碱降解能力较高的融合子。根据融合子遗传稳定性分析及与亲本菌株烟碱降解效率的对比,获得了1株烟碱降解率比亲本菌株更强的融合子A2。获得的高效降解融合子A2在第5天后其烟碱降解率基本稳定在93%。
解淀粉芽孢杆菌T11;边缘假单胞菌;原生质体;融合子;烟碱
邓高毅,彭宇,王远亮.降烟碱解淀粉芽孢杆菌和边缘假单胞菌原生质体融合选育高效降烟碱菌株[J].广东农业科学,2016,43 (6):143-148.
烟碱含量是评价烟叶品质好坏的重要指标之一。烤烟的烟碱含量一般要求在1.5%~3.5%,然而近年研究发现,我国部分地区种植的烟草烟碱含量偏高,特别是烟草上部烟叶,有的烟碱平均含量在4%以上[1-2],这不仅严重影响了烟叶品质,而且过高的烟碱含量会对广大吸烟者的神经产生更强的刺激作用,进而危害身心健康。传统种植工艺通过改善种植条件或采用优化打顶技术等手段,以期降低烟草中过高的烟碱含量,但是效果不佳[3-4]。
利用微生物降低烟草中过高的烟碱含量既经济又环保。国内外学者已从烟草生长环境中分离出多种具有降烟碱能力的微生物,且国外在利用微生物降解烟叶烟碱方面已开展了大量的基础和应用研究[5-7],如Newton等[8]使用假单胞菌菌液降解烟丝中的烟碱,18 h后烟丝烟碱含量由2.0%下降至0.8%。目前国内对微生物应用于降解烟碱研究起步较晚且缺乏系统连续性的研究[9]。
本试验前期已从健康烟叶和烟草种植土壤中分离得到1株降烟碱解淀粉芽孢杆菌T11和1株边缘假单胞菌,其烟碱降解率分别为80.6%、76.3%[11-12],拟利用原生质体融合技术进一步提高其烟碱降解能力。原生质体融合是指通过人为操作的方法,将遗传性状不同的两个细胞的原生质体进行融合,以此获得兼有双亲遗传性状的稳定重组子的一种基因重组技术。这种技术打破了微生物的种界界限,不仅在种内、种间,而且在亲缘很远的两个物种之间都可能进行融合,能扩大融合频率和幅度,是一种常见的微生物育种方法。原生质体融合与常规杂交相比有很多优势,不但能显著提高重组频率,而且具有定向育种的含义,目前该技术已成为细胞生物学迅速发展的方向之一[10]。因此,本研究以解淀粉芽孢杆菌T11和边缘假单胞菌为亲本菌株进行原生质体融合,以期选育高效降解烟碱的融合子。
1 材料与方法
1.1 试验材料
1.1.1 降烟碱细菌 解淀粉芽孢杆菌T11(对青霉素敏感),由本实验室从烟叶内部分离、鉴定及保存[11];边缘假单胞菌(可抗青霉素),由本实验室从烟草土壤中分离、鉴定及保存[12]。
1.1.2 试剂及培养基 (1)液体完全培养基:酵母提取物5 g,蛋白胨10 g,葡萄糖5 g,氯化钠10 g,水1 000 mL,pH7.0,添加2%琼脂即为固体完全培养基。
(2)高渗液体再生培养基:于(1)中加入0.5 mol/L蔗糖,调节pH值至7.0,100~115℃灭菌15 min,温度过高易使蔗糖发生焦糖化反应,添加2%琼脂即为高渗固体再生培养基。
(3)高渗融合子固体筛选培养基:于(2)中加入青霉素,使其终浓度为100 U/mL。
(4)原生质体稳定液(SMM):0.5 mol/L蔗糖,0.02 mol/L氯化镁,0.02 mol/L顺丁烯二酸,使用Tris缓冲液配制,调节pH值至6.5。
(5)0.01 mol/L Tris缓冲液,调pH值至6.5。
(6)高渗Tris缓冲液:于(5)中加入0.5 mol/L蔗糖,0.01 mol/L氯化钙。
(7)6 U/mL青霉素溶液:生理盐水配制,0.22 μm微孔滤膜过滤除菌。
(8)4 mg/mL甘氨酸溶液:蒸馏水配制,0.22 μm微孔滤膜过滤除菌。
(9) 0.1 mol/L EDTA溶液:蒸馏水配制,0.22 μm微孔滤膜过滤除菌。
(10)4 mg/mL溶菌酶液:SMM配制,0.22 μm微孔滤膜过滤除菌。
(11)促融合剂PEG液:40%PEG-6000,使用(6)液配制,120℃灭菌21 min。
(12)液体烟碱培养基:0.5 mL微量溶液(0.4 g MnSO4·7H2O,0.2 g CaC12·2H2O,0.2 g FeSO4·7H2O,用0.1 mol/L盐酸定容至100 mL),1 g烟碱,13.3 g K2HPO4·3H20,4 g KH2PO4,0.2 g MgSO4·7H2O,蒸馏水定容至1 000 mL[13]。添加2%琼脂粉即为固体烟碱培养基。
1.1.3 主要仪器设备 分析天平(湘仪天平有限公司)、DK-BD型电热恒温水槽(上海一恒科技有限公司)、SW-CJ-1FD型超净工作台(苏州净化设备有限公司)、GZX250型生化培养箱(天津玛福尔生化培养)、TDL-5000bR型冷冻离心机(上海安亭科学仪器厂)、紫外可见光分光光度计(日本岛津有限公司)、OLMPUS显微镜、AJ50585型微量移液器(法国)、手持精密pH计(美国)。
1.2 试验方法
1.2.1 烟碱含量的测定 取2 mL液体烟碱发酵液于10 000 r/min下离心10 min,取上清液0.25 mL 于50 mL 容量瓶中,用0.05 mol/L盐酸定容,摇匀。以不加入烟碱的发酵液液作为空白对照,于259 nm波长下测各发酵液中烟碱的吸光值[14]。并依据烟碱标准曲线换算出烟碱含量,计算液体烟碱发酵液中烟碱的降解率。
1.2.2 解淀粉芽孢杆菌T11原生质体的制备 制备解淀粉芽孢杆菌T11生长曲线,按制备生长曲线的条件培养其至对数生长前期,加入终浓度为6 U/mL的青霉素溶液和4 mg/mL的甘氨酸溶液后培养至对数生长后期,7 000 r/min离心5 min,弃上清液,使用Tris缓冲液洗涤菌体3次,悬浮于9 mL预热至35℃高渗Tris缓冲液中,添加预热至35℃的溶菌酶溶液使其终浓度为4 mg/mL,置于恒温水浴锅中35℃保温酶解,30 min后取样镜检观察破壁情况,每隔10 min取样镜检观察,当绝大部分菌体破壁形成原生质体时离心,停止酶解,弃上清后使用高渗Tris缓冲液洗涤3次,将原生质体悬浮于SMM中并置于冰箱保存、备用。原生质体形成率、再生率的计算参照文献[15]进行。
1.2.3 边缘假单胞菌原生质体的制备 制备边缘假单胞菌的生长曲线,按制备生长曲线的条件培养其至对数生长后期,7 000 r/min离心5 min,弃上清液,使用Tris缓冲液洗涤菌体3次,悬浮于9 mL的预热至35℃高渗Tris缓冲液中,加入用高渗Tris缓冲液配制并预热至35℃的EDTA,使其终浓度为0.1 mol/L,添加预热至35℃的溶菌酶溶液使其终浓度为4 mg/mL,置于恒温水浴锅中35℃保温酶解,30 min后取样镜检观察破壁情况,每隔10 min取样镜检观察,适时停止酶解,离心弃上清后使用高渗Tris缓冲液洗涤菌体3次,将原生质体悬浮于SMM中并置于冰箱保存、备用。原生质体形成率、再生率的计算参照文献[15]进行。
1.2.4 边缘假单胞菌原生质体的热力灭活 取若干管同等数量级(5 mL/管,浓度为109cfu/mL)保存于冰箱的边缘假单胞菌原生质体悬液转移至50 mL的三角瓶中,置于65℃恒温水浴锅中分别保温0、5、10、15、20、25、30、35、40 min 后,各取100 μL菌液涂布于高渗固体再生培养基上,培养5~7 d,计算再生菌落数。以热力灭活时间为横坐标、灭活率为纵坐标作热力灭活曲线。
热力灭活率(%)=(灭活前每100 μL菌液涂布后的菌落数-灭活后每100 μL菌液涂布后的菌落数)/灭活前每100 μL菌液涂布后的菌落数×100
1.2.5 PEG-6000诱导原生质体融合及融合子的再生、筛选 取解淀粉芽孢杆菌T11(对青霉素敏感)原生质体和已经热力灭活的边缘假单胞菌(可抗青霉素)原生质体悬液各1 mL,小心混匀后于4℃、3 000 r/min下离心10 min,弃去上清液,加入40%PEG促融剂1 mL,于35℃恒温水浴锅中保温促融3 min。于4℃、3 000 r/min下再次离心10 min,弃上清,使用SMM稳定液经10倍系列稀释后各取100 μL涂布于高渗融合子固体筛选培养基上,35℃培养2~3 d,观察并计算菌落总数及融合率。因为边缘假单胞菌可抗青霉素,而解淀粉芽孢杆菌T11对青霉素极其敏感,所以只有当已被热力灭活的边缘假单胞菌原生质体和解淀粉芽孢杆菌T11原生质体发生了真正的融合,才能在高渗融合子固体筛选培养基上生长。
融合率(%)=灭活后高渗融合子固体筛选培养基上平均菌落数(个/100 μL )/灭活前再生培养基上平均菌落数(个/100 μL)×100
1.2.6 融合子降烟碱能力的遗传稳定性 将筛选得到的融合子全部转接至烟碱固体培养基中,35℃培养3~5 d,对能在烟碱固体培养基上生长出来的融合菌株进行降烟碱能力检测。挑取降烟碱能力最强的5个融合子进行传代试验,传接10代并测定每次传代后其降烟碱能力,操作方法为每次挑取1环菌体加入到5 mL液体烟碱培养基(烟碱浓度为1 g/L)中,5 d后于10 000 r/min下离心10 min,根据1.2.1方法测出烟碱降解率。
1.2.7 融合子与亲株间降烟碱能力的比较 选取降烟碱能力且遗传稳定性最好的融合子菌株与出发菌株解淀粉芽孢杆菌T11、边缘假单胞菌进行降烟碱能力的检测与对比。
1.3 数据处理
采用Origin8.0软件对试验数据进行统计、作图分析。
2 结果与分析
2.1 烟碱标准曲线
按照烟碱标准曲线的制作方法配制一系列浓度的烟碱标准溶液,波长259 nm下测定其吸光度值,以烟碱浓度为横坐标,吸光度值为纵坐标,使用Origin8.0软件作烟碱标准曲线,如图1所示。
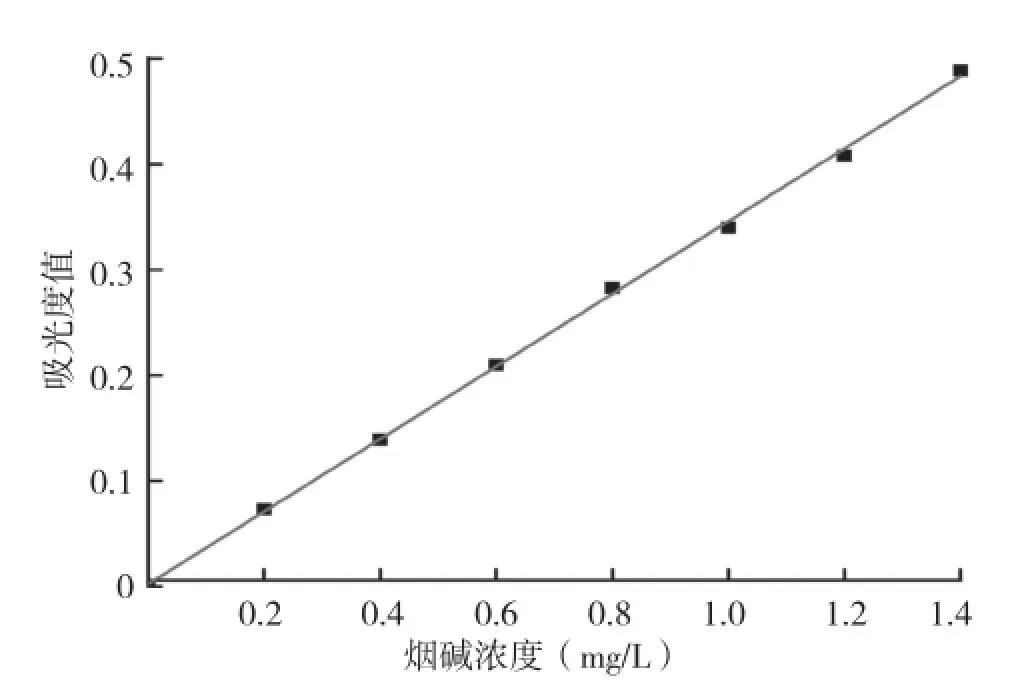
图1 烟碱浓度与吸光度标准曲线
2.2 解淀粉芽孢杆菌T11与边缘假单胞菌的生长曲线
解淀粉芽孢杆菌T11及边缘假单胞菌接种培养后,于13 h之前每隔1 h在波长600 nm下测定吸光度值,13 h后每隔2 h测定1次,使用Origin8.0软件作生长曲线,如图2所示。

图2 解淀粉芽孢杆菌T11和边缘假单胞菌的生长曲线
微生物的生长阶段分为迟缓期、对数生长期、稳定期和衰亡期,每个阶段的菌体对环境的敏感度存在较大差别。对于细菌而言,处于对数生长后期的菌体,其细胞壁更容易被溶菌酶破坏结构而达到破壁的效果,此时原生质体的制备率更高,而处于其他生长阶段的菌体细胞壁对溶菌酶的敏感性较差。由图2可看出,解淀粉芽孢杆菌T11在接种4 h后进入对数生长前期,11 h开始进入稳定期;而边缘假单胞菌则是接种3 h后进入对数生长前期,11 h达到稳定期。因此,试验选择解淀粉芽孢杆菌T11在接种5 h时(对数生长前期)加入青霉素及甘氨酸后继续培养至对数生长后期(10 h时),边缘假单胞菌培养至10 h时取出离心制备原生质体。
2.3 酶解时间对原生质体形成率和再生率的影响
酶解时间对解淀粉芽孢杆菌T11和边缘假单胞菌原生质体的形成率、再生率的影响如图3所示。对于解淀粉芽孢杆菌T11而言,其原生质体形成率随酶解时间的增加而升高,而再生率则在酶解时间为60 min后急剧下降,当酶解时间为90 min时形成率虽然达到了最大值98.7%,可再生率却由酶解时间为60 min时的83.7%下降到40.5%,导致再生率下降的原因是随着时间的推移解淀粉芽孢杆菌T11原生质体脱水较为严重,从而失去了再生能力。边缘假单胞菌于酶解60 min前,原生质体形成率和再生率均呈上升趋势,分别达到了68.2%和62.3%,而再生率紧接着出现了大幅度下降,在90 min时下降至30.1%。综合考虑上述影响因素,解淀粉芽孢杆菌T11和边缘假单胞菌细胞壁的最佳酶解时间均应控制在60 min。
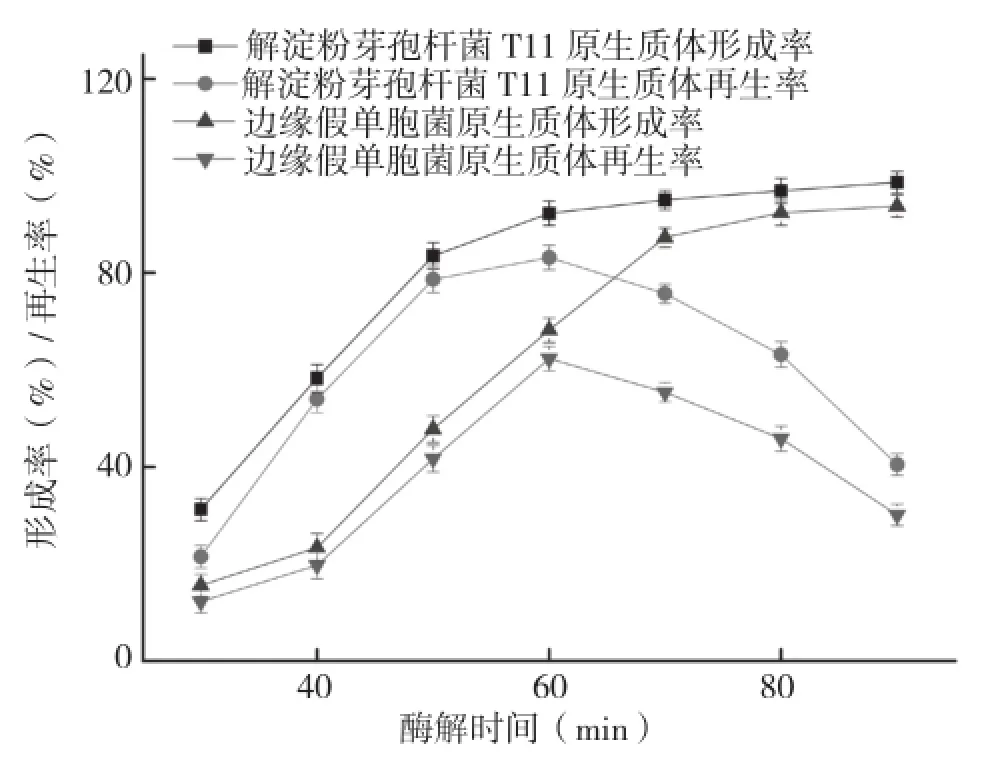
图3 酶解时间对原生质体形成率和再生率的影响
2.4 边缘假单胞菌原生质体热灭活对灭活率的影响
原生质体热力灭活只是使边缘假单胞菌原生质体失去单独存活于再生培养基上的能力,但其染色体仍然保留复制及与其他原生质体染色体重组等能力[16]。试验表明,保温温度为60℃时,边缘假单胞菌原生质体的灭活率在5~20 min之间由10.3%增至92%,在25 min时灭活率达到100%。因此,边缘假单胞菌原生质体的灭活试验时间选择为25 min。
2.5 PEG-6000促融时间对融合率的影响
试验以40%PEG-6000为促融剂、45℃下诱导解淀粉芽孢杆菌T11和已热力灭活的边缘假单胞菌原生质体进行融合。在不同促融时间下测定了原生质体的融合率,结果表明,促融时间1、2、3、5、7、9 min时,融合率分别为2.4×10-6、3.9×10-6、4.7×10-6、3.5×10-6、2.2×10-6、6.7×10-7。可见,促融时间1~3 min之间,融合率呈增长趋势,3 min时达最大值4.7×10-6,但随着促融时间的延长原生质体的融合率反而下降,9 min比7 min时的融合率降低了一个数量级。这说明在较短的时间内(1~3 min)PEG-6000起到了较好的促融效果,但由于PEG-6000的存在对原生质体具有较大毒性作用[17],时间过长反而不利于融合子的再生。因此,促融时间以3 min为宜。
2.6 融合子遗传稳定性的检测
经初步筛选,共获得了176株再生融合子,利用烟碱选择性培养基进一步复筛,得到5株降烟碱能力较强的融合子。对降烟碱能力最强的5个融合子进行传代试验,分别标记为融合子A1、A2、A3、A4、A5,每个融合子每次传代后检测降烟碱能力,均设置3个平行试验,分析结果见表1。经单因素方差分析(表2),融合子A1、A3、A4、A5不同世代对烟碱降解率的差异极显著,而融合子A2不同世代对烟碱降解率的差异不显著,即其烟碱降解率的稳定性好。从表1可以看出,第1代融合子A1、A3、A5的烟碱降解率分别为94%、93.8%和95.7%,均高于第1代融合子A2的92.1%烟碱降解率。但是除了融合子A1第4代的93.2%菌株烟碱降解率略高于相应代数融合子A2的91.8%烟碱降解率外,融合子A1、A3、A5后续传代的菌株烟碱降解率均低于融合子A2相应代数的菌株烟碱降解率。从表2可以看出,融合子A2连续传10代的烟碱降解率较为稳定。融合子A4的第1代菌株烟碱降解率仅为90%,传至第10代时已降至77.2%,故也不适合作为理想降烟碱的融合子。综上,选择A2作为理想的降烟碱融合子进行后续试验。

表1 融合子烟碱降解率(%)遗传稳定性分析结果
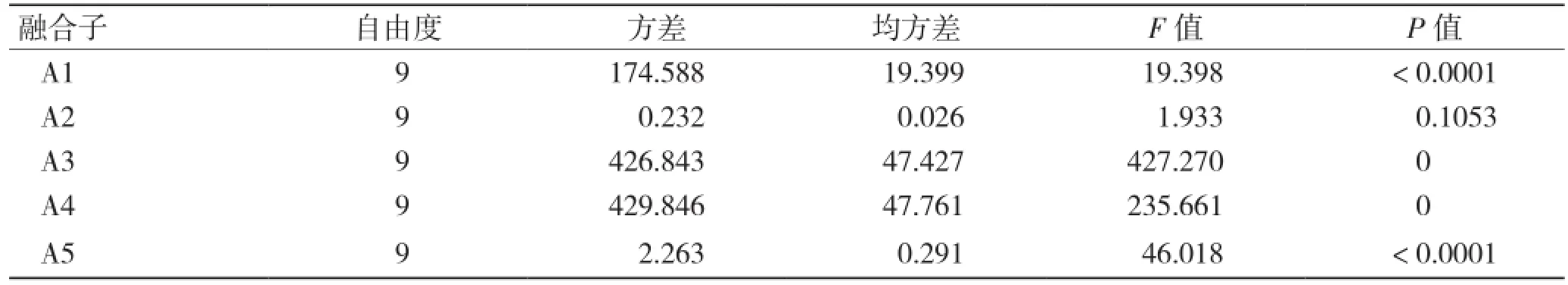
表2 融合子烟碱降解率遗传稳定性的方差分析
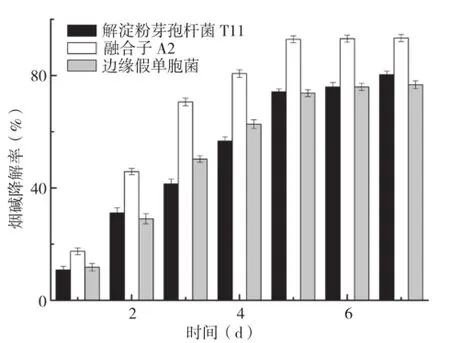
图4 融合子A2与亲株降烟碱能力的对比
2.7 融合子A2与亲株降烟碱能力的对比
将融合子A2与解淀粉芽孢杆菌T11、边缘假单胞菌进行降烟碱能力检测,通过7 d连续降解来对比其降烟碱的效果。每个菌株设置3个平行试验,每天分别测定不同菌株的降烟碱效率,取其均值作图(图4)。从图4可以看出,融合子A2在1~7 d之间的烟碱降解率均高于相应降解天数的解淀粉芽孢杆菌T11、边缘假单胞菌的烟碱降解率。第5天融合子A2、解淀粉芽孢杆菌T11及边缘假单胞菌的烟碱降解率分别为92.9%、74.27% 和73.73%,第6天、第7天各菌株烟碱降解率与第5天的烟碱降解率基本持平,融合子A2的烟碱降率基本维持在93%左右。这说明融合子A2的降解率虽然最高,但未能完全降解烟碱培养基中的烟碱,这可能是因为某种中间代谢产物达到了一定的浓度后会抑制融合子A2降烟碱关键酶的酶活性。经方差分析,第1~5天3种菌株烟碱降解率随时间变化的差异极显著,融合子A2烟碱降解率比解淀粉芽孢杆菌T11和边缘假单胞菌强。而相同条件下重复融合子A2、解淀粉芽孢杆菌T11和边缘假单胞菌降烟碱能力测定试验3次,它们最终的烟碱降解率差异不显著,这说明融合子A2烟碱降解能力比亲株强是具有统计学意义的。
3 结论与讨论
本试验结果表明,利用40%PEG-6000诱导单亲灭活的边缘假单胞杆菌和解淀粉芽孢杆菌T11原生质体进行融合是可行的,经稳定性遗传分析得到1株稳定降解烟碱的融合子A2,其在第5 天后的烟碱降解率达到92.9%,降烟碱能力比亲株高10%,为进一步研究提高微生物降烟碱能力提供基础方法,为构建应用于大田降解烟叶中含量偏高的烟碱提供技术基础。此外,还可应用此高效降烟碱融合子降解烟草废弃物中的烟碱,以降低烟碱对环境的污染,应用价值较大。
国内外已分离得到多种能够降解烟碱的微生物。张娟等[14]分离得到的摩氏摩根氏菌(细菌)发酵14 d后才降解了相同浓度下87.51%的烟碱,降解效率明显比本研究得到的融合菌株低。丁怀宇等[18]使用除虫链霉菌(放线菌)处理白肋烟烟片,烟碱降解率为74.77%,该放线菌是从烟片上分离得到的,具有更能适应存活于烟叶上的遗传特性,本试验获取的融合子A2融合了存活于烟草中两种细菌的遗传特性,因此具有较大优势,有望将其直接降解大田烟叶中含量过高的烟碱。Raman等[19]分离得到了1株降烟碱变形假单胞菌TND35,并对其发酵代谢物进行了研究,发现了新的烟碱降解途径。本研究的融合子A2遗传了亲株的部分遗传特性,但其降解烟碱的具体中间代谢物还需进一步的研究。
目前,国内采用原生质体融合等传统成熟的生物技术手段进一步提高降烟碱能力的研究鲜有报道。因此,利用生物技术获取高效降解烟碱新资源的研究有待深入研究,以加快其运用到烟草大田中去解决烟叶烟碱含量过高的问题。对于未来应用融合子去降解烟叶中的烟碱,需要评价其是否会对烟叶品质造成影响,因此对融合子A2的烟碱降解途径也有待进一步研究探讨。
[1]包勤,张艳玲,王爱国,等.2002—2013 年间我国烤烟主要化学成分变化趋势及原因分析[J].烟草科技,2015,48(7):14-19.
[2]张黎明,张明发,田峰,等.湘西州烤烟烟碱含量的区域特征及其与烟叶评吸质量的关系[J].烟草科技,2014,47(12):57-61.
[3]Chen C,Li X,Yang J,et al.Isolation of nicotinedegrading bacterium Pseudomonas sp.Nic22,and its potential application in tobacco processing[J].International Biodeterioration & Biodegradation,2008,62(3):226-231.
[4]许晓敬,张小全,侯冰清,等.生态,品种和栽培措施及其互作对烤烟主要化学成分含量的影响[J].中国农学通报,2015,31(13):62-66.
[5]Meher K K ,Panchwagh A M,Rangrass S,et al.Biomethanation of tobacco waste[J].Environmental Pollution ,1995,90(2):199 -202.
[6]Calin-Bogdan Chiribau,Marius Mihasan,Petra Ganas,et al.Final steps of nicotine in the catabolism of nicotine deamination versus demethylation of γ-N -methylaminobutyrate[J].FEBS Journal,2006,273:1528-1536.
[7]Piotrowska-Cyplik A,Olejnik A,Cyplik P,et al.The kinetics of nicotine degradation,enzyme activities and genotoxic potential in the characterization of tobacco waste composting[J].Bioresource Technology,2009,100(21):5037-5044.
[8]Newton R P,Geiss V L,Jewell J N,et al.Process for reduction of nicotine content of tobacco by microbial treatment:U.S.Patent 4,037,609[P].1977-7-26.
[9]陈德鑫,许家来,马志远,等.一株新的具有高效降低烟碱含量的短小解淀粉芽孢杆菌 MK21 的分离筛选及作用研究[J].中国烟草学报,2013,19(1):60-64.
[10]王迪,路福平,王海军,等.利用原生质体融合技术选育淀粉发酵产 DHA 的新型裂殖壶菌[J].生物技术通报,2015,31(2):84-90.
[11]申星.降烟碱烟草内生菌的筛选、鉴定及应用研究[D].长沙:湖南农业大学,2013.
[12]张娟.烟碱降解菌的筛选及其酶的纯化与性质研究[D].长沙:湖南农业大学,2012.
[13]Ma Y,Wen R,Qiu J,et al.Biodegradation of nicotine by a novel strain Pusillimonas[J].Research in microbiology,2015,166(2):67-71.
[14]张娟,张丽丽,扈麟,等.烟碱降解菌的筛选与初步鉴定[J].中国烟草学报,2010(6):89-93.
[15]任志红,苏彩云,闫敬,等.霉酚酸产生菌原生质体转基因方法的建立[J].微生物学报,2013,53 (11):1226-1232.
[16]孙剑秋,周东坡,平文祥.灭活微生物原生质体融合的研究进展[J].中国医学生物技术应用,2002 (2):29-32.
[17]赵春苗,徐春厚.原生质体融合技术及在微生物育种中的应用[J].中国微生态学杂志,2012(4):379-382.
[18]丁怀宇,韩铭海.烟碱降解微生物的筛选,鉴定及其烟碱降解效果评价[J].河南农业科学,2012,41 (2):82-85.
[19]Raman G,Mohan K N,Manohar V,et al.Biodegradation of nicotine by a novel nicotinedegrading bacterium,Pseudomonas plecoglossicida TND35 and its new biotransformation intermediates [J].Biodegradation,2014,25(1):95-107.
(责任编辑 崔建勋)
Protoplast fusion between nicotine-degrading Bacillus amyloliquefaciens and Pseudomonas marginalis to breed efficient nornicotine strain
DENG Gao-yi1,PENG Yu2,WANG Yuan-liang1
(1.College of Food Science and Technology,Hunan Agricultural University/Hunan Provincial Key Laboratory of Food Science and Biotechnology,Changsha 410128,China;2.Technology Center of China Tobacco Hunan Industrial Co.Ltd.,Changsha 410014,China)
In order to acquire fusant with high nicotine-degrading ability,Bacillus amyloliquefaciens T11 and Pseudomonas marginalis were used for parent strains.After using lysozyme to break the cell walls of parent strains,the Bacillus amyloliquefaciens T11 protoplast and heat-inactivated Pseudomonas marginalis protoplast were induced by 40% PEG-6000 for protoplast fusion experiment,then the nicotine-degrading ability of fusant was measured.Through preliminary screening,176 fusion strains were obtained.After rescreening by nicotine selective culture medium,5 fusion strains with higher nicotine-degrading ability were acquired.Genetic stability analysis of the 5 fusion strains and comparision with parent strains’ nicotine-degrading rate were further measured.A better fusant A2 with higher nicotinededrading ability than parent strains was obtained finally,93% nicotine in culture medium was degraded in five days.
Bacillus amyloliquefaciens T11;Pseudomonas marginalis;protoplast;fusant;nicotine
S182
A
1004-874X(2016)06-0143-06
10.16768/j.issn.1004-874X.2016.06.025
2015-11-18
湖南中烟工业有限责任公司(KY2012Y C0001)
邓高毅(1989-),男,在读硕士生,E-mail∶610715556@qq.com
王远亮(1976-),男,博士,教授,E-mail∶408083310@qq.com

