大豆GmMYB138A基因的克隆及冷胁迫诱导表达分析
王金宾,金东昊,黄成成,孙浩然,陈 帅,李绪彦
(吉林大学植物科学学院,吉林 长春 130062)
大豆GmMYB138A基因的克隆及冷胁迫诱导表达分析
王金宾,金东昊,黄成成,孙浩然,陈 帅,李绪彦
(吉林大学植物科学学院,吉林 长春 130062)
根据大豆基因组信息,从大豆品种吉林32中克隆了1个转录因子基因,该基因对应大豆基因组中的CDS Glyma02g03020。生物信息学分析表明,该基因编码的蛋白属于MYB转录因子类型,主要分布在细胞核中;进化树分析将它与1R-MYB蛋白聚为一类,并与大豆MYB138亲缘关系最近,同源性可达96%,将其命名为GmMYB138A;进一步利用qRT-PCR分析GmMYB138A响应冷胁迫的表达模式,结果表明随着胁迫处理时间的延长,该基因表达逐渐增加,并在胁迫24 h达到高峰,提示GmMYB138A可能参与大豆的冷胁迫应答过程。
大豆;GmMYB138A;克隆;冷胁迫;基因表达
王金宾,金东昊,黄成成,等.大豆GmMYB138A基因的克隆及冷胁迫诱导表达分析[J].广东农业科学,2016,43(6):43-48.
MYB蛋白是植物中最大的一类转录因子,广泛存在于真核生物中并发挥着重要的作用[1]。MYB转录因子含有两个重要的功能区域,一个是N端保守MYB结构域,用于结合特定的DNA序列;另一个是C端转录调控区域,用于决定MYB蛋白对基因表达正/负调节作用。MYB结构域通常包含1~3个串联的、不完全重复的R序列(R1、R2和R3),每个重复的R序列含有52个左右的氨基酸,形成3个α螺旋,进而组成具有疏水核心的HTH(螺旋-折叠-螺旋)结构,其中第3 个α螺旋作为识别螺旋,直接与DNA结合并插入到DNA大沟中[2]。在与DNA直接作用过程中,通常是2个识别螺旋协同作用从而结合特定的DNA基序[3]。
植物MYB 转录因子首先在玉米中得到鉴定[4],随着多个植物基因组测序的完成大量的MYB基因被分离鉴定,例如拟南芥有198个MYB,水稻有242个MYB,甜橙有177个MYB[5-7]。根据不完全重复 R序列的数量,这些植物MYB转录因子可分为4类,分别为1R-MYB(R1/R2,R3-MYB)、2R-MYB(R2R3-MYB)、3R-MYB(R1R2R3-MYB)和4R-MYB (R1R2R2R1/R2-MYB)[8]。与动物中MYB蛋白的主要存在形式不同,植物MYB转录因子大多属于R2R3-MYB类型,而其他3类MYB转录因子(1R、3R和4R MYB)类型所占比例相对较少[8-10]。这些MYB转录因子在植物的生长发育、光周期、细胞周期、初次生代谢、激素和光信号转导等生理过程中发挥着重要的作用[8,11-12]。随着人们对逆境胁迫影响植物生长发育和作物产量的认识,MYB转录因子在逆境应答中的作用也倍受关注。目前在拟南芥、水稻、小麦、大豆、甘蔗等多个物种中分别克隆到许多逆境应答相关的MYB基因,如AtMYB2、AtMYB15、AtMYB41、AtMYB44、AtMYB61、AtMYB77、AtMYB102、OsMYB4、OsMYB2、OsMYB55、TaMYB1、TaMYB2A、TaMYB33、GmMYBJ1和 ScMYBAS1等。这些MYB基因在植物响应干旱、热、低温、盐、损伤等胁迫中发挥着重要的作用[8,13-19],然而这些逆境应答相关的MYB转录因子大多都是R2R3-MYB类蛋白。近年来在植物中鉴定了几个与逆境应答相关的R1-MYB蛋白,如AtMYBC1能够负调控拟南芥的耐冻能力[20],OsMYBS3和Jc1RMYB1分别参与了水稻和麻风树响应低温胁迫的过程[21-22],TaLHY在小麦对条锈病的抗性方面发挥着重要的作用[23],羊草的LcMYB1基因能够提高拟南芥的耐盐能力[24]。这些研究结果表明1R-MYB也参与植物的逆境应答过程,然而目前关于1R-MYB在植物响应逆境方面的研究相对较少,需要挖掘更多逆境应答相关的1R-MYB转录因子并阐释其作用机理。
本研究在大豆中克隆了1个1R-MYB转录因子GmMYB138A,并利用生物信息学手段对其编码蛋白的理化特性及进化特性进行了分析,进一步对其在低温胁迫下基因表达模式进行了分析,推测该基因可能参与大豆早期响应低温胁迫的信号转导过程。该研究提供了大豆GmMYB138A的初步信息,这为深入开展GmMYB138A基因功能研究(尤其在低温应答方面)奠定了基础。
1 材料与方法
1.1 试验材料
供试大豆品种为吉林32。
1.2 试验方法
1.2.1 大豆冷胁迫处理 取大豆品种吉林32种子,用15%的次氯酸钠消毒 20 min,然后用无菌水清洗 4~6 次,将种子种在土和蛭石(3∶1)的钵中,在人工气候室内(温度24℃,光照12 h)培养,定时通风,定时浇灌营养液,待种子出苗后,每钵保留生长健壮、大小一致的幼苗 2 株。播种后14 d开始对幼苗进行4℃低温胁迫处理:分别在第0、24、48、60、66 h将正常生长的幼苗移至低温人工气候室(4℃,光照12 h)进行冷胁迫培养,72 h后分别收集不同时间点处理的幼苗整株组织作为冷胁迫处理72、48、24、12、6 h 的材料,并以正常培养的同龄幼苗为对照0h处理,液氮速冻后贮于-80℃冰箱中备用。
1.2.2 RNA提取及cDNA第一链的合成 取大豆幼苗和低温胁迫处理的整株幼苗组织在液氮中研磨,分别称取0.1 g组织粉末,利用RNAisoPlus试剂(TaKaRa)提取幼苗组织中的RNA,其提取流程按照试剂说明书进行。提取的RNA经RNase-Free DNase处理,除去其中的基因组DNA。通过琼脂糖凝胶电泳和OD260/OD280比值判断RNA的完整性与质量。取完整性与质量良好的RNA,利用PrimeScript 逆转录酶(TaKaRa)反转录成 cDNA模板,其方法与流程按照说明书进行,所得cDNA模板用于后续基因克隆与实时定量PCR检测。
1.2.3 RT-PCR克隆GmMYB138A基因 根据公共数据库(www.phytozome.net)中发布的基因组序列信息,通过搜索,根据所得序列设计特异引物,MYB138AF:5' -ATGTCTCGCACGTGCTCA-3',MYB138A -R: 5'- AGCAACGCTGATGATACTATCC -3'。以上述所得cDNA为模板,利用高保真酶Ex Taq(TaKaRa)进行PCR扩增。PCR程序:94℃预变性2 min;94℃变性30 s、60℃退火30 s、72℃延伸1 min,共30个循环;72℃延伸7 min。PCR产物经纯化后连接到pGMT载体(TIANGEN)上并转入大肠杆菌DH5ɑ,由北京华大基因中心进行测序。
1.2.4 GmaMYB138A的生物信息学分析 通过测序获得大豆品种吉林32 GmaMYB138A的基因序列后,利用以下在线软件对其编码蛋白的理化及结构特性进行分析:利用Compute pI/Mw(http://web.expasy.org/compute_pi)对GmaMYB138A蛋白分子量和等电点进行分析;利用ProtParam(http://web.expasy.org/protparam/)对该蛋白的基本性质进行分析;利用SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)预测蛋白质的二级结构;利用SWISS-MODLE (http://swissmodel.expasy.org/interactive)对其三维结构进行预测;利用SMART(http://smart.embl-heidelberg.de/)对蛋白结构域进行分析;利用SignalP (http://www.cbs.dtu.dk/services/SignalP/)预测蛋白质序列中信号肽的剪切位点;利用PSORT (http://www.psort.org/)预测蛋白亚细胞定位;不同物种的MYB蛋白序列来自NCBI (www.ncbi.nlm.nih.gov),运用MEGA5.02 软件对GmaMYB138A蛋白及其同源蛋白进行进化树分析。
1.2.5 GmaMYB138A在冷胁迫下的基因表达分析 运用PrimerBLAST设计GmaMYB138A基因与内参基因SUBI3的特异性引物,其序列分别为qMYB138F2:5'- GCGCAAGCGAGGTGTTCCTT-3',qMYB138R2:5'- CGCCATCGTTTCTTGCGGAA-3',扩增片段长度为237 bp;SUBI3-F:5'-GTGTAAT GTTGGATGTGTTCCC-3',SUBI3-R:5'-ACACAA TTGAGTTCAACACAAACCG-3',扩增片段长度为190 bp。采用SYBR® Premix Ex Taq™Ⅱ试剂盒(TaKaRa),并按照说明书对反应体系进行设置。运用ABI7500荧光定量 PCR 仪及其软件系统进行荧光定量PCR检测与分析。以大豆SUBI3基因为内参,计算GmaMYB138A基因相对表达量2-ΔΔCt。
2 结果与分析
2.1 大豆MYB138A基因的克隆及序列分析
通过phytozome网站(www.phytozome.net) 对大豆基因组进行在线搜索,以所得序列为参考设计特异性引物,以大豆品种吉林32的cDNA为模板对目的基因进行克隆(图1)。测序分析表明,其CDS 全长为903 bp,对应大豆基因组中的Glyma02g03020,编码300个氨基酸,分子量为32.16 ku,等电点为9.86。
2.2 大豆MYB138A蛋白特性预测
利用ProtParam在线工具对该基因编码蛋白氨基酸特性进行分析,结果显示该MYB蛋白含14.0%碱性氨基酸残基(K、R和H),8.0%酸性氨基酸残基(D、E),28.2.%疏水氨基酸残基(A、I、L、F、W、V),29.9%极性氨基酸残基(N、C、Q、S、T、Y),其中碱性氨基酸含量高于酸性氨基酸,说明该MYB蛋白为碱性蛋白。通过SOPMA和SWISS-MODEL分别对该蛋白进行二级结构预测及三级结构建模,结果表明该MYB蛋白由4种二级结构组成(图2A),其中α螺旋为主、占31.7%,β折叠、无规则卷曲以及β转角分别占29.7%、27.3%、11.3%,具有典型的HTH(螺旋-折叠-螺旋)结构(图2A、B)。利用SMART在线工具对该基因编码蛋白的结构域进行分析,结果显示第91~141位氨基酸组成1个典型的SANT/MYB-like结构域,表现为1R-MYB蛋白特点。除此外,该蛋白在第4~20位氨基酸还含有ZnF_C2H结构域(图2C)。
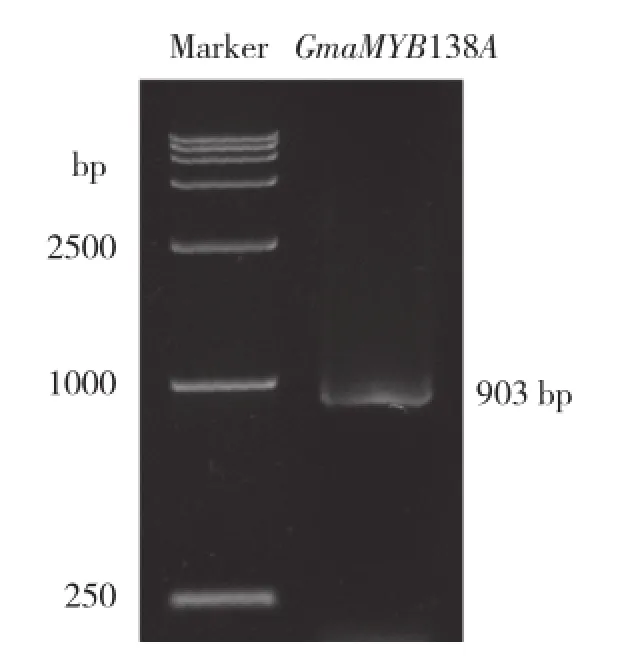
图1 大豆MYB138A的RT-PCR扩增结果
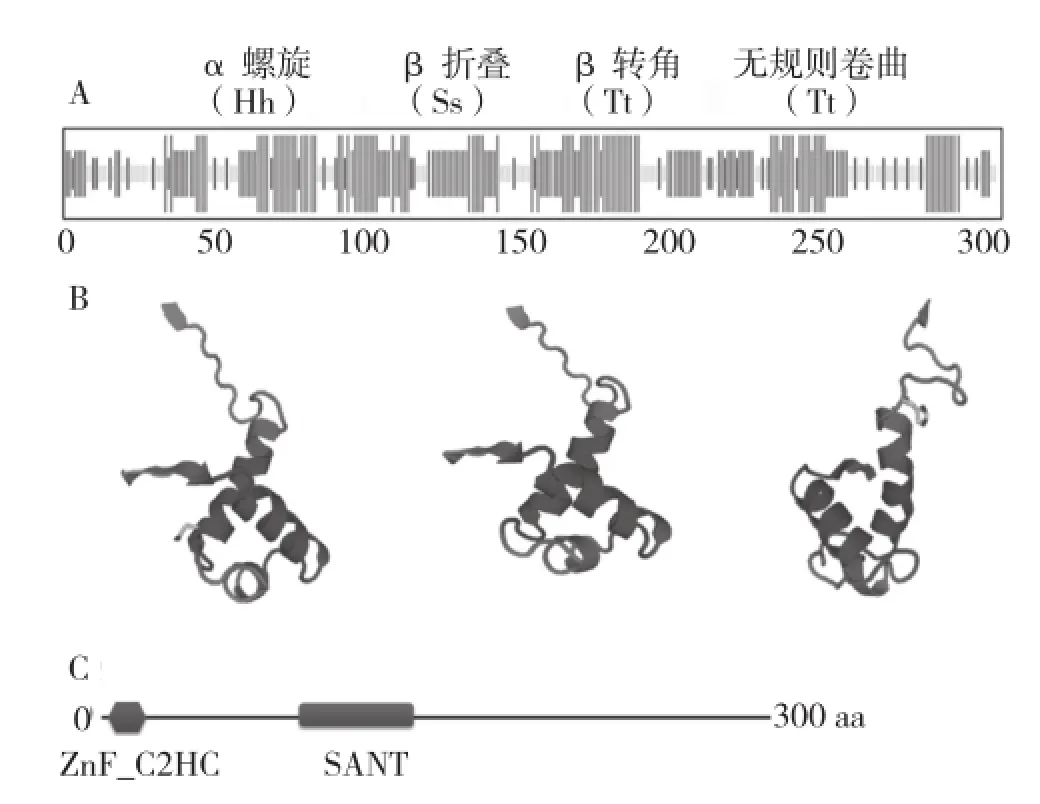
图2 GmMYB138A蛋白二级结构、三维结构及结构域的预测分析
利用PSORT对该MYB蛋白进行亚细胞定位分析,结果表明该蛋白主要分布在细胞核中,这与MYB转录因子的功能相一致。利用NetNES对该蛋白的信号肽进行预测,结果表明该蛋白的247~253位氨基酸(LPLSLNL)是典型的富含亮氨酸的核运输信号肽。利用STRING10预测可能与该MYB蛋白发生相互作用的因子,结果发现它可能与MYB114和MBY118相互作用,而MYB114与下胚轴延迟伸长和生物钟相关。
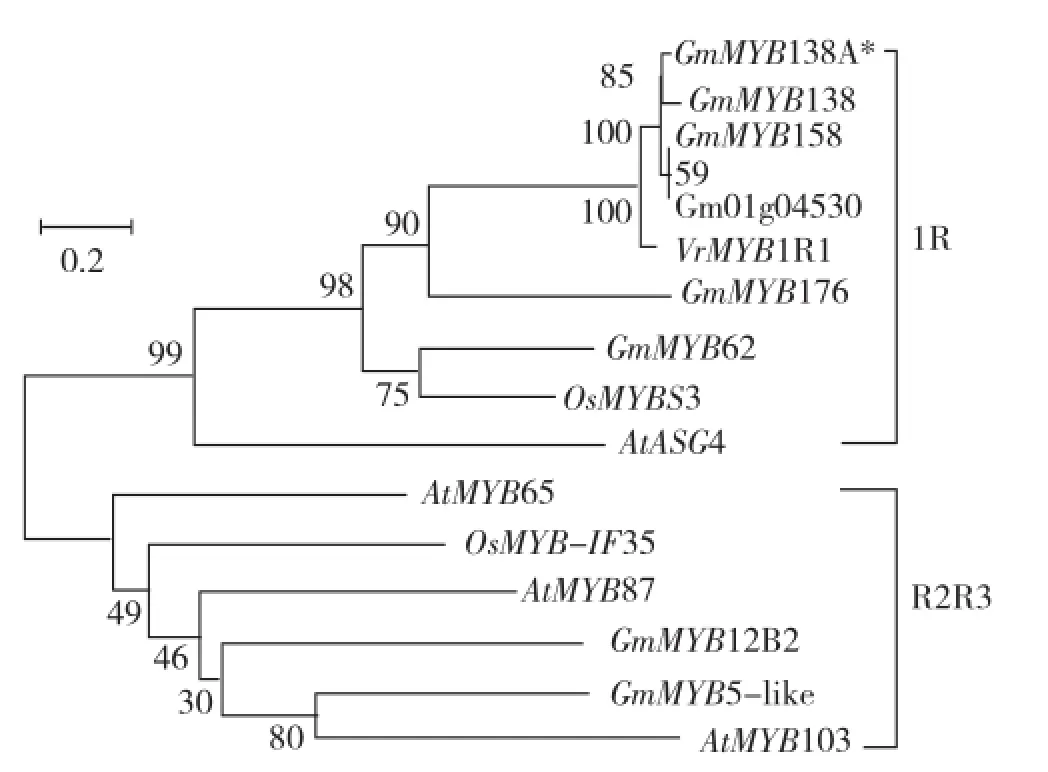
图3 大豆MYB138A蛋白与其它MYB蛋白的系统进化树分析

图4 大豆MYB138A与其他1R-MYB蛋白序列同源比对分析
2.3 大豆MYB138A蛋白同源性比对分析
为了研究该MYB蛋白与其它MYB蛋白的亲缘关系,从NCBI中获取了大豆、拟南芥和水稻中的一些1R-MYB类和R2R3-MYB类蛋白序列,利用MEGA5软件构建了进化树。图3结果表明这些MYB蛋白聚为两类:1R-MYB蛋白类和R2R3-MYB蛋白类。我们鉴定的大豆MYB蛋白与R1-MYB蛋白聚为一类,并与GmMYB138表现为最近的亲缘关系,而与GmMYB176、GmMYB62及拟南芥与水稻中的MYB蛋白亲缘关系相对较远(图3)。进一步利用Clustal W 软件将该MYB蛋白与1R-MYB蛋白序列进行比对,结果显示该蛋白与大豆和绿豆(Vigna radiata var.radiata)中的R1-MYB蛋白相似性最高,其中与GmMYB138、GmMYB158、Gm01g04530和VrMYB1R1相似性分别达到96%、96%、89%和88%(图4)。该蛋白与MYB138亲缘关系最近、序列相似性最高,因此将该MYB蛋白命名为MYB138A。序列比对分析也表明这些1R-MYB蛋白在SANT结构域的序列具有高度的保守性,而其他区域是否具有保守性与它们的进化关系呈正相关,进化关系较近的1R-MYB蛋白相互之间序列保守性较强,反之保守性较弱,这暗示1R-MYB类蛋白功能的多样性和保守性。
2.4 大豆MYB138A在冷胁迫下的表达分析
前人的研究结果表明一些R1-MYB转录因子响应低温胁迫应答,为了研究大豆MYB138A是否具有冷胁迫诱导特性,利用实时定量RT-PCR方法分析了该基因对冷胁迫的响应。结果表明,随着冷胁迫GmMYB138A基因表达量开始增加,冷胁迫24 h时GmMYB138A基因表达量达到最高峰,与对照相比增加了5.39倍;然而随着胁迫时间的延长,GmMYB138A基因表达量开始降低(图5),这表明GmMYB138A基因表达受到冷胁迫诱导。
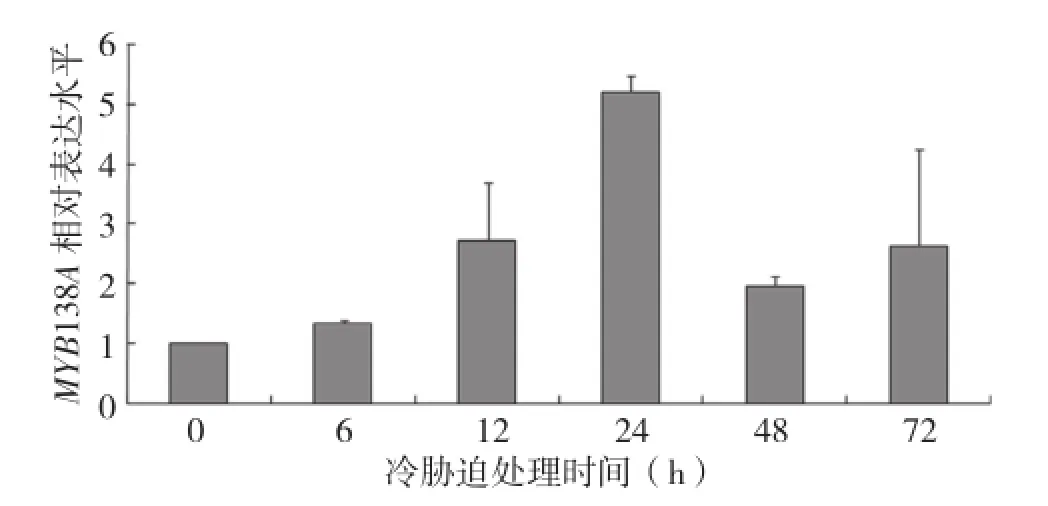
图5 大豆MYB138A基因在冷胁迫条件下的表达模式
3 讨论
MYB蛋白是植物体内存在最为广泛的转录因子,其中 1R-MYB是MYB转录因子中重要的一个类型。尽管目前已经在大豆、拟南芥、水稻、小麦等许多植物物种中鉴定了1R-MYB基因,它们在植物生长发育、次生代谢、逆境应答等许多生理过程中发挥着重要的作用[19-24],但是关于1R-MYB蛋白的研究相对较少。该研究在大豆中鉴定了1个1R-MYB基因,并对其冷胁迫诱导特性进行了分析,这为后期深入研究其功能奠定了基础。
本研究从大豆中克隆 1 R-M Y B蛋白基因GmMYB138A,通过4个方面对其是否属于1R-MYB转录因子蛋白家族成员进行了分析。首先该基因编码蛋白中α螺旋与β折叠所占比例很高,这与MYB结构域具有HTH(螺旋-转角-螺旋)结构相一致;其次,生物信息学预测表明该蛋白主要定位在细胞核中,并且具有核运输信号肽,这与MYB转录因子在细胞核中发挥作用相一致;其三,该基因编码蛋白具有典型的SANT/MYB-like蛋白结构域,并且该SANT/MYB-like结构域的序列具有高度的保守性;最后,该基因编码的蛋白序列与大豆和绿豆中的一些1R-MYB蛋白具有高度同源性,与大豆中的1R-MYB型蛋白GmMYB138的同源性高达96%,说明我们在大豆中克隆的基因GmMYB138A为1R-MYB型蛋白基因。为了了解GmMYB138A的功能,分析了其与大豆、拟南芥、绿豆、水稻中MYB蛋白家族不同成员的系统进化关系,结果显示GmMYB138A与1R-MYB聚为一类,并与大豆中的MYB138、MYB158、Gm01g04530亲缘关系较近,这表明GmMYB138A的功能可能与MYB138、MYB158、Gm01g04530、VrMYB1R1相似,然而目前尚未见到这些蛋白功能的报道。
Liao等研究表明大豆受到冷、干旱、ABA处理后有43个MYB基因表达水平发生了变化[25],说明大豆MYB基因在响应非生物胁迫过程中发挥着重要的作用。近年来也有关于1R-MYB参与响应植物冷害或冻害的报道。例如水稻OsMYBS3通过抑制依赖于DREB1/CFB冷信号途径介导水稻的低温胁迫耐受机制[21];拟南芥MYBC1通过不依赖于CFB冷信号途径负调控冻害胁迫的耐受过程[20],这说明不同的1R-MYB成员在冷/冻胁迫中所起的作用不同。本研究利用实时定量RT-PCR方法分析了GmMYB138A在冷胁迫下的基因表达情况,结果表明受到冷胁迫后GmMYB138A基因的表达量开始增加,在胁迫24 h时达到高峰,这与水稻OsMYBS3和麻风树Jc1RMYB1基因受低温诱导的报道相一致[21-22],表明GmMYB138A基因可能参与大豆的冷胁迫应答过程,但是GmMYB138A在冷胁迫中的作用与功能还有待进一步研究。
[1]Riechmann J L,Ratcliffe O J.A genomic perspective on plant transcription factors[J].Curr Opin Plant Biol.,2000,3(5):423-434.
[2]Ogata K,Kanei-Ishii C,Sasaki M ,et al.The cavity in the hydrophobic core of Myb DNA-binding domain is reserved for DNA recognition and trans-activation [J].Nat.Struct.Biol.,1996,3:178-187.
[3]Dubos C,Stracke R,Grotewold E,et al.MYB transcription factors in Arabidopsis[J].Trends Plant Sci.,2010,15:573-581.
[4]Paz-Ares J,Ghosal D,Wienand U,et al.The regulatory c1 locus of Zea mays encodes a protein with homology to myb proto-oncogene products and with structural similarities to transcriptional activators[J].EMBO J,1987,6(12):3553-3558.
[5]Chen Y,Yang X,He K,et al.The MYB transcription factor superfamily of Arabidopsis: expression analysis and phylogenetic comparison with the rice MYB family [J].Plant Mol Biol,2006,60:107-124.
[6]Katiyar A,Smita S,Lenka SK,et al.Genomewide classification and expression analysis of MYB transcription factor families in rice and Arabidopsis[J].BMC Genomics,2012,13:544.
[7]Hou X,Li S,Liu S,et al.Genome-wide classification and evolutionary and expression analyses of citrus MYB transcription factor families in sweet orange[J].PLoS ONE,2014,9(11):e112375.
[8]Ambawa S,Sharma P,Yadav NR,et al.MYB transcription factor genes as regulators for plant responses: an overview[J].Physiol Mol Biol Plants,2013,19(3):307-321.
[9]Du H,Feng B R,Yang S S,et al.The R2R3-MYB transcription factor gene family in maize[J].PLoS One,2012,7(6):e37463.
[10]Du H,Yang S S,Liang Z,et al.Genome-wide analysis of the MYB transcription factor superfamily in soybean [J].BMC Plant Biol,2012,12:106.
[11]Liu J,Osbourn A,Ma P.MYB transcription factors as regulators of phenylpropanoid metabolism in plants [J].Molecular Plant,2015,8:689-708.
[12]Kobayashi K,Suzuki T,Iwata E,et al.MYB3Rs,plant homologs of Myb oncoproteins,control cell cycle-regulated transcription and form DREAM-like complexes[J].Transcription,2015,6(5):106-111.
[13]刘守梅,孙玉强,王慧中.植物MYB转录因子研究[J].杭州师范大学学报,2012,11(2):146-150.
[14]Agarwal M,Hao Y,Kapoor A,et al.A R2R3 type MYB transcription factor is involved in the cold regulation of CBF genes and in acquired freezing tolerance[J].J Biol Chem,2006,281:37636-37645.
[15]Jung C,Seo J,Han S,et al.Overexpression of AtMYB44 enhances stomatal closure to confer abiotic stress tolerance in transgenic Arabidopsis[J].Plant Physiol.,2008,146:623-635.
[16]El-kereamy A,Bi Y M,Ranathunge K,et al.The rice R2R3-MYB transcription factor OsMYB55 is involved in the tolerance to high temperature and modulates amino acid metabolism[J].PLoS One,2012,7(12):e52030.
[17]Qin Y,Wang M,Tian Y,et al.Over-expression of TaMYB33 encoding a novel wheat MYB transcription factor increases salt and drought tolerance in Arabidopsis[J].Mol Biol Rep,2012,39:7183-7192.[18]Su L,Li J,Liu D,at el.A novel MYB transcription factor,GmMYBJ1,from soybean confers drought and cold tolerance in Arabidopsis thaliana[J].Gene,2014,538:46-55.
[19]Elena B,Annamaria G,Eleonora C.Plant MYB transcription factors:their role in drought response mechanisms[J].Int J Mol Sci,2015,16:15811-15851.
[20]Zhai H,Bai X,Zhu Y,et al.A single-repeat R3-MYB transcription factor MYBC1 negatively regulates freezing tolerance in Arabidopsis[J].Biochem Biophys Res Commun,2010,394(4):1018-1023.
[21]Su C,Wang Y,Hsieh T,et al.A novel MYBS3-dependent pathway confers cold tolerance in rice[J].Plant Physiol,2010,153:145-158.
[22]Li H,Guo D,Peng S.Molecular characterization of the Jatropha curcas JcR1MYB1 gene encoding a putative R1-MYB transcription factor[J].Genet Mol Biol,2014,37(3):549-555.
[23]Zhang Z,Chen J,Su Y,et al.TaLHY,a 1R-MYB transcription factor,plays an important role in disease resistance against stripe rust fungus and ear heading in wheat[J].PLoS One,2015,10(5):e0127723.
[24]Cheng L,Li X,Huang X,et al.Overexpression of sheepgrass R1-MYB transcription factor LcMYB1 confers salt tolerance in transgenic Arabidopsis[J].Plant Physiol Biochem.,2013,70:252e260.
[25]Liao Y,Zou H F,Wang H W,et al.Soybean GmMYB76,GmMYB92,and GmMYB177 genes confer stress tolerance in transgenic Arabidopsis plants[J].Cell Res,2008,18(10):1047-1060.
(责任编辑 邹移光)
Cloning of GmMYB138A from Glycine max.and its expression analysis under cold stress
WANG Jin-bin,JIN Dong-hao,HUANG Cheng-cheng,SUN Hao-ran,CHEN Shuai,LI Xu-yan
(College of Plant Science,Jilin University,Changchun 130062,China)
According to the soybean genomic database,a transcription factor gene,GmMYB138A,was cloned from Glycine max.cv Jilin32.Bioinformatic analysis indicated that the protein encoded by this gene belonged to 1RMYB group,and was localized in nucleus.Sequence alignment and phylogenetic analysis showed that GmMYB138A was clustered into the 1R-MYB group,evolutionarily closest to MYB138 from soybean,and the identity was up to 96%.Furthermore,q PCR analysis was conducted to examine its expression pattern in response to cold stress.As a result,the transcriptional level was gradually promoted with the cold treatment duration,and the peak occurred at 24h after cold stress,suggesting that GmMYB138A might be involved in the signaling transduction during cold stress.
soybean;GmMYB138A;cloning;cold stress;gene expression
S565.1
A
1004-874X(2016)06-0043-06
10.16768/j.issn.1004-874X.2016.06.009
2016-01-08
国家自然科学基金(31300253);国家大学生创新创业训练计划项目(2014A82371)
王金宾(1992-),男,在读本科生,E-mail:2398885301@qq.com
李绪彦(1975-),女,博士, 副教授, E-mail:xuyanli@jlu.edu.cn

