油松幼苗水分传输效率及安全性对养分和水分添加的响应
黄绍琳 ,李秧秧
(1 西北农林科技大学 林学院,陕西杨陵 712100;2 西北农林科技大学 水土保持研究所,陕西杨陵 712100;3 中国科学院水利部水土保持研究所 黄土高原土壤侵蚀与旱地农业国家重点实验室,陕西杨陵 712100)
油松幼苗水分传输效率及安全性对养分和水分添加的响应
黄绍琳1,李秧秧2,3*
(1 西北农林科技大学 林学院,陕西杨陵 712100;2 西北农林科技大学 水土保持研究所,陕西杨陵 712100;3 中国科学院水利部水土保持研究所 黄土高原土壤侵蚀与旱地农业国家重点实验室,陕西杨陵 712100)
摘要:探讨油松水分传输效率和安全性对养分和水分添加的响应是揭示其适应性的基础。该试验采用新改进的离心机技术,以2年生油松幼苗当年生枝为材料,试验设置对照(CK,不施肥、自然降水)、氮磷养分添加(F,按每年120 kg/hm2纯N和60 kg/hm2纯P水平添加N和P素,自然降水)及养分和水分同时添加(FI,按每年120 kg/ hm2纯N和60 kg/hm2纯P水平添加N素和P素,且补水100 mm)3个处理,研究了油松幼苗水分传输效率和栓塞脆弱性对氮磷养分和水分添加的响应。结果表明:(1)与CK相比,氮磷养分添加(F)增加了油松幼苗地径、冠幅和地上部生物量,但对比导水率(Ks)、比叶导水率(LSC)、Huber值、抵抗栓塞能力(P50)及水分传输安全阈值均影响不大。(2)氮磷和水分同时添加处理(FI)的地径、株高、冠幅和地上部生物量显著高于CK和F处理,其Ks、LSC和Huber值与CK及F处理相比并无显著差异,但P50比CK和F处理增加0.2 MPa左右,且水分传输安全阈值相对变小。研究表明,养分添加对油松幼苗当年生枝的水分传输效率和安全性影响不大,水分添加对水分传输效率亦无显著影响,但降低了水分传输的安全性,原因主要与管胞长度增加及管胞壁抗爆破阻力下降有关。
关键词:油松幼苗; 水分养分添加; 水分传输效率; 栓塞脆弱性
植物长距离水分传输直接决定着植物叶的碳摄取和水分利用,是植物体重要的生理过程之一[1]。比导水率(Ks)和对干旱诱导的栓塞脆弱性是植物2个最重要的水力特征,前者是木质部水分传输效率的度量,后者反映了木质部水分传输的安全性。不同植物Ks和对栓塞的脆弱性(经常用导水率损失50%所对应的木质部负压P50来衡量,其值越负,植物抵抗栓塞形成的能力愈强)差别很大,如散孔材树种的Ks可相差100倍[2],不同植物的P50可从-0.2 MPa变化到-14 MPa[3]。除物种的差异外,植物木质部Ks和栓塞脆弱性还受环境条件,特别是水分和养分等的综合影响,揭示其对水分和养分添加的响应有助于揭示植物对不同生境的适应机制。
迄今关于水分和养分对植物水分传输效率和安全性已有一些研究,如对167个物种的研究表明:落叶被子植物茎Ks随降雨量减少而增加,但常绿被子植物和针叶树种的Ks和水分有效性的联系不紧密[3-4];湿润生境中的植物较干旱生境中的植物常常具有低的抗栓塞能力[3,5-7],但在杨树和一些裸子植物上发现不同水分生境植物抗栓塞能力并无显著差异[7-10];施氮增加了杨树Ks,但抗栓塞能力显著降低[7,11-14],磷营养可增加杨树的抗栓塞能力[11];在巴西中部稀树草原生长的树木上发现:氮添加增加了末端枝条Ks,但大多数情况下叶比导水率(LSC)和木材密度降低,氮添加使抗栓塞能力显著增加,添加磷素后5种树种中仅1种的P50有显著降低[15]。磷添加可以显著提高元宝枫和遭受干旱胁迫时女贞的导水率损失百分数[16];氮和磷同时施用增加了阿根廷6种亚热带树种中2种树木的Ks和LSC,但降低了其中1种树木的Ks和LSC,其余3种树木无反应[17];施肥导致火炬松冠层气孔导度和LSC下降了50%,根抗栓塞能力增加50%[18]。上述情况说明,不同研究中水分和养分添加后对水分传输效率和安全性的影响因树种、生长条件、水分或养分处理方法等而异,且大多数研究集中在水分或某个养分的影响上,缺乏同一树种对水分和养分响应的综合研究。鉴于此,我们测定了氮、磷和水分添加下油松幼苗当年生枝的脆弱性曲线、水分传输安全阈值及木质部解剖结构等特征,以揭示油松幼苗茎水分传输效率和安全性对水分和养分的响应,从而为油松的科学培育提供理论参考。
1材料和方法
1.1试验地点概况
试验地位于陕西省咸阳市杨陵区揉谷乡前东村。该地地处陕西关中平原中部,属暖温带大陆性季风半湿润气候,雨热同期, 夏季降水量占全年降水量的70%左右。年平均气温12.9 ℃,最冷月(1月)平均气温-1.1 ℃,最热月(7月)平均气温25.8 ℃,年极端最低气温-19.4 ℃,年极端最高气温42 ℃。年≥0 ℃积温为4 903 ℃,持续天数为309 d,无霜期221 d,年平均降雨量651 mm。
1.2试验设计
试验以密度为每平方4株的2年生油松幼苗为研究对象,土壤为塿土。试验设3个处理:1)对照(CK),未添加N、P肥,自然降雨量下生长;2)养分添加(F),按每年120 kg/hm2纯N和60 kg/hm2纯P水平同时添加尿素和重过磷酸钙,自然降雨量下生长;3)养分和水分同时添加(FI),按每年120 kg/hm2纯N和60 kg/hm2纯P水平添加尿素和重过磷酸钙,且在当地年降雨量基础上补水100 mm。施肥和补水处理从2014年3月起开始实施,施肥为每隔1月结合降雨或人工少量补水进行穴施,当进行人工补水时对照小区也补充同样水量;补水处理主要在3~7月进行,每月1次,补水量均为20 mm(水表控制)。每个处理设3个小区,小区面积为50 m2,随机排列。处理时段内(2014年3月到2015年7月)降雨量为961 mm,与多年同时段降雨量基本一致,其它为常规管理。测定在2015年8月进行,在各小区中部随机选油松3棵,测量株高和地径,然后清晨采样用于油松水力性质的测定,最后统计生物量。
1.3测定项目与方法
1.3.1株高、地径和干生物量地径用游标卡尺进行测量,株高用卷尺进行测定,茎水力性质测定完成后测量整个地上部生物量,每个处理共测定9株。
1.3.2正午叶水势每小区随机选2株油松,每株取当年生针叶2枚,在晴天13:00左右用压力室(1000型压力室,美国PMS公司)测定其叶水势,共测定3次,测定时段主要在5~7月。以3次叶水势测定最低值作为生长季最低叶水势(ψmin)。
1.3.3脆弱性曲线、导水率和Huber值利用改进的Cochard离心机法[19-20]测定油松当年生枝的脆弱性曲线。由于松科植物自然状态下的栓塞很低,加之正压冲洗可能会使纹孔膜的塞-环(torus-margo)结构移位,很多研究者均直接取不冲刷的原位枝干进行脆弱性曲线测定[21-22]。本研究发现油松自然状态下的栓塞程度低于2%,故直接用未冲刷的原位枝干进行脆弱性曲线测定,每处理测定9个茎段。
黎明前用修枝剪直接从基部剪下油松幼苗,放入黑塑料袋中带回实验室。在实验室中水下取油松主茎上当年生茎段,水下多次修剪两端并剥去两端的树皮,使最终茎长约27.4 cm,然后置于离心机(Allegra X-22型,美国Beckman-Coulter公司)中,通过控制离心机转速来形成由低到高的压力梯度,每一压力下至少稳定5 min后用20 mmol/L KCl +1 mmol/L CaCl2溶液测定导水率,当导水率损失至少在90%以上时脆弱性曲线测定结束。导水率损失百分数(PLC,%)=100×(Kmax-Kh)/Kmax,其中Kh为某压力下的导水率,Kmax为-0.2 MPa下对应的导水率(最大导水率)。PLC与诱导栓塞形成的压力之间的关系即为脆弱性曲线。利用Weibull函数对脆弱性曲线进行模拟:
PLC/100 =1-exp[-(-x/b)^c]
其中,b为导水率损失63.2%时所对应的木质部压力的绝对值,c为曲线在-b时的陡度,该值越大,曲线越陡。模拟曲线用来计算导水率损失12%、50%和88%所对应的木质部负压P12、P50和P88。
脆弱性曲线测定中得到Kmax与茎木质部面积之比即为比导水率(Ks,kg·MPa-1·m-1·s-1),Kmax与该茎段上承载的所有叶面积之比即为叶比导水率(LSC,kg·MPa-1·m-1·s-1),茎段上木质部面积与叶面积之比即为Huber值。
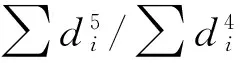
1.3.5管胞长度取测定完脆弱性曲线的9个茎,在茎段中部取长约3 cm茎块,然后去除周皮和髓,置于80%冰乙酸和30%过氧化氢按照1∶1比例配成的混合液中 60 ℃下过夜[25]。软化后的样品在蒸馏水冲洗后,用甲苯胺兰溶液染色3~5 min,然后置于放有甘油的载玻片上,在放大40倍显微镜下测量管胞长度,每个茎段至少测定50个管胞。
1.3.6木材密度在测定完脆弱性曲线的茎段中部,取 2 cm长的茎块,去除树皮和髓心,然后在蒸馏水中浸泡约1周,用排水法在万分之一天平上测定其体积,此后样品在80℃下烘干48 h, 称其干重,干重与体积之比即为木材密度[26]。木材密度测定重复9次。
1.4统计分析
所有数据用平均值标准误表示。不同处理间生长、水力和解剖性质之间的差异用单因素方差分析,当单因素方差分析达到显著后,用Duncan法进行多重比较。所有统计分析用SPSS11.5软件进行。
2结果与分析
2.1养分和水分添加对油松生长的影响
养分添加(F)后,油松株高与对照相比无显著差异,但地径、冠幅和地上部生物量均有显著增加,养分和水分同时添加(FI)使株高、地径、冠幅和地上部生物量显著高于对照(CK)和F处理(表1)。F处理油松的株高、地径、冠幅和地上部生物量分别比CK增加10.18%、15.79%、29.50%和36.16%;FI处理油松的株高、地径、冠幅和地上部生物量分别比F处理增加21.75%、20.0%、39.14%和47.17%,表明养分单独添加或养分水分同时添加均可促进油松的生长,且以养分水分同时添加促进生长的作用最大;水分添加后促进生长的效应大于养分添加后促进生长的效应。
2.2养分和水分添加对油松茎水分传输效率的影响
图1显示,3个处理油松茎的比导水率(Ks)界于1.27~1.37 kg·MPa-1·m-1·s-1之间,平均为1.32 kg·MPa-1·m-1·s-1;叶比导水率(LSC)界于2.50×10-4~2.68×10-4kg·MPa-1·m-1·s-1之间,平均为2.57×10-4kg·MPa-1·m-1·s-1;Huber值界于1.87~1.93×10-4cm2·cm-2之间,平均为1.90×10-4cm2·cm-2。不同处理之间的Ks、LSC和Huber值均无显著差异,表明养分和水分添加对油松幼苗茎水分传输效率和对叶供水能力影响不大。
2.3养分和水分添加对油松茎水分传输安全性的影响
在油松茎木质部水势为-2.4 MPa之前,不同处理间导水率损失百分数(PLC)差异不大,但当木质部水势低于-2.4 MPa时,PLC增加很快,当水势达到-3.5 MPa时,各处理的PLC均已接近100%(图2)。用Weibull函数对脆弱性曲线进行模拟,模拟结果见表2。其中不同处理的b值(导水率损失63.2%时所对应的木质部水势的绝对值)界于2.74~2.98之间,CK和F处理的b值差异不大,但FI处理的b值显著小于其它2个处理;不同处理的c值(木质部水势为-b时曲线的斜率)界于15.44~17.44之间,但处理之间差异不显著。
利用模拟的Weibull曲线求得了每条茎在导水率损失12%、50%和88%时对应的茎木质部水势P12、P50和P88,其中P12代表了空穴化开始启动时的木质部水势,P50为发生灾难性水力失败时对应的木质部水势,P88为完全水力失败时对应的木质部水势[27]。3个处理的P12界于-2.43~-2.58 MPa之间,不同处理之间差异不大(图3);3个处理的P50界于-2.68~-2.91 MPa之间,CK和F处理的P50差异不显著,但两者均低于FI处理约0.2 MPa左右,且差异达到显著水平(图3);3个处理的P88界于-2.86~-3.14 MPa之间,FI处理的P88也比CK和F处理分别高0.22和0.28 MPa,差异均达到显著水平(图3)。3个处理(CK、F和FI)P12-P50分别为0.30、0.33和0.26 MPa,P50-P88分别为0.22、0.24和0.18 MPa,表明油松幼苗从空穴化开始启动到发生大量栓塞,从发生大量栓塞到完全栓塞的水势范围均很窄,且以FI处理的最窄。

表1 养分和水分添加后油松幼苗的生长状况
注:CK为对照,F为养分添加处理,FI为养分水分同时添加处理;不同字母表示处理间在0.05水平达到显著。下同
CK is the control, F is N and P addition treatment, FI is N and P addition plus irrigation treatment (n=9);Different letters indicated significant difference between treatments at 0.05 level; The same as below

图1 油松幼苗3个处理的比导水率、比叶导水率和Huber值(n=9)Fig. 1 The specific hydraulic conductivity, leaf specific conductivity and Huber value for three treatments of Chinese pine seedlings(n=9)

图2 不同处理的典型脆弱性曲线Fig. 2 The typical vulnerability curves for different treatments

处理Treatmentb/MPacCK2.93±0.06a17.25±2.29F2.98±0.08a15.44±1.71FI2.74±0.05b17.44±1.01
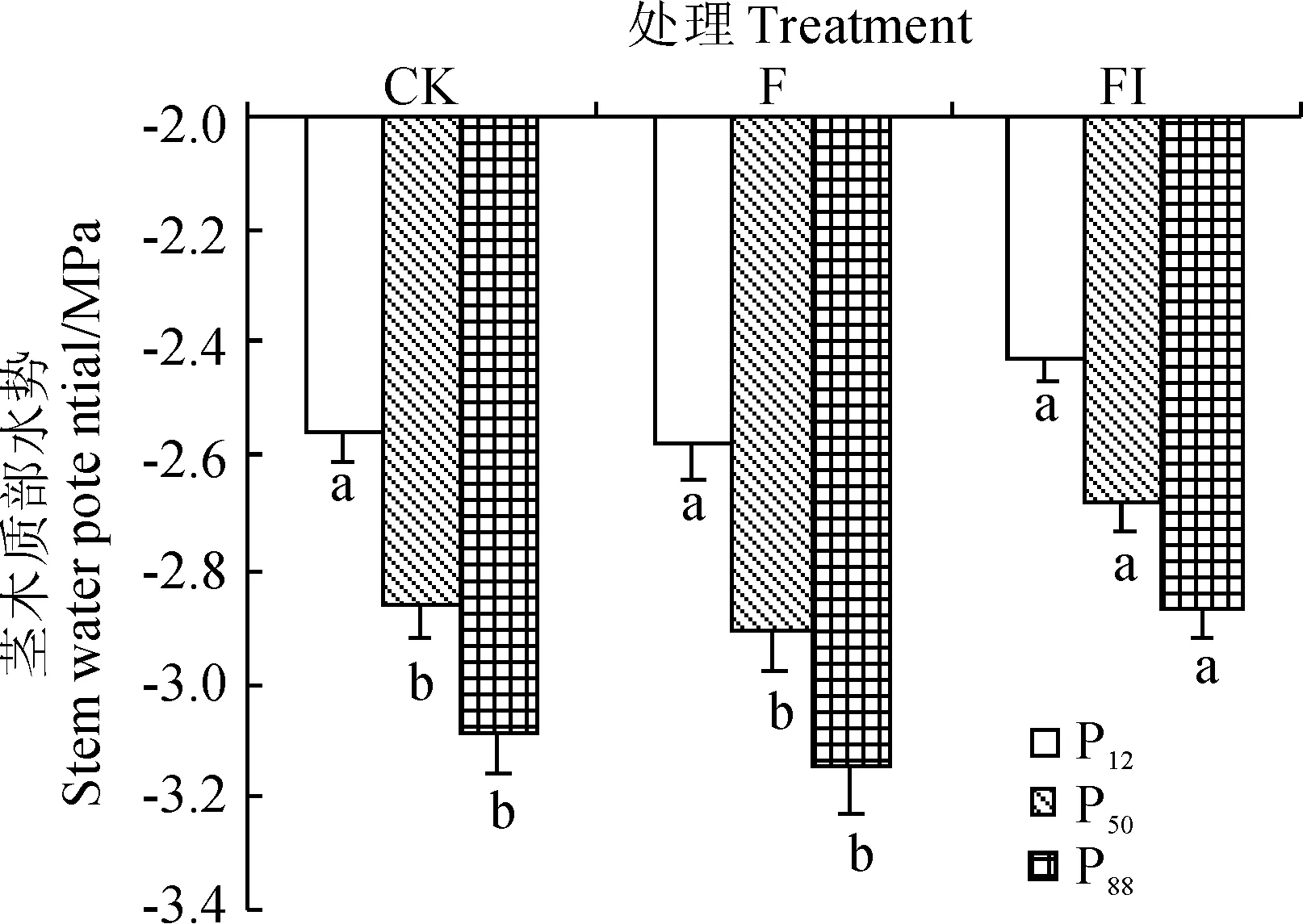
图3 根据模拟Weibull函数计算的P12、P50和P88Fig. 3 The calculated P12, P50 and P88 of different treatments based on modeled Weibull function
水分传输安全阈值(生长季最低水势ψmin与P50或P88之差值)表征了水分传输的安全性,其中ψmin-P50量化了植物水力策略的保守性,其值越小,植物就可能经历大量栓塞,从而遭受潜在的水力失败威胁[28],而ψmin-P88表征了树木距极端干旱死亡时的安全性[29]。CK、F和FI处理中午时的最低水势分别为-1.55、-1.64和-1.48 MPa,以ψmin-P50计算的水分传输安全阈值分别为1.31、1.27和1.2 MPa,以ψmin-P88计算的水分传输安全阈值分别为1.53、1.50和1.38 MPa,FI处理的水分传输安全阈值要小于CK和F约0.1 MPa,表明其水分传输的安全性相对降低。
2.4养分和水分添加对油松茎木质部解剖结构的影响
表3显示,处理F与CK相比,各解剖结构参数和木材密度无显著差异;处理FI的管胞直径和管胞面积占横截面积的比例表现出大于其它2个处理的趋势,其管胞密度和木材密度表现出小于其它2个处理的趋势,但这种差异并不达到显著。同时,FI处理的管胞长度显著大于CK和F处理,其管胞壁厚与跨距之比的平方也表现出同样的趋势,表明FI处理P50增加主要与管胞长度增加和管胞壁抗爆破阻力降低有关。
3讨论
3.1油松幼苗的水力特征
本研究中,油松幼苗3个处理的最低叶水势为-1.48~-1.64 MPa,Martínez-Vilalta等[30]研究的11种成龄松科植物最低叶水势为-1.5~-2.6 MPa,说明油松幼苗的最低叶水势高于其它成龄松科植物。松科植物末端枝条的Ks一般为0.15~0.50 kg·MPa-1·m-1·s-1,LSC为0.43~4.98×10-4kg·MPa-1·m-1·s-1,Huber值为2.71~9.15×10-4cm2·cm-2,P50为-2.65~-5.55 MPa[28,30-31],本研究中油松幼苗茎的Ks为1.27~1.32 kg·MPa-1·m-1·s-1,LSC为2.50~2.68×10-4kg·MPa-1·m-1·s-1,Huber值为1.87~1.93×10-4cm2·cm-2,P50为-2.68~-2.91 MPa,与前人研究相比,本研究中油松幼苗的Ks最高;LSC和P50均落在相应测定范围,但P50位于测定范围内高值端;Huber值低于其它松科植物,这些水力特性的差异可能与我们研究中用的是油松幼苗的当年生枝有关。另外发现,油松幼苗当年生枝脆弱性曲线很陡,其P50-P88值为0.17~0.24 MPa,而大多数成龄松科植物P50-P88均在1~3 MPa之间[28],表明油松幼苗木质部水势一旦跨过发生栓塞的临界值,很快就会发生大量不可逆栓塞而导致死亡。

表3 不同处理油松幼苗的茎解剖结构
松科植物气孔一般在-2~-3 MPa叶水势下完全关闭[32],而其P50为-2.65~-5.55 MPa[28,30]表明松科植物可能通过气孔调节来降低栓塞的威胁。本研究中,油松幼苗的水分传输安全阈值(ψmin-P50)为1.3 MPa左右,高于世界上70%树木的水分传输安全阈值(1 MPa)[28],反映了油松幼苗通过气孔调节维持了水分传输的相对安全性。
3.2养分和水分添加对油松幼苗茎水分传输效率及安全性的影响
尽管养分促进了油松幼苗的生长,其地径、冠幅和生物量均有显著增加,但养分对Ks、LSC和Huber值的影响不大。松科植物叶与边材面积比(Huber值的倒数)对环境变化有很高的可塑性[8],但本研究中Huber值对养分反应并不敏感。养分添加后油松对栓塞的脆弱性(P12、P50和P88)变化不大,水分传输的安全性(ψmin-P50或P88)也无显著不同,说明油松茎栓塞脆弱性对养分添加反应不敏感,养分添加引起的生长增加可能与水力性质的改变关系不大,而可能主要决定于干物质分配的改变。
本研究中,水分添加对水分传输效率(Ks或LSC)影响不大,但水分处理导致P50增加0.2 MPa,这与目前在大多数研究中得到的结果一致[3,5-7]。解剖结构的测定也证实了这点,水分添加后管胞直径和管胞密度均有一定程度增加,但均未达到显著水平,根据Hagen-Poiseuille公式,导水率与导管或管胞直径的四次方和导管密度成正比,因而水分传输效率差异不大。尽管水分添加后导管长度增加,但可能对导水率的影响并不大。在测定的解剖结构参数中,FI处理的管胞长度和管胞壁抗爆破阻力显著增加,表明FI处理P50的降低可能主要与这两个因素有关。管胞长度越长,纹孔所占面积越大,因而增加了纹孔膜上大孔隙所占几率,从而导致管胞更易发生空穴化[33]。植物抵抗栓塞能力和导管壁抗爆破阻力呈正相关[24],低的管胞壁抗爆破阻力导致FI处理对栓塞更敏感。
3.3水分传输效率与抗栓塞能力之间的关系
木本植物水分传输效率和抗栓塞能力之间常常存在权衡关系[34-35],即水分传输效率越高,植物抗栓塞能力愈弱。本研究发现3个处理的水分传输效率并无显著差异,但P50存在差异,表明水分传输效率和安全性之间并未呈现出权衡关系。理论上,水分传输效率主要受导管直径、长度和密度的影响,而抗栓塞能力主要与导管上纹孔面积有关,导管长度越长,纹孔和端壁阻力越小,导水率越大,但相应纹孔所占面积增加,栓塞脆弱性亦会增加[33],本研究中管胞长度增加对P50的影响可能要大于对导水率影响。此外,FI处理管胞壁抗爆破阻力的降低导致P50增加,但可能并未引起其导水率的改变,从而导致FI处理P50降低但导水率和其它处理之间并无显著差异,使不同处理水分传输效率与抗栓塞能力之间缺乏权衡关系。
参考文献:
[1]ZIMMERMANN M H. Xylem Structure and the Ascent of Sap[M]. Berlin: Springer, 1983.
[2]SPERRY J S, HACKE U G, PITTERMANN J. Size and function in conifer tracheids and angiosperm vessels[J].AmericanJournalofBotany, 2006, 93(10): 1 490-1 500.
[3]MAHERALI H, POCKMAN W T, JACKSON R B. Adaptive variation in the vulnerability of woody plants to xylem cavitation[J].Ecology, 2004, 85(8): 2 184-2 199.
[4]CREESE C, BENSCOT A M, MAHERALI H. Xylem function and climate adaptation inPinus[J].AmercianJournalofBotany, 2011, 98(9):1 437-1 445.
[5]POCKMAN W T, SPERRY J S. Vulnerability to cavitation and the distribution of Sonoran desert vegetation[J].AmericanJournalofBotany, 2000, 87(9):1 287-1 299.
[6]AWAD H, BARIGAH T, BADEL E,etal. Poplar vulnerability to xylem cavitation acclimates to drier soil conditions[J].PhysiologiaPlantarum, 2010, 139(3): 280-288.
[8]DELUCIA E H, MAHERALI H, CAREY E V. Climate-driven changes in biomass allocation in pines[J].GlobalChangeBiology, 2000, 6(5): 587-593.
[10]STOUT D L, SALA A. Xylem vulnerability to cavitation inPseudotsugamenziesiiandPinusponderosafrom contrasting habitats[J].TreePhysiology, 2003, 23(1): 43-50.
[11]HARVEY H P, VAN DEN DRIESSCHE R. Nutrition, xylem cavitation and drought resistance in hybrid poplar[J].TreePhysiology, 1997, 17(10):647-654.
[12]HARVEY H P, VAN DEN DRIESSCHE R. Nitrogen and potassium effects on xylem cavitation and water use efficiency on poplar[J].TreePhysiology, 1999, 19(14): 943-950.
[13]HACKE U G, PLAVCOVL, ALMEIDA-RODRIGUEZ A,etal. Influence of nitrogen fertilization on xylem traits and aquaporin expression in stems of hybrid poplar[J].TreePhysiology, 2010, 30:1 016-1 025.
[15]BUCCI S J, SCHOLZ F G,etal. Nutrient availability constrains the hydraulic architecture and water relations of savannah trees[J].PlantCellandEnvironment, 2006, 29(12):2 153-2 167.
[16]黄菊莹, 蔡靖, 等. 不同水分条件下两个树种木质部栓塞对P素添加的响应[J]. 植物生态学报, 2008, 32(1):183-188.
HUANG J Y, CAI J,etal. Response of xylem embolism to phosphorus addition under different water regimes in two tree species[J].JournalofPlantEcology, 2008, 32(1):183-188.
[17]VILLAGRA M, CAMPANELLO P I,etal. Removal of nutrient limitations in forest gaps enhances growth rate and resistance to cavitation in subtropical canopy tree species differing in shade tolerance[J].TreePhysiology, 2013, 33(3):285-296.
[18]EWERS B E, OREN R, SPERRY J S. Influence of nutrient versus water supply on hydraulic architecture and water balance inPinustaeda[J].PlantCellandEnvironment, 2000, 23(10):1 055-1 066.
[19]COCHARD H, DAMOUR G,etal. Evaluation of a new centrifuge technique for rapid generation of xylem vulnerability curves[J].PhysiologiaPlantarum, 2005, 124(4):410-418.
[20]WANG Y J, BURLETT R, FENG F,etal. Improved precision of hydraulic conductance measurements using a Cochard rotor in two different centrifuges[J].JournalofPlantHydraulics,2014, 1:e-0007.
[21]LI Y Y, SPERRY J S, TANEDA H,etal. Evaluation of centrifugal methods for measuring xylem cavitation in conifers, diffuse- and ring-porous angiosperms[J].NewPhytologist, 2008, 177(2): 558-568.
[22]CORCUERA L, COCHARD H, GIL-PELEGRIN E,etal. Phenotypic plasticity in mesic populations ofPinuspinasterimproves resistance to xylem embolism (P50) under severe drought[J].Trees, 2011, 25:1 033-1 042.
[23]SPERRY J S, NICHOLS K L, SULLIVAN J E M,etal. Xylem embolism in ring-porous, diffuse-porous, and coniferous trees of northern Utah and interior Alaska[J].Ecology, 1994, 75(6): 1 736-1 752.
[24]HACKE U G, SPERRY J S,etal. Trends in wood density and structure are linked to prevention of xylem implosion by negative pressure[J].Oecologia, 2001, 126(4):457-461.
[25]MAUSETH J D, FUJII T. Resin-casting: a method for investigating apoplastic spaces[J].AmericanJournalofBotany, 1994, 81(1):104-110.
[26]HACKE U G, SPERRY J S, WHEELER J K,etal. Scaling of angiosperm xylem structure with safety and efficiency[J].TreePhysiology, 2006, 26(6):689-701.
[27]FICHOT R, BRIGNOLAS F,etal. Vulnerability to drought-induced cavitation in poplars: synthesis and future opportunities[J].PlantCellandEnvironment, 2015, 38(7):1 233-1 251.
[28]CHOAT B, JANSEN S, BRODRIBB T J,etal. Global convergence in the vulnerability of forests to drought[J].Nature, 2012, 491(7 426):752-755.
[29]URLI M, PORTÉ A, COCHARD H,etal. Xylem embolism threshold for catastrophic hydraulic failure in angiosperm trees[J].TreePhysiology, 2013, 33(7): 672-683.
[31]徐新武, 樊大勇, 谢宗强, 等. 不同冲洗液对毛白杨和油松枝条水力导度和抵抗空穴化能力测定值的影响[J]. 植物生态学报, 2009, 33(1):150-160.
XU X W, FAN D Y, XIE Z Q,etal. Effects of different flush solutions on values of hydraulic conductance and cavitation resistance abilities of trees ofPopulustomentosaandPinustabulaeformis[J].ChineseJournalofPlantEcology, 2009, 33(1):150-160.
[32]RICHARDSON D M, RUNDEL P W. Ecology and biogeography ofPinus: an Introduction[M]//Richardson D M. Ecology and Biogeography ofPinus. Cambridge University Press, Cambridge, UK, 1998, 3-46.
[33]WHEELER J K, SPERRY J S,etal. Inter-vessel pitting and cavitation in woody Rosaceae and other vesselled plants: a basis for a safety versus efficiency trade-off in xylem transport[J].PlantCellandEnvironment, 2005, 28(6): 800-812.
[34]TYREE M T, DAVIS S D, COCHARD H. Biophysical perspective of xylem evolution: is there a trade off of hydraulic efficiency for vulnerability to dysfunction?[J]IAWAJournal, 1994, 15: 335-360.
[35]HACKE U G, SPERRY J S, WHEELER J K,etal. Scaling of angiosperm xylem structure with safety and efficiency[J].TreePhysiology, 2006, 26(6):689-701.
(编辑:裴阿卫)
文章编号:1000-4025(2016)06-1199-07
doi:10.7606/j.issn.1000-4025.2016.06.1199
收稿日期:2016-01-11;修改稿收到日期:2016-06-12
基金项目:国家自然科学基金(41530854, 41371507)
作者简介:黄绍琳(1990-),女,在读硕士研究生,主要从事植物水分生理生态方面的研究。E-mail: 1169848066@qq.com *通信作者:李秧秧,研究员,主要从事植物生理生态研究。E-mail: yyli@ms.iswc.ac.cn
中图分类号:Q945.79
文献标志码:A
Responses of Hydraulic Transport Efficiency and Safety of Current-year Stems inPinustabulaeformisSeedlings to Nutrient Addition and Irrigation
HUANG Shaolin1, LI Yangyang2,3*
(1 College of Forestry, Northwest A&F University, Yangling, Shaanxi 712100, China; 2 Institute of Soil and Water Conservation, Northwest A&F University, Yangling, Shaanxi 712100, China; 3 State Key Laboratory of Soil Erosion and Dryland Farming on the Loess Plateau, Institute of Soil and Water Conservation, Chinese Academy of Sciences and Ministry of Water Resources, Yangling, Shaanxi 712100, China)
Abstract:The responses of hydraulic transport efficiency and safety to nutrients and water addition are the foundation for probing the mechanisms of extensive acclimation in Pinus tabulaeformis. Using the newly-developed centrifuge method and taking three treatments as control (CK, no fertilization, natural precipitation), N and P addition (F, fertilizers were applied with the application rate as 120 kg/hm2 pure N and 60 kg/hm2 pure P per year, natural precipitation), N and P addition plus irrigation (FI, fertilizers were applied with the application rate as 120 kg/hm2 pure N and 60 kg/hm2 pure P per year, 100 mm water was irrigated excluding local precipitation), we studied the responses of transport efficiency and vulnerability to embolism of current-year stems in Chinese pine seedlings to nutrients and water addition. The results indicated that: (1) N and P addition raised basal diameter, canopy size and aboveground biomass, but had no effect on specific hydraulic conductivity (Ks), leaf specific conductivity (LSC), Huber value, embolism resistance (P50) and safety margin comparing to the control. (2) Concurrent addition of N, P and water increased plant height, basal diameter, canopy size and aboveground biomass, no difference between treatments was found for Ks, LSC and Huber value, but P50of FI treatment increased by 0.2 MPa and safety margin also narrowed. These results suggest that nutrient addition had no obvious effect on transport efficiency and safety; water addition did not affect transport efficiency but increased the vulnerability to embolism. The reason was mainly related with longer tracheid length and lower implosion resistance in FI treatment.
Key words:Pinus tabulaeformis seedlings; nutrients and water addition; transport efficiency; vulnerability to embolism

