促纤维增生性小圆细胞肿瘤1例病例报道
张 乐 刘凯东 白月奎(北京市海淀医院,北京 100080)
促纤维增生性小圆细胞肿瘤1例病例报道
张 乐 刘凯东 白月奎
(北京市海淀医院,北京 100080)
促纤维增生性小圆细胞肿瘤;病例报道
1 病例资料
患者男性,24岁,因“右下腹痛20 d,加重伴发热5 d”于2013年10月10日收入院。患者入院20 d前无明显诱因出现右下腹胀痛,5 d前上述症状加重,伴发热,体温最高39 ℃,行腹部CT(图1):大网膜成饼状,腹腔内多发淋巴结,腹腔内多发种植转移灶,查体:腹部膨隆,下腹部可见多发皮疹。右下腹压痛,无反跳痛,肌紧张,腹部可触及直径15 cm包块,质硬,边界不清,不可推动。CA125 494.9 U/mL,于2013年10月15日全身麻醉下行“剖腹探查术+肿瘤细胞减灭术”,术后病理(图2):肿瘤呈多结节灶状生长遍布大网膜;结节直径0.3~17 cm,总体积24 cm×19 cm×9 cm,免疫组化染色结果calretinin(++),vimentin(+),AE1/AE3(灶状+),EMA(灶状+),desmin(-),NSE(-),WT1(-),CK5/6(-),CD99(-),myoD1(-),Ki67(25%+)。术后病理送医科院肿瘤医院会诊病理诊断:(大网膜)小细胞性恶性肿瘤,主要呈巢片状分布,部分似有上皮样分化,考虑为促纤维增生性小圆细胞肿瘤。分子病理检测结果:EWSR1(22q12)染色体易位。患者术后恢复良好,3 d排气,7 d进流食,术后伤口愈合良好。术后化疗:2013年11月7日、2013年11月28日、2013年12月20日、2014年1月13日予以环磷酰胺+表阿霉素+顺铂方案化疗,复查发现肿瘤进展,予以紫杉醇300 mg D1+VP16 250 mg D1-D5+恩度15 mg D1-D14+希罗达2000 mg BID D1-D14方案化疗1个周期,化疗后复查腹部B超腹水较前增多,2014年2月26日予以顺铂60 mg D1+恩度30 mg D3+5-FU 2000 mg D3腹腔灌注化疗,每7 d 为1个周期,共6个周期,后因化学性腹膜炎经肿瘤医院专科会诊后改为伊立替康320 mg D1+希罗达1500 mg BID D1-D10+替莫唑胺300 mg D1-D14+恩度15 mg D1-D14+沙利度胺200 mg D1-D14化疗,21 d为1个周期,共化疗4个周期,后于医科院肿瘤医院参加药物临床试验,口服CM082药物4个周期,因肿瘤进展,于2015年2月死亡。总生存期16个月。
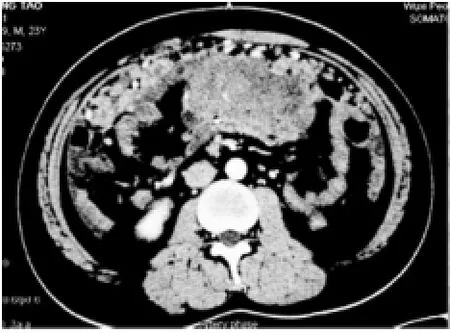
图1 术前CT
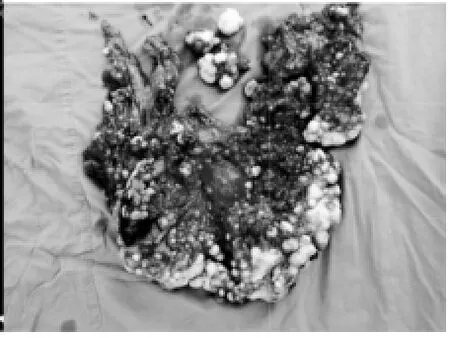
图2 术中标本
2 讨 论
促纤维增生性小圆细胞肿瘤(DSRCT)是一种少见的起源不明的软组织肿瘤,由小的圆形细胞构成,由于染色体上t(11;22)(p13;q13)转位,导致EWS-WT1混合基因的表达,男女发病比例约为4∶1[1]。
最早由Sesterhenn等发现,作为未分化的上皮细胞来源的恶性肿瘤,多见于青年男性阴囊和腹膜浆膜面。1989年Gerald和Rosai 发表了第1例明确定义DSRCT的病例报道。Gozalez-Crussi报道了3例腹腔来源的病例[2]。目前多组病例报道了DSRCT在腹腔内,腹腔外,包括卵巢、睾丸、腹膜、软组织、头颈部等多部位均可出现。
DSRCT是一种高度恶性肿瘤,免疫组化可表现为上皮、浆膜、神经等多种分化,大多数累及青年男性的腹腔内组织,临床进展快,复发率高,远处转移少见,手术、放疗、化疗等常规治疗效果不佳。它的特征性的组织学表现是小圆细胞肿瘤,周围由硬化的纤维组织包绕。
患者临床表现为腹胀,腹部肿块,腹水,排尿困难,发热,体质量减轻,偶尔表现为肝脏肿大,压迫其他组织器官时可引起肠梗阻,肾积水,肾功能不全等异常。
DSRCT是小圆细胞肿瘤的一种,小圆细胞肿瘤(神经母细胞瘤,EWING肉瘤)具有特征性的免疫组化表现,有特殊的染色体移位,将DSRCT与其他小圆细胞肿瘤相鉴别非常重要,因为DSRCT是一种高度恶性肿瘤,平均生存期<2年。组织学上来说,DSRCT有分化良好的细胞巢、细胞岛或是细胞带。由大量纤维组织包绕,细胞和纤维组织的比例可以有很大变化,可以观察到组织坏死、囊性变、出血。明显的增生性的间质血管是其特性的表现,免疫组化染色对鉴别有一定帮助,DSRCT免疫组化染色表现为WT1阳性,细胞质和核周染色,NSE和CD15常为阳性,CD99在DSRCT中为阳性,这点不同于EWINGS肉瘤和PNET。
染色体t(11;22)(p13;q13)转位,导致EWS-WT1混合基因的表达,这种基因可以通过反转录-多聚酶链反应,FISH检测,和分子序列检测等方法来检测。过表达的WT1蛋白,是肾脏和性腺转录基因的激活因子,它调节肾脏从髓质到皮质的转变。所以DSRCT中过表达的WT1蛋白,可能与肿瘤细胞中皮质和髓质标志物的表达有关。最近研究表明:这种蛋白能够激活胰岛素样生长因子1,所以,这种蛋白可能与DSRCT细胞增殖有关[3]。
影像学 CT平扫表现为多发的软组织包块。内有低密度的点状区域。在增强CT表现为不均匀的强化,反映了肿瘤的坏死。MR T1像表现为等密度或低密度病灶,T2像表现为高密度信号。PET-CT有助于准确的分级,并证实其他影像学检查可疑的病灶。DSRCT的影像学表现与其他腹腔原发肿瘤相似。需要与穿刺活检病理相结合以进一步确诊。
多种分级方法可应用于DSRCT的分级,通常根据肿瘤的大小和数目分级。Per Gilly分级是根据肿瘤大小和累及腹膜的程度分级。文献中提到的还有PCI分级[4]。通常用于评估腹膜肿瘤扩散后的严重程度。PCI的分级标准包括解剖位置,数目和病变大小。但PCI的准确性有待进一步评估。见表1。

标1 DSRCT的per Gilly分级
由于文献报道有限,目前并没有充分的循证医学证据。手术、放疗、化疗都是可采用的选择。①手术:R0切除几乎不可能,大多数患者手术方式为减瘤术。外科手术对于是否提高生存期仍是未知数,曾有文献报道R0切除后显著改善生存期。但对肝转移的患者,根治肿瘤是不可能的,文献报道:外科减瘤术后中位生存期34个月,而单纯活检术后中位生存期仅14个月。Lal等的荟萃研究入组66例患者,其中腹盆腔来源63例,27例合并远处转移,29例行减瘤术,外科手术后3年生存期为58%,而未手术组3年生存率为0[5]。虽然手术效果不错,但手术和化疗后复发仍非常普遍,术后仍需辅助治疗甚至二次手术,当肿瘤占位效应明显时,减瘤术能明显改善症状。②化疗:DSRCT对化疗不敏感。在DSRCT曾尝试过许多高强度的联合化疗方案。但都没有取得理想的效果,Biswas等报道化疗的有效率为39%[6]。许多其他中心采用P6方案化疗,包括6种化疗药物。1、2、3、6周期采用环磷酰胺2100 mg/(m2·d),阿霉素24 mg/(m2·d),长春新碱0.67 mg/(m2·d),4、5、7周期采用异环磷酰胺1800 mg/(m2·d),依托泊苷100 mg/(m2·d),Kushner等对12例手术后患者采用P6方案化疗,所有12例患者都有效,但并没有病理学完全缓解的病例。所以减瘤术是综合治疗的重要组成部分,他们认为长期的无病生存期得益于减瘤术和P6化疗。③腹腔灌注:对于控制腹膜转移,外科减瘤术和腹腔灌注化疗也是静脉化疗之外的一种选择,Simon对3例患者进行手术联合腹腔灌注化疗,其中2例在术后4~5个月死亡[7],Hayes-Jordan等报道,2例患者在多个周期全身化疗后进行手术和腹腔灌注化疗,达到了R0切除,获得了长期生存[8]。但随访时间较短,尚需要进一步研究。④放疗:放疗并没有像手术和化疗一样广泛的应用。Goodman等报道了减瘤术,化疗结合腹盆腔放疗的21例病例,剂量为30 Gy。平均随访28个月,3年生存率48%,无复发生存率19%,平均复发时间为19个月,绝大多数复发部位为腹腔和肝脏,其中81%的患者有上消化道毒性反应,71%的患者有下消化道毒性反应,所有患者均出现骨髓抑制,发生4级血小板减少,白细胞减少,红细胞减少的概率分别为76%、29%、33%[9]。
Lal等报道联合3种治疗方法,3年生存率为55%,而以上3种方法单独采用时,生存率仅27%,有10例(34.5%)患者平均随访2.4年后未见复发转移[10]。
总之,DSRCT是一种极为罕见的肿瘤,病死率高,预后差,诊断较困难,治疗上可采用手术、化疗、放疗、腹腔灌注等联合治疗,可取得一定效果,该疾病的诊治还有待进一步临床研究。
[1]Gerald WL,Rosai J.Case 2.Desmoplastic small cell tumor with divergent differentiation[J].Pediatr Pathol,1989,9(2):177-183.
[2]Gerald WL,Miller HK,Battifora H,et al.Intra-abdominal desmoplastic small round-cell tumor.Report of 19 cases of a distinctive type of high-grade polyphenotypic malignancy affecting young individuals[J].Am J Surg Pathol,1991,15(6):499-513.
[3]Zhu ZX,Wang J.Softtissue tumor pathology[M].beijing:People's Medical Publishing House;2008.
[4]Amato RJ,Ellerhorst JA,Ayasa AG.Intraabdominal desmoplastic small cell tumor.Report and discussion of five cases[J].Cancer,19 96,78(4):845-851.
[5]Hassan I,Shyyan R,Donohue JH,et al.Intraabdominal desmoplastic small round cell tumors:a diagnostic and therapeutic challenge[J].Cancer,2005,104(6):1264-1270.
[6]Barnoud R,Sabourin JC,Pasquier D,et al.Immunohistochemical expression of WT1 by desmoplastic small round cell tumor[J]. Am J Surg Pathol,2000,24(6):830-836.
[7]Gerald WL,Ladanyi M,de Alava E,et al.Clinical,pathologic,and molecular spectrum of tumors associated with t(11;22)(p13;q12)[J].J Clin Oncol,1998,16(9):3028-3036.
[8]Yang JL,Xu WP,Wang J,et al.Desmoplastic small round cell tumor:a clinicopathologic study of 15 cases[J].Zhonghua Bing Li Xue Za Zhi,2005,34(10):650-655.
[9]Cummings OW,Ulbright TM,Young RH,et al.Desmoplastic small round cell tumors of the paratesticular region.A report of six cases[J].Am J Surg Pathol,1997,21(2):219-225.
[10]Bismar TA,Basturk O,Gerald WL,et al.Desmoplastic small cell tumor in the pancreas[J].Am J Surg Pathol,2004,28(6):808-812.
R730.43
B
1671-8194(2016)18-0207-02

