肝门阻断在结肠转移性肝癌手术中的应用价值
魏攀登 王秉钧 王先坤 晏 波 李培武(兰州大学第二医院,甘肃 兰州 730030)
肝门阻断在结肠转移性肝癌手术中的应用价值
魏攀登 王秉钧 王先坤 晏 波 李培武*
(兰州大学第二医院,甘肃 兰州 730030)
目的 系统评价肝门阻断(HPC)在结肠癌肝转移肝切除术中的应用价值,以期为外科医师提供参考。方法 计算机系统检索外文数据库(Cochrane library、PubMed、EMBASE)和国内数据库(CBM、CNKI、VIP和万方),收集相关的临床试验进行质量评价后,采用RevMan 5.3进行Meta分析。结果 共纳入5项研究,计2234例患者。结果显示两组患者在5年生存率和5年未进展率方面无差异;而在随访复发率方面,HPC显著降低了术后的复发率。结论 对于结肠癌肝转移的患者,在施行肝切除术时采用肝门部阻断对于5年内的生存率和未进展率无影响,同时可在一定程度降低患者术后的复发率,但此结论仍需进一步的论证和支持。
肝门阻断;肝转移;肝切除术
影响结直肠癌肝转移(CLM)患者治愈概率在很大程度上取决于病变的可切除性。事实上,在常规化疗的基础上,未接受手术切除患者的生存中位时间一般为5~20个月,2年生存很低,而5年存活率甚至为0。在过去的20年里,肝胆外科的技术得到了显著提高,这使得扩大肝切除(ELR)的适应范畴得到延伸。同时联合有效的化疗方案,当前更多的CLM患者可能受益于ELR,其5年生存亦可高达50%或以上[1]。肝门阻断作为(HPC)作为ELR术后防止出血的主要措施,其实用性和有效性已经得到充分的证明[2]。然而,目前HPC同时会导致肝缺血/再灌注(IR),而有动物模型显示HPC导致肝脏微转移的风险为未阻断肝门的5~6倍[3]。随后一系列的临床研究被开展来解决此具有争议的问题,但各项研究结果并不一致[4-8]。因此,我们系统评价了目前发表的所有相关的研究,以期为临床外科医师提供一定的参考。
1 资料与方法
1.1 纳入/排除标准
1.1.1 纳入标准:①研究类型:国内外公开发表的临床试验,语种为为中文或英文。②研究对象:由CT等影像资料证明结直肠癌患者发生肝转移,并同意接受肝肿瘤切除手术者。③干预措施:对照组仅采取肿瘤边缘缝扎切除;试验组在对照的基础上采用术中肝门阻断(HPC),时间为15 min以内。④疗效指标:5年生存率、5年未进展率、随访复发率。
1.1.2 排除标准:①摘要等数据不全文献。②组间患者基本资料有差异者。③非临床试验、个案及综述等。④其他如患者病情特殊者。
1.2 文献检索:全面检索外文数据库(包括Cochrane Library、 PubMed、EMBASE)和国内数据库(中国生物医学文献数据库CBM、中国期刊全文数据库CNKI、中文科技期刊数据库VIP和万方数据库),检索时限2015年10月。使用检索词:“hepatic pedicle clamping、liver Resection、hepatectomy、colorectal metastases、肝门阻断、结肠癌、肝转移、肝手术、肝切除术”。
1.3 资料提取:严格按照纳入/排除标准,首先通过阅读题目和摘要对文献进行初步评价。去重处理和排除不符合的文献,并进行全文评价后,最终确定纳入的文献。使用事先设计好的表格,从原始文献中提取文献的作者姓氏、发表时间、分组,和组内患者的例数、肝转移数、手术情况及结局评价指标数据。
1.4 质量评价:采用Cochrane Handbook 5.1.0从6方面进行随机对照研究的质量评价[8],包括随机方法、分配隐藏、盲法、结果数据的完整、选择性报道结果、其他偏倚。对于非随机对照研究,采用NOS评分[9],从研究类型,组间基线平衡和失访情况进行评价。
1.5 统计学方法:采用Review Manager 5.3进行Meta分析。研究间的异质性采用χ2检验,异质性的大小采用I2及P值表示,若I2<50%或P>0.1,则组间无明显的统计学异质性。可信区间估计采用95%可信区间(95%CI)。
2 结 果
2.1 纳入研究一般情况和质量评价:初检索文献182篇,阅读题目和摘要后排除169篇,全文阅读后排除重复、干预措施不符合和研究人群特殊者8篇,最终纳入5项临床研究[5-13],包括2234例患者,其中HPC 组1617例,对照组617例,纳入研究情况及质量评价结果详见表1。
2.2 5年生存率:5项研究均报道了5年生存率[4-8],研究间存在统计学异质性(P=0.03,I2=63%),采用随机效应后,Meta分析结果显示,HPC组和对照组相比5年生存率无统计学差异[RR=0.88,95%CI (0.72,1.08),P=0.21],见图1。
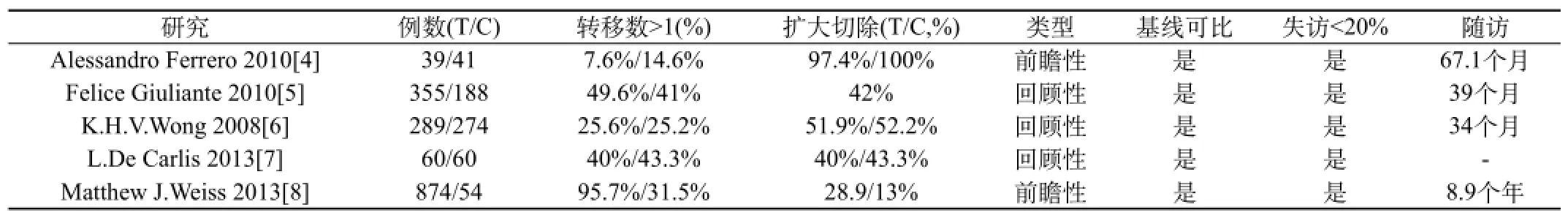
表1 纳入研究一般情况和质量评价结果

图1 两组患者5年生存率的Meta分析结果
2.3 5年无进展率:5项研究均报道了5年无进展率[4-8],研究间存在统计学异质性(P=0.0002,I2=82%),采用随机效应后,Meta分析结果显示,HPC组和对照组相比在5年无进展率方面无显著性差异[RR=1.06,95%CI(0.73,1.53),P=0.77],见图2。

图2 两组患者5年无进展率的Meta分析结果
2.4 随访复发率:5项研究均报道了随访的复发率[4-8],研究间无统计学异质性(P=0.62,I2=0%),采用固定效应后,Meta分析结果显示,HPC组相对于对照组显著降低了随访时的复发率[RR=0.85,95%CI (0.74,0.99),P=0.03],见图3。

图3 两组患者随访复发率的Meta分析结果
3 讨 论
出血是肝脏手术最重要的术中并发症之一,同时术中出血量也是围手术期高并发症和病死率的一个独立危险因素[11]。此外,术中及术后的输血亦会增加长期的肿瘤复发风险。除外在预留切除线处的缝扎止血,外科医师在临床实践中往往会在其基础上选择性使用HPC以保护患者连续的肝脏实质的横断面出血。虽然,当前研究已经证明HPC是安全的,它不增加慢性肝脏疾病患者术后总的并发症和肝功能衰竭的发生率。然而,2005年van der Bilt JD等[3]研究发现当HPC应用于CLM患者ELR时可能会显著增加肿瘤的微转移,并指出严重的肝脏缺血/再灌注损伤是HPC加速肝脏微转移的主要原因。
本研究通过系统检索相关的研究,共纳入5项研究,计2234例患者。Meta结果显示,在ELR术中采用HPC相对于对照组对随访时的5年生存率和进展率没有显著影响。此外,结果显示HPC可在一定程度降低随访时的复发率。证明目前HPC应用于临床时,未增加肿瘤进展、转移和复发的风险,亦对生存率无明显影响。
然而,本研究仍存在一定的局限性。①在方法学方面,纳入研究中仅2项为前瞻性研究。②在具体临床操作中,外科医师往往会根据切除肿瘤的大小、患者的血液指标等综合判断是否使用HPC,同时HPC亦可分为2种:多次间歇性阻断(每次5 min,间隔3次)和一次性持续阻断(一次性阻断15 min以内)[6]。而有动物试验显示,间歇性的阻断未导致结肠肝转移癌症细胞的加速增长。尽管总缺血性时间在间断性阻断和持续性阻断中并无差异,事实上间断性阻断似乎对肝转移存在一定的保护作用,因为它只可能导致早期的肝细胞损害,而几乎不存在晚期肝实质细胞的凋亡和坏死[3,6]。③此外,当前临床研究均尚未涉及循环肿瘤细胞的检测,包括其在血液、骨髓中计数,以及术前和术后血管内皮生长因子或其他肿瘤生长因子的水平。在未来的研究中应该予以评估,协助判断个体特异性分子指标对于结果的影响程度。④同时各项研究未明确区分肿瘤的病理特征,显而易见,肿瘤细胞的分化程度与患者预后密切相关。⑤在过去的10年里,新的化疗药物、单克隆抗体研究取得了重要的进展,对CLM患者的术后治疗可能存在差异[5]。而在目前的研究中,术后进一步治疗的差异亦会对研究结果产生一定影响。
基于当前证据,HPC应用于CLM患者ELR术中时未对5年生存和进展情况产生消极影响,同时在一定程度上降低了术后复发率。然而,限于当前临床研究的局限性,临床中应用HPC时仍需综合考虑,还需大样本随机对照试验的进一步验证。
[1]Adam R,Delvart V.Rescue surgery for unresectable colorectal liver metastases downstaged by chemotherapy[J].Ann Surg,2004,240(4):644.
[2]Nuzzo G,Giuliante F.Liver resections with or without pedicle clamping[J].Am J Surg,2001,181(3):238-246.
[3]van der Bilt JDW,Kranenburg O.Ischemia/reperfusion accelerates the outgrowth of hepatic micrometastases in a highly standardized[J].Hepatology,2005,42(1):165-175.
[4]De Carlis L,Di Sandro S.Colorectal liver metastases: Hepatic pedicle clamping during hepatectomy reduces the incidence[J]. Eur J Surg Oncol,2013,39(7):726-733.
[5]Giuliante F,Ardito F.Does hepatic pedicle clamping affect disease-free survival following liver resection[J].Ann Surg,2010,252(6):1020-1026.
[6]Wong KHV,Hamady ZZR.Intermittent Pringle manoeuvre is not associated with adverse long-term prognosis after resection[J]. Brit J Surg,2008,95(8):985-989.
[7]Weiss MJ,Ito H.Hepatic pedicle clamping during hepatic resection for colorectal liver metastases[J].Ann Surg Oncol,2013,20(1):285-294.
[8]Ferrero A,Russolillo N.Does Pringle maneuver affect survival in patients with colorectal liver metastases?[J].World J Surg,2010,34(10):2418-2425.
[9]Higgins JPT.Green S.Cochrane handbook for systematic reviews of interventions[EB/OL].http://www.cochrane/hand-book.org/2011-03-01.
[10]Wells GA,Shea B.The Newcastle-Ottawa Scale for assessing the quality of nonrandomised studies[J].2014.
[11]Zakaria S,Donohue JH.Hepatic resection for colorectal metastases[J].Ann Surg,2007,246(2):183.
R735.7
B
1671-8194(2016)18-0166-02
E-mail: wuzi360@126.com

