人参主要病原菌生防真菌的筛选及鉴定
肖春萍,杨利民,韩 梅,程 林,马锋敏,郭双双
(吉林农业大学 中药材学院,省部共建生态恢复与生态系统管理国家重点实验室培育基地,吉林 长春 130118)
人参主要病原菌生防真菌的筛选及鉴定
肖春萍,杨利民,韩梅,程林,马锋敏,郭双双
(吉林农业大学 中药材学院,省部共建生态恢复与生态系统管理国家重点实验室培育基地,吉林 长春 130118)
[摘要]【目的】 筛选对人参主要病原菌具高效、广谱抑菌作用的生防真菌,丰富人参生防菌菌种资源。【方法】 采用稀释平板法,从吉林省2处采样地的人参健株根际土壤中分离真菌;采用平板对峙培养法,通过初筛和复筛,筛选对人参链格孢菌(Alternaria panax)、立枯丝核菌(Rhizoctonia solani)、腐皮镰孢菌(Fusarium solani)、毁灭柱孢菌(Cylindrocarpon destructans)、恶疫霉菌(Phytophthora cactorum)、人参核盘菌(Sclerotinia schinseng)和灰葡萄孢菌(Botrytis cinerea)具有高效广谱抑菌活性的生防真菌;利用传统形态学和rDNA-ITS分子分析技术对分离到的生防真菌进行鉴定。【结果】 从人参健株根际土壤中共分离得到400株真菌,其中有15株生防真菌对人参7种主要病原菌具有广谱抑菌作用,特别是对立枯丝核菌有强烈的抑制作用(抑菌率均大于50%),且FSR-106的抑菌作用最强(抑菌率87.41%,下同);FSR-121对人参链格孢菌的抑菌作用最强(60.00%);FSR-74对腐皮镰孢菌的抑菌率高达67.48%;FSR-46对毁灭柱孢菌和灰葡萄孢菌的抑菌率最大(66.67%和68.97%);FSR-97对恶疫霉菌及人参核盘菌的抑制作用最强(73.33%和66.67%)。通过形态学和rDNA-ITS序列分析鉴定发现,15株生防真菌中有8株木霉属(Trichoderma)、3株青霉属(Penicillium)、1株曲霉属(Aspergillus)、1株附球菌属(Epicoccum)、1株毛壳菌属(Chaetomium)和1株轮层炭壳属(Daldinia),其中FSR-38为黑附球菌(Epicoccum nigrum),FSR-10、FSR-43和FSR-106为深绿木霉(T.atroviride),FSR-46为长枝木霉(T.longibrachiatum),FSR-55为钩状木霉(T.hamatum),FSR-72为桔绿木霉(T.citrinoviride),FSR-74为球毛壳菌(Chaetomium globosum),FSR-97为多孢木霉(Trichoderma polysporum),FSR-91为蔡氏轮层炭壳菌(Daldinia childiae),FSR-25、FSR-67和FSR-121为青霉属(Penicillium sp.)。【结论】 从人参健株根际土壤中可快速有效地筛选获得大量广谱性生防真菌;本研究所得的15株生防真菌对7种人参主要病害防治具有较高的潜在应用价值。
[关键词]人参病原菌;木霉属;rDNA-ITS序列分析;生防真菌
人参(PanaxginsengC.A.Mey)为五加科多 年生草本植物,是传统名贵中药材,具有重要的经济价值。吉林省东北部是我国人参的主产区,人参种植业已成为当地的支柱产业之一[1]。长期种植和品种选育难度大导致人参种质退化、土传病害严重,根部病害发生率为20%~70%[2]。人参病害有 20~40种[3],其中根腐病、锈腐病、黑斑病、灰霉病、立枯病、菌核病及疫病是人参的7种主要病害,对人参品质和产量产生了极大的影响。因此,土传病害 防控成为制约人参产业可持续发展的重大问题之一。
在人参病害防治上,化学农药防治因其高效、操作方便、适应性广、经济效益显著等特点而被长期广泛应用[4],然而,化学农药防治不当不仅会导致农药残留和环境污染,还会降低人参药材的安全性和商品价值[5-6]。国家《中药材生产质量管理规范》明确指出,提倡使用生防制剂防治植物病害,因此生防微生物防治已成为植物病虫害综合治理的重要手段[7-9]。土壤真菌是土壤微生物的主要成员,土壤中的生防真菌可通过竞争、重寄生和代谢产物抗生作用等防治植物病害[10],已报道的生防真菌包括木霉属[11]、青霉属[12]及毛壳菌属[13]真菌。国内外研究者利用生防微生物防治人参病害,得到了多株对人参病原菌有拮抗作用的有益菌[14-16],但有关生防真菌的分离鉴定研究较少[17-18],且大多数生防真菌仅作用于1种或同时作用于2~3种人参病原菌,不能满足实际生物防治的需要。鉴于此,本试验以吉林抚松地区人参健株根际土壤为研究对象,分离筛选对人参7种病害主要病原菌具有高效广谱抑菌效果的真菌菌株,并通过形态特征观察以及rDNA-ITS 序列分析对菌株进行鉴定,旨在丰富人参生防真菌菌种资源,为进一步开发广谱型人参生防菌剂和生物农药奠定理论基础。
1材料与方法
1.1材料
1.1.1研究区概况采样地Ⅰ位于吉林省抚松县榆树小西南叉(42°32′18.4″ N, 127°08′34.7″ E,海拔537 m),采样地Ⅱ位于抚松松江河4 km处(42°08′42.3″ N, 127°32′29.2″ E,海拔718 m),2样地均属于中温带湿润寒冷气候,冬季漫长、寒冷、积雪深厚;夏季短促,较热;年平均气温为4 ℃,极端最低气温-44.1 ℃,极端最高气温34.8 ℃;年平均降水量为800 mm,植被类型为针阔混交林,供试土壤均为暗棕色森林土。
1.1.2取样2012年5月、7月及9月于吉林省抚松县采样地Ⅰ采集伐林翻耕后待栽人参土壤及直播1,2和3年生健康人参植株根际土;在采样地Ⅱ采集2年生倒栽1年的人参健株根际土、3年生倒栽1年的人参健株根际土、2003年及2007年撂荒参后土壤。以“S”型取样法分别选取5个样点,去除表面枯枝落叶等杂物后采集土壤样品,按人参根际分布采样深度0~20 cm均匀采集,共采集土壤样品120份。各样地中不同样点采集的鲜土充分混合均匀低温运回实验室后过2 mm筛,于4 ℃保存,用于生防真菌的分离筛选。
1.1.3供试标靶人参病原菌菌株供试人参链格孢菌(Alternariapanax)、立枯丝核菌(Rhizoctoniasolani)、腐皮镰孢菌(Fusariumsolani)、毁灭柱孢菌(Cylindrocarpondestructans)、恶疫霉菌(Phytophthoracactorum)、人参核盘菌(Sclerotiniaschinseng)和灰葡萄孢菌(Botrytiscinerea),均由吉林农业大学农学院植物病理实验室分离鉴定,4 ℃斜面低温保藏。
1.1.4培养基PDA培养基和查氏培养基(CZA培养基),其中用PDA培养基进行土壤真菌的筛选及分离,用PDA培养基和CZA培养基进行生防真菌的形态学鉴定。
1.2方法
1.2.1人参根际土壤中真菌的分离、计数采用传统的稀释平板法[14]进行人参根际土壤真菌的分离、计数。称取10 g人参根际土壤置于90 mL装有玻璃珠的无菌生理盐水中,振荡2 min,取1 mL振荡液于9 mL灭菌生理盐水中,按梯度依次稀释至10-2,10-3,10-4g/mL。吸取100 μL振荡液涂布于PDA平板,25 ℃恒温培养7 d后,挑取菌落形态、大小及颜色等不一的单菌落于PDA培养基上计数,以涂布无菌水作为空白对照。
1.2.2人参根际土壤中真菌的纯化采用单孢分离纯化法[19]进行人参根际土壤真菌的纯化。将分离纯化获得的真菌菌块置于PDA培养基上,25 ℃继代培养3次后转接于PDA试管培养基中,4 ℃下保存备用。
1.2.3人参生防真菌的初筛采用2点杯碟平板对峙法及生长速率法,对分离获得的400株真菌进行菌体抑菌活性初筛。将1.1.3节7种人参常见病原菌作为靶标菌,分别挑取少量病原菌和真菌菌块于PDA平板上25 ℃活化4 d。在活化后的病原菌及真菌菌落边缘打取菌饼(直径=5 mm)接入同一PDA平板两侧,2菌饼相距3 cm,以只接种人参病原菌菌饼的培养皿为空白对照,每个处理3次重复,25 ℃培养7 d后观察是否产生拮抗带。
1.2.4人参生防真菌的复筛采用3点杯碟平板对峙法及生长速率法,依1.2.3节方法得到菌饼后,在PDA平板中央接入一个直径5 mm的病原菌菌饼,在距病原菌2.5 cm处的3个方位各接入同一待测生防真菌菌饼,另1个方位为空白,以仅接种人参病原菌的平板为空白对照,3次重复,25 ℃培养7 d后测量拮抗半径并计算抑菌率。
抑菌率= (对照病原菌菌落扩展半径-生防真菌对峙培养的病原菌菌落扩展半径)/对照病原菌菌落扩展半径×100%。
1.2.5人参生防真菌的鉴定(1)传统形态学鉴定。按照《真菌鉴定手册》[20]和《中国真菌志》将生防真菌鉴定到属。具体操作为:将纯化得到的人参生防真菌菌株接种到PDA或CZA培养基中,25 ℃培养观察菌落的质地、颜色、在培养基上的生长速度以及产生的色素等形态特征。同时挑取少量不同生长时期的人参生防真菌菌丝,置于洁净载玻片上,加盖玻片制得临时性玻片标本,采用基恩士超景深三维立体显微镜(VHX-600)观察产孢结构及孢子的大小和形态。
(2)rDNA-ITS序列鉴定。利用真菌rDNA ITS(Internally transcribed spacer)区段既具保守性,又在科属种水平上有特异性序列的特性,对人参生防真菌的ITS区进行PCR扩增、测序及序列分析,将生防真菌鉴定到种。具体操作为:采用TaKaRa Universal Genomic DNA Extraction Kit Ver.3.0 试剂盒(宝生物工程(大连)有限公司,TaKaRa Code:DV811A)进行人参生防真菌基因组的提取。利用真菌rDNA的ITS通用引物ITS 4和 ITS 5[21],进行rDNA-ITS-PCR扩增。PCR扩增反应体系(20 μL):2×PCR Mix 10 μL,ddH2O 7.8 μL,DNA 模板 1 μL,ITS 4 0.6 μL,ITS 5 0.6 μL。PCR扩增程序为:94 ℃变性3 min;94 ℃变性30 s,56 ℃复性30 s,72 ℃延伸30 s,30个循环;72 ℃延伸10 min。PCR扩增产物经1%琼脂糖凝胶电泳检测,并由上海生工生物工程技术服务有限公司纯化并测序,测序结果登录GenBank,利用Blast(hppt:// blast.ncbi.nlm.nih.gov/)与GenBank数据库中的序列进行比对,获得相似度较高菌株的rDNA-ITS序列作为参比菌株。
1.3数据分析
试验数据采用Excel和SPSS 19.0软件进行统计分析。采用单因素方差(Duncan’s新复极差法)分析,进行同一生防菌株对不同人参病原菌抑菌活性以及不同生防真菌对同一人参病原菌抑菌活性的差异显著性检验。
2结果与分析
2.1人参根际土壤中真菌的分离纯化
在相同的培养条件下,根据真菌的个体形态及培养特征,本研究从吉林省抚松县8株人参健株根际土壤样品中分离、纯化获得400株真菌,并依次编号为FSR-1、FSR-2、FSR-3,…,FSR-400。其中5月份分离得到真菌125株,7月份分离得到真菌140株,9月份分离得到真菌135株,这表明人参根际土壤中存在大量的微生物资源;5月、7月及9月分离获得真菌数目相当,说明不同季节人参健株根际土壤中可培养真菌数量变化不明显,各季节均适宜进行人参根际土壤样品中微生物研究。
2.2人参根际土壤中生防真菌的初筛
对分离得到的400株真菌进行抑菌活性初筛,得到50株对人参不同病原菌具抑菌活性的菌株(表1),生防菌株检出率为12.5%。以拮抗带宽度大于0.5 cm且具广谱抑菌活性为标准[19],综合分析认为,FSR-10、FSR-22、FSR-25、FSR-38、FSR-43、FSR-46、FSR-55、FSR-67、FSR-72、FSR-74、FSR-91、FSR-94、FSR-97、FSR-106和FSR-121等15株真菌对7种不同人参病原菌的抑菌活性较强,且具有一定的广谱性。
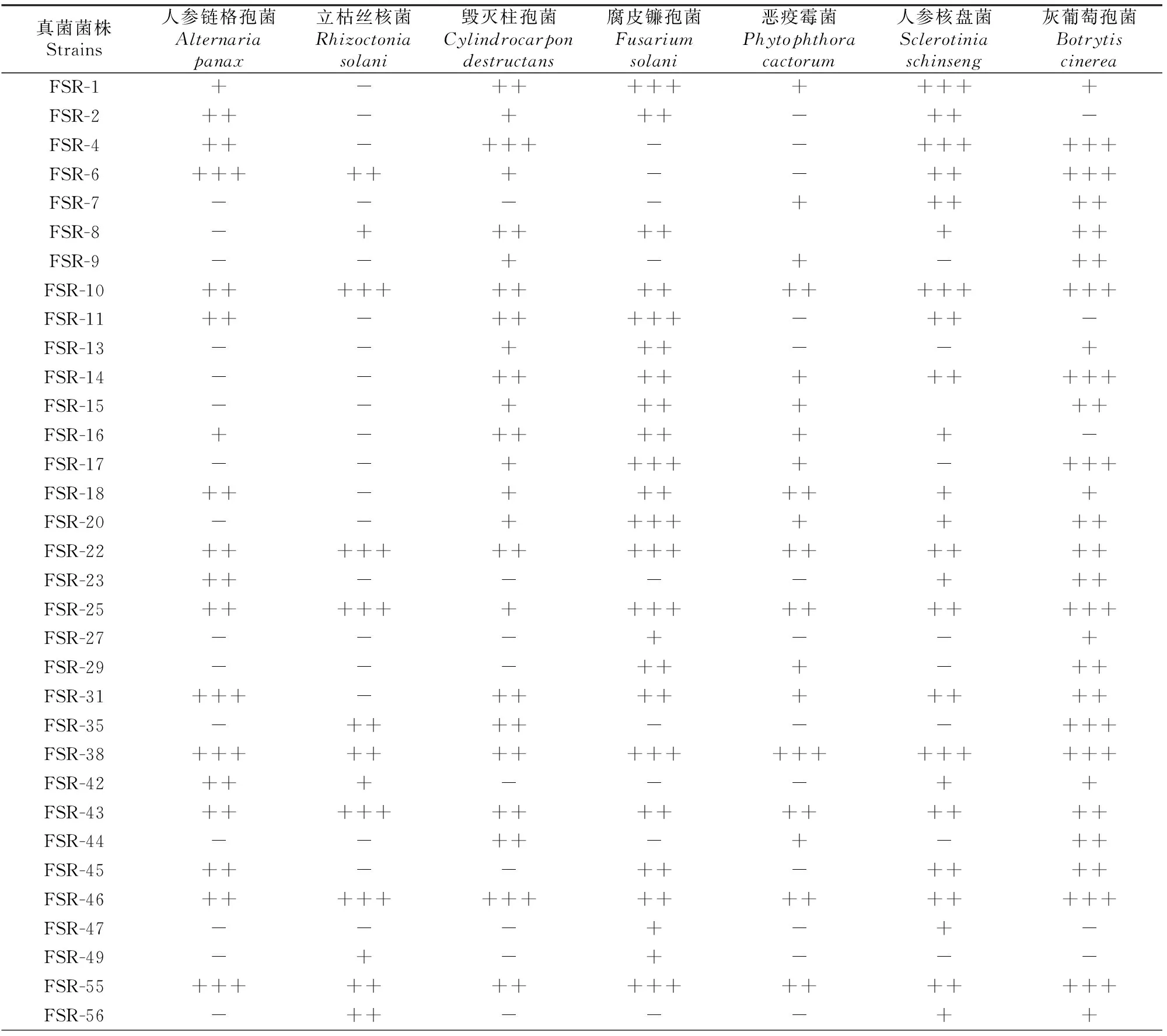
表 1 人参根际土壤中生防真菌的初筛结果Table 1 Preliminary screening of biocontrol fungi in rhizosphere soil of Panax ginseng

表 1(续) Continued table 1
注:+.拮抗带宽度<0.5 cm;++.拮抗带宽度0.5~1 cm;+++.拮抗带宽度>1 cm;-.无抑菌活性。
Note:+.Antagonism belt width less than 0.5 cm;++.Antagonism belt width 0.5-1 cm;+++.Antagonism belt width greater than 1 cm;-.No antibacterial activity.
2.3人参根际土壤中生防真菌的复筛
采用3点杯碟平板对峙法及生长速率法,对初筛出的15株具有广谱抑菌作用的生防真菌进行抑菌活性测定,结果见表2。

表 2 生防菌株对人参病原菌的抑菌作用Table 2 Antibacterial activity of biocontrol fungi against 7 pathogens of Panax ginseng %
注:同行数据后不同小写字母表示同一菌株对不同病原菌的抑菌率差异显著(P<0.05);同列数据后不同大写字母表示不同菌株对同一病原菌的抑菌率差异显著(P<0.05)。
Note:Lowercase letters indicate significant difference(P<0.05) for same fungus against different pathogens onP=0.05 in each row. Uppercase indicate significant difference(P<0.05) for different biocontrol fungi against same pathogens in each line.
由表2可知,FSR-10对立枯丝核菌、毁灭柱孢菌、恶疫霉菌、人参核盘菌和灰葡萄孢菌的抑菌作用较强(抑菌率50.00%~60.00%,下同),对人参链格孢菌的抑菌率最低,但仍可达35.42%;FSR-22对立枯丝核菌和腐皮镰孢菌的抑菌率分别高达 65.18%,63.70%;FSR-25对立枯丝核菌、腐皮镰孢菌和灰葡萄孢菌的抑菌率也高达63.33%~68.26%;FSR-38对立枯丝核菌、人参核盘菌和灰葡萄孢菌的抑菌作用较强(57.58%~65.08%),对其他4种人参病原菌的抑菌率较低(37.04%~54.17%);FSR-43对立枯丝核菌的抑菌作用最强(75.68%),对恶疫霉菌的抑菌作用最弱(29.63%);FSR-46对立枯丝核菌的抑菌作用最强(73.33%),同时对其他6种人参病原菌的抑菌率均可达50%左右;FSR-55对灰葡萄孢菌的抑菌率为63.33%,对人参链格孢菌、立枯丝核菌及腐皮镰孢菌的抑菌率也可达50%以上;FSR-67对灰葡萄孢菌的抑菌率为61.48%;FSR-72对立枯丝核菌、恶疫霉菌、人参核盘菌和灰葡萄孢菌的抑菌率均可达50%以上;FSR-74对腐皮镰孢菌抑菌作用最强(67.48%),同时对其他6种人参病原菌的抑菌率也可达46%以上;FSR-91对立枯丝核菌的抑菌率为74.81%,对毁灭柱孢菌、腐皮镰孢菌及人参核盘菌的抑菌率为57.41%~70.00%;FSR-94对立枯丝核菌、人参核盘菌和灰葡萄孢菌的抑菌率约为60%;FSR-97对恶疫霉菌的抑菌率为 73.33%,同时对其他6种人参病原菌的抑菌率也达47.62%~68.15%;FSR-106对立枯丝核菌的抑菌率为 87.41%;FSR-121对立枯丝核菌抑菌作用最强(71.43%),对毁灭柱孢菌抑菌率最小(36.84%)。
15株生防真菌中,对人参链格孢菌的抑菌率达50%以上的菌株共6株,且FSR-121的抑菌率最大(60.00%);15株生防真菌均对立枯丝核菌产生强烈抑制作用,抑菌率达50%以上,且FSR-106的抑菌作用最强(87.41%),均显著高于其他菌株(P<0.05);对毁灭柱孢菌抑菌率达50%以上的菌株共5株,且FSR-46、FSR-91和FSR-97对其抑制作用较强,但三者之间差异不显著(P>0.05);对腐皮镰孢菌的抑菌率达50%以上的菌株共8株,其中FSR-74和FSR-91的抑菌作用较强,抑菌率分别为67.48%和70.00%;对恶疫霉菌抑菌率达50%以上的菌株共6株,其中FSR-97的抑菌率最大(73.33%),均显著高于其他菌株(P<0.05);对人参核盘菌抑菌率达50%以上的菌株共12株,FSR-97的抑菌作用最强(66.67%),且与FSR-46差异显著(P<0.05);对灰葡萄孢菌抑菌率达50%以上的菌株共13株,FSR-46的抑菌作用最强(68.97%)。
综上可知,筛选出的15株真菌对人参7种常见病原菌均具有高效广谱的防治作用,特别是对人参易发病如立枯病、灰霉病、根腐病和菌核病具有较高的抑菌活性。
2.4人参根际土壤生防真菌的鉴定
2.4.1形态特征FSR-10:菌落在PDA培养基上25 ℃培养时生长快,背面无色,老时呈暗黄色(图1),有芳香气味。其菌丝分枝对生,分生孢子梗略向顶弯曲。瓶梗较长,对生或轮生方式着生于孢子梗上;分生孢子暗绿色,近球形,直径为3~3.4 μm,表面光滑(图2)。根据其形态特征并结合《真菌鉴定手册》及张广志等[22]在木霉菌检索表中的描述,将FSR-10初步鉴定为木霉属(Trichodermasp.)真菌。
FSR-22:菌落在CZA培养基上25 ℃培养7 d时直径为32 mm,质地絮状,平坦,颜色为灰褐色,菌落背面黄褐色(图1)。其分生孢子梗产生于基质,壁光滑;顶囊近球形,直径6~13 μm;分生孢子球形或近球形,直径为2.7~4.8 μm,表面粗糙,褐色(图2)。根据其形态特征并结合《真菌鉴定手册》和齐祖同[23]描述,将FSR-22鉴定为曲霉属(Aspergillussp.)真菌。
FSR-25:菌落在CZA培养基上25 ℃培养7 d时直径为60 mm,质地柔软,蓝绿色,边缘白色,菌丝呈环纹状生长(图1)。其分生孢子梗细长,有横隔,分生孢子梗1至2回分枝,大小(7~16) μm×(3~4) μm;分生孢子萌发初期产生特殊结构,分生孢子球形或椭球形,直径为3~4 μm(图2)。根据其形态特征并结合《真菌鉴定手册》和《中国真菌志》第三十五卷[24]描述,将FSR-25鉴定为青霉属(Penicilliumsp.)真菌。
FSR-38:菌落在PDA培养基上25 ℃培养时生长较慢,培养初期为粉白色,后期伴有橙黄色渗出物,分泌褐色物质,成熟后形成黑色点状结构,内含孢子,菌丝质地柔软,菌丝呈轮纹状生长,孢子沿菌丝生长(图1)。其分生孢子梗暗色,短而粗,有横隔;分生孢子球形或半球形,暗色,有横隔,单生于分生孢子梗上,直径为19~25 μm(图2)。根据孢子梗及孢子的结构特点,并结合菌落形态特征,将FSR-38鉴定为附球菌属(Epicoccumsp.)真菌。
FSR-43:菌落在PDA培养基上25 ℃培养时生长快,背面无色,老时呈暗黄色(图1),有芳香气味。其菌丝分枝对生,分生孢子梗略向顶弯曲,瓶梗较长,对生或轮生方式着生于孢子梗上;分生孢子暗绿色,近球形,直径为3~3.4 μm,表面光滑(图2)。根据其形态特征并结合《真菌鉴定手册》及张广志等[22]在木霉菌检索表中的描述,将FSR-43鉴定为木霉属(Trichodermasp.)真菌。
FSR-46:菌落在PDA培养基上25 ℃培养时生长快,初期为白色、致密、圆形,向四周扩展,生长一段时间后从菌落中央产生绿色孢子,中央变成绿色,菌落有明显的轮纹,周围有白色菌丝的生长带,最后整个菌落全部变成黄绿色(图1)。其产孢菌丝主枝较长,瓶梗细葫芦形,不规则单生或轮生方式着生于孢子梗上;分生孢子灰绿色,倒卵形或椭圆形,约为 4.5 μm,表面光滑(图2)。根据其形态特征并结合《真菌鉴定手册》及张广志等[22]在木霉菌检索表中的描述,将FSR-46鉴定为木霉属(Trichodermasp.)真菌。
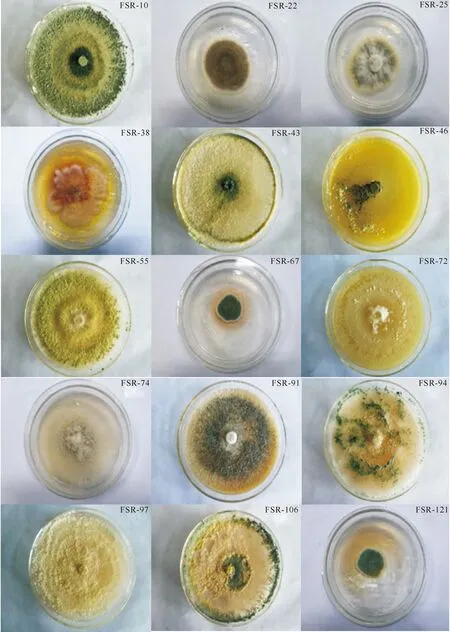
图 115株人参生防真菌的培养特征
Fig.1Cultural characteristics of 15 biocontrol fungi strains ofPanaxginseng
FSR-55:菌落在PDA培养基上25 ℃培养时生长较慢,初期菌丝为无色,向四周扩展,生长一段时间后产生绿色孢子,菌丝白色(图1)。其分生孢子梗主枝粗壮,具不规则分枝,短而粗壮,着生于主枝基部;分生孢子绿色,椭圆形,长度为2.6~4.0 μm,表面较光滑(图2)。根据其形态特征并结合《真菌鉴定手册》及张广志等[22]在木霉菌检索表中的描述,将FSR-55鉴定为木霉属(Trichodermasp.)真菌。

图 215株人参生防真菌分生孢子结构的显微特征(×500)
Fig.2Microscopic characteristics of conidia structure of 15 biocontrol fungi strains ofPanaxginseng(×500)
FSR-67:菌落在CZA培养基上25 ℃培养7 d时直径为71 mm,蓝绿色,质地柔软,菌落圆形,菌丝呈环纹状生长(图1)。其分生孢子梗细长,有横隔,1至2回分枝,着生于气生菌丝上,大小(7~16) μm×(3~4) μm;分生孢子萌发初期产生特殊结构,分生孢子球形或椭球形,直径为3~4 μm(图2)。根据其形态特征并结合《真菌鉴定手册》和《中国真菌志》第三十五卷[24]描述,将FSR-67鉴定为青霉属(Penicilliumsp.)真菌。
FSR-72:菌落在PDA培养基上25 ℃培养时生长快,新鲜菌株背面呈黄绿色。菌落在产孢区产生平展的产孢簇,绿色(图1)。其分生孢子梗不规则排列,多单生;分生孢子绿色,椭球形,直径为2.0~3.3 μm(图2)。根据其形态特征并结合《真菌鉴定手册》及张广志等[22]在木霉菌检索表中的描述,将FSR-72鉴定为木霉属(Trichodermasp.)真菌。
FSR-74:菌落在PDA培养基上25 ℃培养时生长较慢,菌落深褐或棕褐色,背面棕褐色,常具橄褐色渗出物,菌落边缘常呈不整齐的波裂状(图1)。其子囊果表生,以褐色假根固着于基质表面,在反射光下为橄绿色至橄褐色,倒卵形至近球形,直径160~240 μm,高220~300 μm,顶生毛大量而密集,曲折状、波浪状或稍呈螺旋状卷曲,褐色,具隔,基部隔膜较明显,不分枝,表面具密集疣点,基部宽2.5~4 μm;侧生毛曲折状,分隔明显;子囊棍棒状,长(27~36) μm×(11~15) μm,内有 8 个子囊孢子,子囊壁容易消解;子囊孢子柠檬形,两侧扁,两端各具一细尖,成熟时褐色,大小(8.5~11) μm×(7~8.5) μm,具单个顶生芽孔(图2)。根据其形态特征并结合《真菌鉴定手册》和白金铠[25]《中国真菌志》第十五卷描述,将FSR-74鉴定为毛壳菌属(Chaetomiumkunzesp.)真菌。
FSR-91:菌落在PDA培养基上25 ℃培养时生长较慢,背面淡黄色,培养初期菌丝白色,培养后期菌丝黑褐色(图1)。其菌丝局部特化,产生特化的厚壁菌丝(图2)。根据上述形态特征并结合《真菌鉴定手册》描述,将FSR-91鉴定为轮层炭壳属(Daldiniasp.)真菌。
FSR-94:菌落在PDA培养基上25 ℃培养时生长快,背面从无色过渡到棕黄色,伴有淡的泥土芳香气味(图1)。其分生孢子梗瓶梗近球形且略向上弯曲;分生孢子近球形,灰绿色,直径为2.6~3 μm,表面光滑(图2)。根据其形态特征并结合《真菌鉴定手册》及张广志等[22]在木霉菌检索表中的描述,将FSR-94鉴定为木霉属(Trichodermasp.)真菌。
FSR-97:菌落在PDA培养基上25 ℃培养时生长较快,菌落白色至黄白色,背面从无色过渡到黄色(图1)。其分生孢子梗常聚集成簇状,分枝密集,较粗,瓶梗短粗较拥挤;孢子簇形成紧密的簇状,白色到黄绿色;分生孢子淡绿色,壁光滑,椭圆形或近球形,直径为2.3~3.6 μm(图2)。根据其形态特征并结合《真菌鉴定手册》及张广志等[22]在木霉菌检索表中的描述,将FSR-97鉴定为木霉属(Trichodermasp.)真菌。
FSR-106:菌落在PDA培养基上25 ℃培养时生长快,背面无色,老时呈暗黄色,有芳香气味(图1)。其菌丝分枝对生,分生孢子梗略向顶弯曲,瓶梗较长,对生或轮生方式着生于孢子梗上;分生孢子暗绿色,近球形,直径为3~3.4 μm,表面光滑(图2)。根据其形态特征并结合《真菌鉴定手册》及张广志等[22]在木霉菌检索表中的描述,将FSR-106鉴定为木霉属(Trichodermasp.)真菌。
FSR-121:菌落在CZA培养基上25 ℃培养7 d时直径为64 mm,菌落圆形,黄绿色,质地柔软,菌丝呈环纹状生长(图1)。其分生孢子梗细长,有横隔,分生孢子梗1至2回分枝,长(7~16) μm×(3~4) μm;分生孢子萌发初期产生特殊结构,分生孢子球形或椭球形,直径为3~4 μm(图2)。根据其形态特征并结合《真菌鉴定手册》和《中国真菌志》第三十五卷[24]描述,将FSR-121鉴定为青霉属(Penicilliumsp.)真菌。
2.4.2分子鉴定利用真菌ITS区域的通用引物ITS 4和ITS 5,对15株人参生防真菌的核糖体ITS区进行序列测定。经过测序拼接,15株生防真菌PCR扩增产物大小为577~663 bp,菌株序列提交到NCBI “GenBank”中注册(注册号:KJ572247~KJ572261)并对相似属菌株ITS序列的同源性进行比对,结果(表3)表明,15株生防真菌的序列与相似种序列同源性为99%~100%。根据形态学特征及分子鉴定结果可知,FSR-10、FSR-43和FSR-106为深绿木霉(Trichodermaatroviride);FSR-22为焦曲霉(Aspergilluscalidoustus);FSR-25、FSR-67和FSR-121为青霉属真菌(Penicilliumsp.)。FSR-38为黑附球菌(Epicoccumnigrum);FSR-46为长枝木霉(Trichodermalongibrachiatum);FSR-55为钩状木霉(Trichodermahamatum);FSR-72为桔绿木霉(Trichodermacitrinoviride);FSR-74为球毛壳菌(Chaetomiumglobosum);FSR-91为蔡氏轮层炭壳菌(Daldiniachildiae);FSR-94为哈茨木霉(Trichodermaharzianum);FSR-97为多孢木霉(Trichodermapolysporum)。
3讨论
土传病害能在极大程度上影响人参的产量和品质,我国每年由于土传病害所造成的人参产量损失可达20%~50%,严重削弱了我国人参产品在国际市场上的竞争力[26]。因此,深入研究人参土壤中有益微生物与病原微生物的拮抗作用,对维持土壤中病原微生物和有益微生物的平衡,以及安全有效防治人参土传病害具有重要意义。本研究从人参健株根际土壤共分离获得400株真菌,采用平板对峙法筛选得到了15株对人参7种主要病原菌具有高效广谱抑菌活性的生防菌株。总体来说,FSR-46、FSR-74和FSR-97等菌株有良好的广谱抑菌活性,对人参7种病原菌的抑菌率均能达46.67%以上;个别生防菌株对腐皮镰孢菌、恶疫霉菌及立枯丝核菌的抑制率甚至可达到70%~90%。表明它们在人参土传病害防治中具有较好的应用潜力,这为生防菌剂的开发提供了依据。
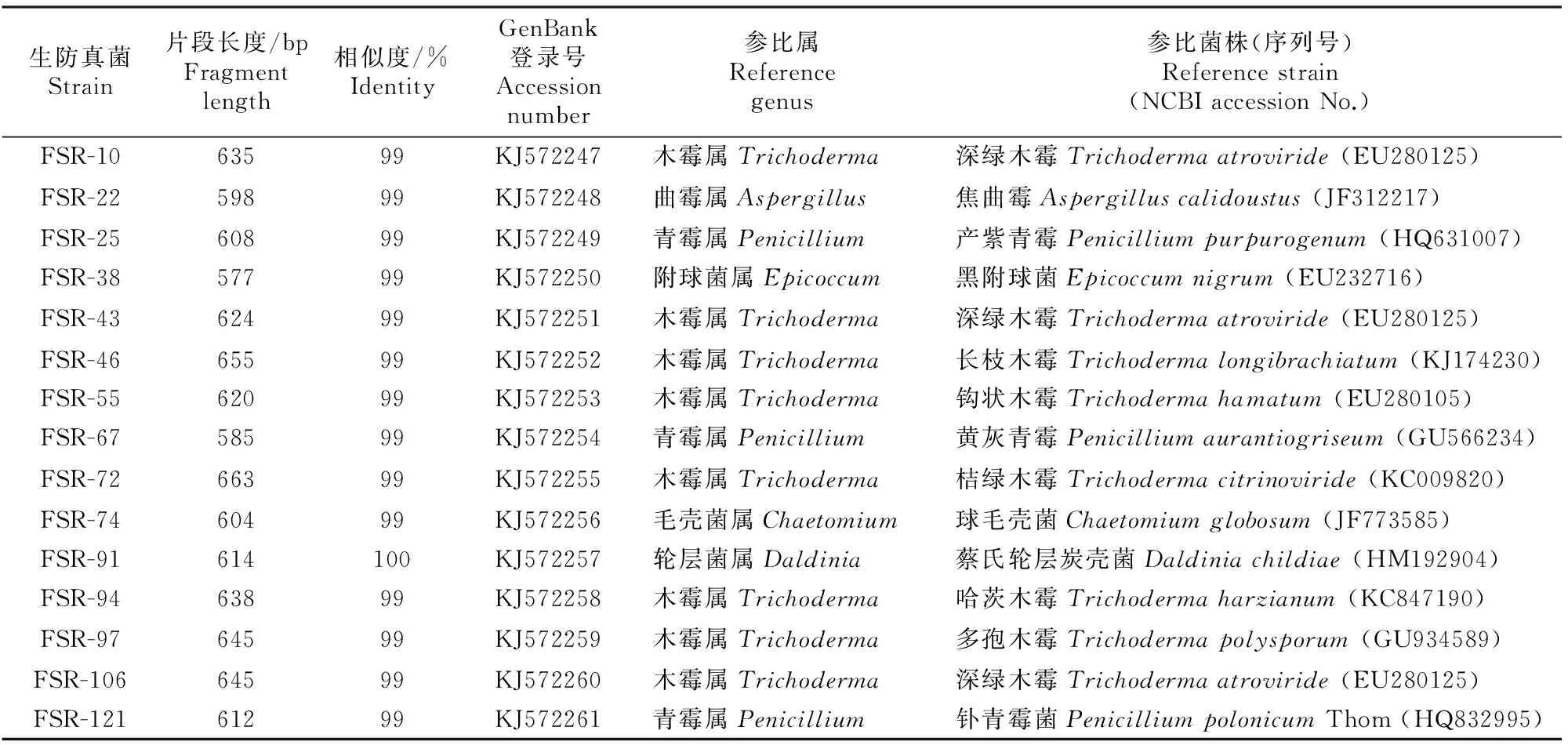
表 3 15株人参生防真菌ITS序列的同源性比较Table 3 Homology of 15 biocontrol fungi strains of Panax ginseng based on ITS sequences
目前,利用拮抗微生物防治人参土传病害已取得一定成果。任守让等[27]从人参土壤中筛选得到2株绿色木霉(T.viride),对人参锈腐病菌(毁灭柱孢菌)的生长具有强烈的抑制作用。邢云章等[28]指出绿色木霉可有效控制人参根腐病的发生。赵阿娜等[29]发现,哈茨木霉Th3080(T.atroviride)对人参疫病菌、锈腐病菌和立枯病菌均有较高的抑菌率。这些研究多是针对1~3种人参病害,且获得具有广谱抑菌活性的新菌株较少。据报道,木霉属(Trichodermasp.)真菌已被广泛应用于植物病害防治中。已有报道的除哈茨木霉和绿色木霉外,还有长枝木霉(T.longibrachiatum)[30]、康宁木霉(T.koningii)[31]和深绿木霉(T.atroviride)[32],而其他木霉属真菌对人参病害的作用尚未见报道。此外,青霉属[13]、附球菌属[33]及毛壳菌属[34]真菌也被应用于防治植物病害。本研究分离筛选获得的黑附球菌FSR-38,深绿木霉FSR-10、FSR-43和FSR-106,长枝木霉FSR-46,钩状木霉FSR-55,桔绿木霉FSR-72,多孢木霉FSR-97,球毛壳菌FSR-74,蔡氏轮层炭壳菌FSR-91及3株青霉属真菌FSR-25、FSR-67和FSR-121等13株生防真菌,在现今人参病害生防研究领域中均属未见报道菌株。这些菌株具有较大的潜在开发应用价值,极大地丰富了人参土传病害的生防菌株资源。与细菌及放线菌相比,真菌的培养方式多样,营养要求简单,培养基来源广泛,价格低廉,产孢能力强,孢子存活时间长[35],更有利于生防真菌的工业化生产及应用。
植物真菌的形态及解剖结构复杂多变,且有些真菌不易甚至不能形成有性繁殖结构[36],这给真菌的分类鉴定带来了诸多不便,甚至可能导致错误的结论。本研究表明,根据15株生防真菌的培养性状及显微特征(孢子梗和孢子的特点),仅能将其初步鉴定到属。随着分子生物学发展和真菌学自身发展的客观需求,分子生物学技术在真菌学研究中得到了广泛而深入的应用[19,37],通过核糖体DNA(rDNA)转录间隔区(Internal transcribed spacer,ITS)序列分析,对生防真菌进行属种鉴定,是对传统形态学鉴定结果的补充[21]。本研究进一步通过rDNA-ITS分子手段将FSR-10、FSR-38、FSR-43、FSR-46、FSR-55、FSR-72、FSR-74、FSR-91、FSR-94、FSR-97及FSR-106鉴定至种;FSR-22、FSR-25、FSR-67和FSR-121的形态学特征与参比菌株相近,鉴于曲霉属及青霉属真菌分类复杂,其具体归属有待进一步验证。
另外,木霉属生防真菌与人参病原菌共培养时,能在人参病原菌上生长并抑制病原菌菌落扩展;青霉属、曲霉属、附球菌属及毛壳菌属的生防真菌与人参病原菌对峙培养时,能形成明显的拮抗带,推测与不同种属生防菌的主要作用机制不同有关。因此,有关生防真菌的防病机制,抑菌活性物质的具体组成及生防菌株的田间防效仍有待于深入研究。
4结论
本研究筛选鉴定出15株对人参7种主要病原菌具一定拮抗效果的生防真菌:8株木霉菌,3株青霉属真菌,1株曲霉菌,1株黑附球菌,1株球毛壳菌和1株炭壳菌。另外,以人参健株根际土壤为试验材料,可快速有效地筛选获得大量广谱性生防真菌,可避免生防菌株筛选的盲目性,提高筛选效率。
[参考文献]
[1]杨利民,陈长宝,王秀全,等.长白山区参后地生态恢复与再利用模式及其存在的问题 [J].吉林农业大学学报,2004,26(5):546-549,553.
Yang L M,Chen C B,Wang X Q,et al.Ecological restoration and reused modes of old ginseng land in the Changbai mountainous area and its existing problems [J].Journal of Jilin Agricultural University,2004,26(5):546-549,553.
[2]吴连举,赵亚会,关一鸣,等.人参连作障碍原因及其防治途径研究进展 [J].特产研究,2008(2):68-72.
Wu L J,Zhao Y H,Guan Y M,et al.Review on studies of the reason and control methods of succession cropping obstacle ofPanaxginsengC.A.Mey [J].Special Wild Economic Animal and Plant Research,2008(2):68-72.
[3]刘亚南,赵东岳,刘敏,等.人参病虫害发生及农药施用现状调查 [J].中国农学通报,2014,30(10):294-298.
Liu Y N,Zhao D Y,Liu M,et al.Investigation of pests and diseases occurrence and pesticides application in main producing areas ofPanaxginseng[J].Chinese Agricultural Science Bulletin,2014,30(10):294-298.
[4]王悦,林红梅,侯志广,等.人参中11种农药残留振荡提取气相色谱法测定 [J].农药,2013,52(7):509-511.
Wang Y,Lin H M,Hou Z G,et al.Determination of 11 pesticide residues in radix ginseng by solid-phase extraction and gas chromatography [J].Agrochemicals,2013,52(7):509-511.
[5]章强华,董国,姚晗珺.人参常用农药国外残留限量标准的分析及对策 [J].人参研究,2009(1):2-10.
Zhang Q H,Dong G,Yao H J.Analysis and countermeasures on residue limits standards of ginseng common pesticide abroad [J].Ginseng Research,2009(1):2-10.
[6]冯家.人参常见病虫害诊断与安全用药 [M].长春:吉林出版集团,2010:15-20.
Feng J.Diagnosis of ginseng common pests and diseases and safe medication [M].Changchun:Jilin Publishing Group,2010:15-20.
[7]胡霞,苑艳辉,姚卫容,等.微生物农药发展概况 [J].农药,2005,44(2):31-32.
Hu X,Yuan Y H,Yao W R,et al.Status of microbial pesticide development [J].Agrochemicals,2005,44(2):31-32.
[8]杨峻,林荣华,袁善奎,等.我国生物源农药产业现状调研及分析 [J].中国生物防治,2014,30(4):441-445.
Yang J,Lin R H,Yuan S K,et al.Survey and analysis of current situation of biologically derived pesticides industry in China [J].Chinese Journal of Biological Control,2014,30(4):441-445 .
[9]刘振华,罗远婵,张道敬,等.农用微生物杀菌剂剂型研究进展 [J].农药学学报,2014,16(5):497-507.
Liu Z H,Luo Y C,Zhang D J,et al.Research progress and prospects of microbial pesticide formulation for plant desease control [J].Chinese Journal of Pesticide Science,2014,16(5):497-507.
[10]王芳,图力古尔.土壤真菌多样性研究进展 [J].菌物研究,2014,12(3):178-186.
Wang F,Bau Tolgor.Research advance in the diversity of soil fungi [J].Journal of Fungal Research,2014,12(3):178-186.
[11]王秉丽,李广纪,郭玉人,等.不同野生木霉菌拮抗作用的比较 [J].中国生物防治,2012,28(1):147-151.
Wang B L,Li G J,Guo Y R,et al.Comparison of antagonistic effects of fourTrichodermastrains [J].Chinese Journal of Biological Control,2012,28(1):147-151 .
[12]李芳,史怀,刘波,等.淡紫拟青霉对尖孢镰刀菌的拮抗作用与机制分析 [J].植物保护学报,2005,32(4):373-378.
Li F,Shi H,Liu B,et al.Antagonistic effect of biocontrol fungus,Paecilomyceslilacinusstrain NH-PL-3 and its mechanism againstFusariumoxysporum[J].Acta Phytophylacica Sinica,2005,32(4):373-378 .
[13]刘永亮.辣椒疫霉拮抗真菌毛壳菌和青霉菌的分离鉴定及其生防潜力的研究 [D].济南:山东农业大学,2013.
Liu Y L.Isolation and identification of fungal antagonistChaetomiumandPenicillumagainstPhytophthoracapsiciand studies on their potential of biocontrol [D].Ji'nan: Shandong Agricultural University,2013.
[14]强薇,郭帅,张爱华,等.人参根际土壤中拮抗人参病害微生物的筛选 [J].华南农业大学学报,2014,35(5):76-81.
Qiang W,Guo S,Zhang A H,et al.Screening antagonistic microorganism against ginseng diseases fromPanaxginsengrhizosphere soil [J].Journal of South China Agricultural University,2014,35(5):76-81.
[15]Ryu H,Park H,Suh D S,et al.Biological control ofColletotrichumpanacicolaonPanaxginsengbyBacillussubtilisHK-CSM-1 [J].J Ginseng Res,2014,38:215-219.
[16]Song M,Yun H Y,Kim Y H.AntagonisticBacillusspecies as a biological control of ginseng root rot caused byFusariumcf.incarnatum[J].J Ginseng Res,2014,38:136-145.
[17]赵阿娜,丁万隆.木霉菌剂对人参根部病害防治效果评价 [J].中草药,2006(10):1552-1554.
Zhao A N,Ding W L.Estimation of control effect ofTrichodermafungicides onPanaxginsengroot disease [J].Chinese Traditional and Herbal Drugs,2006(10):1552-1554.
[18]周如军,傅俊范,史会岩,等.人参锈腐病拮抗生防菌的筛选与鉴定 [J].沈阳农业大学学报,2010,41(4):422-426.
Zhou R J,Fu J F,Shi H Y,et al.Screening and identification of antagonistic strains againstCylindrocarpondestructans[J].Journal of Shenyang Agricultural University,2010,41(4):422-426.
[19]杨骁,李长田.人参内生生防真菌的筛选与鉴定 [J].东北师范大学学报(自然科学版),2013,45(4):107-113.
Yang X,Li C T.Screening and identification of endogeny biocontrol fungi ofPanaxginseng[J].Journal of Northeast Normal University(Natural Science Edition),2013,45(4):107-113.
[20]魏景超.真菌鉴定手册 [M].上海:上海科学技术出版社,1979.
Wei J C.Fungal identification manual [M].Shanghai:Shanghai Scientific Technology Press,1979.
[21]陈凤毛.真菌ITS区序列结构及其应用 [J].林业科技开发,2007,21(2):5-7.
Chen F M.The sequence of ITS region and its application of fungus [J].China Forestry Science and Technology,2007,21(2):5-7.
[22]张广志,杨合同,文成敬.木霉菌形态学分类检索与分子生物学鉴定 [J].山东农业大学学报(自然科学版),2011,42(2):309-316.
Zhang G Z,Yang H T,Wen C J.The key to the morphological classification and the molecular identification ofTrichodermaspp. [J].Journal of Shandong Agricultural University(Natural Science Edition),2011,42(2):309-316.
[23]齐祖同.中国真菌志:第五卷:曲霉属及其相关有性型 [M].北京:科学出版社,1997.
Qi Z T.Chinese fungi:the fifth volume:Aspergillusand its related sexual type [M].Beijing:Science Press,1997.
[24]孔华忠.中国真菌志:第三十五卷:青霉属及其相关有性型 [M].北京:科学出版社,2007.
Kong H Z.Chinese fungi:the thirty fifth volume:Penicilliumand its related sexual type [M].Beijing:Science Press,2007.
[25]白金铠.中国真菌志:第十五卷:球壳孢目,茎点霉属,叶点霉属 [M].北京:科学出版社,2003.
Bai J K.Chinese fungi:the fifteenth volume:Sphaeropsidales,PhornaandPhyllosticta[M].Beijing:Science Press,2003.
[26]吴连举,关一鸣,逄世峰,等.利用拮抗微生物防治人参、西洋参土传病害研究进展 [J].安徽农业科学,2010,38(28):15630-15631,15657.
Wu L J,Guan Y M,Pang S F,et al.Research progress on biological control of soil-borne diseases in ginseng and American ginssseng by anti-micoorganism [J].Journal of Anhui Agri Sci,2010,38(28):15630-15631,15657.
[27]任守让,王瑞霞.对人参锈腐病菌的拮抗真菌及其防病效果 [J].吉林农业大学学报,1998,20(S1):120.
Ren S R,Wang R X.Controlling effects of antagonistic fungi toCylindrocarpondestructansin ginseng [J].Journal of Jilin Agricultural University,1998,20(S1):120.
[28]邢云章,马凤茹.绿色木霉防治人参根腐病的研究 [J].特产科学实验,1983(4):16-18.
Xing Y Z,Ma F R.Study ofTrichodermavirideto controlFusariumsolani[J].Specialty Experiment,1983(4):16-18.
[29]赵阿娜,丁万隆,朱殿龙.拮抗人参根部病原菌木霉的筛选及其生物学特性初步研究 [J].中国中药杂志,2006,31(20):1671-1674.
Zhao A N,Ding W L,Zhu D L.Screening strains forTrichodermaspp. for strong antagonism against ginseng root pathogens and study on their biological characters [J].China Journal of Chinese Materia Medica,2006,31(20):1671-1674.
[30]张瑾,张树武,徐秉良,等.长枝木霉菌抑菌谱测定及其抑菌作用机理研究 [J].中国生态农业学报,2014,22(6):661-667.
Zhang J,Zhang S W,Xu B L,et al.Determining antifungal spectrum and mechanism ofTrichodermalongibrachiatuminvitro[J].Chinese Journal of Eco-Agriculture,2014,22(6):661-667.
[31]胡明江,张秀省,曹兴,等.康宁木霉SMF2防治大白菜软腐病研究 [J].北方园艺,2009(6):102-103.
Hu M J,Zhang X S,Cao X,et al.Studies on the control effect ofTrichodermakningiiOud.against soft rot of Chinese cabbage [J].Northern Horticulture,2009(6):102-103 .
[32]梁巧兰,王芳,魏列新,等.深绿木霉T2菌株对百合疫霉拮抗作用及机制 [J].植物保护,2011,37(6):164-167.
Liang Q L,Wang F,Wei L X,et al.Antagonistic mechanism ofTrichodermaatrovirideT2 strain againstPhytophthoranicotianae[J].Plant Protection,2011,37(6):164-167.
[33]刘晓芸.对致病疫霉具拮抗作用的真菌XF的鉴定及抑菌活性研究 [D].河北保定:河北农业大学,2007.
Liu X Y.Identification and antifungal activity of XF,an antagonistic fungus againstPhytophthorainfestans[D].Hebei Baoding:Hebei Agricultural University,2007 .
[34]王艳红,吴晓民,朱艳萍,等.温郁金内生真菌ChaetomiumglobosumL18对植物病原菌的抑菌谱及拮抗机理 [J].生态学报,2012,32(7):2040-2046.
Wang Y H,Wu X M,Zhu Y P,et al.Inhibition effects and mechanisms of the endophytic fungusChaetomiumglobosumL18 fromCurcumawenyujin[J].Acata Ecologica Sinica,2012,32(7):2040-2046.
[35]马艳,常志州,赵江涛,等.一株疫病拮抗青霉P.st10 菌株的抗菌活性及其对辣椒疫病的盆栽防效 [J].中国生物防治,2006,22(3):239-243.
Ma Y,Chang Z Z,Zhao J T,et al.Antifungal activity ofPenicilliumstriatisporumstrain P.st10 and its inhibition against pepper blight caused byPhytophthoraspp. [J].Chinese Jou-rnal of Biological Control,2006,22(3):239-243.
[36]窦红涛,李若瑜,万哲,等.临床常见镰刀菌rDNA ITS序列分析 [J].临床和实验医学杂志,2006,5(6):646-648.
Dou H T,Li R Y,Wan Z,et al.Sequence analysis of ribosomal DNA ITS of clinical comm onFusariumspecies [J].Journal of Clinical and Experimental Medicine,2006,5(6):646-648.
[37]隋心,冯富娟,娄鑫,等.土壤微生物总DNA的提取以及土壤真菌ITS-PCR体系的建立 [J].中国酿造,2011(9):166-169.
Sui X,Feng F J,Lou X,et al.Total DNA from soil microorganisms and construction of ITS-PCR system for soil fungi [J].China Brewing,2011(9):166-169.
DOI:网络出版时间:2016-06-0816:2110.13207/j.cnki.jnwafu.2016.07.026
[收稿日期]2014-12-25
[基金项目]国家科技支撑计划项目(2011BAI03B01-02);国家自然科学基金项目(31270371);吉林省科技发展计划重点项目(20125068)
[作者简介]肖春萍(1985-),女,山西阳泉人,博士,主要从事药用植物资源开发与利用研究。E-mail:btxnw@163.com [通信作者]杨利民(1963-),男,吉林长春人,教授,博士,博士生导师,主要从事药用植物资源开发与利用研究。 E-mail:ylmh777@126.com
[中图分类号]S432.4+4
[文献标志码]A
[文章编号]1671-9387(2016)07-0181-12
Screening and identification of biocontrol fungi against main pathogens ofPanaxginseng
XIAO Chunping,YANG Limin,HAN Mei,CHENG Lin,MA Fengmin,GUO Shuangshuang
(CollegeofChineseMedicinalMaterial,Co-constructingKeyLaboratorybyProvinceandtheMinistryofScienceandTechnologyofEcologicalRestorationandEcosystemMmanagement,JilinAgriculturalUniversity,Changchun,Jilin130118,China)
Abstract:【Objective】 This study screened effective and broad-spectrum biocontrol fungi against main pathogens of Panax ginseng to enrich biocontrol microorganism resources.【Method】 Soil fungi were isolated from rhizosphere soil of healthy Panax ginseng by dilution plate method.Biocontrol strains,with highly antibacterial activity against 7 ginseng pathogens including Alternaria panax,Rhizoctonia solani,Fusarium solani,Cylindrocarpon destructans,Phytophthora cactorum,Sclerotinia schinseng and Botrytis cinerea were screened using pairing culture method.Biocontrol fungi were also identified based on morphology and rDNA-ITS sequence.【Result】 A total of 400 fungi were isolated from P.giseng soil,among which,15 had broad spectrum antimicrobial effect on 7 P.ginseng pathogens.Especially,Rhizoctonia solani were strongly inhibited by all of them with the inhibition rate of >50%,and FSR-106 was the strongest with the inhibition rate of 87.41%.FSR-121 was the strongest against Alternaria panax with the inhibition rate of 60.00%,and FSR-74 was the strongest against Fusarium solani with the inhibition rate of 67.48%.Inhibition rates of FSR-46 against Cylindrocarpon destructans (66.67%) and Botrytis cinerea (68.97%) were the highest.FSR-97 was the strongest against Phytophthora cactorum and Sclerotinia schinseng with inhibition rates of 73.33% and 66.67%,respectively.Morphological and rDNA-ITS sequence analysis showed that the 15 biocontrol fungi could be divided into 6 genus,i.e.8 belonged to Trichoderma,3 belonged to Penicillium,one belonged to Aspergillus,one belonged to Epicoccum,one belonged to Chaetomium and one belonged to Daldinia.FSR-38 was identified as Epicoccum nigrum,FSR-10,FSR-43 and FSR-106 were T.atroviride,FSR-46 was T.longibrachiatum,FSR-55 was T.hamatum,FSR-72 was T.citrinoviride,FSR-74 was Chaetomium globosum,FSR-97 was Trichoderma polysporum,FSR-91 was Daldinia childiae,while FSR-25,FSR-67and FSR-121 were Penicillium sp..【Conclusion】 The screening method based on rhizosphere soil of healthy gineng is a rapid and efficient way to seek for strong potential biocontrol strains.The 15 biocontrol fungi isolated in this study have good potential for the control of P.ginseng pathogens.
Key words:pathogens of Panax ginseng;Trichoderma;rDNA-ITS sequence analysis;biocontrol fungi
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20160608.1621.052.html

