红花miR397a基因表达及对靶基因LAC2的调控作用
董园园,刘秀明,姚 娜,赵利旦,李海燕
(吉林农业大学 生物反应器与药物开发教育部工程研究中心,吉林 长春 130118)
红花miR397a基因表达及对靶基因LAC2的调控作用
董园园,刘秀明,姚娜,赵利旦,李海燕
(吉林农业大学 生物反应器与药物开发教育部工程研究中心,吉林 长春 130118)
[摘要]【目的】 研究红花miR397a前体基因及成熟基因在红花不同组织中的表达水平,并对miR397a基因序列、靶基因及基因功能进行分析,为深入研究红花抗逆机制提供参考。【方法】 提取红花籽粒、花瓣、茎、根、叶片等5个组织材料的总RNA,使用荧光定量PCR鉴定miR397a在不同组织中的表达水平;利用生物信息学方法分析红花miR397a基因序列,用原生质体转化方法验证红花miR397a调控的靶基因LAC2,并利用转基因拟南芥表型研究miR397a基因的功能。【结果】 miR397a前体基因和成熟基因均能在红花不同组织中表达,且均以叶片组织中的表达量最高,分别是籽粒组织的2.5与1.9倍,差异达极显著水平;miR397a序列在不同物种间高度保守,序列中仅存在 1~2个碱基的错配或缺失;miR397a对LAC2基因有调控作用,miR397a的过表达可引起LAC2表达水平降低,红花miR397a表达引起植物对NaCl的敏感性增加。【结论】 红花miR397a在叶片组织中的表达量最高,基因序列保守,且红花miR397a表达可增强植物对NaCl的敏感性。
[关键词]红花;miR397a;LAC2;转录后调控
microRNA(miRNA)是一类长度为18~24 nt的内源非编码小分子RNA,来源于具有颈环结构的单链microRNA前体基因内部,经RNA内切酶Ⅱ加工后从前体基因上释放并获得成熟基因。microRNA在转录后水平上与靶mRNA形成RISC复合物,通过诱导mRNA的降解或抑制蛋白翻译发挥转录调控功能[1],从而参与植物的生长发育、开花时序、环境应激、组织特异性分化等生理活动[2]。miR397是一类高度保守的microRNA基因家族,在拟南芥及落叶松中均保守存在[3-4],在水稻不同发育阶段及不同组织中,miR397家族成员的基因表达水平差异明显[5]。
漆酶(LAC)为蓝铜氧化酶家族(Blue copper oxidase)成员,属于氧化还原酶。最近在拟南芥花序研究中发现LAC为miR397的调控靶基因[4]。Zhang等[5]研究也发现,水稻miR397可通过对靶基因LAC的调控影响水稻花序数量及穗粒大小。有研究还发现,LAC除影响植物花序发育外,在植物中还参与干旱及盐等逆境环境的应激调节,LAC的过表达可引起植物逆境耐受性提高[6-7]。
红花(CarthamustinctoriusL.)又名草红花,是中国及西亚地区广泛种植的集经济价值与药用价值为一体的植物,红花栽培品种具有适度抗逆性,在生长过程中能够适应轻度的干旱及盐碱等非生物胁迫[8-9]。红花microRNA在植物生长发育、组织分化及环境适应等过程中也参与并执行重要的调控作用,但是迄今为止,国内外尚未见与红花microRNA逆境调控相关的报道。本研究在红花microRNA表达谱中鉴定了miR397a基因,分析其在红花不同组织中的表达,对其靶基因进行预测,并将miR397a过表达载体转化拟南芥,进行NaCl胁迫研究,分析转基因拟南芥的耐盐性,进而为解析红花抗逆作用机制提供参考。
1材料与方法
1.1材料
试验所用的材料品种为新疆裕民红花(CarthamustinctoriousL.),由中国山东菏泽润康中医学院提供。红花种植在吉林农业大学人工气候室内。培育基质用黑土、蛭石按体积比3∶7混合均匀。培养条件为光照16 h 室温26 ℃、暗培养8 h 室温20 ℃,相对湿度80%。收集生长期第6~8片复叶、盛花期花瓣、成熟期籽粒、根、茎5个组织样本材料,液氮处理后储存于―80 ℃冰箱备用。
RNA提取试剂、microRNA反转录试剂盒TaqMan®MicroRNA Reverse Transcription Kit、microRNA荧光定量PCR试剂TaqMan small RNA assays、荧光定量PCR试剂(mRNA)、DNA Marker及核酸内切酶、T载体,均购自大连TaKaRa公司;反转录试剂盒(cDNA),购自北京百泰克公司;DNA T4连接酶,购自NEB公司;质粒提取试剂盒Plasmid Midi Kit Ⅰ,购自OMEGA公司;胶回收试剂盒DNA Gel Extraction,购自AXYGEN公司;DH5α感受态细胞、pUC-T载体,均购自北京全式金生物技术公司;W5溶液配制参见Yoo等[10]方法;P1301载体及pSPYNE(R)载体由本实验室提供。
1.2方法
1.2.1红花不同组织总RNA提取及表达分析将叶片、花瓣、去种皮后的籽粒、茎、根分别于液氮中充分研磨,取100 mg植物材料置于无RNA酶的 1.5 mL离心管内,参照TRIzol试剂说明书进行总RNA提取。将获得的RNA使用DEPC水溶解后,使用NanoDrop 2000在260 nm下测定总RNA的质量浓度,并使用含有EB的1%琼脂糖凝胶电泳估测总RNA的完整性。参照百泰克RNA反转录试剂盒说明进行cDNA的反转录,分别合成红花叶片、籽粒、花瓣、茎、根组织的cDNA。microRNA的反转录参照TaKaRa公司的说明书进行。使用Real-time PCR方法分析红花不同组织样本中成熟miR397a及miR397a前体基因的表达水平。设定18S为内参基因[11],进行基因表达分析。
1.2.2引物的设计与合成参照miRBase 20.0数据库及NCBI上红花small RNA短序列SRA数据库(GSM618276、GSM618277、GSM618278)获得miR397a成熟基因序列及前体基因序列。合成两端带有BamHⅠ及HindⅢ的miR397a前体基因序列,用于植物表达载体的构建。根据基因序列设计引物miR397aPF、miR397aPR、miR397aVF、BastaVR(表1)。其中,miR397aPF、miR397aPR用于miR397a前体基因序列的扩增及检测,miR397aVF、BastaVR用于植物表达载体的验证。以上引物序列使用Primer 5.0软件设计,并委托苏州金唯智生物公司合成。

表 1 研究涉及的引物序列Table 1 Sequences of primer used in this study
1.2.3红花miR397a基因序列分析及靶基因预测根据NCBI中红花SRA短序列数据库(GSM618276、GSM618277、GSM618278)信息获知,红花miR397a前体基因序列长度为107 bp,成熟序列长度为21 nt。整合miRBase 20.0数据库中现有的miR397a基因资源及序列信息,使用ClustalX 2软件,分别对红花miR397a与其他13个不同植物物种miR397a前体及成熟序列进行多序列比对分析,并利用Neighbor-Joining方法构建系统进化树。利用在线预测平台(http://plantgrn.noble.org/psRNATarget/?fTnction=2)根据如下规则进行红花miR397a的靶基因预测:(1) microRNA与靶基因间的错配不得超过3个,G-T配对默认为0.5个错配;(2) 在microRNA与靶基因复合体中不得有超过2处发生于相邻位点的错配;(3) 在microRNA与靶基因复合体中,从microRNA的5′端起第2~12个位点中,连续2个相邻位点不能发生错配,错配总数不能高于2.5个;(4) microRNA与靶基因复合体的最低自由能(MFE)不应小于该microRNA与其最佳互补体结合时MFE的75%[12-14]。
1.2.4红花miR397a小分子作用载体及表达载体的构建参考Qiu等[15]和Huang等[16]人工构建microRNA前体的方法,在miR397a前体基因序列5′端设计加入保护碱基和酶切位点BamHⅠ及Hind Ⅲ,使用基因序列合成的方法获得miR397a前体基因。通过T载体连接后测序验证,使用BamHⅠ及HindⅢ双酶切并胶回收小分子片段,利用DNA T4连接酶将该片段插入P1301植物表达载体内,构建了P1301-miR397a重组载体。
以合成的miR397a前体基因为模板,使用带有XbaⅠ及SacⅠ酶切位点的基因引物miR397aPF-2及miR397aPR-2进行PCR扩增,扩增条件为95 ℃ 预变性5 min;95 ℃变性5 s,59 ℃退火30 s,72 ℃延伸20 s,35个循环;72 ℃延伸5 min,4 ℃保存。基因产物连接T载体并测序正确后,通过XbaⅠ及SacⅠ双酶切并胶回收,小分子片段通过DNA T4连接酶连到小分子表达载体pSPYNE(R)内,获得重组pSPYNE(R)-precusor miR397a表达载体。
1.2.5红花miR397a的原生质体转化在细胞板中,按Yoo等[10]的方法制备红花原生质体细胞后,每孔铺上200 μL红花原生质体细胞,细胞总数约 4×104个。每孔加入质量浓度为1 000 ng/μL的重组质粒pSPYNE(R)-precusor miR397a。每孔加入220 μL 体积分数4%的(PEG-4000)溶液,轻轻混匀后,室温孵育15 min。再加入920 μL W5溶液稀释,混匀后,150g离心90 s,去上清。使用880 μL W5溶液重新悬浮,150g离心90 s,去除残留PEG。每孔使用100 μL W5溶液重新悬浮细胞,过夜培养。
1.2.6红花miR397a的拟南芥转化将转化有P1301-miR397a重组载体的农杆菌4 000 r/min、20 ℃离心15 min,去掉上清液,590 nm条件下检测悬浮液的OD值,最终OD值达到0.8~0.9即可。将适量的农杆菌悬浮液放到500 mL的烧杯中,将拟南芥的茎部和叶片基部都浸入到农杆菌悬浮液中,侵染7 min;将侵染后的营养钵平放,用塑料薄膜保湿过夜。侵染2周后收集全部种子。使用体积分数1%的草铵膦连续筛选T1、T2、T3代转miR397a基因拟南芥植株,提取拟南芥叶片基因组, PCR扩增后使用1%琼脂糖凝胶电泳检测,进行阳性转化苗的鉴定。分别使用含0,100,150,200 mmol/L NaCl的MS培养基萌发转基因拟南芥种子,分别统计7 d内转基因株系及野生型拟南芥(对照)种子的发芽率,评估转基因拟南芥对NaCl的耐受能力。
1.3数据处理及分析
不同组织miR397a表达水平及野生型拟南芥与转基因拟南芥株系发芽率的差异,均采用t-test判断是否具有统计学显著性。
2结果与分析
2.1红花miR397a在不同组织中的表达分析
miR397a(A)和miR397a前体(B)在红花不同组织中表达的qRT-PCR分析见图1。
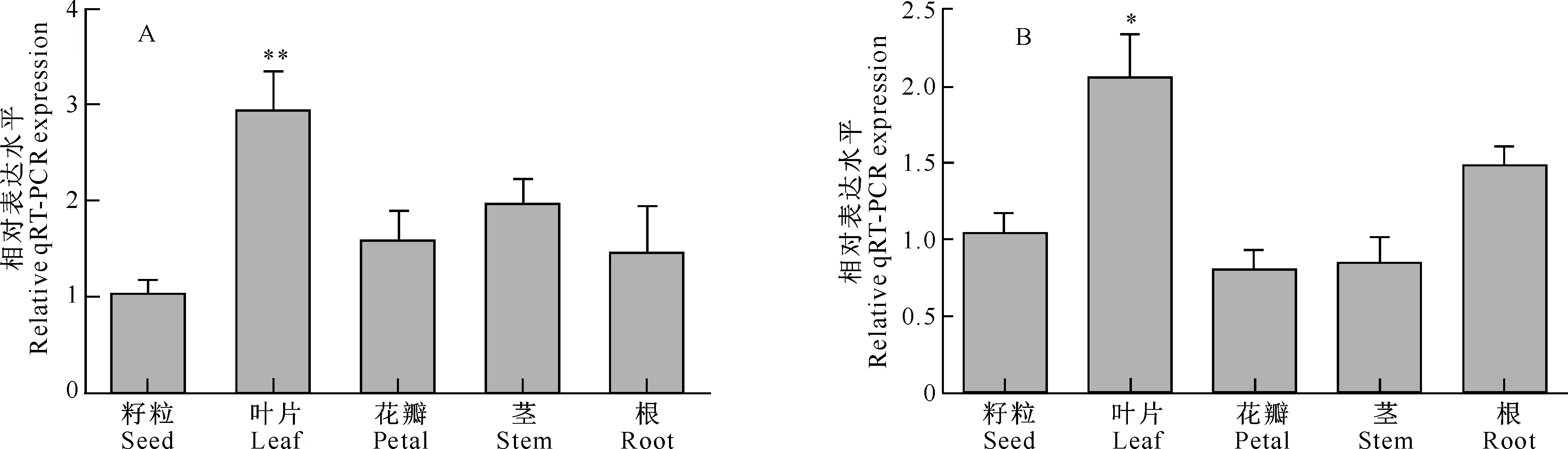
图 1 miR397a(A)和miR397a前体(B)在红花不同组织中表达的qRT-PCR分析 *,**分别表示差异显著(P<0.05)和差异极显著水平(P<0.01)Fig.1 Expression of miR397a (A) and miR397a precursor (B) in different tissues of safflower * indicates significant difference (P<0.05),and ** indicates extremely significant difference (P<0.01)
由图1可知,miR397a在叶片组织中的表达量较籽粒、花瓣、根、茎组织中高,且miR397a基因在叶片组织中的表达量是籽粒组织的2.5倍,差异表达具有极显著性(P<0.01)(图1-A);miR397a前体基因在红花不同组织中的表达分布趋势与miR397a成熟基因一致,也是在叶片组织中表达量最高,是籽粒组织的1.9倍,差异也达显著性水平(P<0.05)(图1-B)。
2.2红花miR397a基因序列的生物信息学分析
由图2可知,红花miR397a前体基因与拟南芥、水稻、杨树、葡萄、大麦的miR397a前体基因亲缘关系最近,归为一类;与苹果、油菜、芹叶拟南芥亲缘关系较近;与玉米、亚麻、短柄草miR397a前体亲缘关系较远;与大豆、无油樟亲缘关系最远,最后才聚到一起。红花miR397a成熟基因与拟南芥、芹叶拟南芥、大豆、短柄草、葡萄、油菜、水稻、杨树miR397a的相似度达90%以上,且该基因在上述植物物种中高度保守,序列中仅存在1~2个碱基的错配或缺失(图3)。

图 2不同植物物种中miR397a序列前体的系统进化树
Fig.2Phylogenetic tree of miR397a precursor from different plant species

图 3 不同植物物种中成熟miR397a序列的比对 * 一致性序列Fig.3 Sequence alignment of miR397a sequences from different plant species * Consensus sequence
2.3红花miR397a的靶基因预测
用红花miR397a序列及SRA数据库内的红花转录组数据(SRX101827),进行microRNA对应调控的靶基因信息预测,结果共预测到7个靶基因(表2和表3),其中靶基因unigene88135的基因功能注释为漆酶基因LAC2。
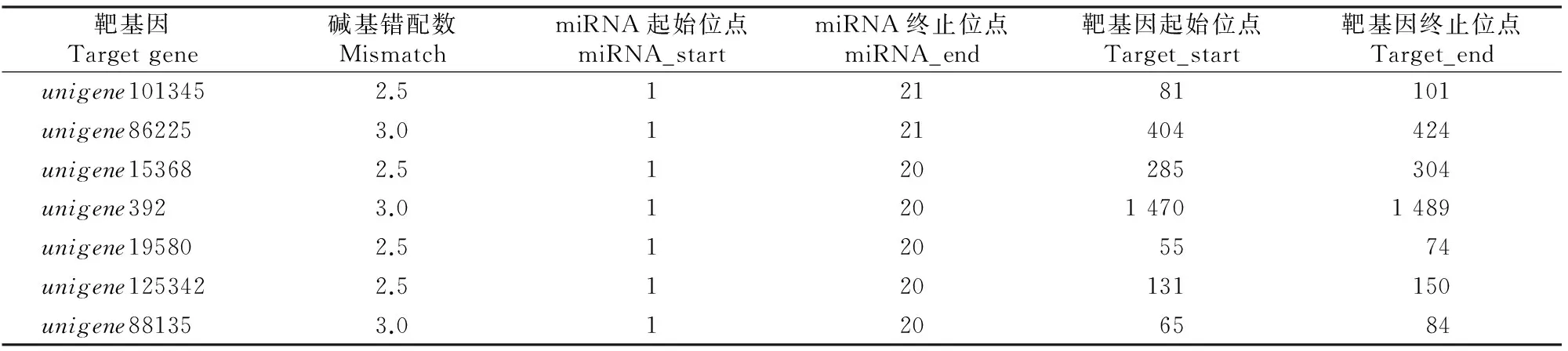
表 2 红花miR397a的靶基因预测Table 2 Target prediction of miR397a
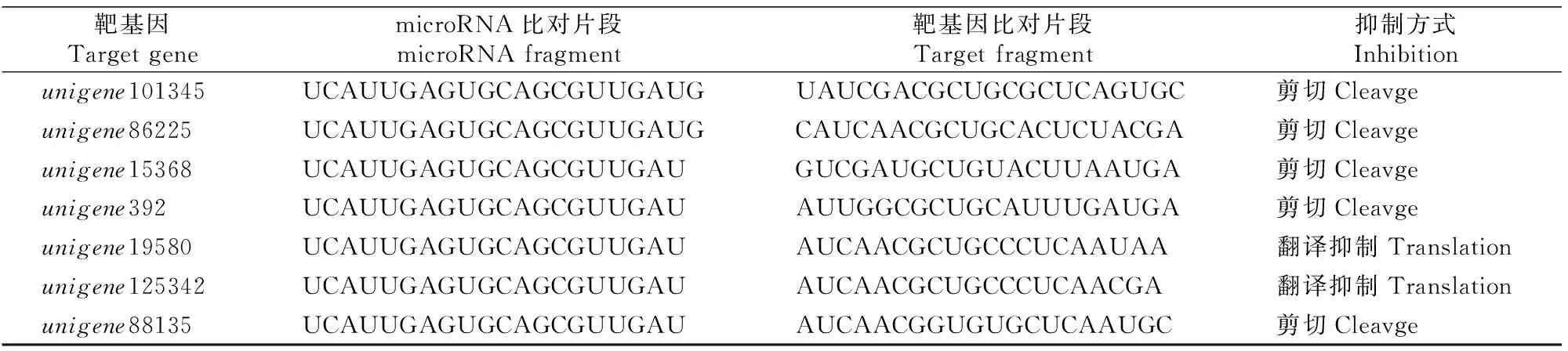
表 3 红花miR397a对靶基因的调控预测Table 3 Prediction of target regulation by miR397a
2.4红花miR397a对靶基因的转录后调控
为研究miR397a对靶基因的调控作用,将带有miR397a前体基因的表达载体P35S-precursor通过PEG-4000介导,转化红花原生质体细胞,检测细胞内miR397a基因及红花叶片原生质体中unigene88135基因的表达水平。结果发现在转化miR397a前体表达载体的原生质体内,miR397a表达水平显著升高,t检验显示该差异具有统计意义(P=0.03)。同时检测unigene88135的表达水平发现,在转化miR397a前体表达载体后,unigene88135的表达明显降低,差异具有统计意义(P=0.02)(图4),说明miR397a在转录过程中对unigene88135具有转录后抑制的调控作用。
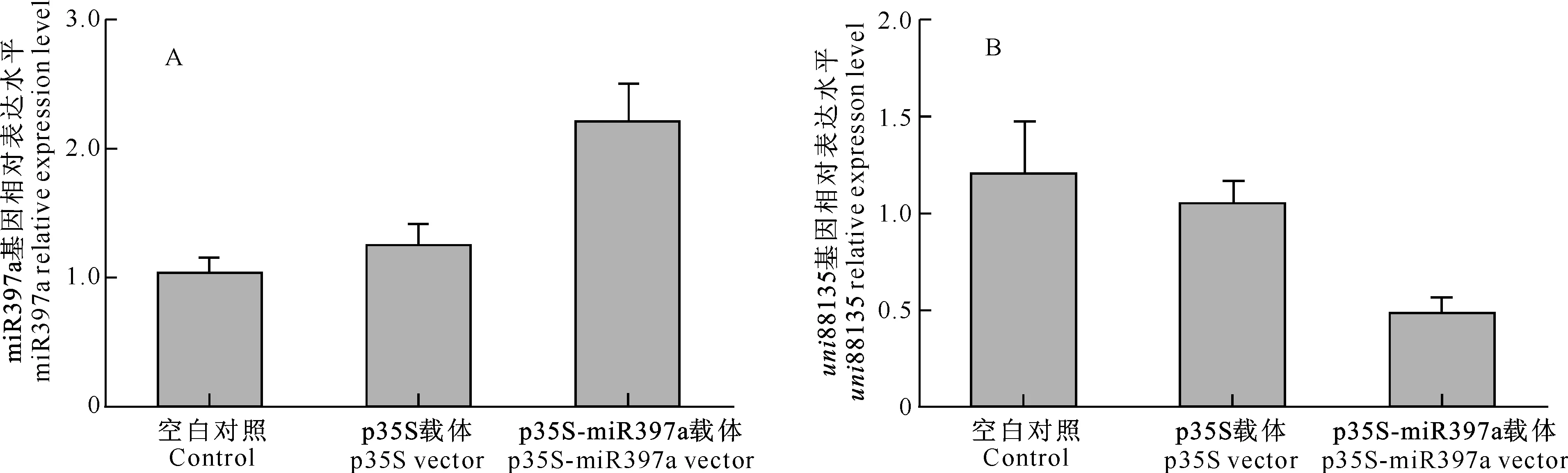
图 4 红花miR397a的表达(A)及对靶基因的调控(B)分析Fig.4 Expression of miR397a (A) and target gene regulation (B)
2.5转miR397a基因拟南芥的鉴定
对重组载体P1301-miR397a进行BamHⅠ及Hind Ⅲ双酶切鉴定,结果(图5-A)显示,酶切产物的核酸片段长度大小为107 bp,与预期结果大小一致,表明重组表达载体构建成功。将含有重组质粒P1301-miR397a的农杆菌转化模式植物拟南芥,利用Bar基因筛选标记及基因组PCR鉴定方法,经过T1、T2代拟南芥筛选鉴定,获得遗传稳定的T3代转基因拟南芥,并以T3代拟南芥基因组为模板,获得了含miR397a基因的核酸扩增产物,片段大小为763 bp(图5-B),与预期设计相符,显示已经成功获得转miR397a基因的拟南芥。

图 5转miR397a基因拟南芥的鉴定
A.重组质粒经BamHⅠ及Hind Ⅲ酶切后产物;M.DNA DL 2000 Marker;1.质粒;2.酶切产物;
B.转miR397a的T3代拟南芥基因组;M.DNA DL 2000 Marker;N.阴性对照;P.阳性对照,1~5.不同转基因植株的基因扩增产物
Fig.5PCR results of T3 transgenicArabidopsis
A.Products of recombinant plasmid digested byBamHⅠ andHind Ⅲ;M.DNA DL 2000 Marker;1.Plasmid;2.Restriction enzyme digestion product;B.PCR validation of transgenicArabidopsis;M.DNA DL 2000 Marker;N.Negative control;P.Positive control,1-5.PCR products of transgenicArabidopsis
2.6红花miR397a的功能分析
通过转miR397a拟南芥种子的萌发试验,判断过表达miR397a拟南芥的发芽率。由T3代转基因拟南芥幼苗在NaCl胁迫下的发芽率可知,萌发试验7 d后,野生型拟南芥及转miR397a基因拟南芥在无NaCl条件下发芽率接近,二者间无显著差异(图6-A)。100及150 mmol/L NaCl浓度下,转基因拟南芥发芽率与野生型拟南芥(对照)相比发芽率呈降低趋势,但差异未达显著性水平(图6-B,6-C)。200 mmol/L NaCl浓度下,野生型拟南芥发芽率平均为69.5%,转基因株系L1、L2发芽率平均为59%及56%,差异达显著水平(P<0.05)(图6-D)。上述结果表明,miR397a过表达可增强拟南芥种子在萌发过程中的NaCl敏感性。
3讨论
红花作为古老的中药植物及油料作物,喜温耐旱,花瓣中蕴含丰富的羟基黄色素A、羟基黄色素B和芦丁醇等黄酮类活性成分,具有活血化瘀、抑制血小板凝集、消炎等药用价值[17-19]。植物microRNA研究有利于在转录后水平深入挖掘基因表达调控及抗逆分子机制,但红花microRNA的已知信息资源目前并不丰富,miRBase数据库尚未收录红花相关信息,且红花microRNA的鉴定与功能研究才刚刚展开。
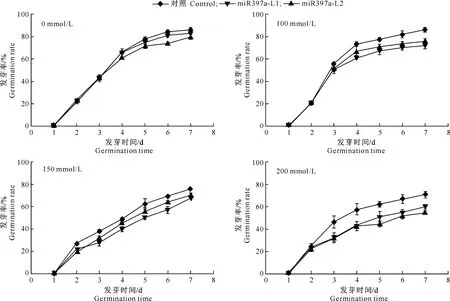
图 6 不同NaCl质量浓度下转miR397a拟南芥的发芽率统计Fig.6 Germination rates of Arabidopsis under NaCl
本研究通过SRA数据库注释的miR397a基因信息,利用荧光定量PCR方法鉴定了红花不同组织中miR397a的表达水平,发现相较于花瓣、根、籽粒、茎等组织,miR397a在叶片组织中高表达,说明该基因表达可能与叶片组织的特异功能调控有关。对该基因的序列分析表明,红花miR397a与拟南芥、芹叶拟南芥、大豆、短柄草、葡萄、油菜、水稻、杨树的miR397a相似度达90%,同源性最高,为高度保守的基因序列。而miR397a前体与其他物种也具有高度同源性,相似度均在57%以上,表明该基因在进化历程中高度保守,这与Ninova等[20]关于“microRNA在进化中高度保守”的研究结论一致。
microRNA作为一类非编码小RNA,广泛参与了真核生物的细胞分裂、组织发育、逆境响应、信号转导等过程[21],microRNA功能的行使往往通过对靶基因的降解或抑制蛋白翻译实现[22]。Jung等[23]报道,miR172通过调控靶基因TOE3实现对拟南芥花序发育的调控。Vazquez等[21]报道,miR163可通过调节SMAT基因表达来影响拟南芥对外界病原体的防御作用。在拟南芥和水稻上的研究表明,LAC为miR397的靶向调控基因[23]。Lu等[24]在杨树miR397a基因鉴定及靶基因研究中发现,ptr-miR397a过表达可调控漆酶基因表达水平下降,甚至使漆酶蛋白活性下降40%,使杨树木质素含量发生改变。红花miR397a的靶基因预测使用了红花转录组数据,预测miR397a可能调控的7个靶基因,揭示microRNA对靶基因的调控存在多个对应关系。漆酶LAC2基因为miR397a的候选靶基因之一,在植物中与氧化还原反应及盐调控有关[6-7],推断miR397a可能参与红花的氧化还原反应过程,还可能参与红花的耐盐胁迫过程。本研究结果证实,红花miR397a过表达导致LAC2基因表达水平降低;通过转miR397a拟南芥株系的表型发现,转基因拟南芥对NaCl的敏感性提高,表现为NaCl耐受性降低,明确红花miR397a参与盐胁迫耐受过程的调控。
[参考文献]
[1]Floyd S K,Bowman J L.Gene regulation:ancient microRNA target sequences in plants [J].Nature,2004,428(6982):485-486.
[2]Feng J,Liu S,Wang M,et al.Identification of microRNAs and their targets in tomato infected with cucumber mosaic virus based on deep sequencing [J].Planta,2014,240(6):1335-1352.
[3]Zhang J,Zhang S,Han S,et al.Genome-wide identification of microRNAs in larch and stage-specific modulation of 11 conserved microRNAs and their targets during somatic embryogenesis [J].Planta,2012,236(2):647-657.
[4]Wang C Y,Zhang S,Yu Y,et al.MiR397b regulates both lignin content and seed number inArabidopsisvia modulating a laccase involved in lignin biosynthesis [J].Plant Biotechnol J,2014,12(8):1132-1142.
[5]Zhang Y C,Yu Y,Wang C Y,et al.Overexpression of microRNA OsmiR397 improves rice yield by increasing grain size and promoting panicle branching [J].Nat Biotechnol,2013,31(9):848-852.
[6]Cho H Y,Lee C,Hwang S G,et al.Overexpression of the OsChI1 gene,encoding a putative laccase precursor,increases tolerance to drought and salinity stress in transgenicArabidopsis[J].Gene,2014,552(1):98-105.
[7]Jaouani A,Neifar M,Prigione V,et al.Diversity and enzymatic profiling of halotolerant micromycetes from Sebkha El Melah,a Saharan salt flat in southern Tunisia [J].Biomed Res Int,2014,2014:439197.
[8]Guan L L,Wu W,Hu B,et al.Devolopmental and growth temperature regulation of omega-3 fatty acid desaturase genes in safflower (CarthamustinctoriusL.) [J].Genet Mol Res,2014,13(3):6623-6637.
[9]Roh J S,Han J Y,Kim J H,et al.Inhibitory effects of active compounds isolated from safflower (CarthamustinctoriusL.) seeds for melanogenesis [J].Biol Pharm Bull,2004,27(12):1976-1978.
[10]Yoo S D,Cho Y H,Sheen J.Arabidopsismesophyll protoplasts:a versatile cell system for transient gene expression analysis [J].Nat Protoc,2007,2(7):1565-1572.
[11]Feng H,Huang X,Zhang Q,et al.Selection of suitable inner reference genes for relative quantification expression of microRNA in wheat [J].Plant Physiol Biochem,2012,51:116-122.
[12]Maziere P,Enright A J.Prediction of microRNA targets [J].Drug Discov Today,2007,12(11/12):452-458.
[13]Rehmsmeier M.Prediction of microRNA targets [J].Methods Mol Biol,2006,342:87-99.
[14]赵东宇,王 岩,罗迪,等.生物信息学中的 microRNA 预测研究 [J].吉林大学学报(信息科学版),2008,26(3):276-280.
Zhao D Y,Wang Y,Luo D,et al.Advances of microRNA prediction in bioinformatics [J].Journal of Jilin University (Information Science Edition),2008,26(3):276-280.
[15]Qiu X,Friedman J M,Liang G.Creating a flexible multiple microRNA expression vector by linking precursor microRNAs [J].Biochem Biophys Res Commun,2011,411(2):276-280.
[16]Huang Y,Zou Q,Wang S P,et al.Construction and detection of expression vectors of microRNA-9a in BmN cells [J].J Zhejiang Univ Sci B,2011,12(7):527-533.
[17]Thao N T,Cuong T D,Hung T M,et al.Simultaneous determination of bioactive flavonoids in some selected Korean thistles by high-performance liquid chromatography [J].Arch Pharm Res,2011,34(3):455-461.
[18]Wu C,Zhang J,Zhou T,et al.Simultaneous determination of seven flavonoids in dog plasma by ultra-performance liquid chromatography-tandem mass spectrometry and its application to a bioequivalence study of bioactive components in Herba Epimedii and Er-Xian Decoction [J].J Pharm Biomed Anal,2011,54(1):186-191.
[19]陈文梅,金鸣.红花黄色素抑制血小板激活因子介导的血小板活化作用的研究 [J].中国药学杂志,2000,35(11):741-744.
Chen W M,Jin M.Inhibition of safflor yellow on rabbit platelet activation induced by platelet activating factor [J].Chin Pharm,2000,35(11):741-744.
[20]Ninova M,Ronshaugen M,Griffiths-Jones S.Conserved temporal patterns of microRNA expression inDrosophilasupport a developmental hourglass model [J].Genome Biol Evol,2014,6(9):2459-2467.
[21]Vazquez F.Arabidopsisendogenous small RNAs:highways and byways [J].Trends Plant Sci,2006,11(9):460-468.
[22]Wang B,Sun Y F,Song N,et al.MicroRNAs involving in cold,wounding and salt stresses inTriticumaestivumL. [J].Plant Physiol Biochem,2014,7(80):90-96.
[23]Jung J H,Lee S,Yun J,et al.The miR172 target TOE3 represses AGAMOUS expression duringArabidopsisfloral patterning [J].Plant Sci,2014,2(215/216):29-38.
[24]Lu S,Li Q,Wei H,Chang M J,et al.Ptr-miR397a is a negative regulator of laccase genes affecting lignin content inPopulustrichocarpa[J].Proc Natl Acad Sci USA,2013,110:10848-10853.
DOI:网络出版时间:2016-06-0816:2110.13207/j.cnki.jnwafu.2016.07.025
[收稿日期]2014-12-10
[基金项目]国家高新技术研究发展计划(863)项目“油体生物反应器研制及产品开发”(2011AA100606);国家自然科学基金项目“干旱条件下Gma-miR169对大豆蒸腾作用的调控机制研究”(31101091)
[作者简介]董园园(1985-),女,吉林长春人,讲师,博士,主要从事分子生物学研究。E-mail:yydong@aliyun.com [通信作者]李海燕(1972-),女,吉林舒兰人,教授,博士生导师,主要从事植物基因工程研究。E-mail:hyli99@163.com
[中图分类号]Q789
[文献标志码]A
[文章编号]1671-9387(2016)07-0173-08
Expression of safflower miR397a gene and its role inLAC2 regulation
DONG Yuanyuan,LIU Xiuming,YAO Na,ZHAO Lidan,LI Haiyan
(MinistryofEducationEngineeringResearchCenterofBioreactorandPharmaceuticalDevelopment,JilinAgriculturalUniversity,Changchun,Jilin130118,China)
Abstract:【Objective】 This study analyzed the expression levels of precursor of miR397a and mature miR397a gene in different safflower tissues,identified the sequence of miR397a, predicted its target genes and explored its function.【Method】 Total RNA was extracted from 5 issues including seed,petal,leaf,stem and root of safflower and qRT-PCR was employed to analyze the gene expression levels.Sequence analysis and target genes prediction were conducted by bioinformatics methods.Protoplast transformation method was employed to validate target gene regulated by safflower miR397a.At last,transgenic Arabidopsis was used to discuss function of miR397a gene.【Result】 The expressions of miR397a precursor and mature miR397a were higher in safflower leaf than in other tissues.Their expressions in leaf were 2.5 and 1.9 times higher than in seed with extremely significant difference.The miR397a was highly conservative in different plants with only one or two bases mismatching or missing.Gene miR397a played role in LAC2 regulation.Over expression of miR397a could decrease LAC2 expression level and miR397a expression could increase plant sensibility to NaCl.【Conclusion】 Conserved miR397a expresses the highest in leaf,and it could increase plant sensibility to NaCl.
Key words:Carthamus tinctorius L.;miR397a;LAC2;post-transcriptional regulation
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20160608.1621.050.html

