奶牛外周血树突状细胞体外诱导培养与鉴定
詹 康 赵倩明 隋雁南 封飞飞 占今舜 赵国琦
(扬州大学动物科学与技术学院,扬州225009)
奶牛外周血树突状细胞体外诱导培养与鉴定
詹康赵倩明隋雁南封飞飞占今舜赵国琦*
(扬州大学动物科学与技术学院,扬州225009)
摘要:通过粒-巨噬细胞集落刺激因子(GM-CSF)和白细胞介素-4(IL-4)体外诱导外周血单核细胞为树突状细胞,为利用树突状细胞免疫疗法治疗奶牛乳房炎奠定基础和提供细胞模型。利用淋巴细胞分离液分离获得奶牛外周血单核细胞,在6孔板内培养2 h后,弃掉含有大量的T细胞和B细胞上清液,贴壁的基本上是单核细胞,磷酸盐缓冲液清洗5次,加入含有GM-CSF和IL-4的2 mL培养基进行3 d诱导。之后,从培养基顶部小心吸弃1.4 mL的培养基,然后再补加含有GM-CSF和IL-4的1.8 mL培养基继续诱导3 d。每天通过显微镜观察细胞形态。第7天经流式检测细胞表面抗原CD11c、CD14、主要组织相容性复合体Ⅱ(MHCⅡ)、CD40、CD80、CD86的表达。结果表明:1)第2天,一些细胞表面可以生长出刺突并伴随着伪足的生长。第3天,细胞表面的刺突和伪足越来越多。第4、5天,一些带有刺突和伪足的细胞开始聚集和融合。第6天,单核细胞基本被诱导为树突状细胞,细胞表面含有大量清晰可见的刺突和伪足。2)经流式检测,CD14、CD11c、MHCⅡ阳性表达细胞分别占诱导细胞的6.8%、65.0%、75.9%,CD80和CD86阳性表达细胞分别占诱导细胞的2.0%和1.2%。综上所述,采用奶牛外周血单核细胞经体外诱导能够获得一定纯度的奶牛树突状细胞。
关键词:细胞免疫治疗;单核细胞;树突状细胞;奶牛乳房炎
近年来有关树突状细胞的表型、功能及细胞免疫疗法等方面的研究已成为热点[1]。细胞免疫疗法主要通过对疾病动物进行静脉采血,然后在体外获得的外周血单核细胞,经过特定培养条件下定向诱导为树突状细胞,被诱导的细胞与病原菌或抗原共孵育,最后经过静脉注射至动物体内[2]。奶牛乳房炎是奶牛最重要的疾病之一,直接导致产奶量下降,甚至淘汰,这给畜牧业经济带来严重的损失[3]。因此,利用未成熟的树突状细胞治疗奶牛乳房炎具有重要意义,然而,如何在体外获得一定纯度的未成熟树突状细胞阻碍了利用细胞免疫疗法治疗乳房炎的发展。同时,动物外周血的未成熟树突状细胞数量极其少,仅仅只有外周血单核细胞的1%,因此,如果直接从外周血分选未成熟的树突状细胞是不可行的。动物体内的大部分的前体细胞是单核细胞,在一定条件下能够定向分化为所需要的目的细胞。因此,本试验通过体外获得单核细胞,再经过粒-巨噬细胞集落刺激因子(GM-CSF)和白细胞介素-4(IL-4)细胞因子诱导,以期获得未成熟的奶牛树突状细胞。同时,奶牛营养与免疫的关系能够得到很好的阐明。人和动物体内有很多抗原呈递细胞,如单核细胞、巨噬细胞和树突状细胞。其中,树突状细胞是人体内功能最强的抗原递呈细胞。树突状细胞分化成熟过程中具有未成熟与成熟2个阶段[4]。Werling等[5]在体外通过外周血获得了奶牛树突状细胞,并利用此细胞来俘获和吸收牛呼吸道合胞体病毒,结果表明奶牛树突状细胞能够加工和处理这种病毒。Schreiner等[6]通过树突状细胞、T细胞和金黄色葡萄球菌调节肽共培养,发现黄色葡萄球菌调节肽能够加强树突状细胞和T细胞功能并调节初始型T细胞的功能。Guermonprez等[7]树突状细胞与疟原虫共培养,诱导T细胞的激活,尤其是CD8杀伤性T细胞的激活,能够抑制疟原虫的增殖。本试验旨在体外诱导外周血单核细胞为未成熟的树突状细胞并观察细胞形态变化和鉴定其表面分子的丰富度,同时利用未成熟的树突状细胞与奶牛乳房炎病原菌共培养提供素材,这将为利用细胞免疫疗法治疗奶牛乳房炎提供细胞模型。
1材料与方法
1.1材料
对3头荷斯坦奶牛进行颈静脉采血,转移至无菌肝素钠抗凝管中放冰上,立即带回实验室。RPMI1640完全培养基和澳洲胎牛血清均购自Gibco公司;100 U/mL青霉素、100 μg/mL链霉素均购自Sigma公司;GM-CSF和IL-4均购自Kingfisher公司;淋巴细胞分离液购自Cedarlane公司;2-巯基乙醇(2-ME)购自Amresco公司;CD11c、CD14、主要组织相容性复合体Ⅱ(MHCⅡ)、CD40、CD80、CD86以及Isotype Control IgG1、IgM和IgG2a)均是鼠源单克隆抗体(1∶50),均购自University of Washington;PerCP-Rat Anti-Mouse IgG1(1∶4)购自BD公司;PE-Goat Anti-Mouse IgM和FITC-Goat Anti-Mouse IgG 2a(1∶50)均购自Southern Biotech公司。
1.2奶牛外周血单核细胞的获得
对奶牛静脉采血20 mL至肝素钠抗凝管中,用含有100 U/mL青霉素和100 μg/mL链霉素磷酸盐缓冲液(PBS)进行1∶1稀释外周血,总体积40 mL。加淋巴细胞分离液到50 mL离心管底部,然后缓慢加入稀释的奶牛静脉血至淋巴细胞分离液表面,2 000/min条件下离心30 min。离心之后,细胞将分层,依次是血清和稀释液层、淋巴细胞层、淋巴细胞分离液层、血细胞和粒细胞层。转移淋巴细胞层到新的50 mL移液管中。加PBS至总体积40 mL。2 000/min条件下离心10 min,弃上清。加800 μL红细胞裂解液悬浮细胞,然后再加红细胞裂解液至总体积20 mL,室温静置5 min。2 000/min条件下离心10 min,倒掉上清。加800 μL PBS悬浮细胞,然后再加PBS至总体积40 mL,2 000/min条件下离心10 min,弃上清。加1 mL的PBS悬浮细胞,将4管1 mL细胞全部转移至15 mL离心管中,冰上保存。80倍稀释细胞,计数。
1.3奶牛外周血树突状细胞的分化诱导
通过细胞计数,取107个细胞加至6孔板,每孔加入3 mL的含有终浓度为50 ng/mL GM-CSF、50 ng/mL IL-4、0.5 mol/L 2-ME、100 U/mL青霉素和100 μg/mL链霉素,37 ℃、5% CO2培养箱孵育3 d。之后,从培养基顶部吸弃适量的培养基,然后再补加上述培养基。培养至第7天,收获细胞,进行流式分析。培养的6 d内,每天通过显微镜观察细胞形态。
1.4奶牛树突状细胞表型的鉴定
取106诱导细胞悬液加入1.5 mL指形管,2 000/min条件下离心3 min弃上清。100 μL PBS悬浮细胞,加50 μL的一抗,总体积150 μL,4 ℃孵育30 min,接下来4 ℃、2 000/min条件下离心3 min弃上清,重复3次。再加对应于PerCP-Rat Anti-Mouse IgG1、PE-Goat Anti-Mouse IgM和FITC-Goat Anti-Mouse IgG各自二抗,4 ℃避光孵育30 min,4 ℃、2 000/min条件下离心3 min,弃上清,重复3次,通过FACS Aria流式细胞仪检测树突状细胞的表型。对于每个样品都加入Isotype Control一抗,进行同型对照,以消除非特异性荧光的差异。
2结果
2.1奶牛外周血树突状细胞形态鉴定
由图1可知,外周血单核细胞接种第1天(接种2 h之后),细胞开始贴壁,但是细胞贴壁不牢。细胞上清液中仍然有大量的悬浮细胞,这些细胞大部分为T细胞和B细胞。加入GM-CSF和IL-4细胞因子之后,单核细胞开始被分化。第2天,一些细胞表面可以生长出刺突并伴随着伪足的生长。第3天,细胞表面的刺突和伪足越来越多。第4、5天,一些带有刺突和伪足的细胞开始聚集和融合。第6天,显微镜下具有典型的树突状细胞的形态特征,细胞表面的刺突更加明显,一些形态开始向周围延伸。一些细胞体积变大,细胞表面有许多树突,呈长短、大小不一的树枝状,有的突起较直,有的较弯曲并且叠加在一起形成较大突起。同时,少部分细胞开始衰老并开始脱落。
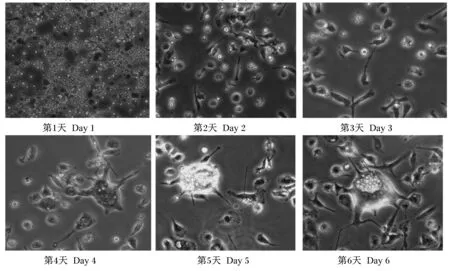
图1 诱导过程中树突状细胞的形态Fig.1 The morphology of induced dendritic cells in process (10×)
2.2奶牛树突状细胞表型鉴定
由图2和图3可知,贴壁的单核细胞经过GM-CSF和IL-4细胞因子6 d诱导之后,CD14阳性表达细胞占诱导细胞的6.8%,然而,CD11c阳性表达细胞占诱导细胞的65.0%,MHCⅡ阳性表达细胞占诱导细胞的75.9%。结果表明,刚开始贴壁的单核细胞已大部分被诱导为树突状细胞。然而,树突状细胞在体内有2种状态。一般情况下,树突状细胞在体内呈现为成熟状态,在血液中监视外来入侵者,一旦发现体内有外来入侵抗原,成熟细胞立刻启动免疫应答,此时未成熟的树突状细胞变为成熟的树突状细胞。鉴定树突状细胞是否成熟的表面标志抗原为CD80和CD86。由图4可知,CD80和CD86表面抗原分子阳性表达细胞占诱导细胞的分别占诱导细胞2.0%和1.2%,说明诱导的树突状细胞呈现未成熟状态,此时,它能高效地摄取、加工处理抗原。同时,未成熟树突状细胞具有较强的迁移能力。然而,成熟树突状细胞能有效激活初始型T细胞,处于启动、调控和维持体内自身免疫应答。
3讨论
3.1奶牛树突状细胞的培养和形态分析
树突状细胞是由加拿大科学家斯塔曼于1973年发现的,是目前所知的功能最强的抗原提呈细胞,由于其形态伸出许多树突样或伪足样刺突而得名[8]。同时,它对诱导初次免疫应答具有独特的功能,未成熟的树突状细胞在对抗原的摄取、加工和处理具有很强的作用,成熟的树突状细胞对抗原的摄取和加工则减弱[9]。由于它在机体的细胞免疫及唯一能够激活初始型T细胞免疫应答中的作用而成为研究治疗疾病重要手段之一。然而,树突状细胞在畜牧领域中研究较少,尤其是利用树突状细胞来治疗奶牛乳房炎未见报道。奶牛乳房炎一直是困扰着奶业发展重要阻碍之一。目前,治疗奶牛乳房炎一般是利用大量的抗生素进行治疗,这样病原菌会对抗生素产生耐药性。更为重要的是奶牛乳腺所产的奶中也会有抗生素残留,从而给人类健康带来不利影响。Guermonprez等[7]利用树突状细胞与疟原虫感染期间能够激活T细胞的免疫应答,从而有效地抑制了疟原虫的生长。Schreiner等[6]利用金黄色葡萄球菌的苯酚肽能够调节树突状细胞的功能并在体外活化初始型调节性T细胞。Lei等[10]利用树突状细胞与分歧杆菌亚种类结核在体外共培养并感染树突状细胞,发现被类结核感染的奶牛树突状细胞的功能和活性受损,结果表明类结核感染的树突状细胞将限制树突状细胞的表型和功能。Cruz-Adalia等[11]在研究小鼠树突状细胞俘获抗原并呈递给T细胞,最终T细胞能够杀死细菌和给予小鼠免疫保护。树突状细胞起源于造血干细胞主要来源于2条途径:骨髓样干细胞在GM-CSF和IL-4的刺激下分化为树突状细胞,称为骨髓样树突状细胞,它与单核细胞和粒细胞有共同的前体细胞,包括朗格汉斯细胞、表皮树突状细胞以及单核细胞分化而来的树突状细胞。其次,是来源于淋巴样干细胞,称为淋巴样树突状细胞[12]。它与T细胞和自然杀伤细胞有共同的前体细胞。在体内外周血中树突状细胞数量不足外周血单核细胞的1%,然而,表面具有丰富的抗原递呈分子主要组织相容性复合体Ⅰ(MHCⅠ)和MHCⅡ以及共刺激因子CD40、CD40L、CD80和CD86,是功能强大的专职抗原递呈细胞。但是,骨髓样和淋巴样的树突状细胞的形态和功能也不尽相同。本试验结果表明诱导的树突状细胞在第6天时,显微镜下呈现典型的树突起的形态特征,细胞表面的刺突明显,表明细胞膜表明具有大量的捕获抗原的受体。
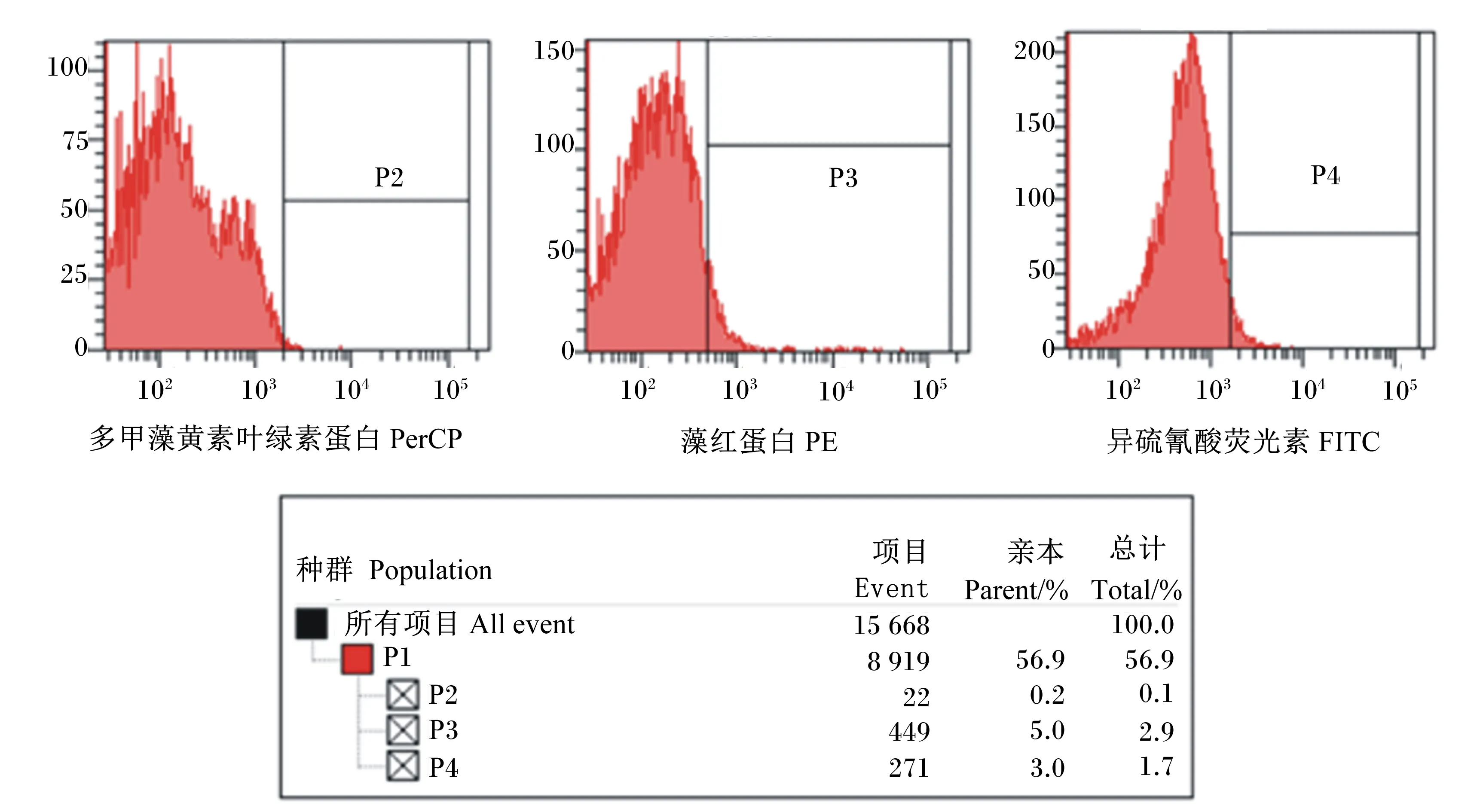
P1为门水平阳性表达细胞总数;P2、P3、P4均为对照的阳性表达细胞数。
P1 was total positively expressed cell count at phylum level; P2,P3 and P4 were positively expressed cell count of control.
图2同型对照
Fig.2Isotype control
3.2奶牛树突状细胞鉴定
通过单核细胞添加GM-CSF和IL-4细胞因子在体外获得树突状细胞是最好的选择。然而,从骨髓和外周血来源的树突状细胞的表型并不一致。Borkowski等[13]和Galy等[14]指出人和小鼠的树突状细胞存在2种不同的世系,即髓系和淋巴系的树突状细胞。本试验的结果表明,从外周血单核细胞诱导获得的树突状细胞的表型为CD11c+/CD14-。Miyazawa等[15]在奶牛外周血的树突状细胞表型研究中,得出奶牛外周血来源的树突状细胞表型为CD11c+/CD172A+,从鉴定的表型显示此树突状细胞为髓样树突状细胞。来自于胸腺的奶牛树突状细胞表型为CD1+/CD172Aa+,进一步表明髓样的树突状细胞缺乏CD1分子。在小鼠来源的外周血树突状细胞中也被报道都表达CD11c分子[16]。Renjifo等[17]在奶牛外周血中也能检测到外周血树突状细胞表达CD11c分子。这些结果表明,CD11c+能够作为外周血树突状细胞表型标志。一般来说,具有功能的树突状细胞是具有能够激活初始型T细胞和初始型免疫反应。树突状细胞在黏膜免疫系统具有重要的作用,如肠道黏膜和乳腺组织经常受到外来病原菌的攻击[18],尤其奶牛乳腺受到病原菌的感染之后,引起乳腺组织局部红肿,这是由于大量的淋巴细胞和细胞因子迁移至乳腺感染部位进行免疫应答所产生的生理反应。乳腺受到细菌感染之后,首先,定居在乳腺组织的淋巴细胞,如树突状细胞和自然杀伤细胞俘获抗原,立即启动免疫应答来杀伤病原菌。同时,乳腺上皮细胞也遭到细菌致命的损坏,最终,引起奶牛乳房炎导致产奶量下降。因此,营养与免疫的结合对于畜牧发展产生深远影响。尤其是近来树突状细胞对外来抗原的俘获、加工并呈递至淋巴结的T细胞区进行杀伤作用。本试验研究结果表明在体外通过外周血单核细胞诱导的树突状细胞的表型为CD11c+/CD14-/CD80-/CD86-,为典型的未成熟的树突状细胞,因此,可作为细胞免疫疗法的细胞素材来治疗奶牛乳房炎。
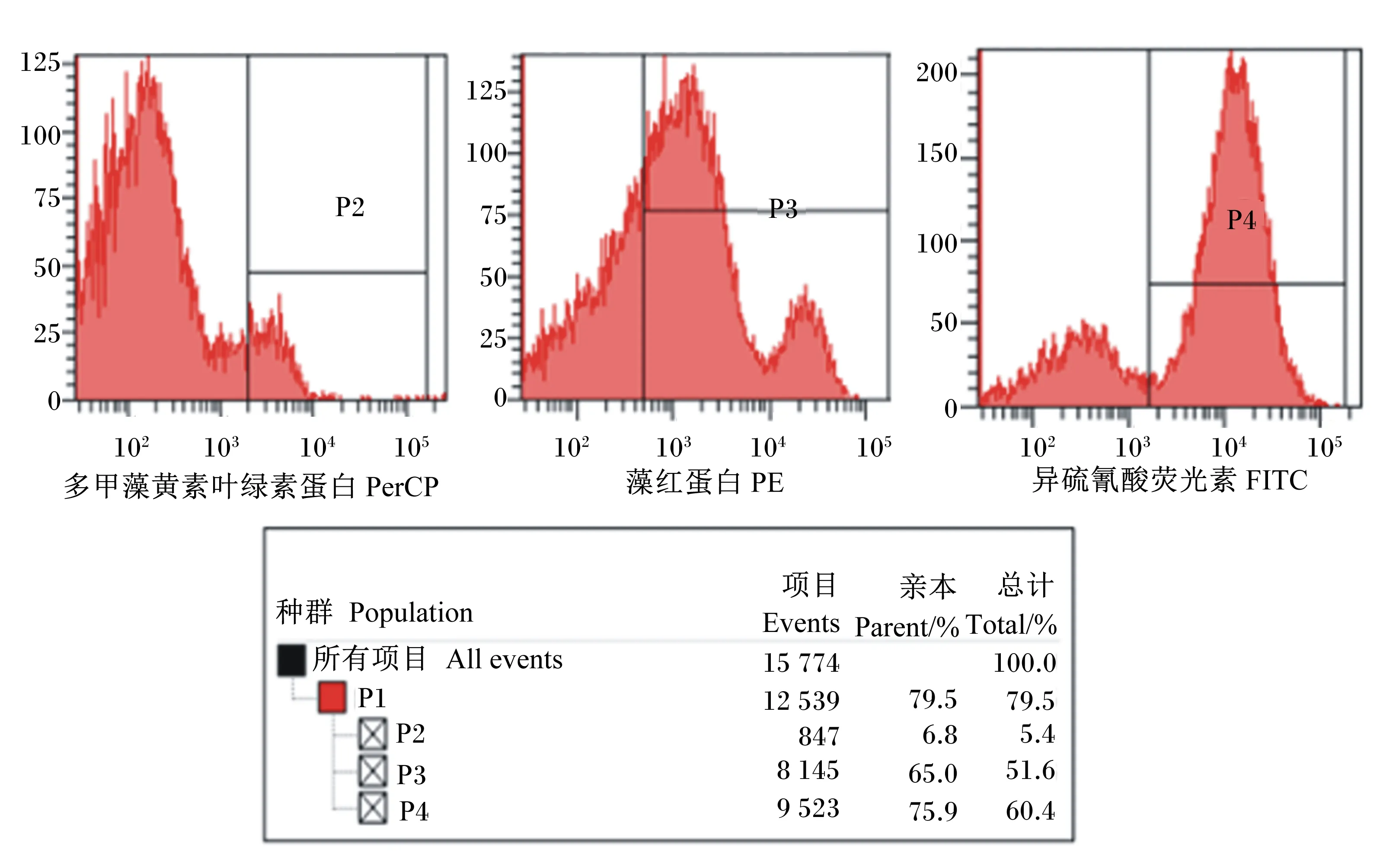
P1为门水平阳性表达细胞总数;P2为CD14阳性表达细胞数;P3为CD11c阳性表达细胞数;P4为MHC II阳性表达细胞数。
P1 was total positively expressed cell count at phylum level; P2 was CD14 positively expressed cell count; P3 was CD11c positively expressed cell count; P4 was MHCⅡ positively expressed cell count.
图3CD14、CD11c和MHCⅡ阳性表达细胞占诱导细胞的比例
Fig.3The percentage of CD14, CD11c and MHCⅡ positively expressed cells in induced cells
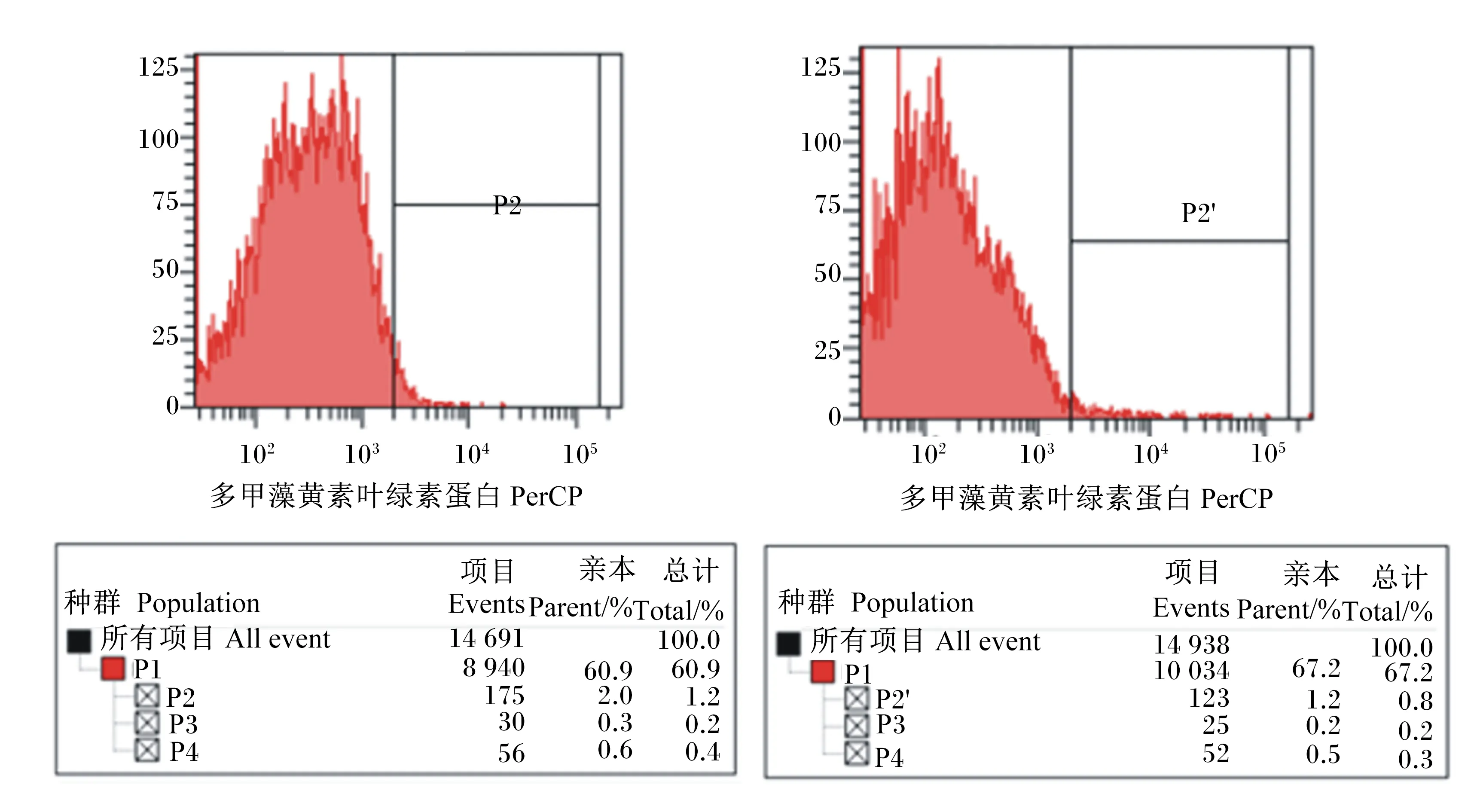
P1为门水平阳性表达细胞总数;P2为CD80阳性表达细胞数;P2′为CD86阳性表达细胞数。
P1 was total positively expressed cell count at phylum level; P2 was CD80 positively expressed cell count; P2′ was CD86 positively expressed cell count.
图4CD80和CD86阳性表达细胞占诱导细胞的比例
Fig.4The percentage of CD80 and CD86 positively expressed cells in induced cells
4结论
① 通过6 d对外周血单核细胞诱导树突状细胞的体外培养,细胞表面含有大量清晰可见的刺突,同时,细胞向外围延伸并长出树枝的伪足。
② 通过流式检测诱导细胞的表型,得出CD14、CD11c、MHCⅡ阳性表达细胞分别占诱导细胞的6.8%、65.0%、75.9%,CD80和CD86阳性表达细胞分别占诱导细胞的2.0%和1.2%,表明单核细胞已被诱导为树突状细胞且是未成熟的树突状细胞。
③ 采用奶牛外周血单核细胞经体外诱导能够获得一定纯度的奶牛树突状细胞。
参考文献:
[1]MELLMAN I,STEINMAN R M.Dendritic cells:specialized and regulated antigen processing machines[J].Cell,2001,106(3):255-258.
[2]WOO S R,CORRALES L,GAJEWSKI T F,et al.The STING pathway and the T cell-inflamed tumor microenvironment[J].Trends in Immunology,2015,36(4):250-256.
[3]马燕芬,宋利文,高民,等.氧化应激对围产期奶牛乳房炎的影响及其调控机制[J].动物营养学报,2015,27(3):671-676.
[4]李幼平.树突状细胞与移植免疫耐受研究进展[J].生物医学工程学杂志,1997,14(4):383-387.
[5]WERLING D,HOPE J C,CHAPLIN P,et al.Involvement of caveolae in the uptake of respiratory syncytial virus antigen by dendritic cells[J].Journal of Leukocyte Biology,1999,66(1):50-58.
[6]SCHREINER J,KRETSCHMER D,KLENK J,et al.Staphylococcusaureusphenol-soluble modulin peptides modulate dendritic cell functions and increaseinvitropriming of regulatory T cells[J].Journal of Immunology,2013,190(7):3417-3426.
[7]GUERMONPREZ P,HELFT J,CLASER C,et al.Inflammatory Flt3L is essential to mobilize dendritic cells and for T cell responses duringPlasmodiuminfection[J].Nature Medicine,2013,19(6):730-738.
[8]STEINMAN R M,COHN Z A.Identification of a novel cell type in peripheral lymphoid organs of mice[J].Journal of Experimental Medicine,1973,137(5):1142-1162.
[9]STEINMAN R M,HEMMI H.Dendritic cells:translating innate to adaptive immunity[J].Current Topics in Microbiology and Immunology,2006,311:17-58.
[10]LEI L Y,HOSTETTER J M.Limited phenotypic and functional maturation of bovine monocyte-derived dendritic cells followingMycobacteriumaviumsubspecies paratuberculosis infectioninvitro[J].Veterinary Immunology and Immunopathology,2007,120(3/4):177-186.
[11]CRUZ-ADALIA A,RAMIREZ-SANTIAGO G,CALABIA-LINARES L C,et al.T cells kill bacteria captured by transinfection from dendritic cells and confer protection in mice[J].Cell Host & Microbe,2014,15(5):611-622.
[12]LIU Y J.Dendritic cell subsets and lineages,and their functions in innate and adaptive immunity[J].Cell,2001,106(3):259-262.
[13]BORKOWSKI T A,LETTERIO J J,FARR A G,et al.A role for endogenous transforming growth factor β1 in Langerhans cell biology:the skin of transforming growth factor β1 null mice is devoid of epidermal Langerhans cells[J].Journal of Experimental Medicine,1996,184(6):2417-2422.
[14]GALY A,TRAVIS M,CEN D Z,et al.Human T,B,natural killer,and dendritic cells arise from a common bone marrow progenitor cell subset[J].Immunity,1995,3(4):459-473.
[15]MIYAZAWA K,ASO H,HONDA M,et al.Identification of bovine dendritic cell phenotype from bovine peripheral blood[J].Research in Veterinary Science,2006,81(1):40-45.
[16]LIPSCOMB M F,MASTEN B J.Dendritic cells:immune regulators in health and disease[J].Physiological Reviews,2002,82(1):97-130.
[17]RENJIFO X,HOWARD C,KERKHOFS P,et al.Purification and characterization of bovine dendritic cells from peripheral blood[J].Veterinary Immunology and Immunopathology,1997,60(1/2):77-88.
[18]段杰林,杨冠,尹杰,等.肠道树突状细胞的作用机制及益生菌对其影响[J].动物营养学报,2013,25(1):26-35.
(责任编辑王智航)
doi:10.3969/j.issn.1006-267x.2016.07.024
收稿日期:2016-01-12
基金项目:江苏省高校优势学科建设工作资助项目(PAPD);国家自然科学基金(31572430)
作者简介:詹康(1988—),男,江苏南京人,博士研究生,从事动物分子营养研究。E-mail: zhankang0305@163.com *通信作者:赵国琦,教授,博士生导师,E-mail: gqzhao@yzu.edu.cn
中图分类号:S852.2
文献标识码:A
文章编号:1006-267X(2016)07-2184-07
*Corresponding author, professor, E-mail: gqzhao@yzu.edu.cn
Bovine Peripheral Blood Monocyte Derived Dendritic Cell Culture and IdentificationinVitro
ZHAN KangZHAO QianmingSUI YannanFENG FeifeiZHAN JinshunZHAO Guoqi*
(College of Animal Science and Technology, Yangzhou University, Yangzhou 225009, China)
Abstract:This study aimed to induce bovine peripheral blood monocyte derived dendritic cell by granulocyte-macrophage colony stimulating factor (GM-CSF) and interleukin-4 (IL-4) cytokines, which could lay foundation and provide cell model for dairy cow mastitis treatment using cell immunotherapy. The bovine peripheral blood monocyte was acquired by lymphocyte separation medium and seeded in 6-proe plate to culture for 2 h. Then, suspended cells containing an amount of B and T cells were discarded, and adherent cells were mostly monocyte. The cells were washed for 5 times using phosphate buffer, and 2 mL culture medium containing GM-CSF and IL-4 cytokines was added to culture for 3 d. After that, 1.4 mL culture medium was discard from medium top, and 1.8 mL culture medium containing GM-CSF and IL-4 was added to culture for another 3 d. The cell was observed under microscope every day. On days 7, the cells were harvested to detect CD11c, CD14, major histocompatibility complex Ⅱ (MHCⅡ), CD40, CD80 and CD86 molecules by flow cytometry. The result showed as follows: 1) on days 2, some of the cells started to extend spikes and accompanied by pseudopodia stretching. On days 3, the spikes and pseudopodia grew more and more. On days 4 and 5, cells with spikes and pseudopodia started aggregation and fusion. On days6, most of monocytes were derived to dendritic cells, on which plenty of spikes and pseudopodia could be clearly seen. 2) CD14, CD11c, MHCⅡ, CD80 and CD86 positively expressed cells accounts for 6.8%, 65.0%, 75.9%, 2.0% and 1.2% of induced cells by flow cytometry, respectively. In conclusion, bovine peripheral blood monocytes can be derived to dendritic cells with certain purity.[Chinese Journal of Animal Nutrition, 2016, 28(7):2184-2190]
Key words:cellular immune treatment; monocyte; dendritic cell; bovine mastitis

