新疆盐生植物芦苇根围AM真菌的空间分布特征
李桂真,陈志超,李新川,盛建东,黄长福,金俊香
(1.新疆土壤与植物生态过程重点试验室,新疆农业大学草业与环境科学学院,新疆 乌鲁木齐 830052;2.河南理工大学测绘与国土信息工程学院,河南 焦作 454000)
新疆盐生植物芦苇根围AM真菌的空间分布特征
李桂真1,陈志超2,李新川1,盛建东1,黄长福1,金俊香1
(1.新疆土壤与植物生态过程重点试验室,新疆农业大学草业与环境科学学院,新疆 乌鲁木齐 830052;2.河南理工大学测绘与国土信息工程学院,河南 焦作 454000)
摘要:为了揭示新疆盐生植物根围AM真菌的空间分布特征,本研究以新疆北疆3个典型区域的盐生植物芦苇(Phragmites australis)为研究对象,分别在0-10、10-20、20-30、30-40和40-50 cm 5个土层采集根围土壤样品,研究AM真菌的空间分布及其土壤因子的相关性。结果表明,盐碱化是AM真菌在盐碱土中空间分布的重要限制因子,但AM真菌可与芦苇共生,AM真菌各项指标在盐渍地中的分布具有显著的空间特征。AM真菌侵染率、侵染强度在3个样地间存在显著差异(P<0.05),并随土层加深呈降低趋势,其最大值均出现在0-10 cm土层;孢子密度随土层深度增加而降低,最高值出现在0-20 cm土层;孢子密度与土壤pH、电导率、速效K呈极显著负相关(P<0.01);AM真菌侵染率、侵染强度、菌丝丰度、丛枝丰度与速效K、速效P呈极显著正相关(P<0.01),侵染强度、菌丝丰度和丛枝丰度与有机质呈极显著负相关(P<0.01)。本研究结果对利用盐生植物AM真菌资源,促进盐渍化草地植被恢复和生态重建方面具有一定的价值。
关键词:盐生植物;芦苇;AM真菌;空间分布
新疆是我国土壤盐碱化、盐渍化较为严重的地方之一,盐渍化土地面积达11万km2,占全区土地面积的7%。广袤的盐渍土生境生长着种类众多的盐生植物,芦苇(Phragmitesaustralis)是盐渍化生境中的自然植被之一,也是新疆盐化草甸的主要建群种之一。芦苇适应性广、抗逆性强,从盐化沼泽土、盐化草甸土到典型盐土或者残余盐土都有生长,是新疆宝贵的生物资源。盐生植物对于维持新疆盐渍土-荒漠-绿洲复合生态系统平衡,促进区域经济发展起着重要的作用[1]。
丛枝菌根(arbuscular mycorrhiza,AM)真菌可增强植物抗胁迫能力[2],在提高植物存活率和促进生长发育方面有相对优势[3]。研究发现,接种AM真菌可提高宿主植物叶片叶绿素含量[4],促进植物生长调节物质和渗透调节物质的产生[5],提高植物抗过氧化酶活性[6],使Na+在植物根部累积,增强植物耐盐碱能力,减少地上部盐害[7]。此外,土壤盐碱度不但对植被的分布有影响,而且决定AM真菌对植物根系的侵染能力及其生物多样性[8]。
在河北安新县3个自然生境下,AM真菌均能与芦苇共生[9],AM真菌孢子密度和侵染情况与样地的立地条件和土壤因子密切相关,但盐渍化草地上芦苇根围AM真菌有哪些特征,需要进一步的研究。本研究选取北疆玛纳斯县、阜康市、乌鲁木齐周边3个不同盐渍化程度草地,对其芦苇根围土壤AM真菌的空间分布进行调查,以期为盐碱化草地AM真菌种质资源的开发及菌根生物技术在盐生植物芦苇生长和植被恢复中的利用提供依据。
1材料与方法
1.1研究区域概况
根据新疆不同程度盐碱化草地分布特征,选取玛纳斯县北五岔镇、阜康市西部准东基地、乌鲁木齐市柴窝堡湖周边盐渍化草地作为3个试验样地,它们分别位于准噶尔盆地的上部、中部、下部(表1)。

表1 样地概况Table 1 Introduction of different sites
1.2样品采集
在3个样地随机选取3株生长良好的芦苇植株,在距植株0-30cm范围内,分别在0-10、10-20、20-30、30-40和40-50 cm土层采集根围土壤样品(约 l kg)和根样各1份,每个样品重复3次,并将每个样品贴上标签,装入隔热性能良好自封袋排气密封,详细记录采样人、采样时间、地点、气候、海拔、地形及植被等信息。将土样带回室内,阴凉处保存。
1.3试验方法
1.3.1菌根侵染状况的测定根据Phillips和Hayman[10]的方法对植物根系进行染色,随机取30条根段裱糊在有PVLG作为浮载剂的载玻片上[11],在放大100~400倍的显微镜下观测。根据Trouvelot[12]的方法,按丛枝丰度和菌根侵染分级标准输入等级参数,用MYCOCALC软件计算菌根侵染强度、侵染率、泡囊丰度、菌丝丰度和丛枝丰度。
1.3.2土壤中孢子分离及孢子密度测定孢子密度是将土壤样品混匀,用四分法取土样100 g,采用湿筛倾析-蔗糖离心法[13]筛取孢子,在体视显微镜下于培养皿分格计数。
1.3.3土壤基本性质测定土样在实验室进行理化性质测定,土壤速效磷采用NaHCO3浸提-钼锑抗比色法测定,土壤有机质采用KCr2O7容量法测定,土壤pH值采用精密酸度计测定,土壤速效钾采用火焰分光光度计法测定,土壤电导率采用电导率仪测定,土壤碱解氮采用碱解扩散法[14]测定。
1.4数据统计分析
采用SPSS 20.0 统计分析软件对侵染率、丛枝丰度、孢子密度等侵染指标和土壤有机质、速效P、速效K等土壤理化性质指标,试验数据进行单因素方差分析(ANVOA)、Pearson相关性分析,用Excel 2010作图。
2结果与分析
2.1芦苇根围AM真菌侵染情况及真菌各项指标的空间分布
芦苇根围AM真菌分布和侵染情况受土层深度的影响,AM真菌孢子密度和侵染状况在不同土壤深度明显不同(表2)。
3个样地的菌根侵染率随土层的加深基本呈下降趋势,最大值均出现在0-10 cm,最小值在40-50 cm土层。3个样地0-10cm侵染率均显著高于其它各土层的(P<0.05),其中北五岔镇和柴窝堡湖样地10-30 cm各土层的显著高于30-50 cm各土层的(P<0.05),准东10-40 cm各土层的显著高于40-50 cm各土层的(P<0.05)。

表2 芦苇根围AM真菌的空间分布Table 2 Spatial distribution of arbuscular mycorrhizal fungi in the rhizoposphere of Phragmites australis
注:同列同一样地数据后不同小写字母表示不同土层间差异显著(P<0.05)(n=12)。
Note: Different lower case letters within the same column mean significant difference among different soil layers at the same site at 0.05 level.
北五岔镇和柴窝堡湖的侵染强度随土层加深呈下降趋势,准东的侵染强度0-30 cm各土层内呈下降趋势,30-40 cm显著高于20-30和40-50 cm各土层的。准东和柴窝堡湖样地AM真菌的侵染强度0-20 cm各土层显著高于20-50 cm各土层的(P<0.05),北五岔镇样地0-10 cm土层的显著高于10-50 cm各土层的(P<0.05)。整体上看,AM真菌的侵染强度表现为准东>柴窝堡湖>北五岔镇。
3个样地中只有准东出现丛枝结构,丛枝丰度不高;而北五岔镇和柴窝堡湖没有出现丛枝结构。泡囊结构也只有柴窝堡湖出现,其它两个样地没有发现泡囊。
3个样地的菌丝丰度也都随着土层深度增加呈下降趋势;最高值除柴窝堡湖出现在10-20 cm外,均出现在0-10 cm土层。准东和柴窝堡湖样地AM真菌的菌丝丰度0-20 cm各土层显著高于20-50 cm各土层的(P<0.05),北五岔镇样地0-10 cm土层的显著高于其它土层的(P<0.05)。整体上看,准东的菌丝丰度高于北五岔镇和准东的。
从空间分布来看,孢子密度均是随着土层深度增加而降低,最高值出现在0-20 cm土层,柴窝堡湖出现在10-20 cm土层,其余的出现在0-10 cm土层;准东0-10 cm土层的显著高于20-50 cm各土层的(P<0.05);北五岔镇和柴窝堡湖0-20 cm土层的显著高于40-50 cm土层的(P<0.05);从样地来看,柴窝堡湖的孢子密度高于北五岔镇和准东的。
2.2不同样地土壤因子空间分布
随样地的不同和土壤深度的改变,土壤因子有明显空间变化,土壤各项理化性质指标也随之发生变化(图1)。北五岔镇和准东的pH在土层间无显著差异(P>0.05),北五岔镇的pH随土层加深呈先下降再上升,准东呈先上升再下降再上升趋势;柴窝堡湖的pH在0-10和20-30 cm土层的显著高于40-50 cm土层的(P<0.05),与10-20和30-40 cm土层的无显著差异(P>0.05),并呈先下降再上升再下降趋势。
准东的电导率随土层的加深呈上升趋势,40-50 cm土层的显著高于0-10和10-20 cm土层的(P<0.05);北五岔镇和柴窝堡湖的电导率土层间无显著差异(P>0.05);北五岔镇的电导率呈先降低后升高再降低趋势,柴窝堡湖呈先降低后升高趋势。
准东速效磷0-10 cm土层的显著高于10 cm以下各土层的(P<0.05),随土层加深呈下降趋势,但40-50 cm土层较20-40 cm各土层略有上升(P>0.05);柴窝堡湖0-50 cm呈先升高再降低趋势,20-30 cm土层速效磷显著高于其它4个土层的(P<0.05);北五岔镇速效磷呈先降低后升高再降低趋势,在0-40 cm各土层间无显著差异(P>0.05)。
准东的速效钾0-10 cm土层显著高于10 cm以下各土层的(P<0.05),10-20、20-30和40-50 cm之间差异显著(P<0.05);柴窝堡湖的速效钾在土层间无显著差异(P>0.05),呈先降后升趋势;北五岔镇的速效钾随土层加深呈先降低后升高再降低趋势,0-40 cm各土层间无显著差异(P>0.05),0-10 cm土层的显著高于40-50 cm土层的(P<0.05)。
准东的有机质随土层加深呈逐渐降低趋势,0-20 cm各土层的显著高于20-50 cm各土层的(P<0.05);柴窝堡湖的有机质随土层加深呈先升高后降低的趋势,20-30和30-40 cm土层的显著高于0-10和10-20 cm土层的(P<0.05);北五岔镇的有机质土层之间无显著差异(P>0.05),呈先降低后升高再降低趋势。
柴窝堡湖和北五岔镇样地碱解氮土层间无显著差异(P>0.05);准东呈先降后升趋势,0-10 cm土层的显著高于20-30 cm土层的(P<0.05)。
2.3芦苇根围AM真菌指标与土壤因子的相关性分析
芦苇根围AM真菌指标和土壤因子相关性结果表明(表3),孢子密度与土壤pH、电导率、速效K都呈极显著负相关(P<0.01);侵染率、侵染强度、丛枝丰度、菌丝丰度与速效P、速效K呈极显著正相关(P<0.01),侵染强度、丛枝丰度和菌丝丰度与有机质呈极显著负相关(P<0.01);孢子密度与泡囊丰度呈极显著正相关(P<0.01)。
3讨论
3.1AM真菌能够适应高盐渍化土壤生境
盐渍生境中具有丰富的AM真菌资源,AM真菌能够侵染生长在盐渍生境中的大多数植物并形成菌根[15]。在位于欧洲中部内陆和边缘地区的盐碱地中有59 种盐生植物全部被 AM 菌根真菌侵染[16],松嫩盐碱草地和西北地区盐碱土也发现丰富的AM真菌资源[17-18],可见,AM真菌能够适应盐渍化土壤生境。本研究在北疆典型盐渍化生境中也发现芦苇可与AM真菌有共生关系,即使在重度盐渍生境中,也有AM真菌存在,但由于土壤的重度盐渍化,严重制约了植物和AM真菌的多样性,与河北等地[9]芦苇根围AM真菌侵染率和孢子密度相比相对较低,说明盐渍化程度可能是影响盐渍生境中AM真菌侵染状况的限制因子之一。内蒙古盐碱土具有丰富的AM真菌资源,不仅优势种芨芨草(Achnatherumsplendens)根围AM真菌有较高的侵染率,一些过去认为不被侵染的莎草科(Cyperaceae)和藜科(Chenopodiaceae)植物中,寸草(Carexduriuscula)、盐角草(Saliconiaeuropaea)也均有被侵染现象[19], 在松嫩盐碱草地上也存在类似现象[20]。这说明,在盐渍生境中植物对AM真菌的依赖性很大,AM真菌可以适应高盐渍化土壤生境,但其作用机理还需要进一步研究。

图1 各样地芦苇根围土壤因子空间分布Fig.1 Spatial distribution of soil fators in the rhizoposphere of Phragmites australis in different sites 表3 芦苇根围AM真菌指标及生态因子的相关性Table 3 Correlation analysis between AM fungi and soil factors in the rhizosphere of Phragmites australis
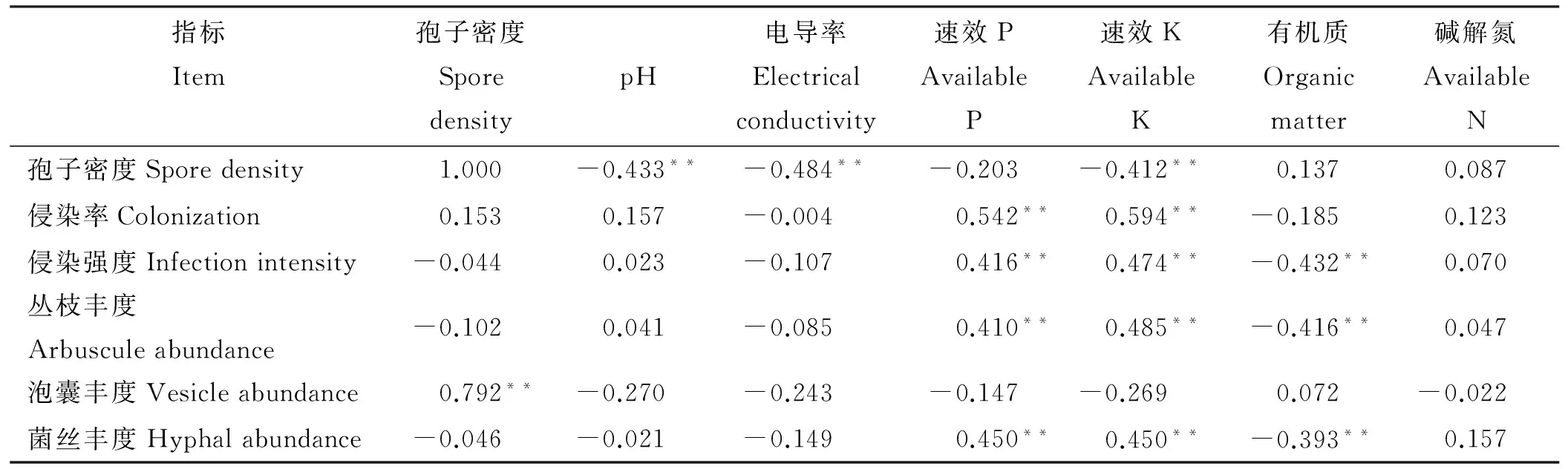
指标Item孢子密度SporedensitypH电导率Electricalconductivity速效PAvailableP速效KAvailableK有机质Organicmatter碱解氮AvailableN孢子密度Sporedensity1.000-0.433**-0.484**-0.203-0.412**0.1370.087侵染率Colonization0.1530.157-0.0040.542**0.594**-0.1850.123侵染强度Infectionintensity-0.0440.023-0.1070.416**0.474**-0.432**0.070丛枝丰度Arbusculeabundance-0.1020.041-0.0850.410**0.485**-0.416**0.047泡囊丰度Vesicleabundance0.792**-0.270-0.243-0.147-0.2690.072-0.022菌丝丰度Hyphalabundance-0.046-0.021-0.1490.450**0.450**-0.393**0.157
注: *和**分别表示两者显著(P<0.05)和极显著(P<0.01)相关。
Note: * and ** means significant correlation at 0.05 and 0.01 level, respectively.
3.2芦苇根围AM真菌共生关系及其空间分布特征
本研究表明,芦苇根围AM真菌平均侵染率为37.1%,最高为75.79%,孢子密度平均为26个·100 g-1,最高为184个·100 g-1。由此可见,AM真菌与芦苇能形成共生关系。这与杨磊和贺学礼[9]、贺学礼等[21]的研究结果类似。
芦苇根围AM真菌的侵染和分布具有明显的空间分布特征,均随土层的加深呈下降趋势,但侵染率和孢子密度在3个样地的不同土层变化不同,这可能是由于芦苇的根系在不同土层木质化和须根情况不同造成的。3个样地AM真菌的孢子密度最大值出现在0-20 cm土层,侵染率最大值出现在0-10 cm土层。这可能是因为AM真菌的菌丝和孢子的生长发育需要适宜的氧气和土壤湿度,而浅层土壤的通气性和土壤湿度相对比深层土壤高,有利于AM真菌菌丝的生长和产孢。王发园和刘润进[22]也发现,土壤养分、水分状况和通气特性直接影响土壤微生物的分布,土壤真菌对低氧环境较敏感。
从孢子密度和菌根侵染率来看,新疆盐生芦苇AM真菌的产孢能力和侵染活性不是特别强,其孢子密度为26个·100 g-1,平均侵染率为37.1%,相对于贺学礼等[21]检测到的克隆植物芦苇根围AM真菌侵染率和孢子密度来说较低。在伊朗的大不里士平原,随着盐浓度的增加,土壤中AM真菌的孢子数量不减反增[23],而本研究结果显示,随着土壤盐碱化程度的增加,芦苇根围AM真菌的孢子密度逐渐降低;在不同土壤类型条件下芦苇根围AM真菌侵染率具有明显的差异,其规律为盐化灰漠土>重度盐化草甸土>盐化沼泽土。本研究中,柴窝堡样地平均电导率低于另外两个样地的,对应的孢子密度却高于其它样地的,这与前人的研究结论[23]不一致,可能是因为3个采样地的盐碱度都非常高,植物长期处于“盐胁迫”环境中,影响了植物细胞的稳定性,进而破坏了细胞结构,影响菌株的正常生长,造成AM真菌的侵染情况和孢子密度都较低。
3.3土壤因子与AM真菌孢子密度、侵染率间的关系
大量研究表明,AM真菌侵染状况、孢子密度与土壤因子关系密切[24-26],本研究同样证实了这一点。本研究中,侵染率、侵染强度、丛枝丰度、菌丝丰度与速效P、速效K呈极显著正相关,孢子密度与土壤pH、电导率都呈极显著负相关,说明在盐渍化土壤条件下,一定范围内提高土壤肥力,有利于AM真菌菌根的形成和菌丝生长,而丛枝菌根的形成有可能是芦苇适应盐渍化环境的有效对策之一。
Rillig和Allen[27]认为土壤pH直接影响AM真菌菌根及产孢的形成,且AM真菌的有效性则随着pH值的不同而有较大变化。本研究中3个样地的pH值在7.6~9.1,说明在碱性-强碱性土壤中AM真菌也能与芦苇形成共生关系,而相关性分析显示,土壤pH与孢子密度呈极显著负相关,可见pH越高则可能抑制AM真菌的产孢和菌根的形成,这与岳英男和杨春雪[20]对松嫩盐碱草地AM真菌与土壤理化性质关系研究结果一致。
本研究中,柴窝堡湖样地的有机质最高,相应的AM真菌的孢子密度也最大,这可能是因为有机质高的土壤对菌根发育会有不同程度的促进作用,这与He等[28]对宁夏沙坡头地区沙冬青(Ammopiptanthusmongolicus)AM 真菌研究结果一致,但这种促进作用是有一定范围的[29]。
4结论
芦苇根围AM真菌的分布和侵染具有明显的空间异质性。AM真菌的侵染情况和孢子密度与土壤因子是密切相关的,AM真菌的孢子密度和侵染率受土壤条件的影响很大,特别是与土壤电导率的关系最为密切。事实上,AM真菌、寄主植物和环境之间是动态平衡体系,各环境因子之间是互相制约,互相联系的一个整体。在盐渍化这种极端环境下,土壤含盐量可能是主要限制因子,是影响盐碱化草地AM真菌侵染情况和孢子密度的重要因素。
本研究中,即使在电导率很高的情况下,仍然能观察到AM真菌,这反映了AM真菌在新疆重度盐碱化草地这种极端环境有适应性,同时也说明AM与盐生植物的内在关系对改善土壤盐碱化程度具有重要的科学价值,两者的互作机理需要进一步的科学研究。
参考文献References:
[1]郗金标,张福锁,毛达如,田长彦,董振成,王开芳.新疆盐生植物群落物种多样性及其分布规律的初步研究.林业科学,2006,42(10):6-12.
Xi J B,Zhang F S,Mao D R,Tian C Y,Dong Z C,Wang K F.Species diversity and distribution of halophytic vegetation in Xinjiang.Forest Research,2006,42(10):6-12.(in Chinese)
[2]Zandavalli R B,Dillenburg L R,Paulo V D.Growth responses ofAraucariaangustifolia(Araucariaceae)to inoculation with the mycorrihiza fungusGlomusclarum.Applied Soil Ecology,2004,25(3):245-255.
[3]Trimble M R,Knowles N R.Influence of vesicular-arbuscular mycorrhizal fungi and phosphorus on growth,carbohydrate partitioning and mineral nutrition of greenhouse cucumber(CucumissativusL.)plants during establishment.Canadian Journal of Plant Science,1995,75(1):239-250.
[4]杨海霞,徐萌,刘宁,郭绍霞.丛枝菌根真菌对两种草坪草耐盐性的影响.草业科学,2014,31(27):1261-1268.
Yang H X,Xu M,Liu N,Guo S X.Effects of arbuscular mycorrhizal fungi on salinity tolerance of two turfgrass.Pratacultural Science,2014,31(27):1261-1268.(in Chinese)
[5]Rabie G H.Influence of arbuscular mycorrhizal fungi and kinetin on the response of mungbean plants to irrigation with seawater.Mycorrhiza,2005,15(3):225-230.
[6]Ghorbanli M,Ebrahimzadeh H,Sharifi M.Effects of NaCl and mycorrhizal fungi on antioxidative enzymes in soybean.Biologia Plantarum,2004,48(4):575-581.
[7]Prasad A,Kurnar S,Khaliq A,Pandey A.Heavy metals and arbuscular myeorrhizal(AM)fungi can alter the yield and chemical composition of volatile oil of sweet basil (OcimumbasilicumL.).Biology and Fertility of Soils,2011,47:853-861.
[8] 蔡晓布,彭岳林,冯固.西藏高原草地植物AM真菌多样性及其环境影响因子研究.土壤学报,2005,42(4):641-650.
Cai X B,Peng Y L,Feng G.AM fungi diversity and their environmental factors in Altiplano grassland in Tibet.Acta Pedologica Sinica,2005,42(4):641-650.(in Chinese)
[9]杨磊,贺学礼.芦苇根际AM真菌生态学研究.河北农业大学学报,2006,29(3):29-32.
Yang L,He X L.Ecological research of arbuscular mycorrhizal fungi from the rhizosphere ofPhragmitescommunis.Journal of Agricultural University of Hebei,2006,29(3):29-32.(in Chinese)
[10]Phillips J M,Hayman D S.Improved procedures for clearing roots and staining parasitic and vesicular arbuscular mycorrhizal fungi for rapid assessment of infection.Transactions of the British Mycological Socity,1970(55):158-161.
[11]Koske R E,Tessier B.A convenient,permanent slide mounting medium.Mycological Society of America Newsletter,1983,34(2):59.
[12]Trouvelot T.Mesure du taux de mycorhization VA d’un systeme radiculaire.Recherche de methodes d’estimation ayant une signification functionnelle.In:Gianinazzi-Pearson V,Gianinazzi S.(eds).Mycorrhizae:Physiology & Genetics.Paris:INRA Press,1986:217-221.
[13]Daniels H B A,Skipper H D.Methods for the recovery and quantitative estimation of propagules from soil.In:Schenck N C.(ed).Method and Principles of Mycorrhiza Research.Minnesota:American Society for Phytopathology,1982:29-37.
[14]鲍士旦.土壤农化分析.北京:中国农业出版社,2005.
Bao S D. Agrochemical Soil Analysis.Beijing.China Agriculture Press,2005.
[15]Gareia I V,Mendoza R E.Arbuscular mycorrhizal fungi and plant symbiosis in a saline-sodic soil.Mycorrhiza,2007,17:167-174.
[16]Hildebrandt U,Janetta K,Ouziad F.Arbuscular mycorrhizal colonization of halophytes in Central European salt marshes.Mycorrhiza,2001,10(4):175-183.
[17]杨春雪,陈飞,岳英男,阎秀峰.松嫩盐碱草地26种植物根围丛枝菌根真菌多样性特征.草业科学,2015,32(12):2008-2020.
Yang C X,Chen F,Yue Y N,Yan X F.Diversity characteristics of arbuscular mycorrhizal fungi in the rhizosphere of twenty six species of plants in Songnen saline-alkaline grassland.Pratacultural Science,2015,32(12):2008-2020.(in Chinese)
[18]盛敏,唐明,张峰峰,黄艳辉.土壤因子对甘肃、宁夏和内蒙古盐碱土中AM真菌的影响.生物多样性,2011,19(1):85-92.
Sheng M,Tang M,Zhang F F,Huang Y H.Effect of soil fators on arbuscular mycorrhizal fungi in saline alkaline soils of Gansu,Inner Mongolia and Ningxia.Biodiversity Science,2011,19(1):85-92.(in Chinese)
[19]唐明,黄艳辉,盛敏,张峰峰,肖文发.内蒙古盐碱土中AM真菌的多样性与分布.土壤学报,2007,44(6):1104-1110.
Tang M,Huang Y H,Sheng M,Zhang F F,Xiao W F.Diversity and distribution of arbuscular mycorrhizal fungi in saline alkaline soil,Inner Mongolia.Acta Pedologica Sinica,2007,44(6):1104-1110.(in Chinese)
[20]岳英男,杨春雪.松嫩盐碱草地土壤理化特性与丛枝菌根真菌侵染的相关性.草业科学,2014,31(8):1437-1444.
Yue Y N,Yang C X.Relationship between soil properties and the colonization of arbuscular mycorrhizae in Songnen saline-alkaline grassland.Pratacultural Science,2014,31(8):1437-1444.(in Chinese)
[21]贺学礼,杨磊,唐宏亮,赵丽莉.克隆植物芦苇(Phragmitescommunis)生长对AM真菌时空分布的影响.自然科学进展,2007,17(7):978-983.
He X L,Yang L,Tang H L,Zhao L L.The temporal distribution of arbuscular mycorrhizal fungi growth onPhragmitescommunis.Progress in Natural Science,2007,17(7):978-983.(in Chinese)
[22]王发园,刘润进.环境因子对AM真菌多样性的影响.生物多样性,2001,9(3):301-305.
Wang F Y,Liu R J.Effects of environmental factors on the diversity of arbuscular mycorrhizal fungi.Biodiversity Science,2001,9(3):301-305.(in Chinese)
[23]Aliasgharzadeh N,Rastin S N,Towfighi H,Alizadeh A.Occurrence of arbuscular mycorrhizal fungi in salinity soils of Tabriz Plain of Iran in relation to some physical and chemical properties of soil.Mycorrhiza,2001,11:119-122.
[24]Feng H Y,Feng G,Wang J G,Li X L.Regulation of P status in host plant on alkaline phosphatase(ALP)activity in intraradical hyphae and development of extraradical hyphae of AM fungi.Mycosystema,2003,22(4):589-598.
[25]Dhillion S S,Zak J C.Microbial dynamics in arid ecosystems:Desertification and potential role of mycorrhizas.Revista Chilena de Historia Natural,1993,66:253-270.
[26]赵青华,孙立涛,王玉,丁兆堂,李敏.丛枝菌根真菌和施氮量对茶树生长、矿质元素吸收与茶叶品质的影响.植物生理学报,2014,50(2):164-470.
Zhao Q H,Sun L T,Wang Y,Ding Z T,Li M.Effects of abuscular mycorrhizal fungi and nitrogen regimes on plant growth,nutrient uptake and tea quality inCamelliasinensis(L.)O.Kuntze.Plant Physiology Journal,2014,50(2):164-470.(in Chinese)
[27]Rillig M C,Allen M F.What is the role of arbuscular mycorrhizal fungi in plant to ecosystem responses to elevated CO2.Mycorrhiza,1999,9(1):1-8.
[28]He X L,Liu X W,Li Y P.The spatio-temporal distribution of arbuscular mycorrhizal fungi in the rhizosphere ofAmmopiptanthusmongolicusfrom Shapotou.Acta Ecologica Sinica,2010,30(2):370-376.
[29]刘雪伟,贺学礼.沙坡头地区猫头刺根际AM真菌时空分布研究.河北农业大学学报,2008,31(5):52-56,65.
Liu X W,He X L.The patio-temporal distribution of arbuscular mycorrhizal fungi ofOxytropisaciphyllarhizophere in the area of Shapotou.Journal of Agricultural University of Hebei,2008,31(5):52-56,65.(in Chinese)
(责任编辑武艳培)
DOI:10.11829/j.issn.1001-0629.2015-0631
*收稿日期:2015-11-03接受日期:2016-02-24
基金项目:新疆农业大学草业科学国家重点学科开放课题(XJCYB-2013-03)
通信作者:盛建东(1973-),男,甘肃秦安人,教授,博导,博士,主要从事土壤质量空间变异和养分资源利用。E-mail:sjd_2004@126.com
中图分类号:S564+.2;Q945.78
文献标志码:A
文章编号:1001-0629(2016)7-1267-08*
Corresponding author:Sheng Jian-dongE-mail:sjd_2004@126.com
Spatial distribution characteristics of arbuscular mycorrhizal fungi in the rhizosphere of halophytesPhragmitesaustralisin Xinjiang
Li Gui-zhen1, Chen Zhi-chao2, Li Xin-chuan1, Sheng Jian-dong1, Huang Chang-fu1, Jin Jun-xiang1
(1.Xinjiang Key Laboratory of Soil and Plant Ecological Proceses, College of Grassland and Environmental Sciences, Xinjiang Agricultural University, Urumqi 830052, China;2.School of Surveying and Land Information Engineering, Henan Polytechnic University, Jiaozuo 454000, China)
Abstract:In order to elucidate the spatial distribution characteristics of arbuscular mycorrhizal fungi in rhizosphere of halophyte, roots and soil samples in the rhizosphere of Phragmites australis from three typical sites in northern Xinjiang were collected at 0-10, 10-20, 20-30, 30-40 and 40-50 cm depth. The results showed that AM fungi could form symbiotic relationship with P. australis although salinization was main limiting factor for spatial distribution of AM fungi. AM fungi colonization rates and spore density were significantly different in different depth of saline soil. Colonization and arbuscule abundance of AM fungi had significant difference among three sites, and gradually decreased with the increase of soil depth, which reached the maximum in the 0-10 cm layer. Spore density also decreased with the increase of soil depth, which had the highest spore densities in the layer of 0-20 cm. Correlation analysis showed that spore density had very significant negative correlation (P<0.01) with the soil pH, electrical conductivity and available K. Colonization rate, infection intensity, arbuscule and hypha abundance had very significant positive correlation (P<0.01) with soil available P and available K, but had very significant negative correlation (P<0.01) with soil organic matter. The results provided reference for the usage of halophytes AM fungi resources and promote the vegetation repair and ecological restoration in saline land.
Key words:halophytes; Phragmites australis; AM fungi; spatial distribution
李桂真,陈志超,李新川,盛建东,黄长福,金俊香.新疆盐生植物芦苇根围AM真菌的空间分布特征.草业科学,2016,33(7):1267-1274.
Li G Z,Chen Z C,Li X C,Sheng J D,Huang C F,Jin J X.Spatial distribution characteristics of arbuscular mycorrhizal fungi in the rhizosphere of halophytesPhragmitesaustralisin Xinjiang.Pratacultural Science,2016,33(7):1267-1274.
第一作者:李桂真(1983-),女,河南夏邑人,讲师,在读博士生,主要从事草地生态与植物营养方面的研究工作。E-mail:515291171@qq.com

