影像组学应用于肝脏特征分析及其预测治疗反应的初步研究
夏 凡,胡盼盼,王佳舟,胡伟刚,李桂超,章 真复旦大学附属肿瘤医院放疗科,复旦大学上海医学院肿瘤学系,上海 200032
影像组学应用于肝脏特征分析及其预测治疗反应的初步研究
夏凡,胡盼盼,王佳舟,胡伟刚,李桂超,章真
复旦大学附属肿瘤医院放疗科,复旦大学上海医学院肿瘤学系,上海 200032
[摘要]背景与目的:影像组学通过挖掘影像特征数据对组织特性进行判断,预测组织对治疗的反应和患者的预后。该研究旨在探索运用影像组学方法评估肝脏组织特征,以及预测化疗后肝功能异常的可行性。方法:回顾性收集胃癌患者化疗前腹部CT平扫图像,勾画全部肝脏,利用影像组学方法提取图像特征值并进行聚类分析。采用Pearson χ2检验分析聚类结果与患者临床特征的相关性,以及其与化疗后肝功能异常发生的相关性。结果:73例患者根据其图像特征聚类为两组,两组间性别构成比差异有统计学意义(P=0.004)。两组化疗后肝功能异常的发生率为48.7%和67.6%,相差为18.9%。临床参数如年龄、性别、化疗给药途径、化疗周期数、HBV感染史、化疗前血清HBsAg状态与化疗后肝功能异常发生率均无显著相关性。影像组学聚类分析预测,化疗后肝功能异常的准确性为0.59。结论:影像组学分析结果反应了不同性别人群肝脏影像学特征的差异,并可能有助于预测化疗后肝功能异常。影像组学用于评估肝脏组织特征以及预测治疗相关不良反应是可行的。
[关键词]影像组学;肝脏;聚类;性别;化疗相关肝损伤
近年来,随着肿瘤个体化治疗的发展,影像组学应运而生。影像组学利用自动化高通量的数据特征提取算法将影像数据转化为具有高分辨率的可挖掘的影像特征数据[1],通过这些数据挖掘描述组织特性。有研究报道,影像组学数据可以判断组织特性、对治疗的反应,并预测患者的预后[2-4]。应用影像组学数据对患者或肿瘤表型进行精确区分,可以成为对临床参数的一种有效补充。目前的研究多探索影像组学应用于肿瘤组织的分析,而用于评价正常组织特性及治疗并发症的较少[5]。因此,本研究探索运用影像组学分析评估肝脏组织的影像学特征,旨在评价这一方法是否有助于反映肝组织的临床特征,以及预测治疗相关的不良反应。
1 资料和方法
1.1病例资料
回顾性收集在本院初诊为胃癌并治疗的患者。入组标准为:① 患者年龄大于等于65岁(高龄组)或者小于等于45岁(低龄组);② 接受根治性或姑息性手术以及术后化疗;③ 化疗前行腹部CT扫描,并且CT诊断肝脏未见异常;④ 化疗前、期间及化疗后有血清生化检查结果,包括转氨酶和胆红素,化疗前基线指标均正常。2013年1月—2014年12月共入组73例,其中男性45例,女性28例;高龄组32例,低龄组41例。其临床资料分布情况见表1。
1.2图像采集和勾画
所有患者于化疗前行腹部CT平扫,采用64排螺旋CT(购自德国西门子公司),扫描层厚为5 mm,范围包括全部肝脏。CT图像上传到Eclipse(购自美国Varian公司)上进行肝脏的勾画。肝肝的勾画由一名经验丰富的放疗科医师完成,并由另一名放疗科医师进行检查。患者肝脏的勾画图像见图1。勾画之后,将医学数字成像和通信图像以及医学数字成像和通信勾画结构一起上传到MATLAB软件(购自美国Math Works公司)上进行纹理特征提取及分析。流程见图2。
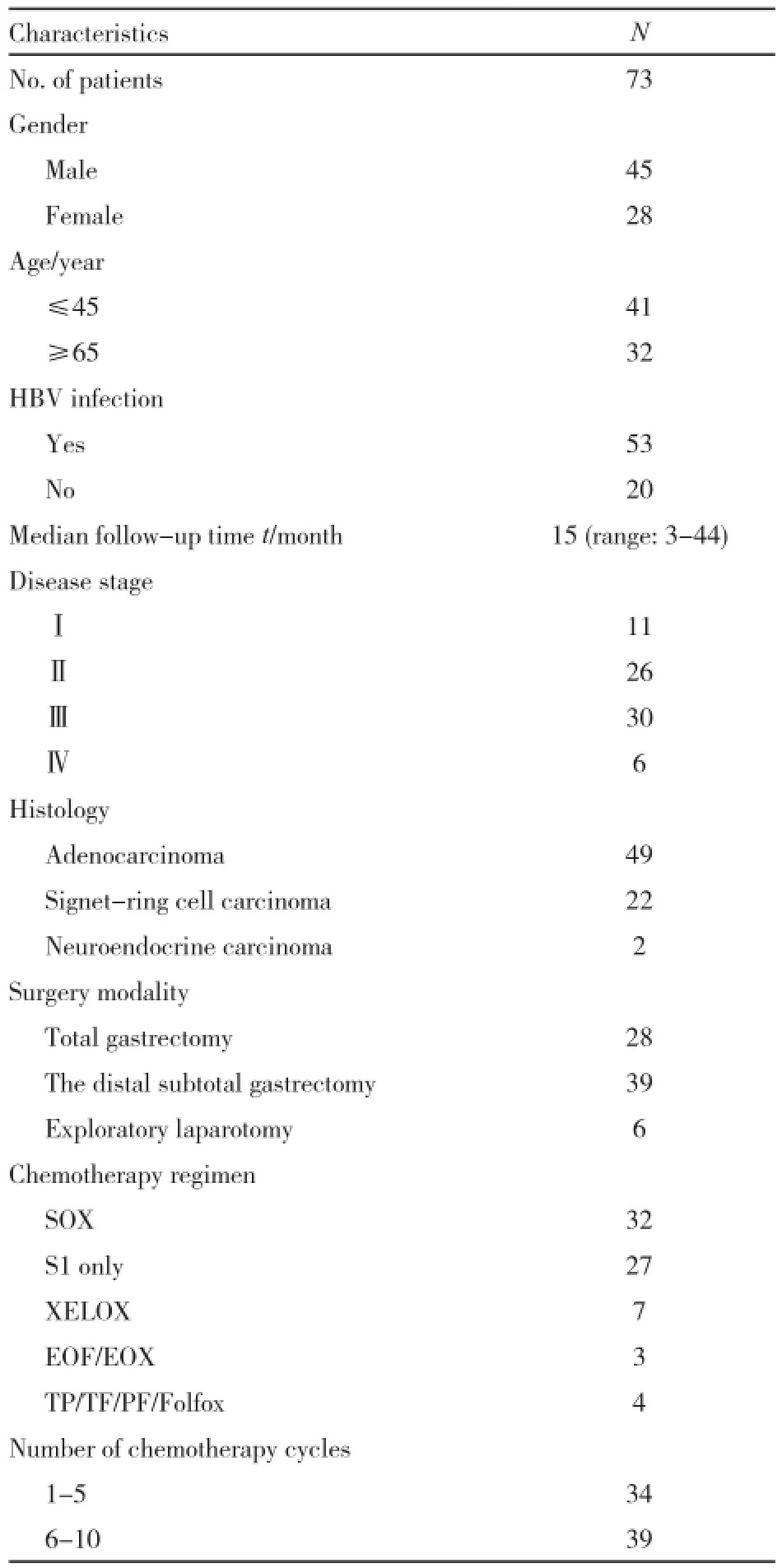
表1 病例临床资料Tab.1 Patient characteristics

图1 CT图像上勾画肝脏组织Fig.1 The delineation of liver on CT images
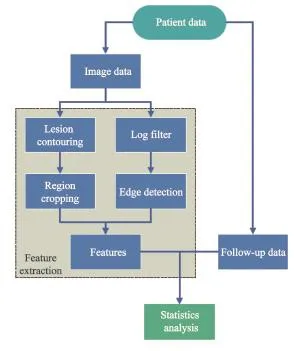
图2 影像组学分析流程Fig.2 Radiomics analysis workfow
1.3影像学特征提取及计算
本研究采用MATLAB软件进行特征提取。本课题组已经编写了经过验证的特征提取程序,提取灰度共生矩阵和灰度运行长度矩阵特征。所有特征均为特征的平均值(对肝的不同层面提取特征,并进行平均),并且所有的特征都进行了肝脏体积的归一化[6]。
将所得到的肝脏影像组学特征使用R软件进行Z-score归一化[6]。将归一化处理后的特征使用R软件进行聚类分析。
1.4肝功能评价
患者肝功能以血清生化检查结果进行评价,指标包括总胆红素(total bilirubin,TB)、直接胆红素(direct bilirubin,DB)、谷丙转氨酶(alanine transaminase,ALT),谷草转氨酶(aspartate aminotransferase,AST)、γ-谷氨酰转肽酶(γ-glutamyl transpeptadase,GGT)和碱性磷酸酶(alkaline phosphatase,ALP)。肝功能异常按CTCAE 3.0不良反应分级标准进行定义。
1.5统计学处理
影像组学聚类结果与患者临床特征之间的相关性采用Pearson χ2检验。患者的影像学特征、性别、年龄、化疗方案、化疗周期数、乙型肝炎病毒(hepatitis B virus,HBV)感染、乙型肝炎表面抗原(hepatitis B surface antigen,HBsAg)状态与化疗后肝功能异常的相关性采用Pearson χ2检验,并计算预测的准确度(accurate,ACC)值。统计检验用R软件(R3.2.2)实现。P<0.05为差异有统计学意义。
2 结 果
2.1影像组学特征值聚类分析
共提取了403个特征,根据重复性研究的成果,选取其中265个稳定特征进行分析。这些特征值反映了图像多方面信息,包括清晰度、粗细度和灰度相关性等,从而反映了组织内部结构的形状、密度、纹理规律和同质性等[5, 7-8]。每个患者均根据其化疗前肝脏CT图像特征值的相似性进行聚类。73例患者被归为两组,各有39和34例(图3)。

图3 聚类分析热图结果Fig.3 Radiomics heat map
2.2影像组学特征值聚类结果与性别显著相关
聚类结果显示两组中性别构成不同,聚类Ⅰ(cluster Ⅰ)中男性构成比为76.9%,而聚类Ⅱ(cluster Ⅱ)中男性构成比为44.1%,差异有统计学意义(P=0.004);而两组间高龄构成比为41.0% vs 47.1%,HBV感染阳性构成比为69.2% vs 76.5%,差异均无统计学意义(P>0.05,表2)。
2.3影像学特征可能有助于预测化疗后肝功能异常
73例患者中,化疗后出现肝功能异常共43例,发生率为59%;根据CTCAE 3.0化疗相关肝损伤标准,出现一级肝毒性为33例,二级肝毒性为10例。本研究分析了患者影像组学特征、年龄、性别、化疗给药途径、化疗周期数、HBV感染史、化疗前血清HBsAg状态与化疗后肝功能异常发生率的相关性,并计算了这些因素预测化疗后肝功能异常的ACC值。结果显示,这些临床因素均未与化疗后肝功能异常呈显著性相关;以影像组学特征值聚类的两组相比,虽然化疗后肝功能异常差异无统计学意义(P>0.05),但两组的发生率为48.7%和67.6%,差值达18.9%。聚类分析结果预测化疗后肝功能异常的准确性为0.59,高于年龄、性别、化疗周期数、HBV感染史和HBsAg状态预测化疗后肝功异常的准确性(表3)。

表2 聚类结果与临床特征的相关性分析Tab.2 Association of radiomic data with clinical data

表3 影像学及临床特征与化疗后肝功能异常的相关性分析Tab.3 Association of radiomic data and clinical factors with liver function abnormalities after chemotherapy
3 讨 论
与蛋白组学和基因组学手段相比,影像学方法具有独特的优势:① 不需要组织活检,是一种无创性检测手段;② 可以反映人体组织器官的整体特点,而非局限于可测量的组织样本。③ 影像学检查贯穿临床病例的诊断、治疗、随访全过程,是一种常规的、可多次使用的手段,可在不同的时间点进行重复检测。自2012年Lambin等[1]提出影像组学的概念之后,越来越多的研究尝试利用影像组学提取的数据来综合评价肿瘤的各种表型,包括组织形态、细胞分子、基因遗传等各个层次[2,4,9-10]。Aerts等[2]从1 019例肺癌和头颈部肿瘤患者的CT影像中提取了440个影像特征,其中包括了肿瘤的影像灰度分布、肿瘤的形状和纹理特征。结果显示,这些影像特征捕捉的肿瘤异质性,与肿瘤病理类型、T分期、基因表达的模式相关,并且与患者的预后有显著关联。Yoon等[4]分析了539例肺腺癌的CT特征,分析了肿瘤大小、位置、体积、密度和CT值,以及基于像素的纹理特征与基因表达模式的关系,发现这些影像特征在ALK基因阳性和ROS/RET融合基因阳性组有显著差别。这些研究均提示影像特征数据分析可以有效地区分肿瘤组织的分子表型。但迄今为止很少有研究对正常组织的影像学特征进行挖掘。
本研究对CT诊断为正常肝脏组织的图像进行特征提取,以265个稳定的图像特征进行聚类分析。采用非监督学习算法,所有数据只有特征向量没有标签,但是这些数据呈现出聚群的结构,一个相似的类型会聚集在一起,使得聚类结果能够稳定地反映出图像特征的本质[11]。聚类结果显示,两组之间的性别构成比有显著差异,提示不同性别人群的肝脏CT影像特征在整体上有差别。这一结果反映了影像组学提取的特征值在基因层面上区分了肝脏组织的表型,这是以往诊断性影像学提供的半定量信息所不能做到的,也提示了这一方法可能有助于从影像学角度解释不同性别人群肝脏疾病的发生、转归及预后等方面存在的差异[12]。
影像组学提取的量化特征数据也有助于预测正常组织因治疗引起的并发症。Cunliffe等[5]分析了106例接受胸部照射的患者CT图像提取的影像组学特征值,发现随着照射剂量的升高,某些特征值在治疗后发生了显著变化,且其变化与放射性肺炎的发生显著相关。与放射性肺炎类似,治疗相关肝脏损伤也是抗肿瘤治疗中常见的剂量限制性不良反应之一[13],尤其是在胃癌和肝癌患者接受放化疗过程中药物代谢给肝脏带来的负担,以及肝脏受到一定剂量放射线照射的情况下[14-15]。一般认为,除了治疗本身,患者自身因素如女性、高龄、基础肝病(如病毒性肝炎)可能是治疗相关性肝损伤的危险因子[16-18],但目前并无一种量化的指标可以有效地预测治疗性肝损伤的发生。因此,本研究选取了化疗前肝功能均正常的胃癌患者,排除了肝癌患者治疗前因肿瘤导致肝功能异常基线不一致的情况,并且选择高龄组(≥65岁)和低龄组(≤45岁),旨在比较影像学和临床参数对于化疗后肝功能异常的预测作用。结果显示,59%的患者化疗后出现酶指标或胆红素指标异常,相关分析显示,年龄、性别、化疗途径、化疗周期数、HBV感染史和化疗前血清HBsAg状态与化疗后肝功能异常发生率均无显著相关性。而影像学特征聚类的两组间,虽然化疗后肝功能异常的发生率差异无统计学意义,但两组的发生率为48.7% vs 67.6%,差值达18.9%。预测准确度为0.59,高于年龄、性别、化疗周期数和HBV感染等以往认为可能相关的临床因素,提示影像组学分析在预测化疗后肝功能异常方面可以作为临床参数的有效补充。考虑到本研究为回顾性,受临床数据和影像学数据完整性的限制,仅入组了73例,样本量较小,这一结果有待扩大样本量进一步验证。
本研究在报道了基于CT图像的影像组学分析反应了不同性别人群肝组织特征差异,并提示该方法可能有助于预测化疗后肝功能异常。目前影像组学在图像获取、重建、软件和算法方面仍需进行优化。本研究结果为影像组学方法用于肿瘤患者个体化治疗的可行性提供了依据。
[参考文献]
[1] LAMBIN P, RIOS-VELAZQUEZ E, LEIJENAAR R, et al. Radiomics: extracting more information from medical images using advanced feature analysis [J]. Eur J Cancer, 2012,48(4): 441-446.
[2] AERTS H J, VELAZQUEZ E R, LEIJENAAR R T, et al. Decoding tumour phenotype by noninvasive imaging using a quantitative radiomics approach [J]. Nat Commun, 2014, 5:4006. doi: 10.1038/ncomms 5006.
[3] WANG J, KATO F, OYAMA-MANABE N, et al. Identifying triple-negative breast cancer using background parenchymal enhancement heterogeneity on dynamic contrast-enhanced MRI: a pilot radiomics study [J]. PLoS One, 2015, 10(11):e0143308.
[4] YOON H J, SOHN I, CHO J H, et al. Decoding tumor phenotypes for ALK, ROS1, and RET fusions in lung adenocarcinoma using a radiomics approach [J]. Medicine (Baltimore), 2015, 94(41): e1753.
[5] CUNLIFFE A, ARMATO S G 3rd, CASTILLO R, et al. Lung texture in serial thoracic computed tomography scans:correlation of radiomics-based features with radiation therapy dose and radiation pneumonitis development [J]. Int J Radiat Oncol Biol Phys, 2015, 91(5): 1048-1056.
[6] FAVE X, MACKIN D, YANG J, et al. Can radiomics features be reproducibly measured from CBCT images for patients with non-small cell lung cancer? [J]. Med Phys, 2015, 42(12):6784.
[7] KARAHALIOU A, SKIADOPOULOS S, BONIATIS I, et al. Texture analysis of tissue surrounding microcalcifications on mammograms for breast cancer diagnosis [J]. Br J Radiol,2007, 80(956): 648-656.
[8] KNOGLER T, EL-RABADI K, WEBER M, et al. Threedimensional texture analysis of contrast enhanced CT images for treatment response assessment in Hodgkin lymphoma: comparison with F-18-FDG PET [J]. Med Phys, 2014,41(12): 121904.
[9] GUTMAN D A, DUNN W D Jr, GROSSMANN P, et al. Somatic mutations associated with MRI-derived volumetric features in glioblastoma [J]. Neuroradiology, 2015, 57(12):1227-1237.
[10] VAN STIPHOUT R G, VALENTINI V, BUIJSEN J, et al. Nomogram predicting response after chemoradiotherapy in rectal cancer using sequential PETCT imaging: a multicentric prospective study with external validation [J]. Radiother Oncol, 2014, 113(2): 215-222.
[11] JORDAN M I, MITCHELL T M. Machine learning: Trends,perspectives, and prospects [J]. Science, 2015, 349(6245):255-260.
[12] GUY J, PETERS M G. Liver disease in women: the influence of gender on epidemiology, natural history, and patient outcomes [J]. Gastroenterol Hepatol (N Y), 2013, 9(10):633-639.
[13] MAOR Y, MALNICK S. Liver injury induced by anticancer chemotherapy and radiation therapy [J]. Int J Hepatol,2013: 815105. doi: 10.1155/2013/815105. Epub 2013 Jul 17. [14] CHENG J C, LIU H S, WU J K, et al. Inclusion of biological factors in parallel-architecture normal-tissue complication probability model for radiation-induced liver disease [J]. Int J Radiat Oncol Biol Phys, 2005, 62(4): 1150-1156.
[15] LI G, WANG J, HU W, et al. Radiation-induced liver injury in three-dimensional conformal radiation therapy (3D-CRT)for postoperative or locoregional recurrent gastric cancer: risk factors and dose limitations [J]. PLoS One, 2015, 10(8):e0136288.
[16] HAQUE T, SASATOMI E, HAYASHI P H. Drug-induced liver injury: pattern recognition and future directions [J]. Gut Liver, 2016, 10(1): 27-36.
[17] AMACHER D E. Female gender as a susceptibility factor for drug-induced liver injury [J]. Hum Exp Toxicol, 2014,33(9): 928-939.
[18] BAHIRWANI R, REDDY K R. Drug-induced liver injury due to cancer chemotherapeutic agents [J]. Semin Liver Dis,2014, 34(2): 162-171.
DOI:10.19401/j.cnki.1007-3639.2016.06.007
中图分类号:R735.7
文献标志码:A
文章编号:1007-3639(2016)06-0521-06
收稿日期:(2015-12-01 修回日期:2016-03-12)
通信作者:章 真 E-mail: zhenzhang6@hotmail.com
Application of radiomics approach for decoding normal liver features and predicting chemotherapy-associated liver injury: A preliminary study
XIA Fan, HU Panpan, WANG Jiazhou, HU Weigang, LI Guichao, ZHANG Zhen
(Department of Radiation Oncology, Fudan University Shanghai Cancer Center;Department of Oncology, Shanghai Medical College, Fudan University, Shanghai 200032, China)Correspondence to: ZHANG Zhen E-mail: zhenzhang6@hotmail.com
[Abstract]Background and purpose: Radiomics refers to the comprehensive quantification of human tissues through assessing a large number of quantitative image features. Radiomics approach is used to decode tumor phenotypes and predict treatment outcomes. Here we present a study investigating radiomic analysis to assess normal liver features and predict chemotherapy-associated liver injury. Methods: Gastric cancer patients treated with surgery and adjuvant chemotherapy were enrolled in this study retrospectively. CT images were obtained before chemotherapy. The whole liver organ was delineated by radiation oncologists. Images were extracted and filtered by radiomic approach to extract radiomic features. Clustering was performed to reveal clusters of patients with similar radiomic expression patterns. Chi-squared tests were used to assess the association of radiomic data with clinical data and chemotherapy-related liver injury. Results: Radiomic features of 73 patients were clustered into two clusters. A significant association with gender (P=0.004, chi-squared test) was observed, where in male showed a higher presence in cluster Ⅰ. Incidence of abnormal liver function after chemotherapy was 48.7% in cluster I and 67.6% in cluster Ⅱ, respectively (Δ=18.9%). Clinical data including age, gender, chemotherapy modality, number of chemotherapy cycles, HBV infection history, HBs-antigen presence were not associated with liver function abnormalities after chemotherapy. Accuracy of radiomic analysis to predict liver injury is 0.59. Conclusion: Radiomic approach revealed different imaging features of liver between men and women. It could help to predict chemotherapy-associated liver injury. It is feasible to use radiomics approach to decode normal liver features and predict treatment-associated liver injury.
[Key words]Radiomics; Liver; Cluster; Gender; Chemotherapy-associated liver injury

