实时荧光LAMP技术快速检测变形杆菌
马桂芬,张蕴哲,付博宇,袁耀武,苑宁,王鑫,张伟,*(.河北农业大学食品科技学院,河北保定07000;.河北农业大学理工学院,河北沧州06000)
实时荧光LAMP技术快速检测变形杆菌
马桂芬1,张蕴哲1,付博宇1,袁耀武1,苑宁2,王鑫2,张伟1,*
(1.河北农业大学食品科技学院,河北保定071000;2.河北农业大学理工学院,河北沧州061000)
摘要:建立一种快速检测变形杆菌的方法。采用实时荧光LAMP(RealAmp)技术检测变形杆菌,分析GenBank中公布的变形杆菌atpD基因序列,针对其6个区域设计4条引物,利用实时荧光监测仪等温(62℃)扩增模板DNA,通过与电脑相连进行实时监测,对该方法检测变形杆菌的特异性、灵敏度、人工污染猪肉检出限等方面进行研究,并将该检测法的灵敏度与普通环介导等温扩增(LAMP)检测法进行比较。结果表明,RealAmp检测方法比普通LAMP检测方法更加方便快捷,20min内即可判定结果;用于特异性试验的19株试验菌株中,6株变形杆菌呈阳性结果,其他13株非变形杆菌均呈阴性结果;检测纯菌的灵敏度为8.1CFU/mL,是普通LAMP检测方法的10倍;人工污染猪肉的检出限为81CFU/mL。本研究建立的RealAmp检测方法操作简单,耗时短,特异性强、灵敏度高,能够实现对变形杆菌的快速检测。
关键词:实时荧光LAMP;LAMP;变形杆菌;检测;atpD基因
当前全球性食品安全问题受到的关注越来越多,世界卫生组织将控制食品污染和食源性疾病列为优先重点战略工作领域。变形杆菌是一种食源性条件致病菌,吃剩下的食物、食品沙拉和一些豆类制品,还有动物的内脏及肉、蛋类等一系列食品都很容易被变形杆菌污染,从而导致食物中毒。致使身体的抵抗力变弱,身体的某些部位极易被感染和病变,如:尿路感染、呼吸道感染、败血症,此外还能引起脑膜炎,腹膜炎,类风湿关节炎等疾病[1-2]。
在2000年,日本的荣研化学株式会Notomi等[3]研发出一种新型的能够在体外进行等温扩增核酸片段的技术——环介导等温扩增技术(Loop-mediated Isothermal Amplification,简称LAMP),这一技术的特点就是根据靶基因序列的6个位置区域,设计出4种具有特异性的引物(包扩外引物F3和B3及内引物FIP 和BIP),然后在DNA聚合酶(Bst DNA polymerase)的催化作用下等温(65℃左右)持续数十分钟,就能够完成核酸的扩增,这里使用的Bst DNA polymerase是具有强的链置换活性的。由于LAMP技术可以在恒温下实现模板的快速扩增且特异性和灵敏度较高,被广泛的应用,且尚在不断的发展。
实时荧光监测仪(ESE-Quant Tube Scanner)可对模板DNA进行等温扩增。实时荧光监测仪的价格相对便宜,体积较小,便于携带,能够在现场进行快速检测,更加易于推广。实时荧光环介导等温扩增(Real-time Fluorescence Loop-Mediated Isothermal Amplification Technology,RealAmp)技术,是指将实时荧光监测仪与电脑相连,在LAMP反应体系中加入荧光染料(SYBR GreenⅠ),SYBR Green I和双链DNA发生结合,荧光强度会大大增强。当反应开始,DNA便开始扩增,反应体系中的荧光信号也随之发生变化[4],通过电脑软件对整个LAMP反应进行实时监测,扩增曲线就会被显示出来。2010年,Naomi W.Lucchi等[5]用实时荧光LAMP技术建立了疟原虫基因的检测方法。同年,Yamazaki等[6]运用实时荧光LAMP技术实现了副溶血弧菌的检测。实时荧光LAMP检测法可实时监测并直观判定检测结果,操作简单,耗时短,特异性强、灵敏度高。目前,利用实时荧光LAMP技术检测病原菌在国内外少有报道,而利用该方法检测变形杆菌的研究在国内外鲜见报道。
1 材料与方法
1.1材料
1.1.1菌株
本试验所用菌株见表1。
1.1.2试剂
8 000 U/mL Bst DNA聚合酶大片段(Bst DNA polymerase large fragment)和 10×ThermoPolTMReaction Buffer:New England Biolab公司;2.5 mmol/L High Pure dNTPs、50 mmol/L MgSO4、100-bp DNA ladder及Hpa I限制性内切酶:宝生物(大连)工程有限公司;SYBR Green I:北京天恩泽公司;LAMP引物合成于北京华大基因;营养肉汤培养基、营养琼脂培养基:北京陆桥技术有限责任公司。
1.1.3仪器与设备
实时荧光监测仪(ESE-Quant Tube Scanner):ESE GmbH,Stockach,Germany;Whatman T Gradient PCR仪:Biometra Co.Ltd;DLCJ-1N净化工作台:哈尔滨市东联电子技术开发有限公司;UVIpro凝胶成像系统:UVItec公司;DYY-10C电泳仪:北京市六一仪器厂;数显超级恒温水浴锅:金坛市杰瑞尔电器有限公司;高速冷冻离心机:德国西格玛公司。
1.2方法
1.2.1引物设计
对GenBank中已公布的变形杆菌atpD保守基因(普通变形杆菌AY134488,奇异变形杆菌AX109601)序列进行同源性对比分析,针对靶序列的6个位点,运用LAMP引物设计软件(Primer Explorer V3)在线设计引物[7-10]。设计的4条引物包括:2条外引物(F3和B3),2条内引物(FIP和BIP)[11],其中FIP由F1的互补序列F1c和正向序列F2构成,BIP由B1的互补序列B1c和正向序列B2构成。经过筛选引物,扩增靶基因序列中272至470的位置区域,扩增的目的基因片断长度为199 bp。实时荧光LAMP的4条引物见表2,每一条引物在靶基因序列中的位置见图1。

表1 试验菌种Table 1 Experimental strains
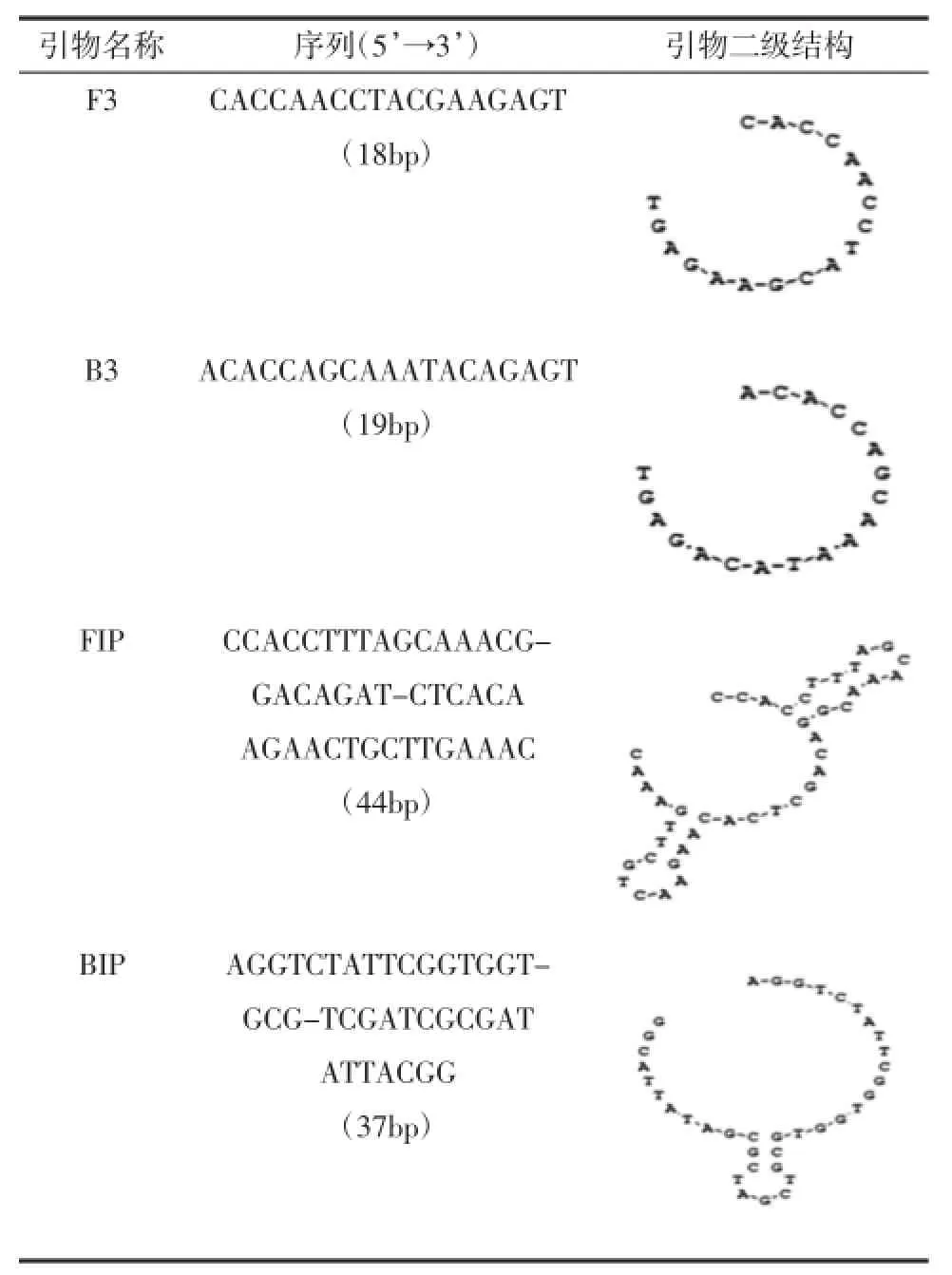
表2 LAMP引物Table 2 Primer of LAMP
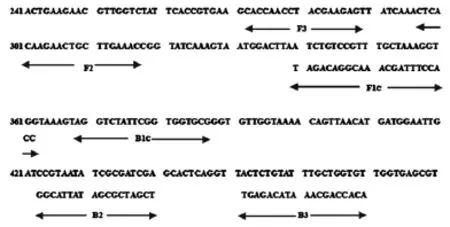
图1 引物位置Fig.1 Gene map of the target sequences
1.2.2纯菌培养
将变形杆菌菌种接种于无菌的营养肉汤中,在36.8℃,220 r/min的摇床中培养过夜(约12 h),此方法适用于本试验其它细菌的培养。采用稀释平板菌落计数法进行变形杆菌菌落计数,测定变形杆菌纯培养物的活菌数为8.1×108CFU/mL。
1.2.3制备DNA
采用热裂解法提取基因组DNA,将提取的DNA储存在-80℃备用。
热裂解法具体步骤如下:①将1 mL过夜培养的菌液加入到1.5 mL灭菌离心管中,在11 000 r/min,1 min条件下离心,弃上清。②用300 μL灭菌水反复吹吸菌体沉淀,然后11 000 r/min,离心1min,弃去上清。③在沉淀中加100 μL灭菌水,反复吹吸沉淀物,使其充分悬浮。④将悬浮液置于沸水浴中,约10 min后取出,11 000r/min离心1 min,取上清(基因组DNA)。
1.2.4LAMP反应
1.2.4.1实时荧光LAMP反应
经实时荧光监测仪反复优化确定RealAmp反应体系和程序。
反应体系:2.5 mmol/L high-pure dNTPs 5 μL,10× ThermoPolTMReaction Buffer 3 μL,50 mmol/L MgSO40.5 μL,10 μmol/L F3和B3各1 μL,10 μmol/L FIP和BIP各2.5μL,8000U/mLBstDNA聚合酶大片段1.5μL,1.5 μL SYBR Green I(1∶500稀释),模板DNA 3 μL,剩余为无菌蒸馏水,补足25 μL反应体系。
反应程序:温度为62℃,时间为60 min,可以依照实际反应的情况进行终止。
产物验证:吸取扩增产物4μL,然后与1μL的10× Loading Buffer进行均匀的混合,在进行完1.5%的琼脂糖凝胶电泳后,将凝胶放到凝胶成像系统中,观察是否产生正确LAMP梯形条带,验证实时荧光LAMP扩增反应发生了正确的LAMP扩增。
1.2.4.2普通LAMP反应
为了比较RealAmp和普通LAMP检测变形杆菌纯培养物的灵敏度,用PCR仪对普通LAMP反应体系和反应程序进行了优化。以下为优化后的普通LAMP反应体系和反应程序。
反应体系:2.5 mmol/L High Pure dNTPs 4 μL,10× ThermoPolTMReaction Buffer 2.5 μL,50 mmol/L MgSO40.5μL,10 μmol/L F3和B3各1 μL,10 μmol/L FIP和BIP 各1.5μL,8000U/mLBstDNA聚合酶大片段1μL,模板DNA 2 μL,剩余为无菌蒸馏水,补足25 μL反应体系。
反应程序:温度62℃,时间60 min,80℃10 min终止反应。
产物检测:与RealAmp反应的产物验证方法相同。
1.2.5酶切分析RealAmp反应产物
由于RealAmp扩增产物的电泳条带为梯状,故很难用于测序。研究发现对RealAmp产物进行酶切分析,也可以验证其产物的特异性。取RealAmp反应产物1 μL,加入2 μL 10×K Buffer和1 μL Hpa I限制性内切酶,用无菌蒸馏水补足20 μL反应体系,37℃水浴1.5 h(可根据酶切效果适当延长酶切时间)。吸取酶切产物5 μL,与1 μL的10×Loading Buffer混合均匀,进行完1.5%琼脂糖凝胶电泳(120 V,30 min)后,将凝胶放到凝胶成像系统中,观察分析RealAmp反应产物酶切结果是否与理论相一致。
1.2.6实时荧光LAMP的特异性
采用热裂解法,提取表1所列的19株特异性试验菌株的基因组DNA,阴性对照以无菌蒸馏水作为模板,采用RealAmp反应体系和程序进行扩增,验证该检测方法的特异性。
1.2.7比较RealAmp与普通LAMP检测纯菌的灵敏度
将过夜培养的变形杆菌纯培养物进行10倍系列梯度稀释,取各稀释度菌液1 mL进行平板计数,通过计数可知变形杆菌纯培养物的浓度为8.1×108CFU/mL。用1.2.3热裂解法提取各稀释度(8.1×10-1CFU/mL~8.1×108CFU/mL)的变形杆菌基因组DNA,进行实时荧光LAMP和普通LAMP扩增反应,比较两种检测方法的灵敏度。
1.2.8RealAmp法检测人工污染猪肉的检出限
在进行变形杆菌污染前,根据FDA推荐的常规检测方法确定猪肉中是没有变形杆菌存在的。取25 g已绞成均匀肉馅的猪肉,加入225 mL灭菌生理盐水,制成猪肉匀浆液。分别取1.2.7中10倍系列梯度稀释的变形杆菌纯菌液1 mL,加入装有9 mL猪肉匀浆液的无菌离心管中,振荡均匀,以1 000 r/min的转速离心10 min。取上清,加入到另一个无菌的离心管,在14 000 r/min的转速下离心10 min。弃上清,加入500 μL生理盐水,将沉淀物进行悬浮。加入乙酸乙酯(上述悬浮液0.25倍体积),反复吹吸并混匀振荡(约2 min),14 000 r/min,离心10 min。将上清液去除,用500 μL的TE缓冲液将沉淀溶解。各取溶解液1 mL,用热裂解法提取DNA,进行实时荧光LAMP扩增。
2 结果与分析
2.1建立RealAmp检测方法
RealAmp直观检测变形杆菌,见图2。
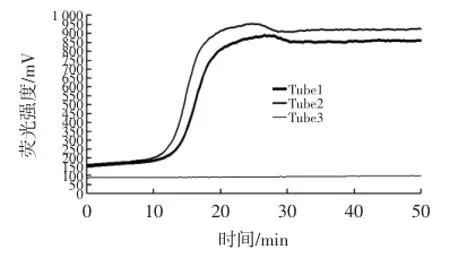
由图2可知,随着反应的进行,开始出现荧光曲线,当反应约10 min的时候,Tube1试验管和Tube2试验管荧光强度开始增强,当反应达到25 min左右时荧光曲线的峰值相继达到最高。而Tube3阴性对照管的荧光曲线一直处于相对平滑的状态,直到反应终止也没有出现明显的峰值。琼脂糖凝胶电泳检测实时荧光LAMP反应产物,见图3。

图3 变形杆菌凝胶电泳检测结果Fig.3 Reaction products of RealAmp detected using agarose gel electrophoresis
由图3可知,Tube1和Tube2出现了LAMP反应典型的梯状条带,而Tube3未出现梯状条带。由此可知,实时荧光LAMP的直观检测结果和电泳检测结果一致,表明Tube1和Tube2发生了LAMP扩增反应。
2.2酶切分析RealAmp反应产物
LAMP产物的酶切分析结果见图4。
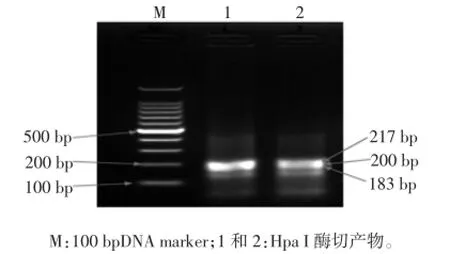
图4 LAMP产物的酶切分析结果Fig.4 Restriction enzyme analysis results of RealAmp
由图4可知,利用DNAMAN软件对靶序列进行限制性切酶分析可知,Hpa I的酶切位点在靶序列405的位置区域,也就是B1和B2之间。运用酶切理论图进行推导计算,理论上酶切产物的片段大小主要为183、200、217 bp。实时荧光LAMP扩增产物经Hpa I酶切后,切出的片段长度与理论值是一致的。
2.3研究RealAmp法的特异性
实时荧光LAMP的特异性试验结果见图5。
由图5可知,用于RealAmp特异性试验的19株试验菌株中,3株普通变形杆菌和3株奇异变形杆菌有明显的扩增峰,仪器自动判定为阳性,而其他13株非变形杆菌没有出现扩增峰,故均未发生扩增,判定为阴性。试验表明实时荧光LAMP检测变形杆菌的特异性较强。
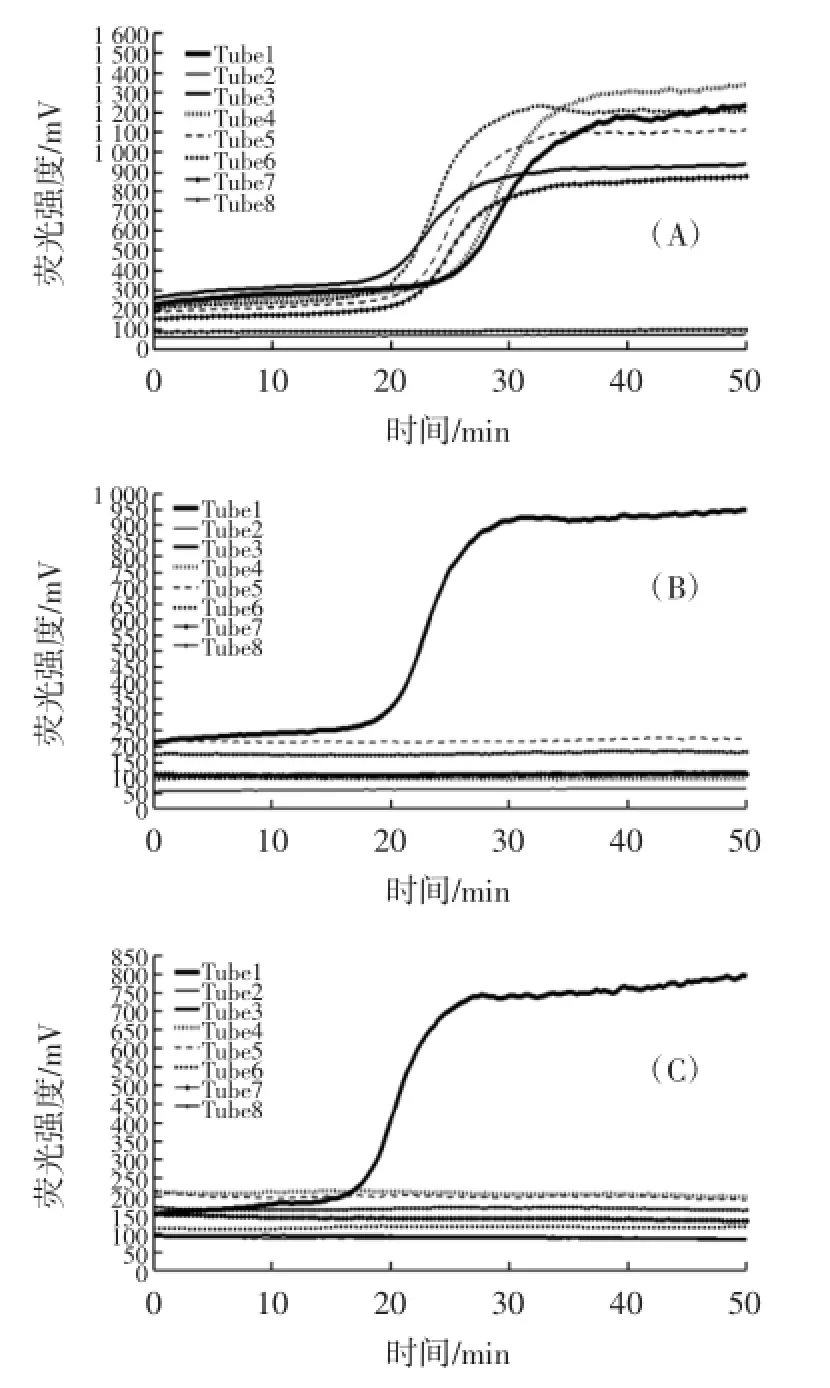
图5 实时荧光LAMP的特异性试验结果Fig.5 Results of the specificity test of RealAmp detection
2.4比较RealAmp与普通LAMP检测纯菌的灵敏度实时荧光LAMP反应的灵敏度试验结果见图6。
如图6所示,采用RealAmp反应,当变形杆菌纯培养物浓度为8.1×108CFU/mL(Tube1)和8.1× 104CFU/mL~8.1×100CFU/mL(Tube3~Tube7)时,荧光曲线出现明显的扩增峰,仪器自动判定为阳性;当浓度为8.1×10-1CFU/mL(Tube 8)时,荧光曲线平缓,未出现扩增峰,判定为阴性。因此,本试验所建立实时荧光LAMP检测变形杆菌的灵敏度为8.1 CFU/mL。
普通LAMP反应的灵敏度试验结果见图7。
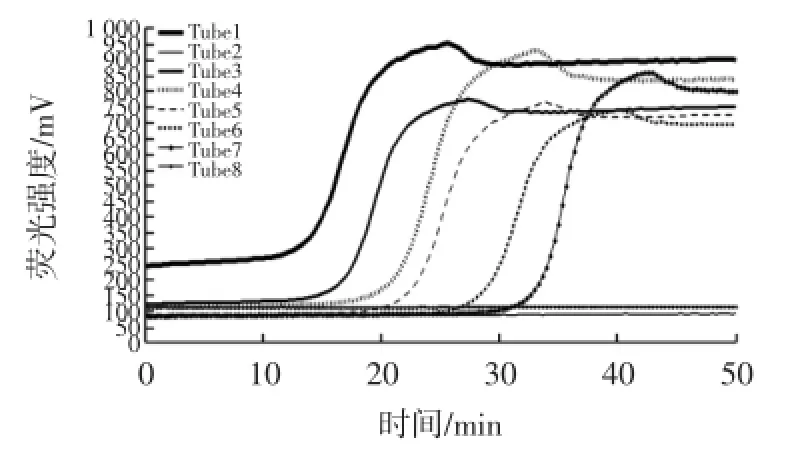
图6 实时荧光LAMP反应的灵敏度试验结果Fig.6 Sensitivity test using RealAmp
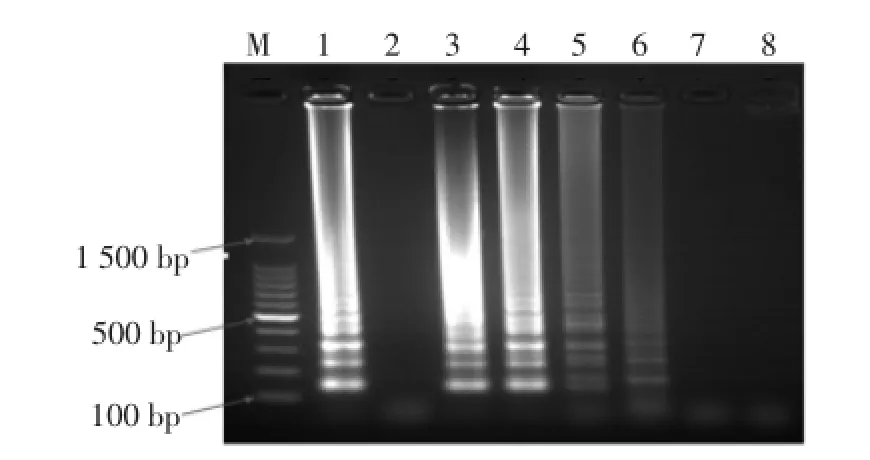
图7 普通LAMP反应的灵敏度试验结果Fig.7 Sensitivity test using conventional LAMP
如图7所示,采用普通LAMP反应,当变形杆菌纯培养物浓度为8.1×101CFU/mL(第7个胶孔)时,不再出现梯状条带,故普通LAMP检测变形杆菌的灵敏度为81 CFU/mL。
由此可知,RealAmp检测变形杆菌的灵敏度是普通LAMP的10倍。
2.5RealAmp法检测人工污染猪肉的检出限
实时荧光LAMP检测人工污染猪肉的检出限试验见图8。
如图8所示,采用实时荧光LAMP检测人工污染猪肉的检出限,当变形杆菌纯培养物浓度为8.1×108CFU/mL (Tube1)和8.1×104CFU/mL~8.1×101CFU/mL(Tube3~Tube6)时,荧光曲线出现明显的扩增峰,仪器自动判定为阳性;当浓度为8.1×100CFU/mL and 8.1×10-1CFU/mL (Tube 7~Tube 8)时,荧光曲线平缓,未出现扩增峰,判定为阴性。因此,本试验所建立实时荧光LAMP检测人工污染猪肉的检出限为81 CFU/mL。
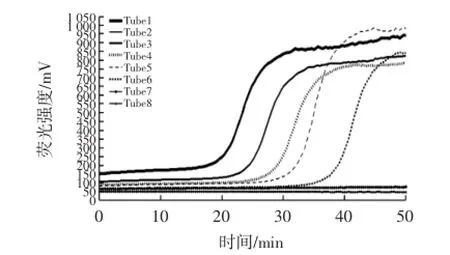
图8 实时荧光LAMP检测人工污染猪肉的检出限试验Fig.8 Detection limit of the pork artificially contaminated with proteus using RealAmp
3 结论
本试验建立的变形杆菌RealAmp检测方法的灵敏度是普通LAMP的10倍,且大大缩短了检测时间,20 min内仪器自动判定结果。该检测方法可实时监测并直观判定检测结果,避免了繁琐的凝胶电泳过程,其操作简单,耗时短,特异性强、灵敏度高,能够实现对变形杆菌的快速检测,其应用前景十分广阔。
参考文献:
[1]苏良,张如胜,宋克云,等.环介导等温扩增技术检测奇异变形杆菌方法的建立[J].现代预防医学,2010,37(4):741-743
[2]Pérez-Sancho M,García-Seco T,Arrogante L,et al.Development and evaluation of an IS711-based loop mediated isothermal amplification method(LAMP)for detection of Brucella spp.on clinical samples[J].Res Vet Sci.,2013(95):489-494
[3]Notomi T,Okayama H,Masubuchi H,et al.Loop-mediated isothermal amplification of DNA[J].Nucl Acids Res,2000,28(12):63
[4]Smith C J,Osborn A M.Advantages and limitations of quantitative PCR(Q-PCR)-based approaches in microbial ecology[J].FEMS Microbiol Ecol,2009,67(1):6-20
[5]Lucchi N W,Demas A,Narayanan J,et al.Real-time fluorescence loop mediated isothermal amplification for the diagnosis of malaria [J].PLOS ONE,2010,5(10):13733
[6]Yamazaki W,Kumeda Y,Misawa N,et al.Development of a loopmediated isothermal amplification assay for sensitive and rapid detection of the tdh and trh genes of Vibrio parahaemolyticus and related Vibrio species[J].Appl.Environ.Microbiol,2010,76(3):820-828
[7]Das A,Babiuk S,McIntosh M T.Development of a loop-mediated isothermal amplification assay for rapid detection of capripoxviruses [J].Clin.Microbiol,2012,50(5):1613
[8]Singh P,Mirdha B R,Ahuja V,et al.Loop-mediated isothermal amplification(LAMP)assay for rapid detection of Entamoeba histolytica in amoebic liver abscess[J].World JMicrobiol Biotechnol,2013 (29):27-32
[9]王鹏,张会彦,马晓燕,等.环介导等温扩增技术快速检测变形杆菌[J].食品工业,2011(10):104-109
[10]Ziros P G,Kokkinos P A,Papanotas K,et al.Loop-mediated isothermal amplification(LAMP)method for the detection of Salmonella spp. strains isolated from food samples[J].Microbiol,Biotechnol and Food Science,2012,2(1):152-161
[11]Yang H,Zhang W,Zhang X,et al.Development and evaluation of a loop-mediated isothermal amplification assay for the rapid detection of staphylococcus aureus in Food[J].EUR FOOD RES TECHNOL,2011,232(5):769-776
DOI:10.3969/j.issn.1005-6521.2016.11.030
基金项目:河北省自然科学基金项目(C2008000216)
作者简介:马桂芬(1990—),女(汉),硕士研究生,研究方向:有害微生物检测与控制。
*通信作者:张伟(1963—),男(汉),教授,院长。
收稿日期:2015-05-02
Real-time Fluorescence LAMP Assay for Rapid Detection of Proteus
MA Gui-fen1,ZHANG Yun-zhe1,FU Bo-yu1,YUAN Yao-wu1,YUAN Ning2,WANG Xin2,ZHANG Wei1,*
(1.College of Food Science and Technology,Agricultural University of Hebei,Baoding 071000,Hebei,China;2.College of Science and Technology,Agricultural University of Hebei,Cangzhou 061000,Hebei,China)
Abstract:We established a rapid detection method for proteus by using real-time fluorescence loop-mediated isothermal amplification(RealAmp)technology.Four loop-mediated isothermal amplification primers were constructed based on the atpD gene of proteus published in GenBank.The portable fluorescence reader(ESEQuant Tube Scanner)was used for isothermal(62°C)amplification of DNA template.Real-time monitoring was achieved by connecting the reader to a computer.Sensitivity,specificity and the detection limit of artificially contaminated pork of proteus were determined using RealAmp and compared with the sensitivity of the conventional LAMP.The results showed that RealAmp method was more simple and rapid than the conventional LAMP.The total time of judgment result of the former was generally less than 20 min.A total of 19 strains were subjected to specificity tests,6 proteus strains indicated positive results,whereas the other 13 non-proteus strainsindicatednegativeresults.ThesensitivityofRealAmpindetectingpureculturesof proteuswas8.1CFU/mL,which was10 times compared with that of the conventional LAMP.Moreover,the detection limit of artificially contaminated pork was 81 CFU/mL.The RealAmp method was superior in terms of testing time,convenience,specificity,and sensitivity,and had significant potential for rapid detection of proteus.
Key words:RealAmp;LAMP;proteus;detection;atpD

