丙烯与HBr/Br·发生自由基加成和取代反应的机理和竞争
陈 勇
(山东科技大学应用化学系,山东青岛266590)
丙烯与HBr/Br·发生自由基加成和取代反应的机理和竞争
陈勇*
(山东科技大学应用化学系,山东青岛266590)
摘要:含有α-H的烯烃可以与溴自由基发生自由基加成和自由基取代反应。本文以丙烯为例,论述了自由基加成和取代反应的机理和竞争关系,从而帮助读者更好地理解反应条件对优势反应及产物的影响。
关键词:丙烯;溴自由基;自由基加成;自由基取代;竞争关系
烯烃是非常活泼的反应物,容易发生加成、α-H取代、氧化等诸多反应。此外,不对称烯烃的许多反应还具有区域和立体选择性。由于篇幅的限制,有机教材未能对某些反应的机理及与其他反应的关系讲述透彻,学生容易产生疑问。在这些问题中,比较突出的是以丙烯为代表的、含α-H的烯烃,与HBr和过氧化物发生自由基加成反应,而与HBr和N-溴代丁二酰亚胺(NBS)发生α-H取代反应。从表面上看,这两个反应的条件不一样,学生想当然地接受产物也不一样。但是,在意识到这两个反应都涉及到丙烯和溴自由基的反应、且体系里都存在HBr时,学生会自然地探求组成相似的两个体系主要产物相差甚远的原因。
实际上,丙烯与溴自由基的加成和取代会同时发生,只是两个反应在不同条件下的主次不同。当溴自由基加成到丙烯的双键为主要反应,生成的仲碳自由基继续与HBr加成时,优势产物为1-溴丙烷。而当溴自由基取代丙烯的α-H为主要反应,生成的烯丙型自由基继续与Br2反应时,优势产物为烯丙基溴。本文对这两个反应的机理、竞争关系和主要产物的形成原因进行解析和阐述,以帮助学生更好地理解和掌握这两个反应。
1 丙烯与溴自由基的加成反应机理
丙烯与HBr在过氧化物存在下,发生自由基加成的机理可用下列反应式表示:
链引发:

链传递:

链终止:略
通过以上反应式可知,过氧化物首先分解生成自由基,进而与HBr反应生成溴自由基。溴自由基加成到双键的C1或C2分别生成仲碳或伯碳自由基。因为溴原子加到C1的空间位阻较小,且生成的仲碳自由基更稳定,因此加成反应的优势产物是仲碳自由基。仲碳自由基与HBr反应又一次生成溴自由基,与双键发生加成反应,反复循环,表现为氢加到含氢少的碳上,其他原子(溴)加到含氢多的碳上的反马氏加成。
丙烯与HBr在过氧化物存在下的自由基加成反应,与丙烯与HBr在溶液中的亲电加成反应有类似之处,都是优先生成稳定的中间体。只是在亲电加成时,首先是亲电试剂(质子)进攻C1,生成更稳定的仲碳正离子,仲碳正离子继续和溴负离子加成,产物为马氏加成的2-溴丙烷。
2 丙烯与溴自由基的取代反应机理
丙烯与HBr和NBS的α-H取代反应,也称为丙烯α-H的卤化反应。该反应为非均相反应,此类反应的物质浓度难以测定、可重复性低、不同烯烃的选择性差别大、受杂质影响严重,因此许多学者曾经对取代反应提出不同的机理。其中,比较有影响力的有Bloomfield[1]、Goldfinger[2]、Pearson和Martin[3]、Incremona[4]、Dauben和McCoy[5,6]的理论。除了Bloomfield理论已经被证明是错误的以外,其他的研究体系均不相同,都合理地解释了各自的实验结果,且关键步骤是相同或等价的,很难相互证实或证伪,导致了少数教材对这一反应的机理阐述与众不同。现在被普遍接受的是Goldfinger机理,该反应如式(5)所示:

其机理如下列方程所示:
链引发:

链转移:
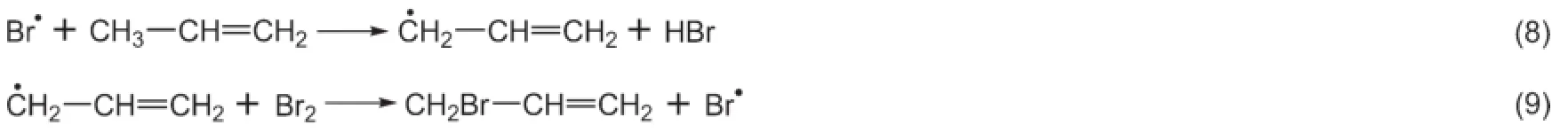
链终止:略
从历程上看,体系中生成溴自由基后,与丙烯发生取代而非加成反应,生成的烯丙基自由基与Br2生成α-H溴化产物。该反应也可以由丙烯与低浓度的Br2在高温或光照情况下实现。Br2在高温或光照条件下生成溴自由基,等同于上述机理中的式7,其他各反应与NBS体系相同。显然,体系中存在丙烯和溴自由基时,二者既可以发生加成反应,也可以发生取代反应。加成反应与取代反应如何分别成为主要反应呢?
3 自由基加成和取代反应的竞争关系
王积涛教授[7]和邢其毅院士[8]主编的教材对丙烯与溴自由基发生取代反应的阐述相对较多,列举了该反应的某些特定条件和特征。比如体系中的HBr和卤素含量要低,加成产生的仲碳自由基不稳定、可逆程度高,真正的反应在NBS固体表面上发生等。但是,这些教材依然没有完整地解释这些因素导致取代反应成为优势反应的原因。
自由基加成和取代反应的竞争,实际上是化学中常见的动力学和热力学的竞争[9]。总的来说,丙烯与溴自由基加成速度快,但是生成的仲碳自由基不太稳定,反应可逆,属于动力学控制;而丙烯与溴自由基发生取代反应时速度慢,但是生成的烯丙基自由基稳定,反应的可逆程度极小,属于热力学控制。通过控制反应体系,可以分别达到动力学或热力学控制的最终产物。
在自由基加成反应条件下,体系中存在着大量的、与丙烯等物质的量的HBr。过氧化物与HBr反应产生溴自由基后,溴自由基可以发生自由基加成或取代反应。加成反应需要打开活泼的碳碳双键,其键能约为272 kJ·mol-1,取代反应则需要打开一个C―H的σ键,需要的能量约为360 kJ·mol-1[7],所以加成反应需要的活化能小。活化能以阿累尼乌斯指数形式影响反应速率,具有稍小活化能的加成反应要快得多。丙烯与溴自由基加成生成的仲碳自由基的反应虽然快,但是由于逆反应活化能小、符合熵增(从一种反应物仲碳自由基生成两种产物丙烯和溴自由基)的原因而高度可逆。由于自由基加成的反应条件下体系中有大量的HBr,能马上与仲碳自由基进行放热的二级反应,阻止了仲碳自由基的可逆反应,顺利生成自由基加成产物。虽然也会生成烯丙型自由基,但是由于该反应慢,不是主要反应。再者,烯丙型自由基虽然稳定,也会和体系中大量存在的HBr反应生成丙烯,如式(10)所示。综合来讲,这是动力学控制的反应。

在自由基取代反应条件下,体系中只含有远少于丙烯的HBr,由于NBS不溶于反应溶剂CCl4,反应在固体NBS表面发生。因为NBS中的N―Br键能仅为240 kJ·mol-1,非常活泼,HBr与NBS的反应比与丙烯的反应快得多。微量HBr与NBS反应生成Br2后,进而生成溴自由基。虽然溴自由基加成到双键上生成仲碳自由基的反应快,可是由于HBr含量很低且优先和NBS反应,导致仲碳自由基不能及时与HBr完成加成反应,仲碳自由基经过可逆反应回到丙烯和溴自由基,动力学控制的加成反应并没有生成产物。溴自由基取代α-H的速度虽然慢,但是因为烯丙型自由基稳定、逆反应活化能高且无熵增优势等原因可逆度小,体系因此生成并积累烯丙基自由基,伴随烯丙基自由基生成的HBr依然优先与NBS反应生成Br2。最终,均出现在NBS表面的烯丙基自由基和Br2反应得到烯丙基溴,热力学控制的取代反应成为主要反应。
需要进一步说明的是,自由基取代条件下体系中存在的Br2主要与烯丙基自由基反应,而不会与双键加成。这是因为取代体系中的HBr为微量,产生的Br2也为微量,一个Br2不论以产生离子或自由基形式加成到双键上,另一个溴离子或原子需要来自另一个溴分子,才能及时与可逆的中间体反应[10]。由于Br2浓度极低,中间体周围出现合适反应对象的几率很低,因而Br2与双键以离子或自由基机理加成不是主要反应,这一结论已被相关研究证实[4]。
4 中间体稳定性的讨论
利用动力学和热力学的竞争解释主要反应和相应产物,其中重要的一条是仲碳自由基比烯丙基自由基生成的速度快且可逆。但是在有机化学的学习过程中,有的学生形成了一个“稳定的中间体更容易形成”的印象,他们认为烯丙型自由基比仲碳自由基稳定,所以更容易更快地生成,因此对此处仲碳自由基生成更快的叙述感到困惑。
稳定的中间体优先形成,是指按同样机理生成不同中间体的规律,此时动力学和热力学的结果一致。比如溴自由基与双键加成,可以形成仲碳或伯碳自由基。由于二者均通过加成反应生成,确实是稳定的仲碳自由基更易生成。但是,本文的仲碳自由基和烯丙型自由基是按照加成和取代这两种不同的机理形成,二者生成速度的快慢不能简单地由稳定性的高低得出,而是要分析活化能的大小和熵的变化。正如前文指出,取代反应的活化能比加成反应的活化能高许多,导致两个反应的快慢也差很多。虽然自由基的稳定性对反应的动力学有影响,但是不足以弥补二者在能垒方面的极大差别。两个反应进程和能量的关系如图1所示:

图1 丙烯与溴自由基加成和取代的势能曲线
5小结
(1)反应体系中除丙烯外其他化合物的极低浓度,保证了反应慢的、稳定的烯丙基卤化过程,超过了快的、高度可逆的加成反应。
(2)HBr与NBS的反应比与烯烃和与中间体的反应快得多。
(3)稳定的中间体容易生成,即动力学和热力学一致的情形,适用于生成机理一样的中间体稳定性的比较,而不是放之四海皆准的规则。
在本文的形成过程中,作者与加州大学戴维斯分校化学系Neil E.Schore教授多次探讨并得到他的指导,特此表示感谢。自由基取代机理中,Schore教授倾向于Incremona的理论,但是不影响本文的讨论和结论。
参考文献
[1]Bloomfield,G.F.J.Chem.Soc.1944,1944,114.
[2]Adam,J.;Gosselain,P.A.;Goldfinger,P.Nature 1953,171,704.
[3]Pearson,R.E.;Martin,J.C.J.Am.Chem.Soc.1963,85(3),354.
[4]Incremona,J.H.;Martin,J.C.J.Am.Chem.Soc.1970,92(3),627.
[5]Dauben,H.J.,Jr.;McCoy,L.L.J.Am.Chem.Soc.1959,81(18),4863.
[6]Dauben,H.;McCoy,L.J.Org.Chem.1959,24(10),1577.
[7]王积涛,王永梅,张宝申,胡青眉,庞美丽.有机化学.第3版.天津:南开大学出版社,2009.
[8]邢其毅,裴伟伟.基础有机化学.第3版.北京:高等教育出版社,2005.
[9]Vollhardt,K.P.C.;Schore,N.E.Organic Chemistry:Structure and Function,7th ed.;W.H.Freeman:New York,2014.
[10]Walling,C.;Rieger,A.L.;Tanner,D.D.J.Am.Chem.Soc.1963,85(20),3129.
中图分类号:O6;G64
doi:10.3866/PKU.DXHX201505020
*通讯作者,Email:ychen168@126.com
基金资助:山东科技大学2013年“群星计划”教育教学研究项目(qx2013242)
Mechanisms and Competition of Free Radical Addition and Substitution Reactions of Propylene with HBr and Br·
CHEN Yong*
(Department of Applied Chemistry,Shandong University of Science and Technology,Qingdao 266590,Shandong Province,P.R.China)
Abstract:Alkenes with α-H can react with bromine radical via both free radical addition and free radical substitution.In this paper,the mechanisms of the free radical addition and free radical substitution and the competition between these two reactions were discussed using propylene as an example to illustrate effects of reaction conditions on the major reaction and products.
Key Words:Propylene;Bromine radical;Free radical addition reaction;Free radical substitution reaction;Competition

