矿化海水淡化水在镀锌管中的化学稳定性研究
张 凯,韩 旭,朱金亮,周潮洪
(天津市水利科学研究院,天津 300061)
矿化海水淡化水在镀锌管中的化学稳定性研究
张凯,韩旭,朱金亮,周潮洪
(天津市水利科学研究院,天津300061)
摘 要:未经合理矿化处理的海水淡化水进入既有市政管网,会与旧管壁上沉积的物质发生反应,影响出水水质。分析了含有不同氯化钙浓度的海水淡化水流经曾经用于输送自来水的镀锌管后管道出水中钙离子、铁离子、总铁、碱度、pH值、浊度以及LSI指数的变化,研究了海水淡化水对镀锌管管壁的腐蚀机理。研究结果表明,当海水淡化水中离子浓度很低时,在管壁上主要发生的是对碳酸钙垢的溶解侵蚀反应,这一反应随着水中钙离子浓度的增加而减弱,当水中钙离子浓度达到28 mg/L时,水中的钙离子与管壁上的钙垢达到溶解平衡;同时,随着水中氯离子浓度增加,淡化海水与管壁的作用逐渐转化为化学腐蚀作用,建议增加入水的碱度,并减少其中的氯离子浓度。
关键词:海水淡化水;镀锌管;化学稳定性
海水淡化水是一种新型的非常规淡水资源,近年来发展迅速,目前全世界已经有150多个国家建立了海水淡化厂,近3亿人的饮水与海水淡化水有关。海水淡化已经成为解决全球沿海地区水资源紧缺的重要措施之一。
截至2014年,全国海水淡化水产能已达85.86 万m3/d,主要分布在沿海地区,其中天津的淡化海水产能达到32.6万m3/d,成为全国海水淡化水产能最大的区域。但是,目前我国的海水淡化水主要用作工业用水和海岛上的生活用水,鲜有向市政供水的成功案例。导致这个结果的主要技术问题之一就是未经合理处理的海水淡化水一旦进入供应自来水的市政管网,会与管壁上的沉积物发生反应,导致管壁上的铁和其他不溶性物质进入水中,用户端出水呈现红色或者黄色,也就是常说的“红水”“黄水”现象[1]。
针对管道中水化学的稳定性问题,Taylor等人的文献中广泛使用朗格列尔指数(Langelier Index,LSI)作为水质稳定性的评价[2];而Birnhack等人的文献中借鉴以色列的海水淡化水广泛使用的碳酸钙沉积势(CCPP)作为水质稳定性评价的指标[3]。LSI和
上述指标在国际上被广泛用于判断海水淡化水厂的出水水质是否达到所需标准,但是各受水区域的供水管网材质不同、地表水水源水质不同,导致各水厂的海水淡化水出厂水质指标也不相同[4];此外淡化海水进入管道后,会与管道中的自来水混合,导致水质的各项参数发生变化,所以单纯依靠出厂水的各项指标,也不能确切地保证淡化海水进入市政供水管网后依旧是安全的。基于这些原因,有必要深入研究淡化海水对管壁的腐蚀机理,并针对进入管道的水体提出合理的水质判据。
尽管新建的建筑物中已经普遍采用PPR材质的入户供水管,但是镀锌管作为传统的供水入户管道,在老城区中还广泛使用,并且在市政供水中往往是“红水”“黄水”的主要铁源。此次以市政供水的镀锌管为对象,研究矿化后的海水淡化水对镀锌管道的腐蚀机理。
1 实验方法和实验装置
1.1实验方法
研究中通过向海水淡化水中添加不同含量的氯化钙,以改变淡化水中钙离子浓度和氯离子浓度;研究不同钙离子和氯离子浓度的淡化海水进入做旧的镀锌管后不同停留时间下出水中钙离子浓度、铁离子浓度、总铁、碱度、浊度、pH等指标的变化规律,以及LSI指数的变化规律;分析海水淡化水在镀锌管内的反应机理。
1.2海水淡化水和自来水水质指标
实验中所使用的海水淡化水采用天津市北疆电厂低温多效蒸馏法的出水,镀锌管做旧时使用的自来水为市政自来水。所用自来水和海水淡化水的相关水质指标,见表1。

表1 实验用水水质
1.3海水淡化水在镀锌管道中的循环实验
淡化海水在镀锌管中循环的实验装置,如图1所示。含有不同浓度的CaCl2的海水淡化水存储于补水桶1中,实验开始前先分别用自来水和实验用水对实验管道进行冲洗,冲洗水经放空阀7排出;实验开始后,关闭放空阀7,水体在管道内进行内循环;取样后管道中水量的损失由位于高位的补水桶1中的水体予以补充。由于每次取样量不超过100mL,仅占管道水量的不足0.3%,因此补水水质导致的水质差异可以忽略。
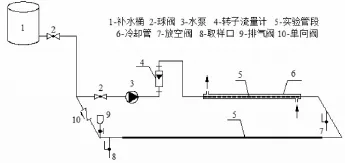
图1 水质稳定性的实验装置示意
装置中所使用的镀锌管道在开展实验前先用市政自来水循环冲洗1年,以保证管道内壁沉积足够的水垢并出现锈蚀,可以模拟现实中的供水管道。
该装置中镀锌管总长3 m,辅助管路长度不超过1.5 m,为PVC材质;为了避免循环过程中因水泵散热导致管道内水体温度升高,对实验管段中的一段镀锌管加装了冷却管,采用水冷的方式以恒定管道中的水温。
不同钙离子浓度的海水淡化水进入实验管段后,每个工况连续运行30 h,取样时间点设为实验启动后10 min、20 min、40 min、1 h、1.5 h、2 h、3 h、4 h、6 h、8 h、11 h、24 h、27 h和30 h。检测水样的钙离子、溶解性铁离子、总铁、碱度、浊度、pH值,计算朗格利尔饱和指数(LSI),分析各水质指标的变化规律。
1.4海水淡化水矿化浓度
研究中用CaCl2调节海水淡化水的钙离子浓度,浓度分别为0、8、12、20和28 mg/L。
2 实验结果及分析
2.1出水中钙离子浓度的变化
不同初始钙离子浓度的海水淡化水进入管道后,出水的钙离子浓度变化如图2所示。由图2可以看出,所有浓度钙离子的水体进入管道之后都需要经过2~6 h才能使水体中的钙离子含量稳定下来达到平衡;当钙离子的初始浓度分别为0、8、12和20 mg/L时,稳定后钙离子的平衡浓度都会有所升高;当钙离子初始浓度为28 mg/L时,钙离子的平衡浓度与初始浓度基本相等。
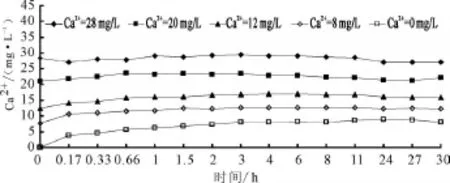
图2 不同初始钙离子浓度下出水中钙离子变化曲线
为了使钙离子浓度变化趋势更加直观,计算出各时间点水中钙离子浓度的增加速率,其计算公式为:

式中:ν为t2时刻的钙离子浓度增加的速率[mg/(L· h)];C2为t2时刻钙离子的浓度(mg/L);C1为t1时刻钙离子的浓度(mg/L);t2,t1为相邻的两个取样时刻(h)。
初始钙离子浓度为12 mg/L时海水淡化水中钙离子的增加速率,如图3所示。
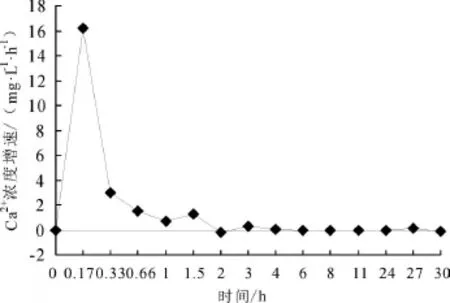
图3 钙离子初始浓度为12 mg/L时钙离子浓度增加速率
从图3可以看出,水体中钙离子浓度的增速呈现阻尼震荡的形式,在迅速增加后又迅速降低,而后小幅增加和降低,并且在局部时段呈现负值,说明这一时期是钙离子沉积过程,而不是释放过程;一定时间以后,钙离子浓度增速为0,说明水中的钙离子浓度不再发生变化,建立起了新的平衡。
这一现象可解释为:在镀锌管做旧过程中使用的自来水的LSI>0,具有碳酸钙沉积的趋势,因此旧的实验管路的内壁上除了铁的氧化物成分,还存在钙的沉积物,以碳酸钙为主。海水淡化水进入这一管道后,会与管壁上的钙垢发生反应并形成新的化学平衡:反应初期由于水中的钙离子浓度低,管壁上的钙离子会溶解到水中,使得水中的钙离子浓度迅速增加;而随着海水淡化水中钙离子浓度的增加,水中的钙离子也会沉积到管壁上;实验运行一段时间后,钙离子的溶解和沉积达到了一个动态平衡的状态,此时钙离子浓度基本上保持不变。
不同钙离子初始浓度的水体进入管道后,出水钙离子浓度达到平衡的时间和平衡浓度见表2。

表2 不同初始钙离子浓度的水体达到钙离子平衡的时间和浓度
从实验结果可以看出,当钙离子初始浓度为0 mg/L时,钙离子在水中基本就是一个纯溶出、再沉淀的过程;当钙离子初始浓度为8、12和20 mg/L时,水体中钙离子的浓度逐渐出现类似阻尼运动的震荡过程,最终达到平衡,并且随着水中初始钙离子浓度的增加,达到平衡的时间逐渐推后;当钙离子初始浓度为28 mg/L时,除了初始阶段水体中的钙离子有一个溶出导致的升高过程,在后续环节中只有单一的沉淀过程,其平衡浓度为28.29 mg/L,溶解和沉积量基本相等。
2.2出水中铁离子浓度和总铁的变化
图4所示为不同初始钙离子浓度条件下出水中铁离子的浓度、总铁平均值的曲线以及总铁中铁离子所占的比例。由于不同采样时间下水样中的铁离子、总铁浓度变幅很大且有一定的随机性,因此研究中是对采样序列过程中样品中铁离子、总铁的算术平均值进行分析,主要研究铁离子和总铁的变化趋势以及二者之间的关系。
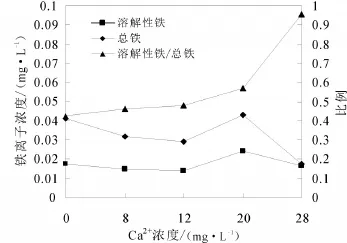
图4 不同初始钙离子浓度条件下出水中铁离子、总铁的变化曲线
由图4可以看出,随着初始钙离子浓度的增加,出水中溶解性铁占总铁的比例也在增加。当钙离子初始浓度分别为0、8和12 mg/L时,溶解性铁占总铁的比例不足50%,说明出水中的铁以不溶性铁为主,包括从管壁上脱落的铁氧化物颗粒;当钙离子初始浓度为20 mg/L时,这一比例为56.9%,水体中溶解性铁所占比例逐渐升高;当钙离子初始浓度为28 mg/L时,这个比例升高为95.5%,水体中的铁基本以溶解性铁离子形式存在。
导致这一结果的机理可以解释为:当初始水体中钙离子浓度很低时,水体与管壁上的沉积物发生的主要是溶解作用,大量碳酸钙进入水中,导致钙垢以块状脱落,混合于钙垢中的铁的氧化物也随之脱落,以难溶于水的颗粒物形式存在于水体中;而随着钙离子浓度的升高,管壁上钙离子溶解的速率减慢,同时由于掺入的是CaCl2,水体中氯离子浓度也随之升高,其自由电荷加速了管壁上的氧化还原反应,加速了管壁上铁的腐蚀,大量铁以离子形式进入水中,因此水中溶解性的铁占据主导地位。
基于这一结论,可以把不同矿化浓度的海水淡化水对镀锌管的腐蚀分为2个阶段:当淡化水中钙离子、氯离子含量低的时候,海水淡化水对管壁上的钙垢起到溶解侵蚀作用,并导致铁的氧化物以固体颗粒形式进入水体;而当海水淡化水中腐蚀性阴离子浓度增加之后,即便增加水体中的钙离子可以避免其对管壁上的钙垢造成破坏,但是仍会加速管壁上铁的腐蚀速度,导致大量铁离子进入水体。
2.3碱度的变化情况
不同初始钙离子浓度下出水中的碱度变化曲线,如图5所示。由图5可以看出,出水的碱度也是在大约6 h之后达到平衡,这与出水中的钙离子变化规律是一致的;而实验所使用的水中的钙离子是海水淡化水加CaCl2配制的,不含碳酸氢盐,因此所有实验中的初始碱度都接近于0;碱度增加的过程反映水体中的HCO3-含量在不断增加,其唯一来源是管壁上碳酸钙的溶出,这也从侧面反映了海水淡化水对管壁钙垢的溶解过程。
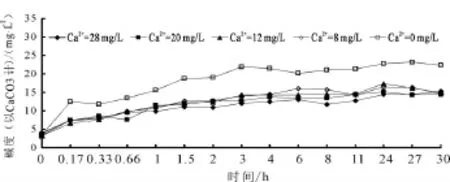
图5 不同初始钙离子浓度下出水中碱度变化曲线
2.4pH值的变化情况
不同初始钙离子浓度下的出水中的pH值变化曲线,如图6所示。由图6可以看出,不论海水淡化水中初始钙离子浓度是多少,在其进入管网之后,pH值迅速升高,随着时间的增加,pH值增加的速度变慢,最终都会稳定在9.4左右。也就是说,管道中水体最终的pH值与初始水体中钙离子含量无关。
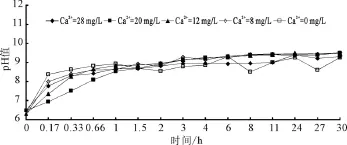
图6 不同初始钙离子浓度下出水中pH值变化曲线
导致这一结果的主要原因是实验中添加氯化钙的海水淡化水碱度低,不具有对pH变化缓冲的能力;而当管壁和水体达到平衡以后,水体的碱度接近于一个常数,此时对应的pH也是一个相对稳定的数值,并且由于碳酸钙的溶出,使得水体呈弱碱性。值得注意的是,我国的生活饮用水标准中规定的pH值范围是6.5~8.5,按照此标准,没有pH缓冲能力的海水淡化水进入管网后的1 h之内,水体的pH值全部超标。为了避免这一现象的发生,在海水淡化水矿化过程中,应当通过添加碳酸氢盐的方式保证水体有一定的碱度。
2.5朗格利尔饱和指数(LSI)的变化情况
朗格利尔饱和指数(LSI)经常被用于判断管道中固液界面上碳酸钙是沉积还是溶出[5]。如果LSI<0,则碳酸钙从管壁溶出;反之LSI>0,碳酸钙从水中沉积到管壁上[6]。图7所示为不同初始钙离子浓度下出水中朗格利尔饱和指数(LSI)的变化曲线,当钙离子浓度为0 mg/L时,朗格利尔饱和指数(LSI)一直小于0,此时的水具有很强的侵蚀性;当钙离子浓度超过8 mg/L时,经过一段时间之后出水中的LSI最终会大于0,说明在海水淡化水中添加钙离子,可以降低其对管壁的侵蚀性;而且随着初始钙离子浓度的增加,系统达到LSI>0的时间越短,当钙离子浓度为8 mg/L时6 h后LSI>0,而当钙离子浓度为20和28 mg/L时3 h后LSI>0,进一步说明了钙离子浓度的升高有助于管道中的系统达到稳定状态。
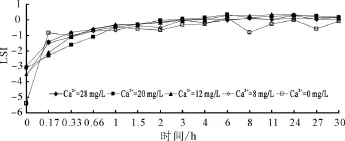
图7 不同初始钙离子浓度下出水中LSI变化曲线
2.6浊度的变化情况
我国生活饮用水卫生标准对浊度的规定值为1NTU。图8是不同初始钙离子浓度下出水的浊度变化曲线。由图8可知,在海水淡化水刚进入管网后短时间内水中的浊度变化较大,40 min以后浊度值波动性变小,水质基本上达到稳定。当入水的钙离子浓度为小于12 mg/L时,系统稳定后水中的浊度值部分时间会超过1NTU;当钙离子浓度大于20 mg/L时,系统稳定后水中的浊度值全部达标。
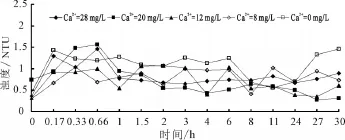
图8 不同初始钙离子浓度下出水中浊度变化曲线
这一结论与前文提到的两段式腐蚀机理相吻合,即入水中钙离子浓度低,会导致管壁的固体物脱落,导致水中浊度增加;而增加入水中的钙离子有助于降低出水的浊度。
3 结论
通过上述研究,可以得出以下结论:
(1)当海水淡化水进入镀锌管时,在淡化水中加入一定浓度的钙离子有助于增强管道系统的化学稳定性,综合考虑建议在海水淡化水中加入的钙离子含量不少于28 mg/L。
(2)提出了海水淡化水对管道内部腐蚀的两段式理论,即当水中钙离子浓度较低时水体对管壁的影响主要是侵蚀作用,而随着钙离子以及腐蚀性阴离子浓度的增加,水体对管壁腐蚀作用成为影响水质和管道系统稳定性主要因素。为了降低出水的pH和总铁,建议在矿化过程中增加水中的碱度,并尽可能降低氯离子浓度。
参考文献
[1]王春,王长平,刘旭辉.深圳梅沙片区供水管网黄水成因分析及控制对策[J].中国给水排水,2012,28(9):44-47.
[2]Zhi Jian Tang,Seunqk Wan Hong,Wei Zhong Xiao,et al. Characteristics of iron corrosion scales established under blending of ground surface and saline waters and their im⁃pacts on iron release intlepipe distribution system[J].Corro⁃sion Science,2006,48:322-342.
[3]Liat Birnhack,Nikolay Voutchkov,Ori Lahaw.Fundamental chemistry and engineering aspects of post-treatment process⁃es for desalinated water-A Review[J].Desalination,2011,273:6-22.
[4]周韬,铁质给水管道内壁腐蚀对管网水质影响研究[D].长沙:湖南大学,2006.
[5]Rushing J C,L S McNeill,M Edwards.Some effects of aque⁃ous silica on corrosion of iron[J].Water Research,2003,37 (5):1080-1090.
[6]骆碧君,刘志强,郑毅,等.海水淡化水在既有管网中的水质变化研究[J].中国给水排水,2009,25(23):57-60.
中图分类号:TV213.9;P746
文献标识码:A
文章编号:1004-7328(2016)03-0060-05
DOI:10.3969/j.issn.1004-7328.2016.03.019
收稿日期:2016—02—25
作者简介:张凯(1976—),男,高级工程师,主要从事水资源研究与保护工作。CCPP都只反映了碳酸钙在管壁上沉积形成钙垢的过程,尽管目前公认管壁上沉积的碳酸钙薄层可以减缓水体对管壁的腐蚀,但是并没有阐述腐蚀的机理。Larson和Skold于1957年提出了拉森比率(LR)作为水质稳定性的判别指标,该指标描述了碳酸氢根离子对管壁的保护作用以及氯离子和硫酸根离子对管壁的腐蚀作用之间的平衡关系。

