微量肉汤稀释法在肠杆菌科细菌药敏试验中的应用研究
吴倩倩孙铭艳王保强王 楠陶元勇*
微量肉汤稀释法在肠杆菌科细菌药敏试验中的应用研究
吴倩倩①孙铭艳②王保强②王 楠②陶元勇②*
[摘要]目的:对微量肉汤稀释法检测抗菌药物最低抑菌浓度(MIC)的准确性进行评价,为其应用推广奠定基础。方法:收集351株肠杆菌科细菌,采用微量肉汤稀释法和自动化仪器法检测抗菌药物的MIC,比较两者药敏结果的一致性。结果:微量肉汤稀释法与自动化仪器法的药敏结果比较差异无统计学意义,两种方法的药敏检测结果无明显的差异。结论:微量肉汤稀释法具有较高的准确性,利用该方法检测抗菌药物MIC的成本低于自动化仪器法,药物选择更加灵活,可应用于常规工作,为临床合理使用抗生素提供依据。
[关键词]微量肉汤稀释法;自动化仪器法;肠杆菌科细菌

吴倩倩,女,(1990- ),硕士研究生。潍坊医学院医学检验学系,研究方向:感染性疾病实验诊断、细菌分类鉴定及耐药性。
[First-author’s address] Department of Medical Laboratory, Weifang Medical University, Weifang, Shandong 261053,China.
肠杆菌科细菌是引起医院感染的重要病原菌,其分离率>50%,可致化脓性疾病、肺炎、脑膜炎、菌血症以及伤口、泌尿道和肠道的感染。然而近年来随着抗生素的广泛应用,肠杆菌科细菌的耐药率持续上升[1]。细菌药敏试验是检测抗菌药物在体外对细菌有无抑制的方法,细菌药敏试验的方法有纸片扩散法、肉汤稀释法、琼脂稀释法、Etest法以及自动药敏仪法。由于纸片扩散法、稀释法等传统方法具有操作简单、成本低廉的特点,是目前常用的药敏试验方法,但是检测结果容易受到多方面因素的影响[2]。自动化仪器法具有便捷、快速的特点,但其成本较高[3]。本研究对351株肠杆菌科细菌,分别采用微量肉汤稀释法、自动化仪器法测定其药敏结果,测定抗菌药物的最低抑菌浓度(minimum inhibitory concentration,MIC),并统计分析两种方法检测药敏结果的一致性。
1 材料与方法
1.1 菌株来源
收集潍坊医学院附属医院2015年1-6月的351株肠杆菌科,去除同一患者相同部位的重复菌株,经细菌分析仪鉴定确认。质量控制菌株为铜绿假单胞菌ATCC27853、大肠埃希菌ATCC25922和大肠埃希菌ATCC35218(为监控β-内酰胺类/β-内酰胺酶抑制剂纸片用),肺炎克雷伯菌ATCC70060、阴沟肠杆菌ATCC700323均购自国家卫生计生委临检中心。
1.2 仪器及试剂
采用梅里埃VITEK2 compact自动细菌鉴定仪(法国);HNTD5-TDR比浊仪(北京)和xk细菌鉴定分析仪(鑫科生物技术股份有限公司,山东)。使用的10 ml样本稀释液、15 ml肉汤稀释液、微量肉汤稀释法药敏反应板(96孔)、盐水分配器、无菌试管、移液器、GN革兰阴性细菌鉴定卡以及AST-GN革兰阴性细菌药敏卡均来自法国梅里埃公司。
1.3 药敏试验方法
1.3.1 微量肉汤稀释法
取样本稀释液(10 ml/瓶)1支,使用无菌接种环,从待检细菌的平板中挑取待检菌落,加入样本稀释液中,制成约0.5麦氏单位均匀的菌悬液备用。使用微量移液器吸取已制备好的菌悬液30 μl加入至对应的培养基内(15 ml/瓶的培养液),进行稀释并混匀,配制成药敏增菌液,再按每孔100 μl的量,使用微量移液器吸取药敏增菌液加入到其余各孔内,盖好盒盖。将接种完毕的试剂盒放入37 ℃培养箱中,培养18~24 h后取出试剂盒,打开细菌鉴定和(或)药敏分析仪软件点击“鉴定”键,选择与生化鉴定组一致的“患者的检验编号”,打开试剂盒进出仓盖,放在试剂盒托盒上并固定,盖上试剂盒进出仓盖;点击“自动分析”后仪器自动分析结果。
1.3.2 自动化仪器法
取无菌试管2支,使用盐水分配器各取3 ml的生理盐水加入试管中,使用无菌接种环,从待检细菌的平板中挑取待检菌落,比浊仪配制0.5麦氏单位均匀的菌液。使用微量移液器吸取145 μl的菌液到药敏管中,配成药敏菌液,将菌液管和药敏管中分别放入相应的GN革兰阴性细菌鉴定卡及AST-GN革兰阴性细菌药敏卡,经VITEK2 compact自动细菌鉴定仪检测鉴定其药敏结果。
1.4 统计学方法
采用统计软件SPSS 19.0对检测数据进行统计,两种方法的准确性比较采用x2检验,α=0.05,以P<0.05为差异有统计学意义。
2 结果
2.1 肠杆菌科细菌的分布及构成比
本研究共分离非重复性肠杆菌科细菌351株,前6位细菌依次为大肠埃希菌(占57.55%)、肺炎克雷伯菌(占13.96%)、奇异变形杆菌(占9.12%)、阴沟肠杆菌(占6.84%)、产酸克雷伯菌(占3.99%)以及普通变形杆菌(占%1.99),菌株的分布及构成比见表1。

表1 肠杆菌科细菌的分布及构成比(%)
2.2 质量控制菌株的MIC测定
药敏试验孔浊度100%落于质量控制范围内,抑菌圈直径相差≤2 mm,总的敏感、中介和耐药的符合率为100%。采用微量肉汤稀释法与自动化仪器法检测351株肠杆菌科细菌对13种抗菌药物进行质量控制菌株的MIC测定,其中第6号抗菌药物的两种方法比较差异有统计学意义(x2=6.029,P<0.05),其余12种抗菌药物均无差异,见表2。
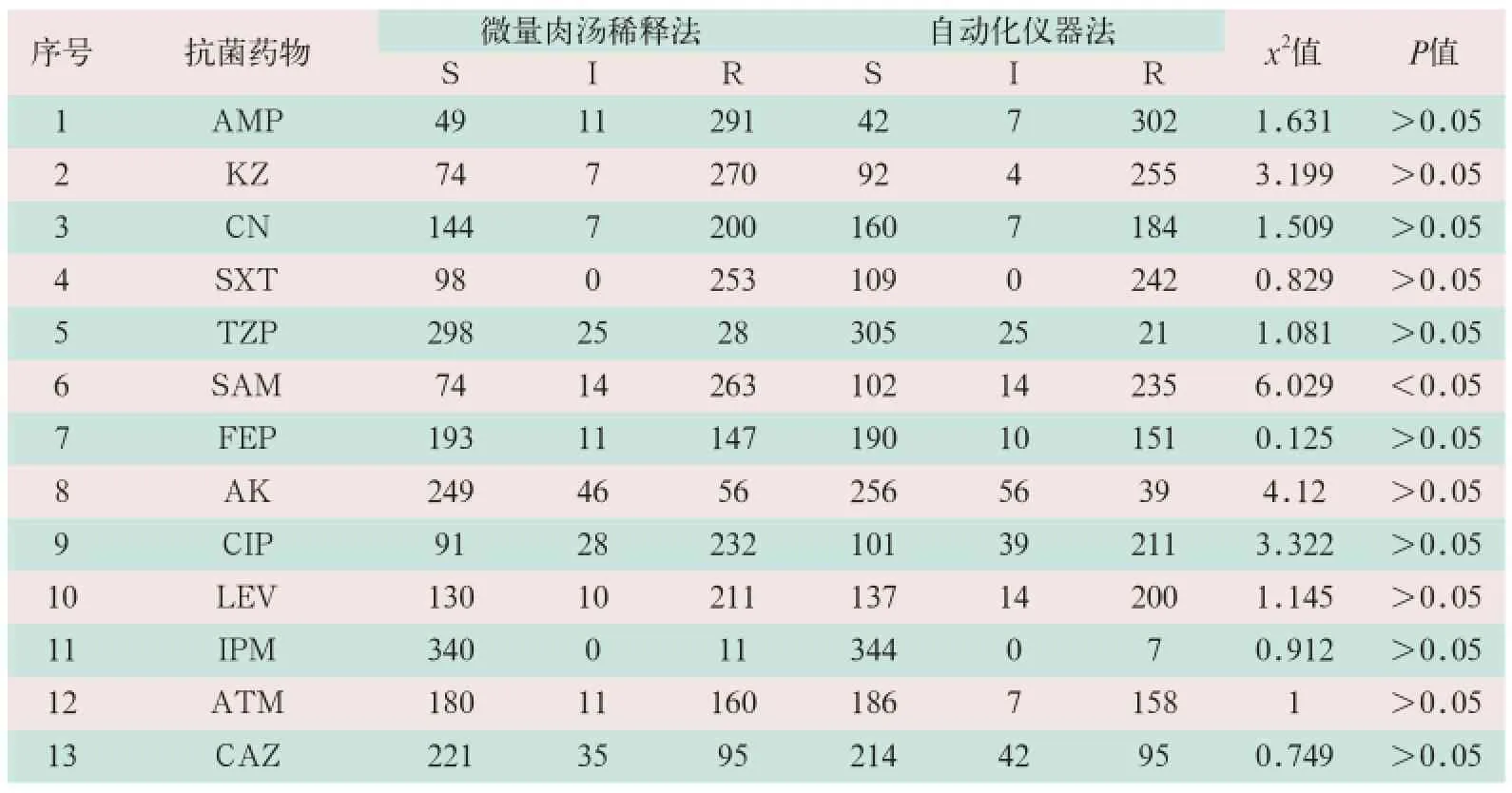
表2 微量肉汤稀释法及自动化仪器法检测13种抗菌药物的药敏试验结果
3 讨论
微量肉汤稀释法是将抗菌药物包被在反应孔中,每种抗菌药物按从高到低的浓度梯度排列,不同抗菌药物采用不同的浓度梯度,抗菌药物浓度以2的倍数递增。反应板中均设有阳性对照孔和阴性对照孔,以帮助判断结果,保证结果的准确性。加入菌液孵育18~24 h后,通过检测反应孔中菌液的浊度,判断是否有细菌生长,从而测得该药物的MIC。
WHO推荐使用的药敏试验是K-B法,其优点是简单及药物选择灵活性强[4]。K-B法是通过测量抗菌药物抑菌环的大小来判断抗菌药物的敏感情况,是一种定性试验,耗时长,不能及时报告细菌的药敏结果[5]。20世纪末,Craig[6]的一项调查表明,药敏方法的选择趋向于定量技术,即测定MIC。微量肉汤稀释法是通过测定MIC来判断细菌对抗菌药物敏感情况,是一种定量的方法,既快速又准确。
本研究选用两种方法检测351株肠杆菌科细菌的药敏结果,经x2检验,微量肉汤稀释法与自动化仪器法测定12种抗生素的药敏结果的差异无统计学意义,仅有1种抗生素有差异,可认为两者的结果具有一致性,即微量肉汤稀释法的药敏结果基本可靠。自动化检测系统其优点是快速,并具有强大的统计分析功能,但自动化仪器也有一定的局限性,首先仪器的成本高,其次药物的选择缺乏灵活性,再者检测一些特殊菌的耐药性时有困难[7]。微量肉汤稀释法较自动化法成本低,可根据临床用药习惯选择药物,能够检测一些厌氧菌及苛养菌。微量肉汤稀释法的试剂板基本能满足临床常见细菌的鉴定和药敏试验,可根据CLSI标准设计药敏板和报告软件[8]。
本研究结果显示,分离菌中居前6位的分别是大肠埃希菌、肺炎克雷伯菌、奇异变形杆菌、阴沟肠杆菌、产酸克雷伯菌以及普通变形杆菌,与吕媛等[9]2010年原卫生部全国细菌耐药检测报告一致,表明以上6种细菌是肠杆菌科最常见的分离菌。
研究表明,革兰阴性菌的临床分离率高于革兰阳性菌,其中革兰阴性菌中肠杆菌科的分离率最高,故本研究选用肠杆菌科细菌作为研究对象,可使研究结果更具有临床价值[10]。大肠埃希菌是肠杆菌科细菌中分离率最高的细菌,近年来随着抗生素的滥用,产ESBLs的大肠埃希菌不断增加,大肠埃希菌的高分离率和产ESBLs大肠埃希菌的增多,要求药敏检测应准确可靠[11]。
4 结语
随着抗生素的广泛应用,临床耐药菌株不断的增加,药敏试验的作用显得十分重要。药敏试验结果直接指导临床用药,故其准确性至关重要[12]。本研究结果表明,微量肉汤稀释法检测抗菌药物的MIC,是一种操作简便、成本低、准确性高和适合于常规检测的方法。
参考文献
[1]Hughes KA,C'ornwall J,Theis JC',et al. Bacterial contamination of unused, disposable norrsterile gloves on a hospital or thopaedic ward[J].Australas Med J,2013,30(6):331-338.
[2]Wheat PF.History and development of antimicrobial susceptibility testing methodology[J].Journal of Antimicrobial Chemotherapy,2001,48(1):1-4.
[3]王金良.我国药敏试验标准化的进程与展望[J].中华检验医学杂志,2006,29(1):14-16.
[4]张鑫海.Microscan AS-4自动微生物分析仪在细菌室间质控中的评价[J].上海医学检验杂志,2000,15(1):22-23.
[5]王淑娟.现代实验诊断学手册[M].北京:北京医科大学,中国协和医科大学联合出版,1995:511.
[6]Craig WA.Qualitative susceptibility tests versus quantitative MIC test[J].Diagn Microbiol Infect Dis,1993,16(3):231-236.
[7]Ongut G,Daloglu AE,Baysan BO,et al. Evaluation of a chromogenic medium for detection of extended-spectrum-betalactamase-producing Escherichia coli and Klebsiella pneumoniae strains.[J].Clin Lab,2014,60(7):1213-1215.
[8]范虹,李彦锋.国产微量肉汤稀释法药敏试剂检测常见多重耐药菌[J].国际检验医学杂志,2013,34(20):2735-2736.
[9]吕媛,李耘,崔兰卿,等.2010年度卫生部全国细菌耐药监测报告:肠杆菌科细菌耐药监测[J].中华医院感染学杂志,2011,21(24):5138-5143.
[10]刘玉岭,汪玉龙,宋文,等.2012年综合医院临床分离病原菌分布及耐药性分析[J].临床合理用药,2015,8(5):3-5.
[11]王亚华,祝永明,邵平扬.产超广谱β-内酰胺酶大肠埃希菌的耐药性分析[J].中华医院感染性杂志,2015,25(6):1221-1223.
[12]邹自英,雷启丽,刘媛,等.鲍曼不动杆菌替加环素不同药敏检测方法敏感性对比分析[J].国际检验医学杂志,2015,36(7):880-881.
①潍坊医学院医学检验学系 山东 潍坊 261053
②潍坊医学院附属医院检验科 山东 潍坊 261053
[文章编号]1672-8270(2016)05-0097-03 [中图分类号] R446.5
[文献标识码]A
DOI:10.3969/J.ISSN.1672-8270.2016.05.030
作者简介
收稿日期:2016-01-20
*通讯作者:taoyuanyong@163.com
Application of micro broth dilution method in the drug sensitivity test of enterobacteriaceae bacteria
WU Qian-qian, SUN Ming-yan, WANG Bao-qiang, et al
China Medical Equipment,2016,13(5):97-99.
[Abstract] Objective: To evaluate the accuracy of minimal inhibitory concentration(MIC) of anti-microbial agents by micro broth dilution method to popularize in application. Methods: 351 strains of enterobacteriaceae bacteria were collected in our hospital from January 2015 to June. The MIC of antibacterial drugs was measured by the two methods, including micro broth dilution method and automatic instrument method, in order to compare the consistency of the results of drug sensitivity. Results: There is no significant difference between the results of the drug sensitivity of the micro broth dilution method and the automatic instrument method. Conclusion: It shows that the micro broth dilution method has higher accuracy. The cost of detecting the MIC of antibacterial drugs is lower than that of automatic instrument. And it is more flexible in drug election. This method can provide the basis for rational use of antibiotics in clinic and can be used in regular work.
[Key words]Micro broth dilution method; Automatic instrument method; Enterobacteriaceae bacteria

