胰腺癌TOMO高剂量少分次放射治疗后胃镜下黏膜损伤相关因素研究*
刘 纤任 刚李莉琴夏廷毅*
胰腺癌TOMO高剂量少分次放射治疗后胃镜下黏膜损伤相关因素研究*
刘 纤①任 刚②李莉琴②夏廷毅①*
[摘要]目的:探讨采用螺旋断层放射治疗高剂量、少分次模式治疗胰腺癌的胃镜下胃肠黏膜损伤表现,及其与剂量学和临床因素的相关性。方法:选取23例胰腺癌患者,并接受TOMO设备治疗,按照高剂量少分次剂量模式,放射治疗前(1周内)及放射治疗结束后(1周内)均行胃镜检查。采用CTCAE v4.0分级标准和胃镜下黏膜反应标准分级,分析胃镜下分级与CTCAE分级、临床因素、胃及十二指肠剂量体积参数间的关系。Logistic多因素回归分析筛选胃镜下分级的影响因素。结果:Spearman相关分析显示,十二指肠Dmax与胃镜下≥2级放射性胃肠损伤的发生具有相关性(r=0.523,P<0.05);十二指肠Dmax、D1(1 cm3所接受的最大剂量)、D3(3 cm3所接受的最大剂量)、V45与≥胃镜下3级放射性胃肠损伤的发生具有相关性(r=0.599,r=0.464,r=0.428,r=0.465;P<0.05)。十二指肠Dmax、D1、D3、V40、V45与≥胃镜下4级放射性胃肠损伤的发生具有统计学意义(r=0.497,r=0.457,r=0.464,r=0.441,r=0.479;P<0.05)。多因素Logistic回归结果显示,胃镜下放射性胃肠黏膜损伤分级与CTCAE分级、临床因素及剂量参数间无差异。结论:胰腺癌螺旋断层放射治疗高剂量、少分次模式治疗后,胃镜下胃肠黏膜损伤的发生与主观症状、临床因素及剂量学因素无相关性,有待进一步研究。
[关键词]胰腺癌;放射性反应;螺旋断层调强放疗;胃镜

刘纤,女,(1991- ),硕士研究生,医师。安徽医科大学空军临床学院、空军总医院肿瘤放疗科,从事肿瘤放射治疗研究工作。
LIU Xian, REN Gang, LI Li-qin, et al
China Medical Equipment,2016,13(5):56-60.
[Abstract] Objective: To observe the endoscopic findings of gastrointestinal toxicity in pancreatic adenocarcinoma patients following tomotherapy(TOMO) hypofractioned radiotherapy, and to explore the relationship between occurrence of gastrointestinal(GI) toxicity and clinical factors. Methods: Analysis of the endoscopy before and after radiation of 23 pancreatic adenocarcinoma patients received TOMO hypofractioned radiotherapy. GI toxicity was scored by the National Cancer Institute Common Terminology Criteria for Adverse Events (CTCAE) version 4.0 and criteria of GI toxicity in endoscopy. Logistic regression models were performed to identify risk factors associated with GI toxicity. Results: On UVA, only Dmaxof the duodenum was significantly related with ≥grade II GI toxicity based on endoscopy(r=0.523, P<0.05). The Dmax, D1, D3, V45of the duodenum were significantly related with ≥grade III toxicity based on endoscopy(r=0.599, r=0.464, r=0.428, r=0.465, P<0.05), and the Dmax, D1, D3, V40, V45of the duodenum were significantly related with ≥grade IV GI toxicity based on endoscopy(r=0.497, r=0.457, r=0.464, r=0.441, r=0.479,P<0.05). On MVA, There was no correlation between GI toxicity based on endoscopy and GI toxicity based on CTCAE (P>0.05). No clinical and dose-volume parameters was significantly associated with the GI toxicity based on endoscopy (P>0.05). Conclusions: There was no correlation between subjective symptoms, clinical and dose-volume parameters and GI toxicity based on endoscopy after TOMO hypofractioned radiotherapy for pancreatic adenocarcinoma and it is worth of a step further research.
[First-author’s address] Clinical College of Air Force, Anhui Medical University, Beijing, 100142, China.
螺旋断层调强放射治疗(tomotherapy,TOMO)是最新一代的放射治疗技术,使用兆伏级CT图像在线引导的调强放射治疗,在围绕治疗床360o旋转照射病灶的同时,治疗床沿轴向同步前进穿过机架,其结合了直线加速器和螺旋CT的特点,能针对病灶精准定位,并形成理想的剂量分布,提高对肿瘤的照射剂量,降低了危及器官的受照剂量,更好的保护了正常组织,患者的不良反应相对较轻[1]。同样的放射治疗剂量下,相对于传统放射治疗技术如三维适形放射治疗技术(3-dimensional conformal radiation therapy,3DCRT)及调强放射治疗(intensity modulated radiation therapy,IMRT),TOMO放射治疗相关的正常组织并发症发生率低,患者对治疗的耐受性要好。夏廷毅等[2]利用TOMO技术结合伽马刀治疗胰腺癌方面的经验,提出采用PTV、CTV、GTV-IGTV的处方剂量分别为50 Gy、60 Gy和70~80 Gy的高剂量少分次模式治疗胰腺癌患者,改变了常规单次2 Gy的剂量模式[3]。TOMO按照高剂量少分次治疗模式治疗胰腺癌疗效得到肯定,依靠主观临床表现CTCAE分级其不良反应可耐受,但缺乏客观指标判别放射治疗导致的胃肠道黏膜损伤[4]。基于此,本研究旨在研究胰腺癌TOMO高剂量少分次模式放射治疗后胃镜下急性胃肠黏膜损伤情况,及其与临床因素、剂量参数间的相关性,有利于临床实践中更好的减轻胃肠道放射治疗损伤。
1 资料与方法
1.1 一般资料
选取2013年9月至2015年4月在空军总医院接受TOMO治疗的23例胰腺癌患者,按照高剂量少分次剂量模式,放射治疗前(1周内)及放射治疗结束后(1周内)均行胃镜检查。其中,男性12例,女性11例;年龄34~76岁,中位年龄60岁。9例患者有病理诊断。胰头颈部肿瘤患者10例,体尾部13例。分期采用胰腺肿瘤TNM分期(AJCC第7版),Ⅰ期0例,Ⅱ期1例,Ⅲ期11例,Ⅳ期11例,N0共9例,N1共14例。23例患者中,12例采用同步放化疗方案,11例采用单纯放射治疗方案。中位处方剂量为70 Gy(60~80 Gy),中位单次放射治疗剂量为4.66 Gy(3.00~5.33 Gy)。
1.2 纳入与排除标准
(1)纳入标准:①年龄在20~90岁;②卡氏(性能)评分量表(Karnofsky performance scale,KPS)评分≥70分;③放射治疗前未行胃及十二指肠切除的胰腺癌患者;④有完整DVH资料的胰腺癌患者;⑤放射治疗前未行腹部照射的患者;⑥完成放射治疗计划的胰腺癌患者;⑦放射治疗前后均行胃镜检查的胰腺癌患者。
(2)排除标准:①失访患者;②恶病质状态;③既往曾有精神系统疾病史患者;④怀孕期及哺乳期的妇女;⑤对造影剂过敏的胰腺癌患者。
1.3 仪器设备
采用西门子SomAToM Emotion 16层螺旋CT(德国)定位,使用Tomotherapy Hi-Art(美国Accuray公司)进行放射治疗。
1.4 放射治疗方法
1.4.1 CT定位
患者空腹口服3%碘帕醇250 ml,15 min后立即行CT定位扫描,取仰卧位,双手上举,采用胸腹部热塑成型体网固定,碘帕醇100 ml静脉滴注增强扫描,扫描范围为肝顶部至髂骨上缘,平静呼吸状态下自然扫描,层厚4 mm,间距4 mm,定位图像传至靶区勾画系统。
1.4.2 靶区勾画
由放疗科医生勾画靶区肿瘤内可见靶体积(internal gross tumor volume,IGTV)、肿瘤体积(GTV)、临床靶体积(CTV)、体内移动靶体积(ITV)、计划靶体积(PTV)及危及器官(胃、十二指肠、小肠、肝、肾及脊髓)。GTV为以CT上所见的肿瘤体积为主,参照MRI及PET-CT勾画靶区。当GTV≥5 cm时,于GTV中内缩3 mm定义为IGTV。CTV为GTV外扩5 mm,ITV为CTV于头脚方向外扩10 mm,左右外扩5 mm,PTV在ITV外扩3 mm。
1.4.3 处方剂量
分别给予PTV、CTV、GTV~IGTV的处方剂量为50 Gy、60 Gy和70~80 Gy,分15~20次。要求胃Dmax<60 Gy,胃D1(胃体积1 cm3所接受的最大剂量)≤55 Gy,D3≤50 Gy,D5≤45 Gy,D10≤40 Gy。十二指肠Dmax<55 Gy,D1≤50 Gy,D3≤45 Gy,D5≤40 Gy,D10≤35 Gy。
1.5 分析参数
(1)剂量学参数。分析的剂量学参数包括处方剂量,单次剂量,CTV,生物效应剂量(biological effective dose,BED),胃Dmax,胃D1、D3、D5和D10,胃V5(接受5 Gy的胃绝对体积)、V10、V15、V20、V25、V30、V35、V40、V45和V50。十二指肠Dmax,十二指肠D1、D3、D5和D10,十二指肠V5、V10、V15、V20、V25、V30、V35、V40、V45和V50。
(2)临床因素。纳入研究的临床因素有年龄、性别、同步化疗、疗前CA199以及肿瘤位置。
1.6 不良反应评价方法
胃镜分级标准[5]:Ⅰ级,黏膜光滑,无变形,绒毛好;Ⅱ级,黏膜轻度充血、肿胀,血管网显露,绒毛感不明显;Ⅲ级,黏膜充血、肿胀,伴组织脆性增加,接触性出血;Ⅳ级,黏膜质脆出血、糜烂,溃疡形成,肠腔狭窄。主观症状分级标准采用CTCAE V4.0标准评价。
1.7 统计学方法
采用SPSS 20.0统计软件对所有数据进行分析,计数资料采用卡方检验,变量间的相关性采用Spearman相关性检验,Logistic多因素回归分析筛选放射性胃肠损伤的影响因素。全部检验为双侧检验,检验水准为α=0.05,以P<0.05为差异有统计学意义。
2 结果
2.1 CTCAE标准分级中胃肠不良反应发生情况
在23例胰腺癌患者放射治疗后有10例(占43%)出现急性不良反应,其中3例(占13%)Ⅰ级反应(恶心1例,呕吐1例,腹胀1例);6例(占26%)Ⅱ级反应(3例恶心,2例呕吐,1例食欲下降);1例(占4.3%)Ⅲ级反应(恶心)。无Ⅳ级以上反应。
2.2 胃镜标准分级中胃肠黏膜损伤发生情况
Ⅰ级胃黏膜损伤10例(占43%),Ⅱ级胃黏膜损伤2例(占9%),Ⅲ级胃黏膜损伤3例(占13%),Ⅳ级胃黏膜损伤8例(占35%)。放射治疗前后胃镜对比胃黏膜损伤加重10例(占43.47%),其中充血3例,糜烂4例,充血伴糜烂1例,溃疡1例,出血1例。1例放射治疗前胃体小弯侧局限性出血患者放射治疗期间予以抑酸及护胃治疗后胃黏膜好转;11例未出现放射治疗后十二指肠黏膜损伤,无Ⅰ级十二指肠黏膜损伤,Ⅱ级反应3例,Ⅲ级1例,Ⅳ级8例。放射治疗前胃镜下提示2例十二指肠黏膜糜烂、1例十二指肠充血水肿,经放射治疗间给予抑酸及保护胃黏膜治疗后十二指肠黏膜好转。胃镜下胃肠黏膜损伤,见表1、如图1所示。
2.3 临床及剂量学参数与胃肠黏膜损伤发生的相关性
胃镜下Ⅱ级及以上放射性胃肠黏膜损伤的统计结果:Spearman相关分析中,十二指肠Dmax与≥Ⅱ级胃肠黏膜损伤的发生具有相关性(r=0.523,P=0.01)。CTCAE分级,年龄,性别,同步化疗,疗前CA199,肿瘤位置,总剂量,单次剂量,CTV,BED,胃Dmax,胃和十二指肠的D1、D3、D5、D10、 V5~V50与≥Ⅱ级胃肠黏膜损伤的发生无相关性。将相关分析中P<0.05的因素进行Logistic多因素回归分析,结果显示,十二指肠Dmax与≥Ⅱ级胃肠黏膜损伤的发生无相关性,P值>0.05,见表2。

表1 23例胰腺癌患者放射治疗前、后胃镜下胃肠不良反应情况[例(%)]

表2 胃镜下Ⅱ级及以上放射性胃十二指肠黏膜损伤的Logistic回归分析
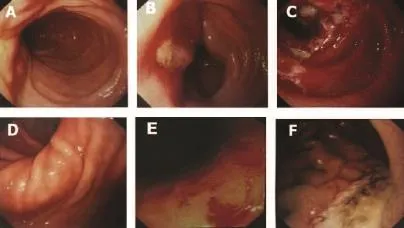
图1 胃镜下黏膜情况示图
胃镜下Ⅲ级及以上放射性胃肠黏膜损伤的统计结果:Spearman相关分析中,十二指肠的Dmax、D1、D3和V45与≥Ⅲ级胃肠黏膜损伤的发生均具有相关性(r=0.599, r=0.464,r=0.428,r=0.465;P <0.05)。CTCAE分级,年龄,性别,同步化疗,疗前CA199,肿瘤位置,总剂量,单次剂量,CTV,BED,胃Dmax、D1、D3、D5、D10、V5~V50和十二指肠的D5、D10、V5~V40、V50与≥Ⅲ级胃肠黏膜损伤的发生无统计学意义。将相关分析中P<0.05的因素进行Logistic多因素回归分析,结果显示,十二指肠Dmax、D1、D3、V45与≥Ⅲ级胃肠黏膜损伤的发生无相关性,P值均>0.05,见表3。
胃镜下Ⅳ级及以上放射性胃肠黏膜损伤的统计结果:Spearman相关分析中,十二指肠Dmax、D1、D3、V40、V45与≥Ⅳ级胃肠黏膜损伤的发生相关性比较具有统计学意义(r=0.497,r=0.457,r=0.464,r=0.441,r=0.479;P<0.05)。CTCAE分级,年龄,性别,同步化疗,疗前CA199,肿瘤位置,总剂量,单次剂量,CTV,BED,胃Dmax、D1、D3、D5、D10、V5~V50和十二指肠的D5、D10、V5~V35、V50与≥Ⅳ级胃肠黏膜损伤的发生无相关性。将相关分析中P值<0.05的因素进行Logistic多因素回归分析,十二指肠Dmax、D1、D3、V40、V45与≥Ⅳ级胃肠黏膜损伤的发生无相关性,P值均>0.05,见表4。

表3 胃镜下Ⅲ级及以上放射性胃十二指肠黏膜损伤的Logistic回归分析

表4 胃镜下Ⅳ级及以上放射性胃十二指肠黏膜损伤的Logistic回归分析
3 讨论
胰腺临近胃肠道,放射治疗导致的胃肠损伤是胰腺肿瘤放射治疗最常见的并发症,亦是提高照射剂量的主要剂量限制因素,胃肠道损伤发生直接影响患者的生存质量[6-13]。国内外学者[14-18]已探索出有关预测胰腺癌放射治疗后的胃肠损伤的剂量学参数,但目前尚无统一标准。不同研究报道显示,影响胰腺癌放射治疗后的胃肠损伤的剂量学参数亦不同。但结论较为一致,均提示受到一定剂量以上照射的胃、十二指肠绝对或相对体积的大小与放射性胃肠损伤的发生率及严重程度相关。本课题组采用TOMO高剂量少分次模式治疗胰腺癌,观察患者主观症状CTCAE分级,Ⅲ级胃肠道反应为9.1%(3/33)[2]。本研究在评价临床症状CTCAE分级的基础上,进一步观察放射治疗带来的胃镜下黏膜改变。
本研究中放射治疗后胃镜下出现胃肠损伤共17例(占73.9%)患者,但发生高级别损伤的只有7例(占30.4%),其中5例溃疡患者予以抑酸及保护胃黏膜治疗后基本控制,2例放射性出血患者仅通过内科药物治疗即可止血。Chon等[19]研究了123例肝癌患者放射治疗前与放射治疗后1个月胃镜下胃肠损伤变化情况,共65例(占52.8%)患者出现胃肠黏膜损伤,其中32例(占26%)及20例(占16.3%)患者分别发生放射性胃、十二指肠溃疡,13例(占10.6%)发生放射性出血,且大部分患者需行内镜下止血治疗。本组高级别胃肠黏膜损伤低于Chon等[19]报道的结果,考虑可能与剂量模式、治疗期间保护用药等因素有关。
本研究中2例放射性出血患者,其中1例胃出血患者胃的绝对剂量均高于中位剂量,且高剂量区绝对体积均高于中位体积,考虑与接受剂量有关;另1例患者十二指肠的绝对剂量及高剂量区绝对体积虽然低于中位剂量,但该例放射治疗前胃镜提示十二指肠溃疡,提示放射治疗前胃镜检查是必要的检查方式。一方面可排除治疗前即有胃肠道损伤的情况,另一方面对于已有胃肠道黏膜损害的患者,在放射治疗前给予抑酸、保护胃黏膜等治疗,在处方剂量制定时也可适当调整,降低严重放射治疗损伤的发生率。
目前尚缺乏放射治疗导致的胃镜下黏膜损伤评价标准,本研究采用薛安静等[5]报道的胃镜下黏膜损伤评价分级标准,此前其与CTCAE分级标准关系尚不得而知。本研究统计结果提示,采用该标准分级所得的胃镜下黏膜损伤与CTCAE分级无明显相关。本研究中CTCAE分级≥Ⅱ级不良反应发生率为26.08%,而胃镜下Ⅳ级黏膜糜烂、溃疡及出血的发生率为34.78%,胃镜标准下高级别胃肠损伤的发生率要高于以CTCAE为评价标准的发生率。具体分析发现,2例胃镜下出现脆性出血的患者,自身并无明显临床不适症状,提示仅以主观症状为主的CTCAE评价标准可能会忽略胃肠损伤发生的情况。因此,建议放射治疗后行胃镜观察患者胃肠黏膜损伤是必要的。目前,国内外尚无有关放射治疗后胃镜下黏膜损伤相关因素的研究,本研究并未得出其与年龄、性别及同步放化疗等临床因素,故有待进一步研究。
综上所述,放射性胃肠损伤为胰腺癌放射治疗的重要剂量限制因素,应用胃镜来评估放射性胃肠损伤是必要的,仍需要进一步扩大样本量研究影响放射性胃肠损伤发生的剂量限制参数,以帮助优化放射治疗计划及提高患者的生命质量。
参考文献
[1]Mackie TR,Holmes T,Swerdioff S,et al. Tomotherapy:a new concept for the delivery of dynamic conformal radiotherapy[J].Med Phys,1993,20(6):1709-1719.
[2]Xia T,Chang D,Wang Y,et al.Dose escalation to target volumes of helical tomotherapy for pancreatic cancer in the phase I-II clinical trial[J].Int J Radiat Oncol Biol Phys,2013,87(2):S303-S303.
[3]常冬姝,夏廷毅,李平,等.全身γ刀治疗局限期胰腺癌临床结果分析[J].中华放射肿瘤学杂志,2009,18(6):470-473.
[4]Ren G,Xia T,Wang Y.IMRT with capecitabine in advanced pancreatic cancer. In regard to Passoni et al[J].Int J Radiat Oncol Biol Phys,2014,89(2):431.
[5]薛安静,周平,王济东,等.胰腺癌放疗对胃、十二指肠黏膜损伤的胃镜观察31例[J].世界华人消化杂志,2013,21(21):2023-2030.
[6]Chang JS,Wang ML,Koom WS,et a1.Highdose helical tomotherapy with concurrent full-dose chemotherapy for locally advanced pancreatic cancer[J].Int J Radiat Oncol Biol Phys[J].Int J Radiat Oncol Biol Phys,2012,83(5):1448-1454.
[7]Mahadevan A,Jain S,Goldstein M,et a1. Stereotactic body radiotherapy and gemcitabine for locally advanced pancreatic cancer[J].Int J Radiat Oncol Biol Phys,2010,78(3):735-742.
[8]Sudo K,Yamaguchi T,Ishihara T,et a1.Phase II study of oral S-1 and concurrent radiotherapy in patients with unresectable locally advanced pancreatic cancer[J].Int J Radiat Oncol Biol Phys,2011,80(1):119-125.
[9]Schellenberg D,Kim J,Christman-Skieller C,et al. Single-fraction stereotactic body radiation therapy and sequential gemcitabine for the treatment of locally advanced pancreatic cancer[J].Int J Radiat Oncol Biol Phys,2011,81(1):181-188.
[10]Dholakia AS,Chang DT,Goodman KA,et al. A Phase 2 Multicenter Study to Evaluate Gemcitabine and Fractionated Stereotactic Body Radiation Therapy for Locally Advanced Pancreatic Adenocarcinoma[J].Int J Radiat Oncol Biol Phys,2013,87:S28.
[11]Chuong MD,Springett GM,Freilich JM,et al. Stereotactic body radiation therapy for locally advanced and borderline resectable pancreatic cancer is effective and well tolerated[J].Int J Radiat Oncol Biol Phys,2013,86(3):516-522.
[12]McGinn CJ,Zalupski MM,Shureiqi I,et al. Phase I trial of radiation dose escalation with concurrent weekly full-dose gemcitabine in patients with advanced pancreatic cancer[J].J Clin Oncol,2001,19(22):4202-4208.
[13]Small W Jr,Berlin J,Freedman GM,et al. Full-dose gemcitabine with concurrent radiation therapy in patients with nonmetastatic pancreatic cancer:A multicenter phase II trial[J].J Clin Oncol,2008,26(6):942-947.
[14]Murphy JD,Christman-Skieller C,Kim J,et al. A dosimetric model ofduodenal toxicity after stereotactic body radiotherapy for pancreatic cancer[J].Int J Radiat Oncol Biol Phys,2010,78(5):1420-1426.
[15]Cattaneo GM,Passoni P,Longobardi B,et al. Dosimetric and clinical predictors of toxicity following combined chemotherapy and moderately hypofractionated rotational radiotherapy of locally advanced pancreatic adenocarcinoma[J].Radiother Oncol,2013,108(1):66-71.
[16]Nakamura A,Shibuya K,Matsuo Y,et al. Analysis of dosimetric parameters associated with acute gastrointestinal toxicity and upper gastrointestinal bleeding in locally advanced pancreatic cancer patients treated with gemcitabine-based concurrent chemoradiotherapy[J].Int J Radiat Oncol Biol Phys,2012,84(2):369-375.
[17]Huang J,Robertson JM,Ye H,et al.Dosevolume analysis of predictors for gastrointestinal toxicity after concurrent full-dose gemcitabine and radiotherapy for locally advanced pancreatic adenocarcinoma[J].Int J Radiat Oncol Biol Phys,2012,83(4):1120-1125.
[18]Kelly P,Das P,Pinnix CC,et al.Duodenal toxicity after fractioned chemoradiation for unresectable pancreatic cancer[J].Int J Radiat Oncol Biol Phys,2013,85(3):143-149.
[19]Chon YE,Seong J,Kim BK,et al.Gastroduo¬denal complications after concurrent chemoradi¬ation therapy in patients with hepatocellular car¬cinoma:endoscopic findings and risk factors[J].Int J Radiat Oncol Biol Phys,2011,81(5):1343-1351.
①安徽医科大学空军临床学院 北京 100142
②空军总医院肿瘤放疗科 北京 100142
[文章编号]1672-8270(2016)05-0056-05 [中图分类号] R735.9
[文献标识码]A
DOI:10.3969/J.ISSN.1672-8270.2016.05.018
作者简介
收稿日期:2016-03-04
*基金项目:首都卫生发展科研专项(2014-1-5124)“以放疗为主的综合治疗不能手术局限期和(或)局部晚期胰腺癌的临床系列研究”;空军总医院面上课题(KZ2014037)“高剂量少分次放疗治疗局部晚期胰腺癌的前瞻性、随机对照研究”
*通讯作者:xtydyx1225@163.com
Predictive factors for gastrointestinal toxicity based on endoscopy after tomotherapy(TOMO)hypofractioned radiotherapy for pancreatic adenocarcinoma
[Key words]Pancreatic adenocarcinoma; Radiation-induced toxicity; Helical tomotherapy; Endoscopy

