寄生蜂毒液的功能与其主要作用成分
辛蓓++郑雅楠++刘佩旋


摘要:寄生蜂在寄主体内或体外产卵时,往往会注入毒液,使寄主麻痹、抑制寄主生长发育、抑制其免疫反应等作用,以确保寄生蜂的后代在寄主中生长发育。寄生蜂毒液的主要作用成分是蛋白质,而毒液蛋白包括酶、蛋白酶抑制剂、麻痹因子,这些蛋白质在害虫生防和生理学研究中都具有重要研究价值。本文综述了寄生蜂毒液作用和主要成分的研究进展,旨在为寄生蜂毒液的进一步研究提供理论基础,为今后害虫生防提供借鉴。
关键词:寄生蜂;毒液;功能;成分
中图分类号: S476.3文献标志码: A文章编号:1002-1302(2016)05-0171-04
寄生蜂是很多农林害虫的自然天敌,人工释放寄生蜂已经成为害虫综合治理中的重要生防手段。雌性寄生蜂在寄生时携带多种寄生因子,如毒液、萼液、多分DNA病毒等,毒液是所有寄生蜂都携带的寄生因子,可以保证子代蜂在寄主体内生长发育,毒液对寄主的影响主要包括:调控寄主的体液免疫、细胞免疫,抑制寄主的生长发育,影响寄主体内的内分泌激素水平以及调控寄主营养代谢等[1]。
寄生蜂的毒器官一般由毒囊和毒腺2部分组成,其中毒囊是用于储存毒液并在产卵过程中利用旋转收缩等方式通过产卵器将毒液注入寄主体内,毒腺作为毒液的分泌部位与毒囊相连,具有十分活跃的分泌细胞并分泌大量毒液,并将产生的毒液贮存于毒囊中。毒液中含有蛋白质、抗菌肽和一些有机化合物,但在寄主体内发挥主要作用的是毒液蛋白,包括酶、蛋白酶抑制剂、神经毒素和另外一些具有其他作用的蛋白,它们在寄主体内相互协同作用,为子代寄生蜂的生长发育提供环境条件和营养基础[2]。本文就寄生蜂毒液的作用和主要成分的国内外研究综述。
1寄生蜂毒液对寄主的影响
1.1寄生蜂毒液的麻痹作用
毒液蛋白作用于寄主中枢神经系统或神经肌肉系统,能够对寄主造成永久性麻痹或暂时性麻痹,寄生蜂毒液对寄主的麻痹作用多见于外寄生蜂,只有少数的内寄生蜂毒液具有麻痹作用并且多数为暂时性麻痹,如外寄生的东方旋小蜂(Eupelmus orientalis)带毒的螫刺能导致寄主永久麻痹并停止发育,足莱肿腿蜂(Laelius pedatus)寄生后谷斑皮蠹(Trogoderma granarium)幼虫完全麻痹[3]。在寄主发育的不同时期,毒液对寄主的麻痹作用不同,寮黑瘤姬蜂(Pimla hypochondriaca)的毒液可以对番茄夜蛾(Lacanobia oleracea)成虫在短时间内造成重度麻痹且不能恢复,但其毒液对番茄夜蛾5龄幼虫麻痹则需要16 h且麻痹作用不明显[4]。
1.2寄生蜂毒液对寄主免疫的影响
寄主的免疫系统包括体液免疫和细胞免疫2种。寄主的体液免疫往往导致寄主血淋巴凝结或黑化复杂酶链活化反应,当外来入侵物进入寄主时,寄主体内的酚氧化酶(PO)可以控制血淋巴发生黑化作用,在入侵物周围产生黑色素沉淀。黑化作用产生的物理屏蔽可以阻止寄生蜂卵的生长发育,并生成高活性、高毒性的醌类物质,醌类物质将最终生成超氧化物和羟基自由基,有助于杀灭多分DNA病毒[1]。因此降低酚氧化酶活性是寄生蜂对抗寄主免疫反应的一个重要措施[5],如菜粉蝶微红绒茧蜂(Cotesia rubecula)的毒液会抑制其寄主体内酚氧化酶的活性,从而抑制寄主血淋巴的黑化作用。
毒液对寄主细胞免疫的影响包括降低寄主血细胞的包囊作用和吞噬作用、改变浆血细胞总量和各类血细胞数量[6]。包囊作用是寄主血细胞包裹在异物周围,最终导致寄生蜂注入寄主体内的卵窒息死亡甚至在最后时期发生黑化[7],蝶蛹金小蜂(Pteromalus puparum)和丽蝇蛹集金小蜂(Nasonia uitripennis)的毒液会抑制寄主细胞包囊[8]。不同种类昆虫的吞噬细胞类型也不同,鳞翅目昆虫的吞噬细胞为颗粒血细胞和浆血细胞,有的鞘翅目昆虫的吞噬细胞则是类绛色细胞[9]。另外,毒液会影响寄主血细胞的数量,有的寄生蜂毒液可以提高寄主细胞的死亡率,导致寄主细胞总数下降,菜粉蝶绒茧蜂(Apanteles glomeratus)的毒液会导致其寄主颗粒血细胞和浆血细胞大量死亡,但其他血细胞数量基本不变[10];也有的寄生蜂毒液引起寄主的免疫反应,导致寄主细胞数量升高[11],丽蝇蛹集金小蜂的毒液可使寄主浆血细胞大量死亡,而颗粒血细胞数量基本不变,最终导致其寄主血细胞数量大量减少[12]。
1.3寄生蜂毒液对寄主生长发育的影响
寄生蜂毒液可使寄主变态提前,还可导致寄主的体质量和形态等发生变化,如棉贪夜蛾(Spodoptera littoralis)的幼虫一般有5个龄期,但其幼虫在被寄生时通常会出现6龄幼虫,且被寄生的幼虫比正常幼虫的头壳更小,体质量更轻[13]。毒液还可以抑制寄主生殖系统的发育,引起寄主寄生性去势[14]。毒液对寄主内分泌的调控是通过对咽侧体、前胸腺以及它们分泌物的抑制和调控,完成毒液对寄主生长发育和变态的调节。毒液能通过阻止寄主前胸腺激素的释放来抑制寄主的化蛹,即通过保持较低的蜕皮激素水平来推迟寄主幼虫—蛹的蜕皮,导致寄主无法化蛹而最终死亡[15]。研究证实黑头折脉茧蜂(Cardiochiles nigriceps)的萼液和毒液能降低寄主前胸腺释放的蜕皮激素活性[1],菜粉蝶绒茧蜂毒液会导致寄主体内的脂肪含量降低[16]。
2寄生蜂毒液的主要组成成分
寄生蜂毒液的主要成分是蛋白质、多肽、一些有机化合物和抗菌活性肽成分[17]。其中,毒液蛋白对寄主的影响最大,有机化合物和抗菌活性肽是毒液中的辅助作用因子。毒液蛋白包含酶、蛋白酶抑制剂、麻痹作用的蛋白和其他蛋白,它们往往无法单独作用于寄主,而是相互协同完成对寄主的麻痹、生长发育的调控和免疫的影响。
2.1寄生蜂毒液蛋白质和多肽
寄生蜂毒液蛋白质包括酶、蛋白酶抑制剂、神经毒素和具有麻痹作用的蛋白以及其他作用的蛋白,而蛋白酶是毒液蛋白质的主要成分。姬蜂和茧蜂的毒液蛋白大部分为酸性蛋白,其等电点(PI)在4.9~6.9之间[18]。同时,一般毒液蛋白的蛋白分子量都较小,如甲腹茧蜂(Braconids chelonus)、烟仓麦茧蜂(Bracon hebetor)和菜粉蝶绒茧蜂的蛋白质分子量都仅有30、20、18 ku[18-19]。已从丽蝇蛹集金小蜂毒液中鉴定出79种蛋白,其中23种蛋白是新发现的[20]。随着生物技术的日益发展,常见的生物技术已经开始应用到寄生蜂毒液蛋白研究中,研究内容涉及毒液蛋白的生化性质、毒液功能以及寄主与寄生蜂之间的相互作用[21]。寄生蜂毒液中存在大量酶类,现已通过基因序列分析和免疫染色等方法鉴定出10余种酶类。除蛋白酶外,寄生蜂毒液中还存在蛋白酶抑制剂,它们有的直接作用于寄主,也有的起保持或修饰毒囊中其他毒液蛋白活性的作用。
2.1.1寄生蜂毒液蛋白中的酶寄生蜂毒液蛋白中酶的种类众多(表1),有水解酶、氧化还原酶和转移酶等,还有一些具有特异性的蛋白酶[22]。研究证明水解酶的种类在毒液蛋白最多,包括常见的磷酸蛋白酶、几丁质酶、β-葡糖苷酶、酯酶、β-半乳糖苷酶、类酯酶等,它们具有水解酶活性,但在寄主体外试验时并没有活性[23]。其中,有关酸性磷酸蛋白酶的研究较多,在蝶蛹金小蜂和瘤姬蜂毒液中,酸性磷酸蛋白酶的主要作用是参与溶酶体的降解与细胞凋亡[24],酸性磷酸蛋白在茧蜂科毒液中参与寄主营养物质的分解,为寄生蜂幼虫发育提供营养,同时也对寄主体内免疫相关蛋白产生去磷酸化作用[25]。还有很多水解酶已从毒液中分离出来,但是它们的作用尚不明确[25]。漆酶是一种金属氧化酶,与酚氧化酶具有相似的活性,在黑瘤姬蜂的毒液中发现漆酶具有氧化多巴胺的活性,丽蝇蛹集金小蜂的毒液中也发现2个漆酶基因[12]。γ-谷氨酰转移酶可以引起细胞死亡、诱导卵巢凋亡,对寄主雌虫有去势作用[26]。另外,特异性的蛋白酶类包括溶血素和几丁质酶等,溶血素是一种金属蛋白酶,在寄主体内的作用主要是抑制寄主蜕皮和变态[27],几丁质酶存在于寄生蜂卵的周围,在寄主中发挥的主要作用是参与寄主细胞分裂和寄主组织退化,促进寄生蜂幼虫在寄主体内取食[27]。
表1毒液蛋白中的酶
蛋白或多肽作用物种海藻糖酶释放烃类物质Ph[27]漆酶氧化Ph[27]丝氨酸蛋白酶蛋白酶、抑制黑化作用Ph[27]酚氧化酶黑化作用Ph[27]溶血素金属蛋白酶Ph,Ma,Mh[27-28]几丁质酶几丁质分解Ph,Ma,Mh[27-28]类天冬氨酰氨基葡萄糖苷酶溶酶体At[32]酸性磷酸酶释放烃类物质PP,Ph[23,27]丁酰胆碱酯酶细胞溶解Pt[29]γ-谷氨酰转移酶诱导细胞凋亡、卵巢凋亡Ae[26]组织蛋白酶与溶解酵素有关Ma,Mh[28]硫醇还原酶溶酶体硫醇还原酶Ma,Mh[28]超氧化物歧化酶在体外有果蝇酚氧化酶活性Lb[30]注:缩写:Ae:Aphidius ervi阿尔蚜茧蜂;At:Asobara tabida反颚茧蜂;Cc:Chelonus near curvimaculatus曲斑甲腹茧蜂;Cr:C. rubecula盘绒茧蜂;Lb:Leptopilina boulardi匙胸瘿蜂;Ph:Pimpla hypochondriaca斑痣悬茧蜂;PP:P.puparum蝶蛹金小蜂;Pt:P.turionellae卷蛾黑瘤姬蜂;Ma:Microctonus aethiopoides埃塞食甲茧蜂;Mh:Microctonus hyperodae。
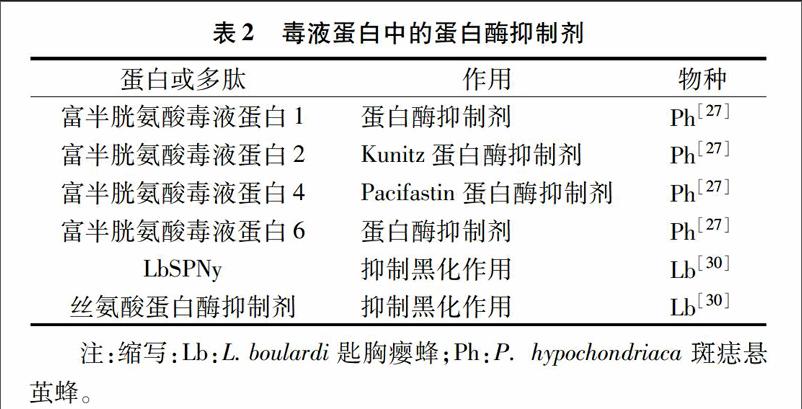
2.1.2毒液蛋白中的蛋白酶抑制剂毒液中具有蛋白酶抑制剂活性的物质大部分是与蛋白酶抑制剂有相同氨基酸序列的多肽,有的氨基酸片段也发挥蛋白酶抑制剂的作用(表2)[31]。其中,丝氨酸蛋白酶抑制剂主要作用是抑制寄主黑化作用,它们是通过抑制酚氧化酶抑制剂在毒囊中发挥作用,与对毒囊组织结构有潜在破坏作用的蛋白质特异性结合,从而保护毒囊[7,30]。此外,Parkinson等研究发现瘤姬蜂体内含有4种富半胱氨酸蛋白酶(Cys-rich venom protein 1,2,4,6),它们与PO抑制剂作用相关[27]。
表2毒液蛋白中的蛋白酶抑制剂
蛋白或多肽作用物种富半胱氨酸毒液蛋白1蛋白酶抑制剂Ph[27]富半胱氨酸毒液蛋白2Kunitz蛋白酶抑制剂Ph[27]富半胱氨酸毒液蛋白4Pacifastin蛋白酶抑制剂Ph[27]富半胱氨酸毒液蛋白6蛋白酶抑制剂Ph[27]LbSPNy抑制黑化作用Lb[30]丝氨酸蛋白酶抑制剂抑制黑化作用Lb[30]注:缩写:Lb:L.boulardi匙胸瘿蜂;Ph:P. hypochondriaca斑痣悬茧蜂。
2.1.3毒液蛋白中具有麻痹作用的蛋白质与神经毒素毒液蛋白的麻痹作用多见于外寄生蜂,而外寄生蜂的毒液对寄主的麻痹作用通常是永久性的麻痹,但是研究发现,内寄生蜂的毒液对寄主也存在暂时性的麻痹作用[27]。毒液蛋白中具有麻痹作用的蛋白有:Pimplin、富半胱氨酸毒液蛋白5、富半胱氨酸毒液蛋白3、Vn4.6、Icarapin、VG3等。毒液中具有麻痹作用的物质具体成分并不确定,其中有的是神经毒素,有的是蛋白质[31],这些神经毒素在常见的有毒动物如蛇(Dendroaspis polylepis)、芋螺(Cone Snail)、蜜蜂(Apis mellifica)等体内均有发现,在寄生蜂的体内就发现了与这些毒素具有相似序列的蛋白质和多肽(表3)[22]。
表3毒液蛋白中具有麻痹作用的蛋白质与神经毒素
蛋白或多肽作用物种富半胱氨酸毒液蛋白5类芋螺毒素Ph[27]Vn4.6类芋螺毒素Cr[34]VG3类火蚁过敏原Ma,Mh[28]富半胱氨酸毒液蛋白3类芋螺毒素Ph[27]Pimplin麻痹作用Ph[27]Icarapin类蜜蜂过敏源Ma,Mh[28]注:缩写:Cr:C. rubecula盘绒茧蜂;Ph:P. hypochondriaca斑痣悬茧蜂;Ma:Mi.aethiopoides埃塞食甲茧蜂;Mh:M.hyperodae。
2.1.4毒液蛋白中其他蛋白质毒液中还含有很多其他蛋白质,具有抑制黑化作用、抑制血球蔓延、抑制包囊作用、离子运输、与PDA基因表达相关联等等[36],详见表4。
表4毒液蛋白中其他蛋白质
蛋白或多肽作用物种激活蛋白使寄主血细胞变形、抑制包囊Lb[30]Vn1.5促进PDA基因表达Cr[34]钙网蛋白抑制血球蔓延Mh[28]昆虫血细胞抗凝蛋白抑制血细胞扩散凝集、抑制包囊Ph[27]Vn50黑化作用抑制剂Cr[34]毒性蛋白,P4Rho-GAP蛋白质影响细胞粘附Lb[30]铁蛋白铁结合蛋白Ma,Mh[28]TEGT(基因)抑制细胞凋亡Ma,Mh[28]VG10离子运输蛋白Ma,Mh[28]VG8热休克蛋白Ma,Mh[28]Vpr3与抗血清细胞结合Ph[27]Vn.11抑制愈合Pp[23]跨膜四蛋白涉及细胞黏附和能动性Ma,Mh[28]注:缩写:Cr:C.rubecula盘绒茧蜂;Lb:L.boulardi匙胸瘿蜂;Ph:P.hypochondriaca斑痣悬茧蜂;Pp:P.puparum蝶蛹金小蜂;Ma:M.aethiopoides埃塞食甲茧蜂;Mh:M.hyperodae。
2.2毒液中的有机化合物和抗菌活性肽
Skinner等在寄生蜂毒液中发现多胺、腐胺和少量巴胺成分,多胺的作用是阻碍神经和肌肉质膜阳离子通道;Shimizu等也发现黏虫盘绒茧蜂(Apanreles kariyai)的毒液中含有多巴胺和4-羟基苯乙酸[23]。目前有研究证实瘤姬蜂的毒液对大肠杆菌和油菜黄单胞菌有抗菌活性[19],郦卫弟也发现颈双缘姬蜂(Diadromus collaris)的毒液对大肠杆菌有活性[35]。
综上所述,寄生蜂的毒液不仅仅含有蛋白类物质,有机化合物与抗菌活性肽对寄生蜂的寄生也提供了条件。另外,随寄生蜂卵和毒液一起注入寄主体内的还有萼液中的多分DNA病毒(PDA)、类病毒颗粒和畸形细胞等,所有这些寄生因子相互协同作用,辅助寄生蜂幼虫生长发育[25,36]。
3应用与展望
现阶段对寄生蜂毒液功能研究取得了一定的进展,已经明确毒液的最主要作用成分为蛋白质,还包括一些有机化合物,但是关于毒液蛋白的鉴定和具体功能的研究仍处于起步阶段。另外,目前大部分毒液蛋白功能的研究都是在寄主体外进行的,而毒液在寄主体内的作用往往是相互协同,因此作者认为今后关于毒液蛋白功能的研究应该更加侧重于毒液各因子间的协同作用和寄主与寄生蜂之间的互作。
毒液的主要成分,特别是毒液蛋白中的酶、蛋白酶抑制剂和麻痹毒素等在害虫生物防治和药理学领域均有很大的应用前景[37]。Khan等已成功将毒液蛋白中的ω-ACTX-Hval转入植物体内,并且抗虫效果良好[38],寄生蜂毒液中的TEGT基因和PDV病毒等基因也可以利用同样的方法导入植物体内,为害虫的防治提供新的可能。
目前,已经有实验室开始探索毒液中生物大分子在寄生蜂发育过程中的变化,还有实验室通过毒液蛋白质组分富集得到了之前并未发现的毒液蛋白,对于寄生蜂毒液的研究还有以下几方面值得进一步探索:(1)先进的蛋白质组学研究方法已经开始在毒液蛋白的组分分析、鉴定和功能的研究中应用,但是取得的成果并不显著。(2)许多毒液的组分在药理学方面都有很广阔的应用前景,但是目前这方面的研究仍然很薄弱。(3)研究过程中通过解剖毒囊来获得毒液,由于寄生蜂个体微小,解剖工作费时费力,且毒液若长时间放置会变质,造成成分分析有误,因此,优化寄生蜂毒液的提取方法,进而快速获得高质量的毒液对后续研究至关重要。
参考文献:
[1]Danneels E L,Rivers D B,de Graaf D C. Venom proteins of the parasitoid wasp Nasonia vitripennis:recent discovery of an untapped pharmacopee[J]. Toxins,2010,2(4):494-516.
[2]Poirie M,Colinet D,Gatti J L. Insights into function and evolution of parasitoid wasp venoms[J]. Current Opinon in Insect Science,2014,6:52-60.
[3]Doury G,Rojas-Rousse D,Periquet G. Ability of Eupelmus orientalis ectoparasitoid larvae to develop on an unparalysed host in the absence of female stinging behavior[J]. Journal of Insect Physiology,1995,41(4):287-296.
[4]Parkison N M,Weaver R J. Noxious components of venom from the pupa-specific parasitiod Pimpla hypochondriaca[J]. Journal of Invertebrate Pathology,1998,73(1999):74-83.
[5]Asgari S,Zhang G,Zareie R,et al. A serine proteinase homolog venom protein from an endoparasitoid wasp inhibits melanization of the host hemolymph[J]. Insect Biochemistry and Molecular Biology,2003,33(10):1017-1024.
[6]Mortimer N T,Goecks J,Kacsoh B Z,et al. Parasitoid wasp venom SERCA regulates Drosophila calcium levels and inhibits cellular immunity[J]. Proceedings of the National Academy of Sciences of the United States of America,2013,110(23):9427-9432.
[7]Pech L L,Strand M R. Granular cells are required for encapsulation of foreign targets by insect haemocytes[J]. Journal of Cell Science,1996,109(Pt 8):2053-2060.
[8]Zhang G,Schmidt O,Asgari S. A calreticulin-like protein from endoparasitoid venom fluid is involved in host hemocyte inactivation[J]. Developmental and Comparative Immunology,2006,30(9):756-764.
[9]Giglio A,Battistella S,Talarico F F,et al. Circulating hemocytes from larvae and adults of Carabus (Chaetocarabus) lefebvrei dejean 1826(Coleoptera,Carabidae):cell types and their role in phagocytosis after in vivo artificial non-self-challenge[J]. Micron,2008,39(5):552-558.
[10]Ibrahim A M,Kim Y. Parasitism by Cotesia plutellae alters the hemocyte population and immunological function of the diamondback moth,Plutella xylostella[J]. Journal of Insect Physiology,2006,52(9):943-950.
[11]张倩倩. 蝶蛹金小蜂寄生对菜粉蝶蛹细胞免疫与生理代谢的影响[D]. 杭州:浙江大学,2009.
[12]Rivers D B,Ruggiero L,Hayes M. The ectoparasitic wasp Nasonia vitripennis (Walker) (Hymenoptera:Pteromalidae) differentially affects cells mediating the immune response of its flesh fly host,Sarcophaga bullata Parker (Diptera:Sarcophagidae)[J]. Journal of Insect Physiology,2002,48(11):1053-1064.
[13]Pfister-Wilhelm R,Lanzrein B. Precocious induction of metamorphosis in Spodoptera littoralis(Noctuidae)by the parasitic wasp Chelonus inanitus(Braconidae):identification of the parasitoid larva as the key regulatory element and the host corpora allata as the main targets[J]. Archives of Insect Biochemistry and Physiology,1996,32(3/4):511-525.
[14]Tanaka T,Agui N,Hiruma K. The parasitoid Apanteles kariyai inhibits pupation of its host,Pseudaletia separata,via disruption of prothoracicotropic hormone release[J]. General and Comparative Endocrinology,1987,67(3):364-374.
[15]Tanaka T,Vinson S B. Depression of prothoracic gland activity of Heliothis virescens by venom and calyx fluids from the parasitoid,Cardiochiles nigriceps[J]. Journal of Insect Physiology,1991,37(2):139-144.
[16]Nakamatsu Y,Fujii S,Tanaka T. Larvae of an endoparasitoid,Cotesia kariyai (Hymenoptera:Braconidae),feed on the host fat body directly in the second stadium with the help of teratocytes[J]. Journal of Insect Physiology,2002,48(11):1041-1052.
[17]Fukushima J,Kuwahara Y,Yamada A,et al. New non-cyclic homo-diterpene from the sting glands of Bracon hebetor Say(Hymenoptera:Braconidae)[J]. Agricultural and Biological Chemistry,1990,54(3):809-810.
[18]Leluk J,Schmidt J,Jones D. Comparative studies on the protein composition of hymenopteran venom reservoirs[J]. Toxicon,1989,27(1):105-114.
[19]Quistad G B,Nguyen Q,Bernasconi P,et al. Purification and characterization of insecticidal toxins from venom glands of the parasitic wasp,Bracon hebetor[J]. Insect Biochemistry and Molecular Biology,1994,24(10):955-961.
[20]Werren J H,Richards S,Desjardins C A,et al. Functional and evolutionary insights from the genomes of three parasitoid nasonia species[J]. Science,2010,327(5963):343-348.
[21] Stcklin R,Rose K. Proteomic analysis of the venom of Conus consors[D]. University of Geneva,Master of Bioinforematics & Proteomics,2000.
[22]Colinet D,Mathé-Hubert H,Allemand R,et al. Variability of venom components in immune suppressive parasitoid wasps:from a phylogenetic to a population approach[J]. Journal of Insect Physiology,2013,59(2):205-212.
[23]Dani M P,Edwards J P,Richards E H. Hydrolase activity in the venom of the pupal endoparasitic wasp,Pimpla hypochondriaca[J]. Comparative Biochemistry and Physiology B:Biochemistry & Molecular Biology,2005,141(3):373-381.
[24]Zhu J Y,Ye G Y,Hu C. Molecular cloning and characterization of acid phosphatase in venom of the endoparasitoid wasp Pteromalus puparum (Hymenoptera:Pteromalidae)[J]. Toxicon:Official Journal of the International Society on Toxinology,2008,51(8):1391-1399.
[25]Crawford A M,Brauning R,Smolenski G,et al. The constituents of Microctonus sp. parasitoid venoms[J]. Insect Molecular Biology,2008,17(3):313-324.
[26]Falabella P,Riviello L,Caccialupi P,et al. A gamma-glutamyl transpeptidase of Aphidius ervi venom induces apoptosis in the ovaries of host aphids[J]. Insect Biochemistry and Molecular Biology,2007,37(5):453-465.
[27]Krishnan A,Nair P N,Jones D. Isolation,cloning,and characterization of new chitinase stored in active form in chitin-lined venom reservoir[J]. The Journal of Biological Chemistry,1994,269(33):20971-20976.
[28] Asgari S,Rivers DB. Venom proteins from endoparasitoid wasps and their role in host-parasite interactions[J]. Annual Review of Entomology,2011,56:313-335.
[29]Uckan F,Ergin E,Rivers D B,et al. Age and diet influence the composition of venom from the endoparasitic wasp Pimpla turionellae L.(Hymenoptera:Ichneumonidae)[J]. Archives of Insect Biochemistry and Physiology,2006,63(4):177-187.
[30]Colinet D,Dubuffet A,Cazes D,et al. A serpin from the parasitoid Wasp Leptopilina boulardi targets the Drosophila phenoloxidase cascade[J]. Developmental and Comparative Immunology,2009,33(5):681-689.
[31]Colinet D,Cazes D,Belghazi M,et al. Extracellular superoxide dismutase in insects Characterization,function,and interspecific variation in parasitoin wasp venom[J]. Journal of Biological Chemistry,2011,286(46):40110-40121.
[32]Moreau S,Cherqui A,Doury G,et al. Identification of an aspartylglucosaminidase-like protein in the venom of the parasitic wasp Asobara tabida(Hymenoptera:Braconidae)[J]. Insect Biochemistry and Molecular Biology,2004,34(5):485-492.
[33]Colinet D,Deleury E,Anselme C,et al. Extensive inter-and intraspecific venom variation in closely related parasites targeting the same host:the case of leptopilina parasitoids of Drosophila[J]. Insect Biochemistry and Molecular Biology,2013,43(7):601-611.
[34]Zhang G,Schmidt O,Asgari S. A novel venom peptide from an endoparasitoid wasp is required for expression of polydnavirus genes in host hemocytes[J]. The Journal of Biological Chemistry,2004,279(40):41580-41585.
[35]郦卫弟. 颈双缘姬蜂调控寄主小菜蛾的生理机制研究[D]. 杭州:浙江大学,2005.
[36]Lanzrein B,Pfister-Wilhelm R,Wyler T,et al. Overview of parasitism associated effects on host haemocytes in larval parasitoids and comparison with effects of the egg-larval parasitoid Chelonus inanitus on its host Spodoptera littoralis[J]. Journal of Insect Physiology,1998,44(9):817-831.
[37]朱家颖,叶恭银,胡萃. 寄生蜂毒液蛋白的研究进展[J]. 植物保护学报,2008,35(3):270-278.
[38]Khan S A,Zafar Y,Briddon R W,et al. Spider venom toxin protects plants from insect attack[J]. Transgenic Research,2006,15(3):349-357.吴琼,罗亮,王香萍,等. 蚜虫的生存适应性研究进展[J]. 江苏农业科学,2016,44(5):175-178.

