低氧后处理对全脑缺血大鼠认知功能及海马CA1区沉默信息调节因子1表达的影响
刁莉君,李建民,赵雅宁,陈长香,周娜
低氧后处理对全脑缺血大鼠认知功能及海马CA1区
沉默信息调节因子1表达的影响
刁莉君1,李建民2,赵雅宁1,陈长香1,周娜1
[摘要]目的观察低氧后处理对全脑缺血大鼠认知功能及海马CA1区沉默信息调节因子1(SIRT1)表达的影响。方法成年健康Sprague-Dawley大鼠60只,随机分为假手术组、模型组和低氧后处理组,每组20只。各组根据缺血再灌注的时间分为1d、2d、3d、7d四个亚组,每个亚组5只。采用改良Pulsinelli四血管闭塞法制备全缺血再灌注大鼠模型,低氧后处理组在缺血后给予8%低氧2h处理。Morris水迷宫实验检测大鼠认知功能,光镜下观察海马CA1区神经细胞形态变化及存活神经细胞数量,免疫组织化学法、Western blotting检测海马区SIRT1表达。结果与模型组相比,低氧后处理组逃避潜伏期缩短(P<0.05),穿越平台次数增加(P<0.05),探索速度、平台象限路程百分比增加(P<0.05),探索路程缩短(P<0.05);海马区神经细胞损伤较轻,存活神经元细胞增加(P<0.05);相应各时间点SIRT1表达升高(P<0.05)。结论低氧后处理能够改善全脑脑缺血大鼠的认知功能,其机制与低氧后处理提高海马组织中SIRT1蛋白表达水平有关。
[关键词]脑缺血;低氧后处理;认知功能;沉默信息调节因子1;大鼠
[本文著录格式]刁莉君,李建民,赵雅宁,等.低氧后处理对全脑缺血大鼠认知功能及海马CA1区沉默信息调节因子1表达的影响[J].中国康复理论与实践,2016,22(6):629-634.
CITED AS:Diao LJ,Li JM,Zhao YN,et al.Effects of hypoxic post-conditioning on cognitive function and expression of silent information regulator 1 in hippocampal CA1 of rats with global cerebral ischemia[J].Zhongguo Kangfu Lilun Yu Shijian,2016,22(6):629-634.
脑血管病是中国第三大死因和首要的致残因素,且流行病学调查显示我国脑血管病的发病率呈逐年上升趋势。缺血性脑卒中患者约占脑血管病患者的80%,而且高达64%的脑卒中患者存在不同程度的认知功能缺损[1]。然而脑缺血性认识功能损伤的预防及治疗仍然是目前的难点,尤其是发生机制尚有待进一步研究。
低氧后处理是指当机体缺血损伤后给予适度低氧干预,诱导组织代偿性修复[2]。2003年赵志青等首次发现低氧后处理能有效修复心肌损伤细胞[3],随后Pignataro等研究发现给予脑损伤成年鼠低氧后处理体外干预能促进修复成年鼠脑损伤[4]。随着对低氧后处理的深入研究,较多研究证实低氧后处理干预成年鼠脑损伤时可通过调节自噬、凋亡细胞及炎症标志物等的表达抑制神经元死亡,进而有效减少脑损伤面积[5-6]。由于低氧后处理是一种体外无创性操作,因此更具临床应用价值。然而,低氧后处理是否能改善脑缺血大鼠认知损伤功能及神经保护作用具体机制方面的研究仍较少。
沉默信息调节因子1(silent information regulator 1,SIRT1)是广泛存在于哺乳动物中NAD+依赖的去乙酰化酶[7],在哺乳动物的脑神经元中高表达,具有调节神经损伤修复及神经保护作用[8]。本研究建立低氧后处理模型,观察大鼠认知功能的变化、海马区神经细胞形态结构及SIRT1的表达。
1 材料与方法
1.1实验动物及分组
成年雄性Sprague-Dawley大鼠60只,体质量250~350g,由北京维通利华实验动物技术有限公司提供。采用随机数字表法,将大鼠分成假手术组(n=20)、模型组(n=20)和低氧后处理组(n=20),每组根据缺血再灌注的时间又分为1d、2d、3d、7d 4个亚组。
1.2模型制备
按照Pulsinelli经典的四血管闭塞法进行改良制作全脑缺血模型[9]。10%水合氯醛4mg/kg常规麻醉大鼠,枕后部正中切口,暴露双侧第1颈椎横突翼孔,直视下热凝椎动脉,电凝每次时间约3~5s,使双侧椎动脉永久闭塞。颈部正中切口,分离双侧颈总动脉,在动脉下留置手术线备用。术后大鼠缝合回笼,24h后以无创性微动脉夹夹闭双侧颈总动脉,缺血20min后松开动脉夹,实行再灌注。
模型成功标准:同时夹闭双侧颈总动脉后30~60s内大鼠的意识丧失,翻正反射消失,瞳孔放大,眼睛颜色由红变白,呼吸急促,松开动脉夹后10~20s,眼球颜色快速恢复红色,大鼠的意识恢复,并能活动。剔除夹闭动脉后诱发癫痫、颈动脉破裂大出血、术后出现肢体瘫痪、手术不成功和死亡大鼠,并予以补齐。
假手术组大鼠常规麻醉,枕后部正中切口,不电凝椎动脉,分离暴露血管,但不夹闭颈总动脉。
低氧后处理组在大鼠脑缺血20min后再灌注1d,置于大小约9000cm3的低氧箱内,连续通入8% O2+92%N2混合气体2h,流速200ml/min。低氧期间禁食不禁水,每次放入低氧箱内大鼠不得多于3只。
1.3Morris水迷宫
各7d亚组通过Morris水迷宫实验测定大鼠认知功能。
1.3.1定位航行实验
于缺血后第3~6天进行,每天上午9:00开始,每天4次,每次间隔至少30min,连续训练4d。按照随机顺序,使大鼠面向池壁分别从四个象限的入水点放入水中,使其寻找水下的平台。图像监视系统自动追踪记录其从入水到爬上平台经过的总路程及爬上平台所需的时间,该时间即其逃逸潜伏期,每天4次测定结果的平均值为其当天逃逸潜伏期。
1.3.2空间探索实验
第7天移走平台,将大鼠从第二象限的入水点面向池壁放入水中,监视系统自动追踪记录其90s内穿越平台象限次数、平台象限路程百分比、探索路程以及探索速度。
1.4HE染色
大鼠缺血再灌注1d、2d、3d、7d,给予腹腔注射10%水合氯醛4mg/kg麻醉后,心脏灌注后断头取脑,取视交叉至乳头体脑组织常规脱水、浸蜡包埋。石蜡切片机连续切片,厚度约4 μm,置60℃烤箱烘烤备用。HE染色后,200倍光镜下观察脑组织海马CAl区不重叠的6个视野,采用Motie 6.0数码医学图像分析系统检测海马CAl区存活神经元个数,取平均值。
1.5免疫组化染色
大鼠脑缺血再灌注1d、2d、3d、7d四个时间点给予常规麻醉,心脏灌流后断头取脑,取视交叉至乳头体脑组织常规脱水、浸蜡、包埋。石蜡切片机连续切片,厚度约4 μm,置60℃烤箱烘烤2h后备用。玻片脱蜡水化;枸橼酸高压热修复,冷却。3%过氧化氢室温15min封闭内源性过氧化物酶活性,PBS冲洗后,滴加稀释SIRT1抗体一抗(1∶300),4℃冰箱过夜;滴加二抗37℃孵育1h后DAB显色。苏木素复染,盐酸酒精分化后,封片。光镜下观察SIRT1蛋白染色呈棕褐色颗粒,位于细胞核内。高倍镜下观察并选取6个不重叠的视野,进行SIRT1蛋白阳性细胞计数,取平均数进行统计分析。
1.6Western blotting
大鼠脑缺血再灌注1d、2d、3d、7d四个时间点,给予腹腔注射10%水合氯醛4mg/kg麻醉后立即断头于冰上取海马,液氮冻存片刻后保存于-80℃冰箱。取出的组织置于15ml离心管中,加入预冷的组织裂解液,4℃12000 r/min离心10min,取上清液,考马斯亮蓝法蛋白质定量。PBS调蛋白浓度至800μg/ml,加入等体积上样缓冲液,沸水煮5min。冷却至室温,放入4℃冰箱备用。取蛋白样品60μg,凝胶电泳,以半干转膜至NC膜,室温封闭1h。加SIRT1抗体,分子量为81 kDa,稀释浓度为1∶1000。4℃冰箱孵育过夜。加稀释二抗(1∶1000),37℃反应2h,ECL显色,暗室胶片曝光显影,Image J分析。
1.7统计学分析
2 结果
2.1Morris水迷宫
与假手术组比较,模型组大鼠第3~6天逃逸潜伏期延长,第7天穿越平台次数减少,探索速度、平台象限路程百分比降低,探索路程增加(P<0.05);与模型组比较,低氧后处理组第3~6天逃逸潜伏期缩短,第7天穿越平台次数增加,探索速度、平台象限路程百分比增加,探索路程缩短(P<0.05)。见表1、表2。

表1 各组大鼠定位航行实验逃避潜伏期的比较(s)

表2 各组大鼠空间探索实验各项指标的比较
2.2HE染色
假手术组大鼠海马区神经元结构完整清晰,排列整齐致密,细胞核大而圆,未见变性坏死的神经元;与假手术组比较,模型组神经元进行性坏死:第1天出现大量神经元核深染,部分神经元出现水肿,第2天神经元水肿加重,排列松散,细胞轮廓不清,细胞核模糊,第3天神经元核皱缩明显,部分细胞溶解碎裂,第7天大量坏死神经元溶解,余红色残碎部分,少数细胞形态可辨,神经元数量减少(P<0.05)。与模型组比较,低氧后处理组神经元损伤均减轻,第1天可见神经元深染,但明显减少;第2、3、7天部分神经元形态清晰,排列整齐,正常神经元数目较模型组增多(P<0.05)。见表3、图1。

表3 各组大鼠海马CA1区存活神经元细胞数量比较(n)
2.3免疫组化检测
SIRT1阳性染色显棕褐色,阳性产物定位于细胞核中。假手术组各时间点偶见阳性表达细胞。与假手术组比较,模型组相应各时间点SIRT1免疫活性增高(P<0.05);与模型组比较,低氧后处理组相应各时间点SIRT1免疫活性增高(P<0.05)。见表4、图2。
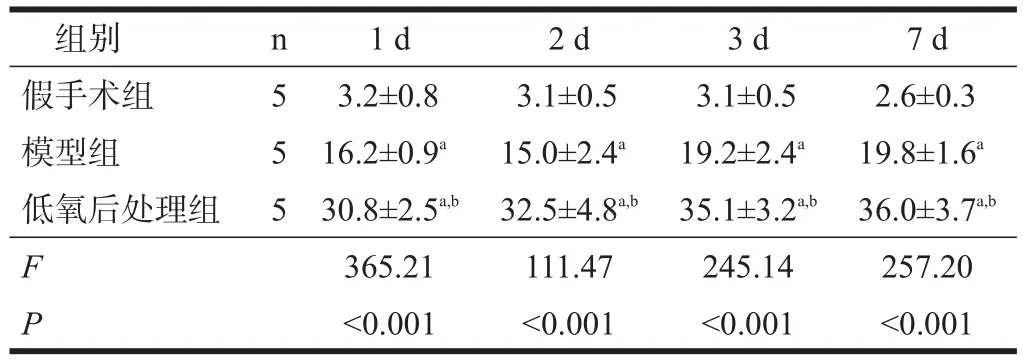
表4 各组大鼠海马CA1区SIRT1阳性细胞数量比较(n)
2.4Western blotting
与假手术组比较,模型组各时间点SIRT1蛋白表达水平升高(P<0.05)。与模型组比较,低氧后处理组各时间点SIRT1蛋白表达水平升高(P<0.05)。见表5、图3。

表5 各组大鼠海马CA1区SIRT1蛋白含量表达比较

图1 各组大鼠海马CA1区神经细胞(HE染色,400×)

图2 各组大鼠海马CA1区SIRT1阳性表达(免疫组化染色,400×)
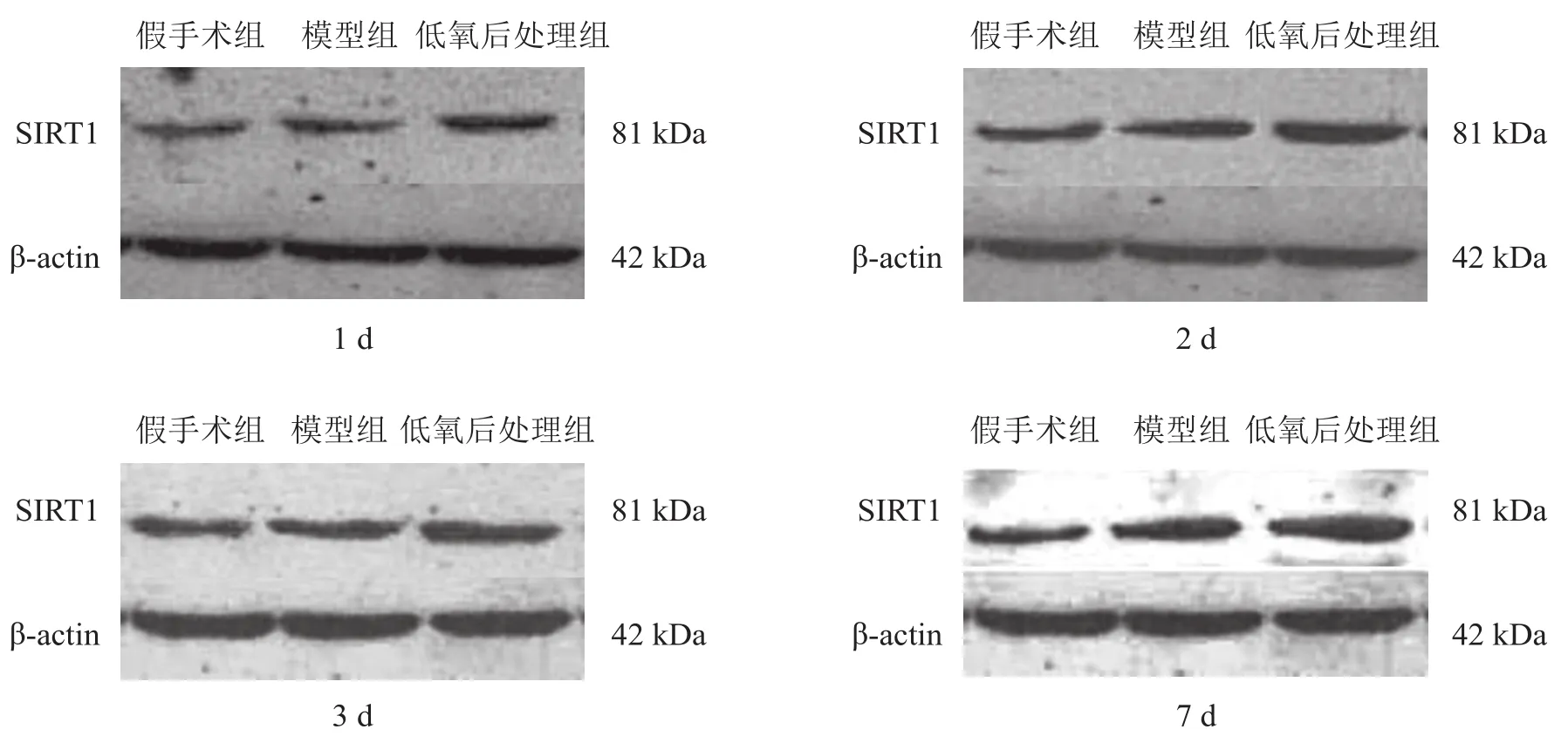
图3 Western blotting检测各组大鼠海马区SIRT1蛋白
3 讨论
脑卒中是导致神经功能障碍的首要病因,超过65岁的脑卒中患者在发病6个月后,约46%发生认知功能障碍[10]。已知在脑组织各结构中海马神经元对缺血损伤最敏感,全脑缺血后认知障碍与海马CA1区神经元死亡相关[11]。在本研究中,模型组大鼠脑缺血后水迷宫实验显示其逃避潜伏期延长,穿越平台象限次数减少,海马CA1区存活神经元减少,说明脑缺血模型制作成功。而低氧后处理组较假手术组大鼠逃避潜伏期缩短,穿越平台象限次数增加,海马CA1区存活神经细胞增加,提示低氧后处理可减轻大鼠脑缺血神经损伤,改善大鼠认知功能障碍。
SIRT1是一种去乙酰化酶,在哺乳动物脑神经细胞中高表达,与细胞增殖、分化、衰老、自噬、代谢等密切相关[12]。研究发现SIRT1在脑缺血中起神经保护作用,其机制包括:①提高糖酵解和抑制糖异生,促进神经元能量恢复;②激活代谢调控中的重要分子过氧化物酶体增殖激活受体共激活因子1α(PGC-1α);③上调超氧化物歧化酶及硫氧还蛋白1等抗氧化剂来对抗缺血再灌注时的氧化应激;④去乙酰化P53蛋白从而抑制P53诱导的细胞凋亡;⑤使核因子(NF-κB)的亚单位去乙酰化,致使其基因表达缺失,从而抑制炎症反应对神经元的损伤作用;⑥促进神经细胞轴突增殖和分化;⑦调节自噬等途径。在Nadtochiy、石瑶等的研究中发现缺血预处理及白藜芦醇预处理可提高脑缺血大鼠脑组织中SIRT1的表达,从而起到神经保护作用[13-14]。然而脑缺血发生具有不可预知性,预处理很难在临床中开展,低氧后处理作为一种临床可操作性更强的手段逐渐成为研究热点。
低氧后处理是在机体缺血、缺氧损伤后给予一定浓度的低氧处理,使机体产生内源性保护作用,较早应用在心肌缺血损伤的保护中[3]。随着对低氧后处理研究的深入,较多学者发现低氧后处理能抑制神经元死亡,减少脑缺血损伤面积,主要机制为通过调节凋亡和自噬减少海马区神经元的死亡[15-18]。但能否促进脑组织中SIRT1的表达以及通过何种分子机制起到神经保护作用仍不清楚。本实验的免疫组化结果显示,低氧后处理组大鼠各相应时间点海马区SIRT1免疫阳性表达较模型组增高,且Western blotting在蛋白水平进一步验证这一结果,说明低氧后处理促进大鼠海马区SIRT1的表达。
综上所述,本研究认为低氧后处理可减轻大鼠缺血性脑损伤,改善大鼠认知功能,其机制可能与低氧后处理提高海马区SIRT1的表达有关。
[参考文献]
[1]林琬,郑璇.缺血性卒中后认知障碍[J].国际脑血管病杂志,2010,18 (2):132-136.
[2]Li Y1,Lv Z,Liu X,et al.Hypoxic postconditioning inhibits endoplasmic reticulum stress- mediated cardiomyocyte apoptosis by targeting PUMA[J].Shock,2013,39(3):299-303.
[3]Zhao ZQ,Corvera JS,Halkos ME,et al.Inhibition of myocardial injury by ischemic postconditioning during reperfusion:comparison with ischemic preconditioning[J].Am J Physiol Heart Circ Physiol,2003,285 (2):H579-H588.
[4]Pignataro G,Meller R,Inoue K,et al.In vivo and in vitro characterization of a novel neuroprotective strategy for stroke:ischemic postconditioning[J].J Cereb Blood Flow Metab,2008,28(2):232-241.
[5]Granfeldt A,Lefer DJ,Vinten-Johansen J.Protective ischaemia in patients:preconditioning and postconditioning[J].Cardiovasc Res,2009,83(2):234-246.
[6]Leconte C,Tixier E,Freret T,et al.Delayed hypoxic postconditioning protects against cerebral ischemia in the mouse[J].Stroke,2009,40 (10):3349-3355.
[7]Dryden SC,Nahhas FA,Nowak JE,et al.Role for human SIRT2 NAD-dependent deacetylase activity in control of mitotic exit in the cell cycle[J].Mol Cell Biol,2003,23(9):3173-3185.
[8]Ramadori G,Lee CE,Bookout AL,et al.Brain SIRT1:anatomical distribution and regulation by energy availability[J].J Neurosci,2008,28 (40):9989-9996.
[9]Pulsinelli WA,Brierley JB.A new model of bilateral hemispheric ischemia in the unanesthetized rat[J].Stroke,1979,10(3):267-272.
[10]Go AS,Mozaffarian D,Roger VL,et al.Executive summary:heart disease and stroke statistics-2014 update:a report from the American Heart Association[J].Circulation,2014,129(3):399-410.
[11]Gorchetchnikov A,Grossberg S.Space,time and learning in the hippocampus:how fine spatial and temporal scales are expanded into population codes for behavioral control[J].Neural Netw,2007,20(2):182-193.
[12]Alcendor RR,Gao S,Zhai P,et al.Sirt1 regulates aging and resistance to oxidative stress in the heart[J].Circ Res,2007,100(10):1512-1521.
[13]石瑶,郭倩,周也涵,等.白藜芦醇通过Sirtuins 1通路促进自噬减轻大鼠脑缺血/再灌注损伤[J].基础医学与临床,2015,35(4):496-501.
[14]Nadtochiy SM,Redman E,Rahman I,et al.Lysine deacetylation in ischaemic preconditioning:the role of SIRT1[J].Cardiovasc Res,2011,89(3):643-649.
[15]Li Y,Guo Q,Liu X,et al.PUMA-mediated mitochondrial apoptotic disruption by hypoxic postconditioning[J].Apoptosis,2015,20(8):1026-1032.
[16]王燕梅.自噬参与低氧后处理对成年大鼠短暂全脑缺血的保护作用[D].广州:广州医学院,2012.
[17]Zhu P,Zhan L,Zhu T,et al.The roles of p38 MAPK/MSK1 signaling pathway in the neuroprotection of hypoxic postconditioning against transient global cerebral ischemia in adult rats[J].Mol Neurobiol,2014,49(3):1338-1349.
[18]Zhan L,Li D,Liang D,et al.Activation of Akt/FoxO and inactivation of MEK/ERK pathways contribute to induction of neuroprotection against transient global cerebral ischemia by delayed hypoxic postconditioning in adult rats[J].Neuropharmacology,2012,63(5):873-882.
Effects of Hypoxic Post-conditioning on Cognitive Function and Expression of Silent Information Regulator 1 in Hippocampal CA1 of Rats with Global Cerebral Ischemia
DIAO Li-jun1,LI Jian-min2,ZHAO Ya-ning1,CHEN Chang-xiang1,ZHOU Na1
1.a.College of Nursing and Rehabilitation,b.School of Basic Medical Sciences,North China University of Science and Technology,Tangshan,Hebei 063000,China;2.Department of Neurosurgery,North China University of Science and Technology Affiliated Hospital,Tangshan,Hebei 063000,China
Correspondence to ZHAO Ya-ning.E-mail:zyning789@126.com
Abstract:Objective To explore the effects of hypoxic post-conditioning on cognitive function and the expression of silent information regulator 1(SIRT1)in hippocampal CA1 of rats with cerebral ischemia.Methods Sixty Sprague-Dawley rats were randomly divided into sham operation group,model group and treatment group with 20 cases in each group.Each group was divided into one day,two days,three days,seven days subgroups according to the time of ischemia reperfusion.Global cerebral ischemia reperfusion was induced with modified Pulsinelli´4-vessel occlusion.The treatment group received 8%oxygen for two hours after ischemia.The cognitive function was assessed with Morris water maze test.Morphological changes of the hippocampal CA1 region were observed by HE staining.The expression of SIRT1 in the hippocampal CA1 region was detected with immunohistochemical assay and Western blotting.Results Compared with the model group,the escape latency significantly shortened(P<0.05),the number of times crossing the platform increased(P<0.05),the speed and the percentage of time spent in the platform quadrant increased(P<0.05),and the total distance decreased(P<0.05);the expression of SIRT1 in hippocampal CA1 increased(P<0.05)and the number of normal neurons increased(P<0.05)in the treatment group.Conclusion Hypoxic post-conditioning can improve the cognitive function of rats with global cerebral ischemia,which may relate with up-regulating SIRT1 in hippocampus.
Key words:cerebral ischemia;hypoxic post-conditioning;cognitive function;silent information regulator 1;rats
[中图分类号]R743
[文献标识码]A
[文章编号]1006-9771(2016)06-0629-06
DOI:10.3969/j.issn.1006-9771.2016.06.002
基金项目:1.河北省自然科学基金资助项目(No.ZD2013093);2.河北省自然科学基金资助项目(No.H2012401007)。
作者单位:1.华北理工大学,a.护理与康复学院;b.基础医学院,河北唐山市063000;2.华北理工大学附属医院神经外科,河北唐山市063000。
作者简介:刁莉君(1987-),女,汉族,安徽亳州市人,硕士研究生,主要研究方向:脑损伤的研究。通讯作者:赵雅宁(1978-),女,汉族,河北唐山市人,博士,教授,主要研究方向:脑损伤的研究。E-mail:zyning789@126.com。
收稿日期:(2015-12-01修回日期:2016-01-22)

