艾粉β-环糊精包合物的质量标准研究Δ
陈振夏,谢小丽,庞玉新,王 凯,杨 全,邹 婧
(1.中国热带农业科学院热带作物品种资源研究所/农业部华南作物基因资源与种质创制重点开放实验室,海南 儋州 571737; 2.海南省艾纳香工程技术研究中心,海南 儋州 571737; 3.广东药学院中药学院,广东 广州 510006)
·论著·
艾粉β-环糊精包合物的质量标准研究Δ
陈振夏1,2*,谢小丽1,2,3,庞玉新1,2#,王凯1,2,杨全3,邹婧1,2,3
(1.中国热带农业科学院热带作物品种资源研究所/农业部华南作物基因资源与种质创制重点开放实验室,海南 儋州571737; 2.海南省艾纳香工程技术研究中心,海南 儋州571737; 3.广东药学院中药学院,广东 广州510006)
摘要目的:对艾粉β-环糊精包合物的质量标准进行研究。方法:通过薄层色谱法、显微成像法和气相色谱法对包合物进行鉴别以及定性、定量分析。结果:显微成像法验证了包合物的形成;薄层色谱法鉴别可以检测出包合物中左旋龙脑对应的斑点,斑点清晰,空白对照组无干扰;采用气相色谱法对包合物中的左旋龙脑进行含量测定,6份艾粉β-环糊精包合物中左旋龙脑的载药量为15.11%~17.52%,平均载药量为16.18%,加样平均回收率为98% (RSD=0.67%)。结论: 该研究方法操作简便,准确性高,可作为该包合物的质量控制参考标准。
关键词艾粉; 包合物; 质量标准
艾粉是菊科植物艾纳香(BlumeabalsamiferaL. DC.)的叶和枝条经水蒸气蒸馏而得到的一种粉状粗加工品[1-2]。其味辛凉、苦,微寒,主要成分为左旋龙脑,其含量能达到88.4%[3],此外还含有异龙脑、芳樟醇、石竹烯、α-石竹烯等萜类化合物,具有抑菌、抗炎、抗氧化、镇痛、驱虫、祛风等多种生理活性[4]。但由于艾粉易挥发,难溶于水,不利于后期制剂的制备。因此,本实验采用了包合技术制备了艾粉β-环糊精(beta-Cyclodextrin,β-CD)包合物,通过显微成像法、薄层色谱法对包合物进行鉴别验证,同时建立了包合物中左旋龙脑含量分析方法,为含有艾粉的制剂提供简便可靠的质控方法。
7890A型气相色谱仪(美国安捷伦科技公司,包括FID检测器,G4513A 16位自动进样器);DHG-9035A型电热鼓风干燥箱(上海一恒科学仪器有限公司);CPA225D型分析天平(Srtarius公司);Heraeus Multifuge X3R型高速冷冻离心机(ThermoFisher公司);KQ-500DB型数控超声波清洗器(昆山市超声仪器有限公司);Axio Imager M2型正置显微镜(Zeiss公司)。
1.2药品与试剂
β-CD(江苏丰园生物技术有限公司,分子量1 134.98,含量≥98%);艾粉(中国热带农业科学院热带作物品种资源研究所,左旋龙脑含量≥60%);左旋龙脑对照品(阿法埃莎化学有限公司,纯度>98%,批号10147015),水杨酸甲酯(天津光复精细化工研究所,纯度>99.5%),其余试剂均为国产分析纯。
在室温下,称取适量β-CD置于研磨钵中,加入4倍量的蒸馏水沿同一方向研匀,使溶液呈糊状,研磨3 min后,再按β-CD与艾粉4∶1(质量)的比例边研磨边加入艾粉乙醇溶液,研磨45 min后,置4 ℃冰箱冷藏12 h后取出,抽滤,再用乙酸乙酯清洗3次,每次超声15 min后离心10 min(转速为3 000 r/min),以除去未被包合的艾粉,45 ℃烘箱干燥,即得[5-8],按以下公式计算包合物收得率与载药量:
(1)收得率(%)=包合物质量(g)/[β-环糊精加入量(g)+艾粉加入量(g)]×100%;
(2)载药量(%)=包合物中左旋龙脑含量(g)/包合物重量(g)×100%。
2.2外观
本品为类白色疏松状粉末,颜色均匀。
2.3粒度测定
依据《中国药典》2010年版第二部,采用双筛分法,取艾粉环糊精包合物30 g,称定其质量,置药筛中,保持水平状态过筛,左右往返,边筛动边轻叩3 min,取能通过6号筛(筛孔直径 0.15 mm)与不能通过4号筛(筛孔直径0.25 mm)的包合物,称其重量,计算其所占百分比小于10%[9]。
2.4定性鉴别
2.4.1薄层色谱法[10]:精密称取艾粉β-CD包合物适量,加乙醇,超声处理15 min,破坏艾粉β-CD包合物,静置过夜,次日离心,取上清夜作为艾粉β-CD包合物溶液备用;同法制备空白β-CD阴性样品溶液,再精密称取左旋龙脑对照品与艾粉适量,加无水乙醇制备左旋龙脑对照品溶液与艾粉对照溶液。取左旋龙脑对照品溶液、艾粉对照溶液、艾粉β-CD包合物溶液与空白β-CD阴性样品溶液,分别点样于同一块硅胶G板上,用石油醚(60~90 ℃)-乙酸乙酯(V∶V=4 ∶1)展开,取出,晾干,用10%的硫酸乙醇溶液显色,加热至斑点显色清晰。结果显示,左旋龙脑对照品溶液、艾粉对照溶液、艾粉β-CD包合物溶液在相应位置处显相同颜色的斑点,而空白β-CD阴性样品溶液在相位置处未显斑点,见图1。

1.左旋龙脑对照品溶液;2.艾粉对照溶液;3.艾粉β-CD包合物溶液;4.空白β-CD阴性样品溶液1. L-borneol control solution; 2. Aifen reference solution;3. Aifen of β-CD inclusion complex solution; 4. Blank β-CD negative sample solution图1 艾粉β-CD包合物的薄层色谱Fig 1 TLC of aifen of β-CD inclusion
2.4.2显微验证[11]:分别取适量艾粉、β-CD和艾粉β-CD包合物于研钵中研细后,置于载玻片上,待观察。另按1∶4比例分取艾粉、β-CD少许混合后再置于研钵中研细,作为物理混合物。将载有样品的载玻片置于光学显微镜下(10×40倍)观察,显微结果显示,艾粉表面呈星点透亮状的不规则晶体状物质,β-CD中间是透亮的不规则团状物质,物理混合物是2种不同大小的团状物质黏附在一起,而包合物是不透明的团状物质,内含黑色物质,表观形态发生变化,表明包合物的形成,见图2。
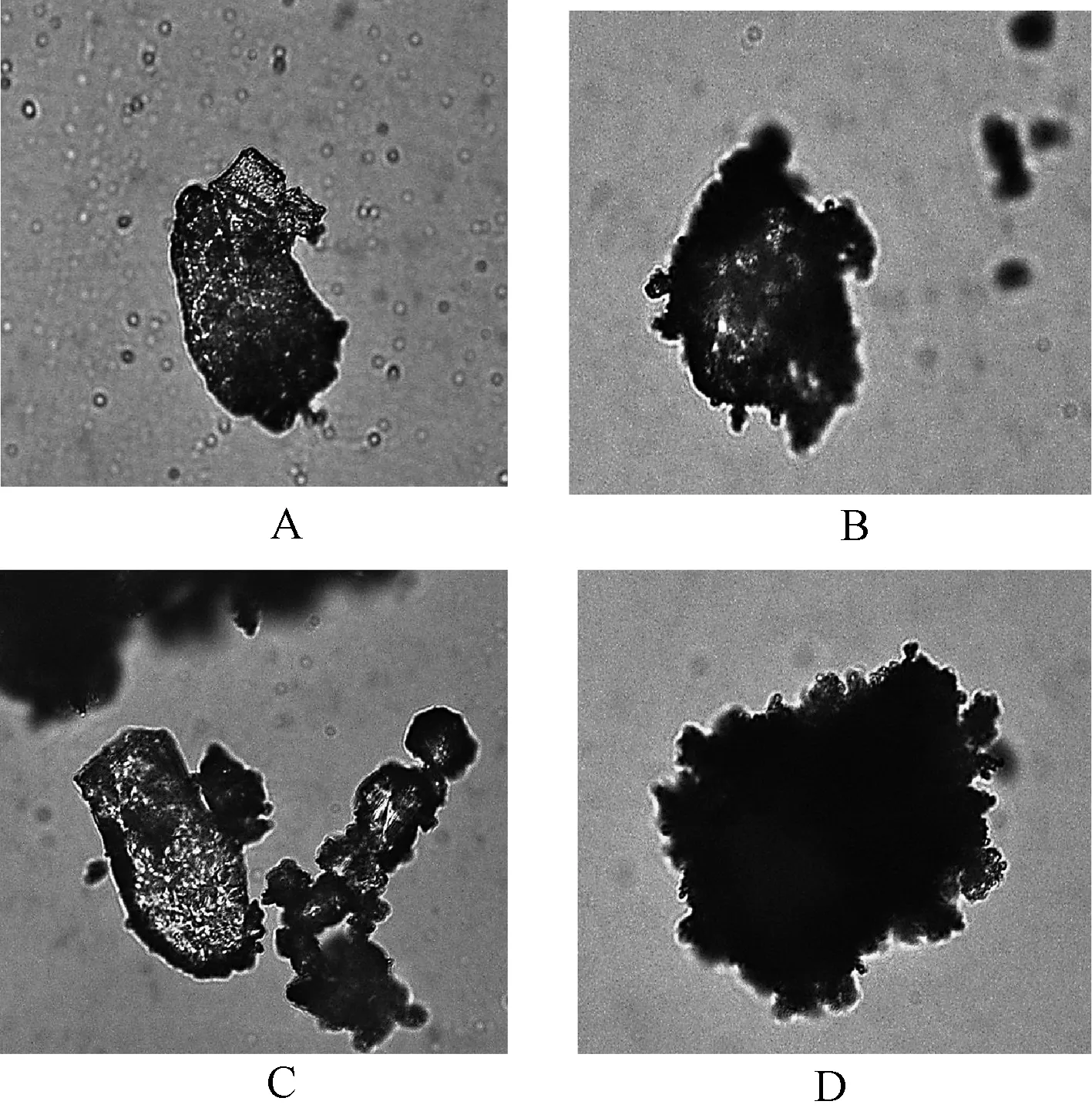
A.艾粉显微照片; B.β-CD显微照片;C.艾粉与β-CD物理混合物显微照片; D.艾粉β-CD包合物显微照片A.Microscopic image of aifen; B.Microscopic image of β-CD; C.Microscopic image of physical mixture of aifen and β-CD;D.Microscopic image of β-CD inclusion complex图2 艾粉β-CD包合物的显微成像图Fig 2 Microscopic image of aifen of β-CD inclusion complex
2.5含量测定
2.5.1色谱条件:HP-5石英毛细管色谱柱(0.32 mm×30 m,0.25 μm);以80 ℃为起始温度,保持2 min,先以5 ℃/min 升温至 100 ℃,然后以20 ℃/min升温至200 ℃,进样口温度220 ℃,检测器温度240 ℃;氮气流速:25 ml/min;氢气流速:30 ml/min;空气流速:400 ml/min;进样量为0.6 μl,分流比为9 ∶1。
2.5.2内标溶液的制备:精密称取适量水杨酸甲酯,以无水乙醇溶解并定容,摇匀,得质量浓度为1.343 3 mg/ml的溶液,作为内标储备液。
2.5.3对照品溶液的制备:精密称取左旋龙脑对照品适量,以无水乙醇定容,摇匀,得质量浓度为2 mg/ml的溶液,作为左旋龙脑对照品储备液。精密量取1 ml对照品储备液于10 ml容量瓶,加入内标溶液1 ml,加无水乙醇定容,摇匀,0.45 μm微孔滤膜滤过,即得。
2.5.4供试品溶液的制备:精密称取50 mg包合物样品置50 ml离心管中,加入20 ml无水乙醇,超声破坏15 min后静置过夜,次日离心10 min(3 000 r/min)。精密量取3 ml上清液于10 ml容量瓶,加入内标溶液1 ml,加无水乙醇定容,摇匀,0.45 μm微孔滤膜滤过,即得。
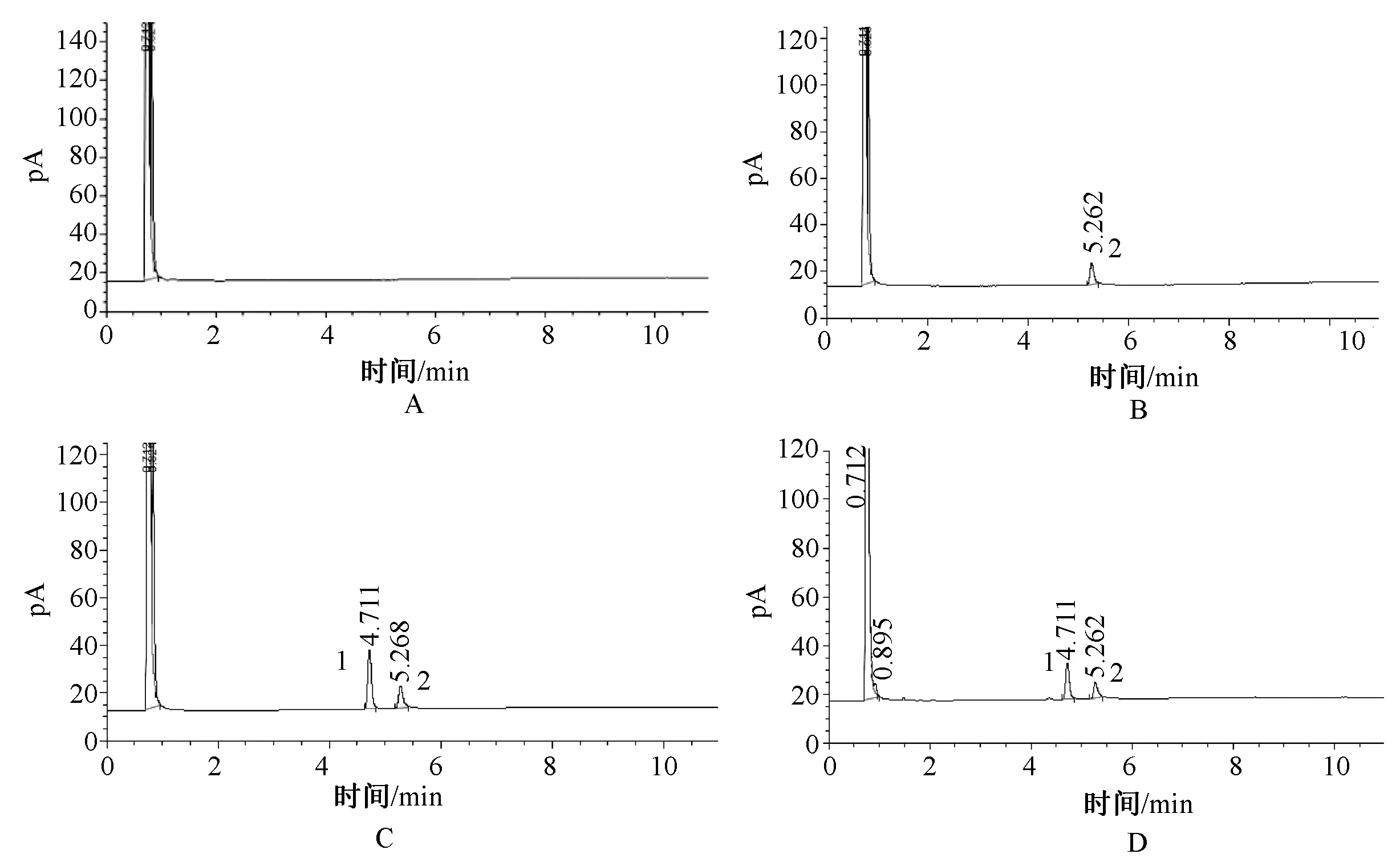
A.阴性对照溶液;B.内标溶液;C.对照品溶液;D.供试品溶液;1.左旋龙脑色谱峰;2.内标溶液色谱峰 A.Negative control solution; B.Internal standard solution; C.Control solution; D.Test solution; 1.Chromatographic peak of L-borneol; 2.Chromatographic peak of internal standard solution图3 艾粉β-CD包合物气相色谱图Fig 3 GC of aifen of β-CD inclusion complex
2.5.5阴性对照品溶液:精密称取适量的空白β-CD样品,按“2.5.4”项下方法进行处理,即得。
2.5.6系统适应性:在上述色谱条件下,分别精密吸取对照品溶液、供试品溶液、阴性对照溶液、内标溶液各0.6 μl进样分析,记录色谱图(见图3),供试品色谱图在与对照品色谱相应保留时间处有相同的色谱峰,而阴性对照溶液色谱图在与对照色谱图相应保留时间无色谱峰,表明β-CD对样品的测定无干扰。
2.5.7线性试验:分别精密吸取对照品储备液0.10、0.25、0.50、1.00、2.50、5.00 ml置于10 ml容量瓶中,各加入1 ml内标溶液,再以无水乙醇稀释至刻度摇匀。分别取上述6种浓度溶液,进样0.6 μl分析,以左旋龙脑峰面积与内标峰面积的比值为纵坐标,以相应浓度的比值为横坐标,得线性回归方程为Y=18.281X-0.149 4(r=0.999 8)。结果表明,左旋龙脑在0.02~1.00 mg/ml质量浓度范围内呈良好的线性关系。
2.5.8精密度试验:精密量取“2.5.3”项下对照品储备液1 ml,置于10 ml容量瓶中,加入内标液1 ml,加无水乙醇定容,摇匀,在上述色谱条件下,连续进样6次,记录左旋龙脑与内标液色谱峰的相对峰面积,并计算RSD为0.66%。
2.5.9稳定性试验:取同一份样品,按“2.5.4”项下方法制备供试品溶液,在室温下放置,分别在0、2、4、8、10、12 h按上述色谱条件进样测定,记录左旋龙脑色谱峰与内标色谱峰的相对峰面积,计算其RSD为1.35%,表明供试品溶液在12 h内稳定。
2.5.10重复性试验:精密称取同一批样品6份,按“2.5.4”项下方法制备供试品溶液,进样分析,记录左旋龙脑色谱峰与内标色谱峰的相对峰面积,测定左旋龙脑的含量均值为16.79 mg,RSD为0.43%
2.5.11左旋龙脑检出限与定量限:精密量取左旋龙脑对照品溶液0.6 μl,在上述色谱条件下,进样分析,测得信噪比约为3 ∶1时,最低检测限为0.139 μg;信噪比约为10 ∶1时,定量限为0.407 μg。
2.5.12加样回收率试验:精密称取6份已知左旋龙脑含量的包合物样品,按“2.5.4”项下方法破坏包合物,精密量取3 ml上清液于10 ml容量瓶中,分别精密加入左旋龙脑对照品溶液及1 ml内标溶液,再加入无水乙醇定容,得供试溶液,在本色谱条件下,进样分析,测定左旋龙脑含量,计算回收率,平均回收率为98%,RSD为0.67%,见表1。
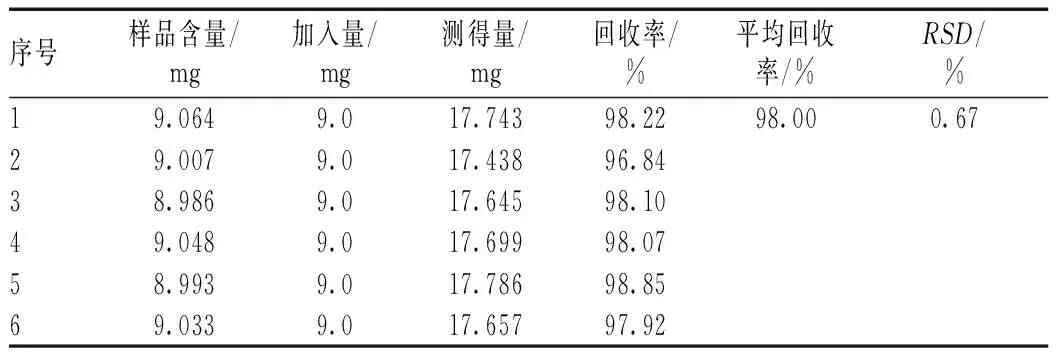
表1 左旋龙脑加样回收率试验
2.5.13样品中左旋龙脑的含量测定:分别精密称取6个不同批次的包合物,按“2.5.4”项下方法操作,制备供试品溶液,进样分析,6批包合物样品中含量为15.11%~17.52%,平均含量为16.18%,见表2。
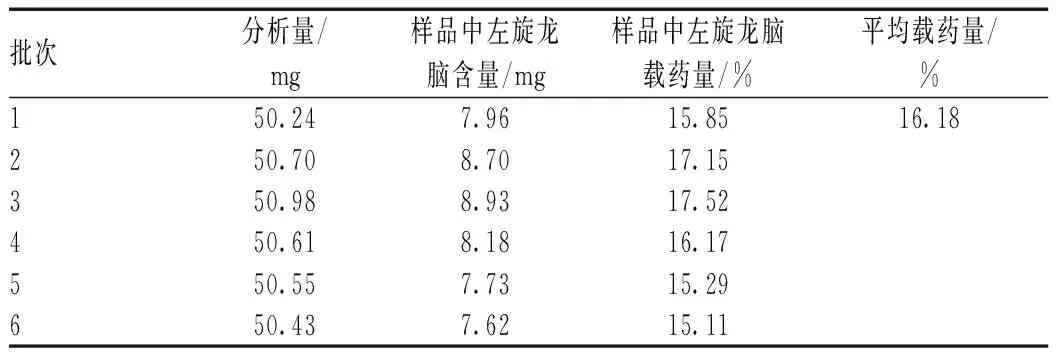
表2 包合物含量测定结果
3讨论
据文献报道,艾粉的抗炎镇痛、抑菌止痒等生理活性与其含有大量的挥发性物质有关,而其中左旋龙脑为主要成分,其含量甚至能达到88.40%[3],故选择左旋龙脑为含量测定的指标成分。另外,气相色谱法能直接测定某单一组分的含量,而且具有方法准确、精密度高、样品用量少等特点,是艾粉β-CD包合物中左旋龙脑含量测定的可行方法。
显微成像法与薄层色谱法是环糊精包合物常用的验证方法[12]。在显微镜下含药的包合物由于晶格的排列发生变化造成形状不同,根据对比分析包合物的相态变化及晶格变化可判断包合物是否形成。而通过薄层色谱法可以看到,在同样的条件下,空白的环糊精不会有展开斑点,而包合物与原料药以及对照品在同一位置有对应的斑点,也说明了包合物未影响艾粉的化学性质。
参考文献
[1]江兴龙,番俊锋,司健,等.贵州艾纳香产地采收提取艾粉技术研究[J].生物质化学工程,2006,40(1):17-20.
[2]王中洋,庞玉新,杨全,等.中药冰片资源及生产加工现状[J].中国现代中药,2014,16(9):780-784.
[3]吴丽芬,杨全,庞玉新,等.GC同时测定艾粉中樟脑、异龙脑、L-龙脑、β-石竹烯和花椒油素的含量及其聚类分析[J].中国药学杂志,2015,50(9):10-14.
[4]王远辉.艾纳香叶中左旋龙脑与精油的制备及其抗氧化与抗菌活性研究[D].无锡:江南大学,2013.
[5]宋凤兰,金海杰,潘育方,等.白纸扇感冒颗粒中挥发油β-环糊精包合物的制备[J].中国实验方剂学,2012,18(23):9-12.
[6]郑晓霞,张丹参,黄红娜,等.大黄酚-羟丙基-β-环糊精包合物的工艺优选及鉴定[J].中成药,2010,32(9):1518-1521.
[7]王静,邢煜军,张保国,等.甘松挥发油β-环糊精包合工艺研究[J].中成药,2011,33(9):1607-1610.
[8]郭丽蓉,周莉玲.冰片β-环糊精包结物制备方法的比较研究[J].时珍国医国药,2011,22(6):1462-1464.
[9]国家药典委员会.中华人民共和国药典:二部[S].2010年版.北京:中国医药科技出版社,2010:附录73.
[10]邓红,李欣蔚,林华庆,等.薄荷、白术混合挥发油β-环糊精包合物的制备和鉴别[J].广东药学院学报,2011,27(4):341-344.
[11]金邻豫,蔡源源,王博,等.银杏叶提取物包合物的制备及其显微验证[J].河南大学学报:医学版,2007,26(4):26-28.
[12]常美玲,薛彦朝,粘立军,等.β-环糊精包合物质量检测研究进展[J].中国中医药,2012,10(16):164-165.
Quality Standard on Aifen ofβ-CD Inclusion ComplexΔ
CHEN Zhenxia1,2, XIE Xiaoli1,2,3, PANG Yuxin1,2, WANG Kai1,2, YANG Quan3, ZOU Jing1,2,3
(1.Tropical Crops Genetic Resources Institute, Chinese Academy of Tropical Agricultural Sciences/Key Labor-atory of Crop Gene Resources and Germplasm Enhancement in Southern China, Hainan Danzhou 571737, China; 2.Hainan Provincial Engineering Research Center for Blumea Balsamifera, Hainan Danzhou 571737, China; 3.School of Traditional Chinese, Guangdong Pharmaceutical University, Guangdong Guangzhou 510006, China)
ABSTRACTOBJECTIVE:To research quality standard on aifen of β-CD inclusion complex. METHODS: To identify and qualitative and quantitative analyze the inclusion complex by TLC, microscopic imaging and GC. RESULTS: Microscopic imaging can verify the formation of inclusion complex, and the analysis of TLC showed the sample and contrast had the same color spots with similar RF value. GC to measure the content of L-borneol, The L-borneol content of 6 inclusion complex were 15.11%-17.52%. The average content was 16.18%; and the average recovery rate was 98%(RSD=0.67%). CONCLUSIONS: The methods were simple, accurate, and can be used for quality control reference standard for the inclusion complex.
KEYWORDSAifen; Inclusion complex; Quality standard
1材料
1.1仪器
2方法与结果
2.1包合物制备
Δ基金项目:国家自然科学基金项目(No.81374065);贵州省黔科合重大专项字(No.2013-6011) 湖北省卫生计生委员会计划项目(No:2012Z-Y41)
#通信作者:研究员。研究方向:南药资源研究与开发。E-mail: blumeachina@126.com 副主任药师。研究方向:临床药学和药理学。E-mail:1052543089@qq.com
中图分类号R927.11
文献标志码A
文章编号1672-2124(2016)06-0728-04
DOI10.14009/j.issn.1672-2124.2016.06.002
(收稿日期:2016-01-05)
*研究实习员。研究方向:南药研究与开发。E-mail:hnchenzhenxia@126.com
*主管药师。研究方向:中药药理学。E-mail:jovea@126.com

