5-α还原酶的表达与前列腺癌生物学行为相关性研究
孙 剑 靳 松 赵宏颖 刘 洋 金木兰 邢念增 牛亦农
(首都医科大学附属北京朝阳医院泌尿外科, 北京 100020)
5-α还原酶的表达与前列腺癌生物学行为相关性研究
孙剑靳松赵宏颖刘洋金木兰邢念增牛亦农*
(首都医科大学附属北京朝阳医院泌尿外科, 北京 100020)
【摘要】目的 探讨两型5-α还原酶表达情况与前列腺癌Gleason分级、血清前列腺特异性抗原(prostate specific antigen,PSA)浓度、TNM分期的相关性。方法选取2013至2014年间首都医科大学附属北京朝阳医院病理科前列腺癌的石蜡包埋组织40例,并收集患者基本信息、前列腺体积,术前PSA浓度,术后病理TNM分期,Gleason分级等。采用χ2检验和Spearman相关分析对2种5-α还原酶表达与病理分期、Gleason分级、PSA浓度及年龄等参数的关系进行分析。 结果Ⅰ型5-α还原酶在前列腺癌组织中的表达明显高于癌旁组织(P<0.001),相反Ⅱ型5-α还原酶在癌旁组织的表达强于癌组织(P=0.002),Ⅰ型5-α还原酶在癌细胞中的表达与肿瘤的恶性程度呈正相关,Gleason分级越高,病理分期越高,Ⅰ型5-α还原酶的表达越强;Ⅰ型5-α还原酶表达和血PSA浓度及年龄呈正相关。结论5-α还原酶在前列腺癌组织中呈现差异性表达的特点,前列腺癌组织内I型酶升高,II型酶降低;I型酶的表达与年龄、PSA浓度、病理分期及Gleason分级呈正相关,在老年人群前列腺癌的发生发展中可能具有重要的作用,I型酶对判断前列腺癌的生物学行为及预后可能具有一定意义。
【关键词】5-α还原酶;Gleason分级;TNM分期;前列腺特异性抗原;前列腺癌
前列腺是男性生殖器官,常见疾病包括良性前列腺增生和前列腺癌等。雄激素在前列腺增生和前列腺癌的发生与发展中起着重要作用,睾酮经5-α还原酶(5-α reductase, 5-AR)的作用转变为双氢睾酮(dihydrotestosterone, DHT)[1],后者生物活性远远高于睾酮,与良性前列腺增生和前列腺癌的发生与发展具有密切的关系。人体内的5-α还原酶主要有Ⅰ型(5-alpha reductase 1,5-AR1)和Ⅱ型(5-alpha reductase 2,5-AR2)两种同工酶,5-AR1主要存在于肝、脑、肺和非生殖器部位的皮肤及其附属器,而5-AR2主要分布于前列腺、附睾、精囊、生殖器部位皮肤及毛囊内毛根鞘等部位[2]。目前关于2种5-α还原酶在前列腺癌中的表达情况以及与患者年龄、血清前列腺特异性抗原(prostate specific antigen,PSA)、前列腺癌病理分期及Gleason分级等指标的关系尚未完全明确。本实验采用免疫组织化学技术从蛋白水平对前列腺癌组织中2种5-α还原酶表达情况进行检测,并分析其表达与前列腺癌生物学行为的关系。
1材料与方法
1.1标本来源
选取2013至2014年首都医科大学附属北京朝阳医院病理科前列腺癌的石蜡包埋组织40例,并收集该40例患者的基本信息如姓名、年龄、体质量指数(body mass index, BMI)等以及B超检查的前列腺大小,术前PSA浓度,术后病理TNM分期,Gleason分级等。
1.2免疫组织化学染色
将选取的前列腺癌组织样本石蜡包埋后,切成4~5 μm厚的组织切片;免疫组织化学染色参照Abcam免疫组织化学染色试剂盒说明书进行,依次经二甲苯脱蜡、梯度乙醇化、过氧化氢处理、热修复抗原、分别滴加5AR1(Abcam-ab110123)(1∶50)、5AR2(Santa Cruze-sc20400)(1∶50)单克隆抗体,4℃过夜,加入二抗、加入DAB 显色、苏木素轻度复染、脱水、透明、封片、显微镜观察。
免疫组织化学评估标准:胞质或胞核出现棕色颗粒的细胞为阳性细胞,每个样本在40×视野下选3个代表区域,手动计数每个代表区域内500个细胞,将<10%、11%~50%、>50%分别定义为-(阴性)、+(弱阳性)、++~+++(强阳性)3级。
1.3前列腺癌病理分级与临床分期
前列腺癌腺体分化采用Gleason分级系统,采用五级十分制,将肿瘤分为主要类型和次要类型,每个类型分为5级计1~5分,最后分级的评分为二者之和。Gleason 2~4分属于分化良好,5~7分属于中等分化,8~10分为分化差或未分化。前列腺癌分期采用临床常用的病理TNM分期系统[3]。
1.4统计学方法

2结果
2.15-α还原酶在癌组织及癌旁组织中的表达
前列腺癌组织及癌旁组织中都存在着两型5-AR。前列腺癌组织中5-AR1表达:5AR1在前列腺癌上皮细胞和间质细胞内均有表达,以上皮表达为主;在前列腺癌细胞核和细胞质中均有表达(图1);在癌组织中强阳性28例,弱阳性6例,阴性6例,在癌旁组织中强阳性6例,弱阳性33例,阴性1例,5-AR1在癌组织中的表达显著高于癌旁组织(P<0.05),详见表1;5-AR2表达:5AR2在前列腺癌上皮细胞和间质细胞内均有表达,以上皮表达为主;在前列腺癌细胞核和细胞质中均有表达(图2);在癌组织中强阳性9例,弱阳性25例,阴性6例,在癌旁组织中强阳性33例,弱阳性5例,阴性2例,5-AR2在癌旁组织的表达与癌组织差异无统计学意义(P=0.551),详见表1。

图1 5-AR1在前列腺癌组织及癌旁组织免疫组织化学染色病理切片
A: strong positive in prostate cancer tissue; B: weakly positive in prostate cancer tissue; C: negative in prostate cancer tissue; D: strong positive in para-neoplastic tissue; E: weakly positive in para-neoplastic tissue; F: negative in para-neoplastic tissue; 5-AR: 5-α reductase.

图2 5-AR2在前列腺癌组织及癌旁组织免疫组织化学染色病理切片
A: strong positive in prostate cancer tissue; B: weakly positive in prostate cancer tissue; C: negative in prostate cancer tissue; D: strong positive in para-neoplastic tissue; E: weakly positive in para-neoplastic tissue; F: negative in para-neoplastic tissue; 5-AR: 5-α reductase.

表1 5-α还原酶Ⅰ、Ⅱ在不同部位的表达情况
2.25-AR表达程度与前列腺癌病理分期的关系
在前列腺癌组织中,5-AR1在癌细胞中的染色程度与肿瘤的病理分期呈正相关,病理分期越高,5-AR1的表达越强,其相关性差异有统计学意义(P=0.021);而5-AR2的表达与肿瘤的病理分期的相关性差异无统计学意义(P=0.061),详见表2。
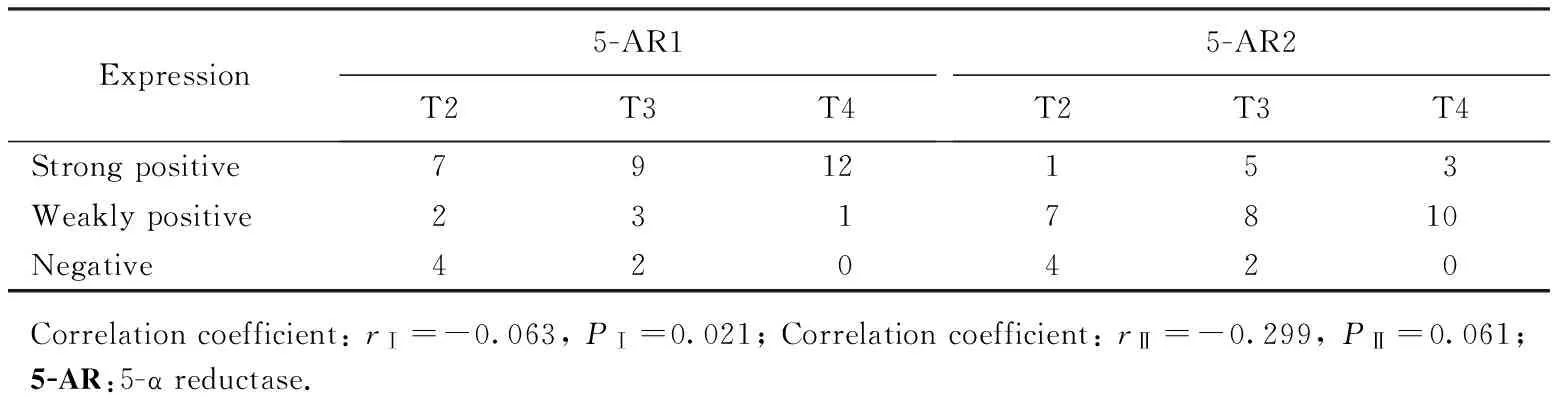
表2 5-α还原酶Ⅰ、Ⅱ不同表达程度与临床分期
2.35-AR表达程度与前列腺癌Gleason分级的关系
40例前列腺癌患者标本组织中5-AR1与Gleason分级的关系:2~4分10例,5~7分13例,8~10分17例。5-AR1表达和Gleason分级具有统计学意义(P=0.012)并呈正相关,Gleason评分越高,其表达越强;5-AR2与Gleason分级的关系:2~4分9例,5~7分14例,8~10分17例。5-AR2表达和Gleason分级无相关性(P=0.417),详见表3。

表3 5-α还原酶Ⅰ、Ⅱ不同表达程度与Gleason分级
2.45-AR在前列腺癌组织中的表达与血清PSA浓度之间的关系
血清PSA值为1.22 ng/mL至282 ng/mL。其中5例患者血清PSA<4 ng/mL,9例为4~10 ng/mL,26例为>10 ng/mL。按照5-AR1强阳性、弱阳性、阴性分组,各组血清PSA值的中位数和四分位间距分别为(10.00,38.23)ng/mL 、(4.58,40.38) ng/mL、(3.22,12.17)ng/mL。5-AR1表达和PSA浓度呈正相关(P=0.013),详见表4。
6例患者血清PSA值为<4 ng/mL,7例为4~10 ng/mL,27例为>10 ng/mL,按照5-AR2强阳性、弱阳性、阴性分组,各组血清PSA值的中位数和四分位间距分别为(11.26,40.90)ng/mL、(6.44,25.00)ng/mL、(3.32,21.82)ng/mL。5-AR2表达和PSA浓度无相关(P=0.053),详见表5。
2.55-AR在前列腺癌中的表达和患者年龄的关系
40例前列腺癌患者平均年龄(68.56±7.58)岁。其中,50~59岁8例,60~69岁10例,70~79岁22例,5-AR1表达与年龄呈正相关,年龄越大,其表达强度越强(P=0.009),详见表6。5-AR2表达与年龄的相关性无统计学意义(P=0.718),详见表7。
3讨论
前列腺癌是一种严重威胁老年男性健康的恶性肿瘤,在美国为男性最常见的肿瘤,并且是男性癌症死亡的主要原因, 在我国也呈逐年上升趋势[4-5]。其病因可能与种族、遗传、环境、吸烟、肥胖及性激素水平有关,例如家族发病率较高、发病年龄较轻、过多的摄入动物脂肪也有可能促进前列腺癌的发展。5-AR将睾酮转化为双氢睾酮,在前列腺增生及前列腺癌的发生发展中发挥重要作用,包括三型5-AR,分别为Ⅰ型、Ⅱ型和III型[6]。
关于2种5-AR在前列腺组织中的表达,一些研究[7]报道2种5-AR均表达于前列腺组织中,也有研究[8]认为在前列腺组织中没有5-AR1的表达与活性。本组实验结果显示,在前列腺癌组织及癌旁组织中2种5-AR均有表达,5-AR1在前列腺癌组织中表达高于癌旁组织,并且在前列腺癌组织中5-AR1表达与肿瘤的恶性程度相关,病理分期越高,腺体分化越差的肿瘤组织中其表达程度也越高。这说明在前列腺癌的发生发展过程中,5-AR1还原酶可能起重要作用,这也与笔者在前列腺癌细胞系中发现5-AR1,而5-AR2阴性相吻合(未发表),与国外一些酶动力学研究[9]所证实的在多种前列腺癌细胞系中存在5-AR1高表达的情况也相符。并且国内外有研究[10-11]报道前列腺组织中5-AR2表达缺失和5-AR2基因启动区CpG岛甲基化有关,甲基化主要发生在CpG二核苷酸的C5位点,由甲基转移酶1(DNMT1)作用,DNMT1主要作用是DNA复制过程中维持子链DNA的甲基化,DNMT1的异常高表达使CpG岛启动子甲基化从而导致5-AR2的表达下降[12]。而5-AR1高表达则与肿瘤细胞增生过快,组织缺氧微环境有关,其有利于5-AR将睾酮催化为双氢睾酮,改变肿瘤细胞代谢,促进肿瘤细胞生长和细胞内基本PH值变化,这些变化反过来有利于5-AR1基因的表达[13]。

表4 5-α还原酶Ⅰ不同表达程度与血清PSA浓度

表5 5-α还原酶Ⅱ不同表达程度与血清PSA浓度

表6 5-α还原酶Ⅰ不同表达程度与年龄构成

表7 5-α还原酶Ⅱ不同表达程度与年龄构成
前列腺特异性抗原(prostate specific antigen,PSA)作为前列腺癌特异性标志物,在前列腺癌的临床诊断与治疗中已得到广泛应用,血清 PSA检测是目前国内外应用最为广泛的前列腺癌筛查和前列腺癌治疗效果评价指标[14-16]。前列腺癌的危险性及侵袭性与PSA浓度直接相关[17],国内研究[18]报道表明血清PSA值与前列腺癌的病理分级呈正相关,血清总前列腺特异性抗原(TPSA)、游离前列腺特异性抗原(FPSA)与前列腺癌患者的Gleason评分、临床分期均呈正相关,且TPSA>30 ng/mL时要高度怀疑前列腺癌处于晚期。本组实验结果显示,5-AR1的表达与PSA浓度具有显著正相关。提示检测癌组织中5-AR1的表达情况对于前列腺癌的早期诊断、病理分期、术后疗效观察及随访具有重要的临床意义。
40例前列腺癌患者中,5-AR1表达程度与患者年龄具有显著相关,年龄越大,5-AR1表达越高,而5-AR2不具有这种相关性,结合5-AR1与血清PSA浓度、前列腺癌病理分期与腺体分化的相关性,提示对于前列腺癌这种老年性疾病,5-AR1的升高可能在前列腺癌的发生发展中发挥重要作用。
综上所述,5-AR在前列腺癌组织中呈现差异性表达,Ⅰ型酶升高,Ⅱ型酶降低;并且与肿瘤的病理分期、Gleason分级、患者血清PSA浓度及年龄因素具有正相关性;I型酶的表达对老年人群前列腺癌的发生发展可能是重要事件;对于前列腺癌筛查、诊断、治疗及预后判断也可能具有重要的参考意义;同时提示应用具有5-AR1与5-AR2双重抑制作用的抑制剂对于预防前列腺癌可能具有更好的疗效。
4参考文献
[1]Wu Y, Godoy A, Azzouni F, et al. Prostate cancer cells differ in testosterone accumulation, dihydrotestosterone conversion, and androgen receptor signaling response to steroid 5alpha-reductase inhibitors[J]. Prostate, 2013, 73(13): 1470-1482.
[2]Wang K, Fan D D, Jin S, et al. Differential expression of 5-alpha reductase isozymes in the prostate and its clinical implications[J]. Asian J Androl, 2014, 16(2): 274-279.
[3]NCCN. The NCCN prostate cancer clinical practice guidelines in oncology (version 2.2016)[EB/OL]. Fort Washington: NCCN,2016[2016-03-13]. http://www.nccn.org/professionals/physician_gls/pdf/prostate.pd
[4]Siegel R, Naishadham D, Jemal A. Cancer statistics, 2013[J]. CA Cancer J Clin, 2013, 63(1): 11-30.
[5]樊东东,王凯,靳松,等. 5-α还原酶在人前列腺组织中的差异性表达及其抑制剂治疗前列腺疾病的临床应用[J]. 中华泌尿外科杂志,2015, 36(1): 75-78.
[6]Godoy A, Kawinski E, Li Y, et al. 5alpha-reductase type 3 expression in human benign and malignant tissues: a comparative analysis during prostate cancer progression[J]. Prostate, 2011, 71(10): 1033-1046.
[7]Thomas L N, Douglas R C, Lazier C B, et al. Type 1 and Type 2 5α-reductase expression in the development and progression of prostate cancer[J]. Eur Urol, 2008, 53(2): 244-252.
[8]Silver R I, Wiley E L, Davis D L, et al. Expression and regulation of steroid 5 alpha-reductase 2 in prostate disease[J]. J Urol, 1994, 152(2 Pt 1): 433-437.
[9]Das K, Lorena P D, Ng L K, et al.Differential expression of steroid 5alpha-reductase isozymes and association with disease severity and angiogenic genes predict their biological role in prostate cancer[J]. Endocr Relat Cancer,2010, 17(3): 757-770.
[10]Ge R, Wang Z, Bechis S K, et al. DNA methyl transferase 1 reduces expression of SRD5A2 in the aging adult prostate[J]. Am J Pathol, 2015, 185(3): 870-882.
[11]Niu Y, Ge R, Hu L, et al. Reduced levels of 5-α reductase 2 in adult prostate tissue and implications for BPH therapy[J]. Prostate, 2011,71(12):1317-1324.
[12]Uysal F, Akkoyunlu G, Ozturk S. Dynamic expression of DNA methyltransferases (DNMTs) in oocytes and early embryos[J]. Biochimie, 2015, 116: 103-113.
[13]Titus M A, Gregory C W, Ford O H 3rd, et al. Steroid 5alpha-reductase isozymes I and II in recurrent prostate cancer[J]. Clin Cancer Res, 2005, 11(12): 4365-4371.
[14]秦桂萍,华玉兰,侯海娜. 前列腺癌组织p504S和p63与血清PSA表达水平相关性分析[J]. 中华肿瘤防治杂志, 2013,20(3):200-202.
[15]杜雄,惠起源,尹香利,等. PSA、CgA及PCA3在前列腺癌中的表达及临床意义[J]. 解放军医药杂志,2014,26(2):47-49.
[16]王炜,李传刚,刘辉,等. 前列腺特异性抗原对前列腺癌诊断价值的探讨[J]. 中国医科大学学报, 2016,45(1):61-65,69.
[17]Loeb S, Catalona W J. Prostate-specific antigen in clinical practice[J]. Cancer Lett, 2007, 249(1): 30-39.
[18]刘贺亮,王禾,杨晓剑,等. 血清PSA、FPSAR与前列腺癌病理分级、临床分期的相关性研究[J]. 中华男科学, 2002,8(4): 261-263.
编辑陈瑞芳
Correlation between 5-α reductase and biological behavior of prostate cancer
Sun Jian, Jin Song, Zhao Hongying, Liu Yang, Jin Mulan, Xing Nianzeng, Niu Yinong*
(DepartmentofUrology,BeijingChaoyangHospital,CapitalMedicalUniversity,Beijing100020,China)
【Abstract】ObjectiveTo investigate the correlation between the expression of two types of 5-αreductase and Gleason score, serum prostate-specific antigen (PSA) concentration, and TNM stage in prostate cancer (PCa). MethodsParaffin-embedded PCa specimens of 40 cases were collected in our hospital from 2013 to 2014. Other data of these patients were also collected including the basic information, prostate volume, preoperative serum PSA concentration, postoperative pathological TNM stage, Gleason score and so on. Chi-square test and Spearman rank correlation were used to analyze the correlation.ResultsThe expression of type I 5-α reductase in PCa tissues was significantly stronger than that in the paraneoplastic tissues (Chi-square test, P<0.001). On the contrary, the expression of type II 5-α reductase in the paraneoplastic tissues was stronger than that in PCa tissues (Chi-square test, P=0.002). expression of type I 5-α reductase in PCa epithelial cells was positively correlated with patient’s age, serum PSA, the degree of tumor malignancy, Gleason score, and clinical stage.ConclusionExpression of 5-α reductases in PCa are different, type I enzyme is increased, and type II enzyme is decreased. The expression of type I enzyme is positively correlated with age, serum PSA concentration, pathological stage and Gleason score. These findings suggest that these enzymes may play an important role in the development and progression of prostate cancer in the elderly population. Type I enzyme may have a certain significance in judging the biological behavior and prognosis of prostate cancer.
【Key words】5-α reductase; Gleason score; TNM stage;prostate specific antigen (PSA); prostate cancer
基金项目:北京市自然科学基金(7122074)。This study was supported by Natural Science Foundation of Beijing(7122074).
*Corresponding author, E-mail:farmerniu@163.com
[doi:10.3969/j.issn.1006-7795.2016.03.010]
【中图分类号】R 737.25
(收稿日期:2016-04-06)
网络出版时间:2016-06-0719∶00网络出版地址:http://www.cnki.net/kcms/detail/11.3662.r.20160607.1900.032.html
· 前列腺癌发病机制与临床治疗研究 ·

